2. 中国农业科学院家禽研究所, 扬州 225125
2. Poultry Institute, Chinese Academy of Agricultural Sciences, Yangzhou 225125, China
热应激是动物机体对热环境非特异性防御应答的生理反应。家禽由于全身覆盖羽毛且没有汗腺,导致难以散热,易产生热应激并诱导氧化应激,对肝脏产生不良影响。研究表明,热应激能抑制动物生长,并且这种抑制作用和氧化损伤有关[1-2],付旭彬[3]的研究表明,热应激会降低肝脏的抗氧化功能,导致试验鸡肝细胞病理性损伤,表现为肝脏产生不同程度的颗粒变性和脂肪变性。2016年我国黄羽肉鸡出栏量超过40亿只,约占肉鸡养殖量的1/2。目前主要以农户地面散养为主,环境控制差,夏季极易产生热应激,然而当前国内开展黄羽肉鸡热应激的研究较少,且大部分采取的是单一温度的持续高温热应激研究,这与生产中的每日实际温度差异较大。本试验模拟华东地区夏季的环境温度构建热应激模型,研究循环热应激对黄羽肉鸡呼吸机能、生长性能和肝脏抗氧化功能的影响,为充分了解氧化应激对机体产生损伤的机理,并延伸到氧化应激的线粒体损伤机制研究上提供依据。
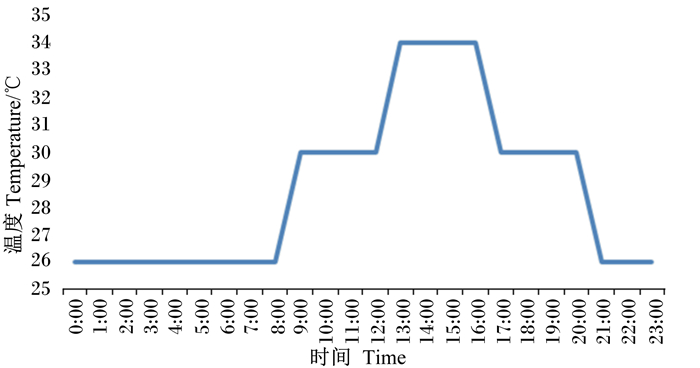
1 材料与方法 1.1 试验设计选择35日龄健康的、体重在(1 360±10) g的雄性黄羽肉鸡144只,随机分为常温组和循环热应激组2个组,每组12个重复,每个重复6只鸡。2个组均饲喂基础饲粮,常温组温度为(26.0±0.5) ℃,循环热应激组模拟华东地区夏季温度,给予如下温度:20:00—次日08:00为26 ℃,08:00—12:00和16:00—20:00为30 ℃,12:00—16:00为34 ℃,该温度模式由江苏立华牧业股份有限公司提供。试验期6 d。
1.2 饲养管理试验在中国农业科学院家禽研究所仪征基地的环控仓中进行,3层笼养,鸡笼规格为100 cm×80 cm×45 cm,自由采食和饮水,相对湿度为(60± 5)%,循环热应激的时间和温度如图 1所示(升温降温均在5 min内完成),24 h光照。试验开始时分组称重,饲喂按照我国《鸡饲养标准》(NY/T 33—2004)配制的基础饲粮,基础饲粮组成及营养水平如表 1所示。环控仓由北京库蓝科技有限公司生产,黄羽肉鸡购自扬州立华畜禽有限公司。
|
图 1 循环热应激的时间和温度 Figure 1 Cycle heat stress time and temperature |
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
循环热应激2和6 d后,用非接触式红外测温仪(AR550型,希玛仪表有限公司)测定黄羽肉鸡的鸡冠温度和翅下温度;用动物直肠体温计(HRQ-S2009型,郑州豪润奇电子科技有限公司)测定黄羽肉鸡的直肠温度,每个指标测定3次,取平均值;每个重复用微型摄像机(SQ8型,深圳市凯尼康科技有限公司)拍摄12:30—13:30的鸡群,并选择13:00附近时间段,统计每重复中鸡每分钟的呼吸次数,每重复统计3只,连续统计5 min,取平均值。
1.3.2 生长性能每次喂料时称料重,试验开始和采样前统计每个重复的体重和余料重,计算循环热应激1~2 d、3~6 d和1~6 d的平均日采食量(ADFI)、平均日增重(ADG)和料重比(F/G)。
1.3.3 肝脏抗氧化功能循环热应激2和6 d后,从每个重复中随机选取1只鸡,采集肝脏组织,称取0.1 g左右的肝脏组织,按照试剂盒测定要求匀浆并稀释,测定匀浆液中过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)的活性及还原型谷胱甘肽(GSH)、丙二醛(MDA)、蛋白质羰基(protein carbonyl, PC)的含量,试验所用试剂盒由南京建成生物工程研究所提供。
1.4 数据处理数据经Excel 2013进行统计和简单处理后,用SPSS 20.0软件的Univariate进行单因素方差分析,均值显著性分析用Duncan氏法多重比较,结果以平均值±标准差表示,并以P < 0.05作为显著差异。
2 结果 2.1 循环热应激对黄羽肉鸡呼吸机能的影响由表 2可知,循环热应激2 d后,循环热应激组的鸡冠温度、翅下温度、直肠温度和呼吸频率显著高于常温组(P < 0.05),循环热应激6 d后,循环热应激组的鸡冠温度和呼吸频率显著高于常温组(P < 0.05)。
|
|
表 2 循环热应激对黄羽肉鸡呼吸机能的影响 Table 2 Effects of cyclic heat stress on breathing function of yellow-feathered broilers |
由表 3可知,循环热应激组1~2 d的ADFI、ADG,3~6 d的ADG和1~6 d的ADFI、ADG显著低于常温组(P < 0.05),1~2 d和1~6 d的F/G显著高于常温组(P < 0.05)。
|
|
表 3 循环热应激对黄羽肉鸡生长性能的影响 Table 3 Effects of cyclic heat stress on growth performance of yellow-feathered broilers |
由表 4可知,循环热应激2 d后,循环热应激组肝脏MDA含量和CAT、SOD活性显著低于常温组(P < 0.05),蛋白质羰基含量显著高于常温组(P < 0.05)。循环热应激6 d后,循环热应激组肝脏MDA、GSH含量和CAT、SOD、GSH-Px活性显著低于常温组(P < 0.05),蛋白质羰基含量显著高于常温组(P < 0.05)。
|
|
表 4 循环热应激对黄羽肉鸡肝脏抗氧化功能的影响 Table 4 Effects of cyclic heat stress on liver antioxidant function of yellow-feathered broilers |
高温环境可引发机体产生生理性调节反应,如加快呼吸、增加体表血流量以维持机体温度[4]。体表温度是机体适应环境的一种调节性的生理反应,也是评价热应激的标志[5]。Bohmanova等[6]研究表明,奶牛热应激能使其直肠温度、体表温度及呼吸频率显著升高。李超等[7]研究也表明,热应激时肉鸡只能通过提高呼吸频率,加大肺通气量,以增加呼吸道的蒸发和对流散热。本试验结果表明,循环热应激2 d后,循环热应激组的鸡冠温度、翅下温度、直肠温度和呼吸频率均显著高于常温组,循环热应激6 d后,循环热应激组的鸡冠温度和呼吸频率显著高于常温组,说明循环热应激升高了黄羽肉鸡的呼吸频率和体表温度,与上述研究结果一致。由本试验结果还可看出,循环热应激6 d后,翅下温度和直肠温度无显著差异,可能是黄羽肉鸡开始逐渐适应循环热应激,从而对体温有了较显著的调节作用。
3.2 循环热应激对黄羽肉鸡生长性能的影响热应激是影响家禽生长性能的主要因素之一,能够使家禽的生理机能发生改变甚至造成紊乱,表现为体增重下降、生长减慢、抵抗力降低[8]。Sohail等[9]研究表明,慢性热应激使42日龄肉鸡体重显著降低了32.6%,F/G显著提高了25.6%,Deng等[10]和Mashaly等[11]的研究表明,采食量下降很有可能是热应激降低生长性能,导致体重、饲料利用率、产蛋量和蛋品质下降的根源。本试验结果表明,给予循环热应激3~6 d,与常温组相比,循环热应激组ADFI降低了19.32%,F/G了增加10.94%,其他阶段ADFI、ADG均显著降低,F/G均显著增加,说明循环热应激降低了黄羽肉鸡的体增重,增加了料重比,降低了生长性能,这与上述研究结果相一致。
3.3 循环热应激对黄羽肉鸡肝脏抗氧化功能的影响适量自由基对机体是无害甚至是有益的,但在应激等条件下,机体产生过量自由基会破坏正常秩序及生理代谢。自由基的清除主要依靠体内各类抗氧化酶,包括SOD、CAT和GSH-Px等。MDA是氧自由基引发的机体脂质过氧化的终产物,蛋白质羰基是机体蛋白质过氧化的终产物。研究表明,热应激会显著降低肝脏中GSH-Px的活性,进而导致肝脏中MDA含量的增加[12],李叶涵等[13]研究表明,热应激显著增加了肉鸡肝脏过氧化程度,Chen等[14]研究表明,氧化应激48 h后,细胞中MDA含量增加,SOD活性降低。本试验结果表明,循环热应激2 d后,肝脏CAT、SOD活性显著降低,蛋白质羰基含量显著升高;循环热应激6 d后,肝脏CAT、SOD、GSH-Px活性和GSH含量显著降低,蛋白质羰基含量显著升高,说明循环热应激能降低黄羽肉鸡抗氧化酶的活性,从而降低了黄羽肉鸡的抗氧化功能。这与上述研究结果相符。通过本试验还发现,循环热应激6 d后黄羽肉鸡的抗氧化功能并未改善,肝脏GSH-Px活性反而显著降低,说明此时循环热应激对黄羽肉鸡仍能起到损伤作用,黄羽肉鸡尚未适应热环境。但2个阶段的肝脏MDA含量均低于常温组,这与前人的研究结果不同,具体原因需要进一步研究。
4 结论循环热应激能升高黄羽肉鸡的体温,加快呼吸频率,降低生长性能和肝脏抗氧化功能。
| [1] |
WANG J J, ZHU Q F, AHMAD H, et al. Combination of linseed and palm oils is a better alternative than single oil for broilers exposed to high environmental temperature[J]. Journal of Poultry Science, 2013, 50(4): 332-339. DOI:10.2141/jpsa.0120112 |
| [2] |
BELHADJ S I, NAJAR T, GHRAM A, et al. Heat stress effects on livestock:molecular, cellular and metabolic aspects, a review[J]. Journal of Animal Physiology and Animal Nutrition, 2016, 100(3): 401-412. DOI:10.1111/jpn.2016.100.issue-3 |
| [3] |
付旭彬. 肉鸡急性热应激损伤及其机理的研究[D]. 硕士学位论文. 南京: 南京农业大学, 2002.
|
| [4] |
袁娇, 刘建伟, 李勇, 等. 富含γ-氨基丁酸米糠对夏季高温期肉鸡的生产性能、呼吸频率及直肠温度的影响[J]. 粮食与饲料工业, 2014, 12(1): 50-53. |
| [5] |
温雅俐, 高民. 热应激对奶牛体温和呼吸机能的影响[J]. 饲料工业, 2011, 32(23): 55-60. DOI:10.3969/j.issn.1001-991X.2011.23.014 |
| [6] |
BOHMANOVA J, MISZTAL I, COLE J B. Temperature-humidity indices as indicators of milk production losses due to heat stress[J]. Journal of Dairy Science, 2007, 90(4): 1947-1956. DOI:10.3168/jds.2006-513 |
| [7] |
李超, 赵青余, 马悦培, 等. γ-氨基丁酸对持续高温热应激肉仔鸡生产性能和血液指标的影响[J]. 中国兽医学报, 2010, 30(4): 556-559. |
| [8] |
刘梅. 急性热应激对肉仔鸡生长性能及脂肪代谢的影响[J]. 动物营养学报, 2011, 23(5): 862-868. |
| [9] |
SOHAIL M U, HUME M E, BYRD J A, et al. Effect of supplementation of prebiotic mannan-oligosaccharides and probiotic mixture on growth performance of broilers subjected to chronic heat stress[J]. Poultry Science, 2012, 91(9): 2235-2240. DOI:10.3382/ps.2012-02182 |
| [10] |
DENG W, DONG X F, TONG J M, et al. The probiotic Bacillus licheniformis ameliorates heat stress-induced impairment of egg production, gut morphology, and intestinal mucosal immunity in laying hens[J]. Poultry Science, 2012, 91(3): 575-582. DOI:10.3382/ps.2010-01293 |
| [11] |
MASHALY M M, HENDRICKS G L, KALAMA M A, et al. Effect of heat stress on production parameters and immune responses of commercial laying hens[J]. Poultry Science, 2004, 83(6): 889-894. DOI:10.1093/ps/83.6.889 |
| [12] |
王松波, 邓琳, 赵婕, 等. 热应激对肉鸡抗氧化能力及腓肠肌纤维类型的影响[J]. 华南农业大学学报, 2015, 36(6): 23-28. DOI:10.7671/j.issn.1001-411X.2015.06.004 |
| [13] |
李叶涵, 周佳, 张越, 等. L-精氨酸和α-酮戊二酸对热应激肉鸡肝脏功能的影响[J]. 饲料工业, 2016, 37(16): 6-11. |
| [14] |
CHEN X X, REN F, HESKETH J, et al. Interaction of porcine circovirus type 2 replication with intracellular redox status in vitro[J]. Redox Report Communications in Free Radical Research, 2013, 18(5): 186-192. DOI:10.1179/1351000213Y.0000000058 |




