2. 山西农业大学动物科技学院, 太谷 030801
2. College of Animal Science and Technology, Shanxi Agricultural University, Taigu 030801, China
我国畜牧业持续快速发展的同时,饲草用量也在大幅度上升,饲粮和优质饲草短缺的问题正日益突出,而我国奶牛养殖业的发展也受到国内优质粗饲料资源短缺的限制。随着畜牧业的不断发展,奶牛存栏量进一步增加,优质牧草的供需缺口仍将以每年10%左右的速度递增。据统计,2015年我国苜蓿的进口总量突破120万t,同比增长37.2%,成为苜蓿进口第一大国[1]。
近年来我国玉米淀粉加工业迅速发展,每年大量的玉米用于加工玉米淀粉。生产玉米淀粉的过程伴随有数量庞大的副产物产生,包括玉米纤维、玉米浆、玉米蛋白质饲料、玉米胚芽粕等。玉米纤维饲料(corn fiber feed, CFF)就是湿法生产玉米淀粉的副产物之一,由玉米浆和玉米纤维组成,具有粗蛋白质含量高、纤维含量高、溶解率高、容积密度大等特点,且其奶牛产奶净能达到7.99 MJ/kg[2]。CFF价格低廉,在畜禽饲料中合理利用对降低畜禽养殖成本、提高经济效益有重要意义。
已有大量的研究证明,CFF可以作为一种价格低廉的饲料原料用于反刍动物生产,且合理比例内利用对奶牛生产性能和机体健康没有不良影响[3-4]。在国外,CFF更多是以湿玉米纤维饲料(wet corn fiber feed, WCFF)被利用,少数研究中利用干玉米纤维饲料(dry corn fiber feed, DCFF)作为奶牛饲料。Macleod[5]利用WCFF替代奶牛饲粮中40%豆粕或50%玉米后,对奶牛干物质采食量没有显著影响,并且改善了乳品质,提高了乳脂率。Montgomery等[6]报道富含快速发酵碳水化合物的饲料在瘤胃中快速发酵可能导致瘤胃微生物代谢紊乱,引起亚急性瘤胃酸中毒。但饲喂WCFF可以有效避免这种代谢性紊乱,因为WCFF的主要供能物质为可发酵纤维,而不是淀粉。DCFF在营养方面保留了WCFF绝大部分营养特点,且在贮存和运输方面较WCFF更方便。Firkins等[7]研究表明,20%的DCFF和1%碳酸氢钠组合可以替代奶牛饲粮中相同比例的玉米青贮,并取得良好的饲养效果。目前,关于DCFF作为奶牛饲粮的纤维来源替代苜蓿干草的研究很少,相关数据非常有限。由于DCFF纤维长度较小,不能有效地刺激反刍,DCFF在奶牛饲粮中的应用要与长纤维饲料(例如羊草)合理搭配,以确保瘤胃发酵功能正常。本试验采用体外产气法研究DCFF与羊草组合替代饲粮中的部分苜蓿干草对奶牛体外瘤胃发酵的影响,为DCFF替代苜蓿干草在奶牛生产中的应用提供数据和理论依据。
1 材料与方法 1.1 发酵底物制备及成分分析本试验在黑龙江省双城市雀巢奶牛养殖培训中心奥特奇IFM实验室进行。以奶牛饲粮为发酵底物,精饲料由哈尔滨市富邦饲料公司加工,粗饲料样品取自黑龙江省哈尔滨市综合牧场。采用DCFF与羊草组合后分别等比替代底物中0、5.00%、10.50%、17.50%、22.90%的苜蓿干草,其中DCFF在底物中比例分别为0、3.00%、7.00%、11.00%和15.00%,分别命名为0DCFF、3DCFF、7DCFF、11DCFF、15DCFF组。发酵底物样品制样后粉碎过1 mm筛备用。
|
|
表 1 发酵底物组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of fermented substrates (DM basis) |
选用2头体况良好、健康且装有永久性瘤胃瘘管的产奶量为(24.5±0.8) kg的荷斯坦奶牛作为瘤胃液的供体动物。散栏饲养,每天于07:30和14:30饲喂,自由饮水。试验动物全混合日粮(TMR)组成及营养组分见表 2。于晨饲后3 h分别从2头牛瘤胃瘘管采集瘤胃液各1 000 mL,置于39 ℃预测的保温瓶中并迅速带回实验室。将采集的瘤胃液充分混匀后经4层纱布过滤[同时通入二氧化碳(CO2)]备用,且整个操作过程保证瘤胃液处于39 ℃。
|
|
表 2 奶牛全混合日粮组成及营养水平(干物质基础) Table 2 Composition and nutrient levels of the TMR for dairy cows (DM basis) |
体外发酵装置由德国Endress+Hauser公司生产的产气全自动记录装置(Cerabar T PMP131, Memograph M RSG40)和奥特奇公司提供软件系统组成。发酵所需缓冲液组成:蒸馏水1.881 L、磷酸氢二钠1.576 g、磷酸二氢钾2.605 g、六水合氯化镁0.210 g、碳酸氢铵2.814 g、碳酸氢钠10.838 g、1 g/L刃天青溶液2.0 mL、还原性溶液(组成为蒸馏水250 mL、L半胱氨酸盐酸盐1.638 g、氢氧化钠0.42 g)119.05 mL。在配制好的缓冲液中通入饱和的CO2,直到缓冲液变成无色透明的液体。缓冲液预热至39 ℃,与新鲜瘤胃液以2 : 1(V/V)的比例混合,保持混合发酵液为漩涡混匀状态,温度为39 ℃,并持续通入CO2。称取0.5 g样品到已知重量(105 ℃烘干2 h后称量)的F75滤袋中并封口。样品放入对应编号的发酵瓶中,通入CO2,拧紧瓶盖,将所有发酵瓶与气压记录系统链接,连续10~12 h记录气压变化,检查发酵瓶的气密性。经检验气密性良好的发酵瓶中用抽滤泵泵入混合发酵液100 mL,每个样品设计6个重复,并设计3个空白用于数据矫正。样品分别连续发酵24和48 h,实时监控发酵瓶连续48 h的产气量并自动记录。
1.4 样品采集和处理体外发酵24 h后每组分别取出3个发酵瓶,取发酵液5 mL到离心管中并于-80 ℃保存,用于微生物总DNA的提取。取出滤袋在自来水下冲洗直到水无色无味,冲洗干净的滤袋在105 ℃条件下烘干4 h至恒重,计算样品的干物质消失率(dry matter disappearance rate, DMD)。另采集50 mL发酵液分装于离心管中,测定pH,然后3 500 r/min离心15 min,用于测定挥发性脂肪酸(VFA)、氨态氮(NH3-N)和微生物蛋白(MCP)浓度。其中用于测定VFA和NH3-N浓度的样品中按比例加入25%偏磷酸溶液(5 : 1,V/V),-20 ℃保存待测。
1.5 测定指标及方法发酵底物、TMR的干物质、粗灰分、粗蛋白质含量,发酵24 h残渣的干物质含量的测定参照AOAC(2000)[9]的方法。发酵底物、TMR的淀粉含量采用酶法测定,淀粉葡萄糖苷酶及α-淀粉酶购自爱尔兰Megazyme公司。发酵底物、TMR的中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)含量参照Van Soest等[10]的方法,采用Ankom 220纤维分析仪(美国ANKOM公司)测定。
发酵液pH采用Sartorius Basic pH Meter PB-20酸度计测定。发酵液NH3-N浓度采用Broderick等[11]报道的靛酚比色法测定。发酵液VFA浓度采用日本岛津GC-200气相色谱仪测定,色谱条件如下:气化室参数,载气为氮气,载气温度220 ℃,分流比40 : 1;进样量为0.4 μL;色谱柱参数, 流量2.0 mL/min,平均线速度为38 cm/s;柱温箱参数, 升温程序为120 ℃ 3 min, 以10 ℃/min的速度升温至180 ℃,保持1 min;检测器参数,氢气流量为40 mL/min,空气流量为450 mL/min,尾吹流量为45 mL/min,火焰氢离子检测器(FID)温度为250 ℃。
发酵液中MCP浓度的测定采用嘌呤碱基法测定[12]。利用酵母RNA为标准品制作标准曲线,10 mL发酵液经前处理后利用UV-2000型紫外分光光度计在260 nm处比色,测定紫外吸光度。根据吸光度值及标准曲线计算样品RNA浓度。MCP计算公式如下:
微生物蛋白氮浓度(mg/mL)=RNA浓度(mg/mL)×RNA含氮量(17.83%)/细菌氮中RNA含氮量(10%)×稀释倍数;
MCP浓度(mg/mL)=微生物蛋白氮浓度(mg/mL)×6.25。
发酵液微生物相对定量:发酵液总DNA的提取采用珠磨-十六烷基三甲基溴化铵(CTAB)法[13]。DNA经紫外分光光度计测定其浓度和纯度,确保DNA在260与280 nm处OD值的比值在1.6~1.8,且利用琼脂糖凝胶电泳检测DNA在加样孔附近出现整齐的亮带,将DNA样品-20 ℃保存备用。
利用实时荧光定量PCR(RT-qPCR)技术检测微生物的相对数量,所用仪器为ABI7500型PCR仪,RT-qPCR的反应条件及体系组成参照SYBR Premix Ex TaqTM试剂建立20 μL反应体系。反应程序为:95 ℃预变性5 min,95 ℃变性5 s,50~55 ℃退火30 s,72 ℃延伸40 s,35个循环;每个样品3个重复。引物序列见表 3,由上海生工生物工程有限公司合成。
|
|
表 3 引物序列 Table 3 Primer sequences |
目标细菌相对数量表示为该菌相对于瘤胃总细菌16S rDNA的百分比:

|
式中:Ct目标细菌为目标细菌的循环阈值;Ct总细菌为总细菌的循环阈值。
1.6 产气量和产气参数的计算计算4、8、12、24、36和48 h的产气量,采用以下动态发酵模型计算产气参数:
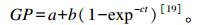
|
式中:a为快速发酵部分产气量(mL);b为慢速发酵部分产气量(mL);c为产气速率(%/h);a+b为潜在产气量(mL);GP为t时间点的产气量(mL)。根据非线性最小二乘法原理,求出a、b和c的值。
1.7 数据处理与统计数据采用SAS 9.2软件处理,用Mixed模型进行统计分析。P < 0.05表示差异显著。
2 结果与分析 2.1 DCFF与羊草组合替代苜蓿干草对体外发酵产气量和产气参数的影响由表 4可知,随着替代比例的增加,各时间点产气量均随之增加,但发酵12 h后15DCFF组产气量显著低于11DCFF组(P < 0.05),与7DCFF组差异不显著(P>0.05)。11DCFF组12 h后产气量均显著高于其他各组(P < 0.05)。7DCFF组与15DCFF组各时间点产气量差异不显著(P>0.05),且均显著高于0DCFF组(P < 0.05)。0DCFF组与3DCFF组在发酵前36 h产气量差异不显著(P>0.05)。
|
|
表 4 DCFF与羊草组合替代苜蓿干草对体外发酵产气量及产气参数的影响 Table 4 Effects of replacing alfalfa hay with DCFF and Chinese leymus on gas production and gas parameters of in vitro fermentation |
3DCFF和7DCFF组的快速发酵部分产气量较低,显著低于11DCFF和15DCFF组(P < 0.05)。11DCFF组慢速发酵部分产气量和潜在产气量最大,显著高于其他各组(P < 0.05)。0DCFF组的潜在产气量显著低于其他各组(P < 0.05),产气速度显著低于7DCFF、11DCFF、15DCFF组(P < 0.05)。
2.2 DCFF与羊草组合替代苜蓿干草对体外发酵参数的影响由表 5可知,与0DCFF组相比,11DCFF和15DCFF组干物质消失率显著提高(P < 0.05)。随着替代比例的增加,发酵液pH随之降低,7DCFF、11DCFF、15DCFF组显著低于0DCFF、3DCFF组(P < 0.05),11DCFF、15DCFF组显著低于7DCFF组(P < 0.05)。11DCFF和15DCFF组发酵液NH3-N浓度较高,0DCFF和3DCFF组较低,差异显著(P < 0.05)。苜蓿干草被部分替代后,发酵液MCP浓度有所提高,7DCFF和11DCFF组显著高于0DCFF组(P < 0.05)。与0DCFF组相比,苜蓿干草被部分替代后,发酵液总挥发性脂肪酸浓度显著提高(P < 0.05),其中以11DCFF和15DCFF组较高。11DCFF、15DCFF组发酵液乙酸、丙酸、丁酸浓度显著高于0DCFF组(P < 0.05)。发酵液乙酸/丙酸随着替代比例的增加而降低,0DCFF组显著高于其他各组(P < 0.05)。
|
|
表 5 DCFF与羊草组合替代苜蓿干草对体外发酵参数的影响 Table 5 Effects of replacing alfalfa hay with DCFF and Chinese leymus on in vitro fermenation parameters |
由表 6可知,从纤维分解菌上来看:11DCFF、15DCFF组发酵液黄色瘤胃球菌、产琥珀酸丝状杆菌相对数量显著高于0DCFF、3DCFF组(P < 0.05), 7DCFF、11DCFF、15DCFF组发酵液溶纤维丁酸弧菌相对数量显著高于其他2组(P < 0.05),11DCFF、15DCFF组显著高于7DCFF组(P < 0.05)。各组发酵液白色瘤胃球菌相对数量差异不显著(P>0.05)。从淀粉分解菌来看:发酵液牛链球菌、嗜淀粉瘤胃杆菌、溶淀粉琥珀酸单胞菌的相对数量在各组间差异不显著(P>0.05)。
|
|
表 6 DCFF与羊草组合替代苜蓿干草对体外发酵发酵液微生物区系的影响 Table 6 Effects of replacing alfalfa hay with DCFF and Chinese leymus on in vitro fermentation fluid microflora |
饲粮经瘤胃微生物发酵后的产气量是衡量饲粮可发酵程度的重要指标,发酵产气量与营养物质的消化率呈正相关[20]。饲粮碳水化合物和粗蛋白质是发酵产气的主要来源,饲粮中可发酵养分含量和瘤胃微生物活性与发酵产气量显著相关[21]。本试验中,11DCFF组各时间点产气量和慢速发酵部分产气量均高于其他各组,说明11DCFF组饲粮消化率最高,可发酵有机物含量最高。DCFF含有较高含量的可降解粗蛋白质和可发酵纤维,其干物质在瘤胃中的可降解部分大于其他粗饲料[4]。Silva等[22]研究认为不同粗饲料组合可能出现饲料间的正组合效应,即改善低质粗饲料的消化率,原因是当饲粮中低质粗饲料和优质粗饲料组合时,降解纤维的优势菌群会首先附着于易消化的纤维上,并快速增殖生长,从而提高低质粗饲料的降解率,继而提高产气量及NH3-N、VFA等的浓度。因此,本试验中DCFF与羊草组合部分替代苜蓿干草后可能产生了正组合效应,一定程度上提高了不易消化羊草的降解率,所以7DCFF、11DCFF、15DCFF组饲粮的产气量相对于0DCFF和3DCFF组饲粮均有所提高。0DCFF组饲粮中由于粗饲料组成比较单一,苜蓿干草的干物质可消化部分含量较高,ADF含量亦高于DCFF,NDF含量较低,所以0DCFF组饲粮快速发酵部分产气量相对较高,而慢速发酵部分产气量及产气速度相对较低。
pH则是反映瘤胃内环境的重要指标,是影响瘤胃微生物生长代谢的重要因素,偏离正常范围的pH会降低瘤胃微生物活性,不利于瘤胃微生物发酵饲料养分及其自身的生长和繁殖[23]。瘤胃中纤维分解菌的最佳活性pH为6.2~6.8,如果pH低于6.2,纤维分解菌的活性降低、繁殖受限,纤维类物质的降解率降低[24]。本试验中,随着替代比例的增加,发酵24 h发酵液pH呈降低的趋势,但均处在正常pH范围内,说明发酵环境稳定,有利于微生物的生长和代谢。VFA的产生和积累导致瘤胃液pH下降,随着替代比例的增加,发酵液VFA浓度提高,因此pH呈降低趋势。
NH3-N是含氮物质在瘤胃内分解的主要产物,其浓度可以反映饲粮蛋白质在瘤胃中的降解情况及其被微生物利用的效率。瘤胃中适宜的NH3-N浓度是提高MCP合成效率的必要条件,浓度过高说明微生物利用氨的速度与生成氨的速度不协同,可能造成蛋白质的浪费;过低的NH3-N浓度抑制微生物的生长,降低MCP的合成效率[25]。Hoover[26]报道瘤胃中微生物生长的最适宜氨浓度为3.3~8.0 mg/dL,而大多数情况下瘤胃液NH3-N浓度在较大的范围(1~76 mg/dL)内波动。本试验中,随替代比例的增加,发酵液中NH3-N浓度升高,说明饲粮粗蛋白质降解率有所提高,为瘤胃微生物发酵提供了更多的底物。DCFF的CP快速发酵部分含量显著高于苜蓿干草,CP的瘤胃降解率高于苜蓿干草[27]。因此,11DCFF和15DCFF组饲粮的可降解粗蛋白质含量有所提高,为瘤胃微生物提供了比较充足的氮源。反刍动物主要以VFA的形式利用能量,碳水化合物在瘤胃中发酵产生大量的VFA,其中乙酸、丙酸和丁酸占总挥发性脂肪酸的95%以上[28]。Leng等[29]认为瘤胃液VFA浓度和比例主要与饲粮非纤维性碳水化合物(NFC)和NDF含量有关;饲粮中粗饲料品质也会影响瘤胃的发酵模式和功能[30]。本试验中,DCFF与羊草组合替代饲粮中不同比例苜蓿干草经体外发酵后乙酸、丙酸和丁酸浓度有所提高,这可能是因为粗饲料组合影响了瘤胃微生物区系及纤维降解酶活性。同时,DCFF富含半纤维素[28],随着饲粮中DCFF比例的提高,饲粮半纤维素含量升高,ADF含量降低,饲粮可降解纤维含量的增加提高了发酵液VFA浓度,从而为瘤胃微生物生长繁殖提供充足的能量。此外,较高含量的NFC可以提高饲粮的降解速率和降解率[31]。因此,11DCFF和15DCFF组饲粮干物质消失率较高。
张智慧等[32]研究发现,不同粗饲料组合会影响瘤胃内溶纤维丁酸弧菌、产琥珀酸丝状杆菌及黄色瘤胃球菌等分解纤维的菌群的数量,从而影响饲粮纤维的降解和VFA浓度。根据Silva等[22]的组合效应理论,本试验中,瘤胃微生物可能优先利用DCFF中较易消化的纤维,并提高微生物活性,进一步提高其他ADF含量较高的粗饲料如羊草的纤维降解率,从而提高发酵液乙酸浓度。不同种类饲料间可以通过营养物质间的互补作用来弥补单一饲料营养物质不平衡的缺点,为瘤胃微生物代谢提供更好的条件,从而提高瘤胃发酵水平和MCP浓度,为奶牛生产提供更多的营养物质[33]。本试验中,DCFF与羊草组合部分替代苜蓿干草后整体发酵水平提高,发酵液NH3-N和VFA浓度增加,微生物的生长代谢加快,MCP浓度有所增加,这可能与DCFF、羊草、苜蓿干草及玉米青贮间正组合效应有关,体外发酵产气参数也表明这种正组合效应可能存在。
瘤胃中的纤维分解菌主要有黄色瘤胃球菌、白色瘤胃球菌、产琥珀酸丝状杆菌和溶纤维丁酸弧菌,本试验结果表明体外发酵24 h发酵液黄色瘤胃球菌、产琥珀酸丝状杆菌和溶纤维丁酸弧菌相对数量随替代比例增加而提高。Silva等[22]研究认为,相比于难消化纤维如秸秆,瘤胃细菌在易消化的纤维饲料表面附着能力更强,有利于细菌更好地作用于食糜团,从而提高微生物繁殖效率和饲料的利用效率。溶纤维丁酸弧菌既能够降解纤维,同时也是最主要的蛋白质分解菌,DCFF中高含量的可溶性蛋白质为其生长提供了充足的氮素。
4 结论① DCFF与羊草组合替代奶牛饲粮中部分苜蓿干草提高了体外发酵48 h的产气量、潜在产气量和产气速率,提高了体外发酵24 h发酵液MCP、NH3-N、乙酸、丙酸、丁酸和TVFA浓度,并提高了体外发酵24 h发酵液主要纤维分解菌的相对数量。
② DCFF与羊草组合替代饲粮中17.50%和22.90%苜蓿干草较为适宜,此时饲粮中DCFF的比例分别为11.00%和15.00%,但DCFF属于短纤维饲料,缺乏物理有效纤维,因此还需要进一步在体内试验中验证。
| [1] |
韩成伟, 安载学, 王玮, 等. 1992-2016年我国苜蓿进出口变化及成因分析[J]. 农业网络信息, 2016(12): 16-20. DOI:10.3969/j.issn.1672-6251.2016.12.005 |
| [2] |
HAO X Y, GAO H, WANG X Y, et al. Replacing alfalfa hay with dry corn gluten feed and Chinese wild rye grass:effects on rumen fermentation, rumen microbial protein synthesis, and lactation performance in lactating dairy cows[J]. Journal of Dairy Science, 2017, 100(4): 2672-2681. DOI:10.3168/jds.2016-11645 |
| [3] |
SARWAR M, FIRKINS J L, EASTRIDGE M L. Effect of replacing neutral detergent fiber of forage with soyhulls and corn gluten feed for dairy heifers[J]. Journal of Dairy Science, 1991, 74(3): 1006-1017. DOI:10.3168/jds.S0022-0302(91)78250-7 |
| [4] |
KELZER J M, KONONOFF P J, TEDESCHI L O, et al. Evaluation of protein fractionation and ruminal and intestinal digestibility of corn milling co-products[J]. Journal of Dairy Science, 2010, 93(6): 2803-2815. DOI:10.3168/jds.2009-2460 |
| [5] |
MACLEOD G K. Wet corn gluten feed for dairy cows[J]. Highlights of Agricultural Research in Ontario, 1984, 7(1): 12-14. |
| [6] |
MONTGOMERY S P, DROUILLARD J S, SINDT J J, et al. Combinations of alfalfa hay and wet corn gluten feed in limit-fed growing diets for beef cattle[J]. Journal of Animal Science, 2003, 81(7): 1671-1682. DOI:10.2527/2003.8171671x |
| [7] |
FIRKINS J L, EASTRIDGE M L, PALMQUIST D L. Replacement of corn silage with corn gluten feed and sodium bicarbonate for lactating dairy cows[J]. Journal of Dairy Science, 1991, 74(6): 1944-1952. DOI:10.3168/jds.S0022-0302(91)78360-4 |
| [8] |
中华人民共和国农业部. NY/T 34-2004奶牛饲养标准[S]. 北京: 中国农业出版社, 2004.
|
| [9] |
AOAC International. Official methods of analysis[M]. .
|
| [10] |
VAN SOEST P J, ROBERTSON J B, LEWIS B A. Methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition[J]. Journal of Dairy Science, 1991, 74(10): 3583-3597. DOI:10.3168/jds.S0022-0302(91)78551-2 |
| [11] |
BRODERICK G A, KANG J H. Automated simultaneous determination of ammonia and total amino acids in ruminal fluid and in vitro media[J]. Journal of Dairy Science, 1980, 63(1): 64-75. DOI:10.3168/jds.S0022-0302(80)82888-8 |
| [12] |
MAKKAR H P S, BECKER K. Purine quantification in digesta from ruminants by spectrophotometric and HPLC methods[J]. British Journal of Nutrition, 1999, 81(2): 107-112. |
| [13] |
刘凯玉. 不同方法处理稻秸对瘤胃降解及其体外甲烷产生量的影响[D]. 硕士学位论文. 哈尔滨: 东北农业大学, 2014.
|
| [14] |
KHAFIPOUR E, KRAUSE D O, PLAIZIER J C. A garin-based subacute ruminal acidosis challenge causes translocation of lipopolysaccharide and triggers inflammation[J]. Journal of Dairy Science, 2009, 92(3): 1060-1070. DOI:10.3168/jds.2008-1389 |
| [15] |
CERRATO-SÁNCHEZ M, CALSAMIGLIA S, FERRET A. Effect of the magnitude of the decrease of rumen pH on rumen fermentation in a dual-flow continuous culture system[J]. Journal of Animal Science, 2008, 86(2): 378-383. DOI:10.2527/jas.2007-0180 |
| [16] |
WANG R F, CAO W W, CERNIGLIA C E. PCR detection of Ruminococcus spp.in humen and animal faecal samples[J]. Molecular and Cellular Probes, 1997, 11(4): 259-265. DOI:10.1006/mcpr.1997.0111 |
| [17] |
STEVEMSON D M, WEIMER P J. Dominance of Prevotella and low abundance of classical ruminal bacterial species in the bovine rumen revealed by relative quantification real-time PCR[J]. Applied Microbiology and Biotechnology, 2009, 75(5): 165-174. |
| [18] |
KHAFIPOUR E, LI S C, PLAIZIER J C, et al. Rumen microbiome composition determined using two nutritional models of subacute ruminal acidosis[J]. Applied and Environmental Microbiology, 2009, 75(22): 7115-7124. DOI:10.1128/AEM.00739-09 |
| [19] |
ØRSKOV E R, MCDONALD I. The estimation of protein degradability in the rumen from incubation measurements weighted according to rate of passage[J]. Journal of Agricultural Science, 1979, 92(2): 499-503. DOI:10.1017/S0021859600063048 |
| [20] |
MENKE K H, RAAB L, SALEWSKI A, et al. The estimation of the digestibility and metabolizable energy content of ruminant feedingstuffs from the gas production when they are incubated with rumen liquor in vitro[J]. Journal of Agricultural Science, 1979, 93(1): 217-222. DOI:10.1017/S0021859600086305 |
| [21] |
雷冬至, 金曙光, 乌仁塔娜. 用体外产气法评价不同粗饲料与相同精料间的组合效应[J]. 饲料工业, 2009, 30(3): 30-33. |
| [22] |
SILVA A T, GREENHALGH J F D, ØRSKOV E R. Influence of ammonia treatment and supplementation on the intake, digestibility and weight gain of sheep and cattle on barley straw diets[J]. Animal Production, 1989, 48(1): 99-108. DOI:10.1017/S0003356100003834 |
| [23] |
RUSSELL J B. The importance of pH in the regulation of ruminal acetate to propionate ratio and methane production in vitro[J]. Journal of Dairy Science, 1998, 81(12): 3222-3230. DOI:10.3168/jds.S0022-0302(98)75886-2 |
| [24] |
卢德勋. 系统动物营养学导论[M]. 北京: 中国农业大学出版社, 2004.
|
| [25] |
张吉鹍, 李龙瑞, 吴文旋, 等. 稻草补饲苜蓿对山羊瘤胃发酵的组合效应[J]. 草业科学, 2014, 31(2): 313-320. DOI:10.11829/j.issn.1001-0629.2013-0202 |
| [26] |
HOOVER W H. Chemical factors involved in ruminal fiber digestion[J]. Journal of Dairy Science, 1986, 69(10): 2755-2766. DOI:10.3168/jds.S0022-0302(86)80724-X |
| [27] |
郝小燕, 高红, 张幸怡, 等. 应用康奈尔净碳水化合物-蛋白质体系和NRC模型比较常用粗饲料和玉米纤维饲料的营养价值[J]. 动物营养学报, 2016, 28(3): 842-850. |
| [28] |
李炯明, 庄苏, 王恬, 等. 海南霉素对人工瘤胃体外发酵调控的影响[J]. 家畜生态学报, 2007, 28(1): 41-46. |
| [29] |
LENG R A, BRETT D J. Simultaneous measurements of the rates of production of acetic, propionic and butyric acids in the rumen of sheep on different diets and the correlation between production rates and concentrations of these acids in the rumen[J]. British Journal of Nutrition, 1966, 20(3): 541-552. DOI:10.1079/BJN19660053 |
| [30] |
刘大程, 卢德勋, 侯先志, 等. 不同品质粗饲料日粮对瘤胃发酵及主要纤维分解菌的影响[J]. 中国农业科学, 2008, 41(4): 1199-1206. |
| [31] |
ZHU W, FU Y, WANG B, et al. Effects of dietary forage sources on rumen microbial protein synthesis and milk performance in early lactating dairy cows[J]. Journal of Dairy Science, 2013, 96(3): 1727-1734. DOI:10.3168/jds.2012-5756 |
| [32] |
张智慧, 杨红建, 任清长, 等. 不同粗饲料组合全混合日粮对泌乳奶牛瘤胃液微生物蛋白浓度24h变化和小肠微生物蛋白流量的影响[J]. 动物营养学报, 2013, 25(9): 2005-2011. |
| [33] |
谭支良, 卢德勋. 提高粗饲料利用效率的系统组合营养技术及其组合效应的研究进展[J]. 饲料博览, 1999(7): 6-10. |




