在海水鱼胚胎发育和卵黄期仔鱼阶段中,其生长发育所需营养完全依靠自身卵黄物质供给。而脂质作为卵黄重要的营养物质之一,通常被用来作为能量代谢的底物和膜生物生产的结构性成分,或参与仔鱼细胞分化和器官组织形成[1],对仔鱼生长发育与存活具有决定性作用[2]。糖是自然界中分布广泛的有机物,也是鱼类体内新陈代谢不可缺少的营养元素,是供能物质之一。目前,对于水产动物胚胎阶段和尚未开口摄食仔鱼阶段可采用溶液浸泡法补充营养物质[3]。李俊霞[4]研究表明,采用孵化溶液中添加1.5%的葡萄糖能显著地促进斑马鱼(Danio rerio)胚胎的发育及提高仔鱼成活率;薛凌展[5]研究发现,四倍体栉孔扇贝(Chlamys ferreri)胚胎发育至担轮幼虫期,孵化溶液中添加2 mmol/L的葡萄糖可以显著降低胚胎的畸形率和滞育率;熊铧龙等[6]和蒋左玉[7]研究结果发现,水体中添加15 g/L葡萄糖进行普安银鲫(Carassius auratus gibelio)受精卵孵化,能显著缩短出膜时间及提高孵化率,并能促进胚胎发育过程中的乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACC)和脂肪酸合成酶(fatty acid synthase,FAS)的合成与分泌。上述研究表明,水体中添加适当浓度的葡萄糖,能为仔鱼或幼虫提供营养补充,从而促进早期发育。在海水养殖经济鱼类多以幼鱼为研究对象,采用饲料添加法研究适宜的葡萄糖添加水平对其生长性能的影响,如斜带石斑鱼(Epinephelus coioides)[8]、军曹鱼(Rachycentron canadum)[9]。尚未见葡萄糖浓度对海水鱼早期发育影响的相关报道。
石斑鱼作为重要的海水养殖经济鱼类,因其味道鲜美、营养丰富,在我国东南沿海及东南亚地区广泛养殖。然而,石斑鱼产业可持续发展受到种质资源退化和鱼苗大规模生产的制约,为了解决这些问题,杂交技术被引入石斑鱼人工繁育[10],已获得具有不同优良性状的杂交石斑鱼[11-13],并已利用转录组分析揭示石斑鱼杂交优势的分子机制[10]。本研究团队开展褐点石斑鱼(Epinephelus fuscoguttatus ♀)和清水石斑鱼(Epinephelus polyphekadion ♂)杂交育种研究,并成功培育出杂交石斑鱼子1代,在盐度对其受精卵孵化和卵黄囊仔鱼形态的影响[14]、形态性状对体质量影响的通径分析[15]进行了研究。国外学者曾报道该杂交石斑鱼生长速度比亲本快,具有生长杂交优势[16]。目前,该杂交石斑鱼的人工育苗技术仍不稳定,表现为胚胎发育孵化率及育苗成活率低。因此,本研究将一定浓度葡萄糖添加到孵化水体中,探讨了杂交石斑鱼受精卵孵化率、初孵仔鱼畸形率以及卵黄囊仔鱼发育过程中与脂质代谢密切相关的ACC和FAS的活性变化规律,旨在为有效提高其人工育苗的成活率提供参考。
1 材料与方法 1.1 试验材料本试验于2016年5月在广东海洋大学鱼类增养殖试验进行。杂交石斑鱼的母本(褐点石斑鱼)为广东海洋大学水产学院鱼类团队繁育的第3代群体,体质量为11~14 kg,父本(清水石斑鱼)由海南省俊泓实业有限公司提供,体质量为5~7 kg。经过人工催产、干法授精获得杂交石斑鱼受精卵。受精卵在盐度31的自然海水孵化桶中孵化,水温逐渐降至22 ℃,然后用150目筛绢网捞取上浮卵打包。采用双层尼龙袋充纯氧低温密封运输至实验室,运输密度为10 g/L。运至实验室后,先平衡孵化水体与尼龙袋内的水体温度,然后将受精卵放入孵化水槽(长70 cm×宽50 cm×高60 cm)中微充气进行孵化。受精卵抵达实验室后,显微镜下观察其发育至原肠中期,并于此发育时期开始试验。
1.2 试验方法 1.2.1 孵化率与畸形率设置孵化水体葡萄糖(广东光华科技股份有限公司,分析纯)浓度分别为0(对照组)、2、4、6、8、10 mg/L,将受精卵放在1 000 mL烧杯中,分别装入700 mL上述不同葡萄糖浓度的孵化水体,每个烧杯放200~250个受精卵,每组设3个重复,孵化密度约为0.3个/mL,连续微充气孵化,使得受精卵轻度翻滚。为避免孵化温度波动太大,试验在数显恒温水浴锅(HH-6,邦西仪器科技有限公司)中进行。孵化期间水质指标:温度(27.5±0.5) ℃,盐度29~31,溶解氧浓度5.5~5.8 mg/L,光照强度600~800 lx,光照周期12 h光照:12 h黑暗,氨氮和亚硝酸盐未测出。连续观察各组孵化情况,记录每组出膜时间,并于出膜后6 h用海水配制的3%甲醛溶液固定所有的初孵仔鱼和未孵出的受精卵[17],统计孵化率。以初孵仔鱼脊椎弯曲、油球异位或异数为畸形判断标准[17]。初孵仔鱼总数占受精卵总数的百分比为孵化率;畸形仔鱼数量占全部初孵仔鱼总数的百分比为畸形率。
1.2.2 仔鱼全长与脂质代谢酶活性设置孵化水体葡萄糖浓度为0(对照组)、2、4、6、8、10 mg/L,在水槽(长70 cm×宽50 cm×高60 cm)中进行受精卵孵化及卵黄囊仔鱼培育。孵化水槽中受精卵的平均密度为500个/L,连续微充气孵化,孵化水温28~29 ℃,盐度29~30,pH 8.1,溶解氧浓度大于5 mg/L,光照强度600~800 lx,光照周期12 h光照: 12 h黑暗,氨氮和亚硝酸盐未测出,每12 h换1次同浓度的葡萄糖孵化水体,每次换水量为孵化桶容积的1/3。每组设3个重复。用显微镜连续观察发育情况,并记录发育时间。分别在发育至1、2和3日龄仔鱼取样。3日龄仔鱼开口摄食,以经200目筛绢网过滤的轮虫为仔鱼的开口饵料,密度大约为20个/mL。用胶头滴管吸取每个取样点每组仔鱼10尾,用测微尺在显微镜下测定仔鱼全长;每个取样点取样500个仔鱼,用滤纸吸干水后放入1.5 mL的离心管中,并置于-80 ℃低温冰箱保存,用于ACC和FAS活性的测定。
蛋白质含量用考马斯亮蓝法测定,采用蛋白质定量测试盒(A045-2,南京建成生物工程研究所试剂盒)测定。ACC和FAS活性均采用比色法,用酶联免疫分析试剂盒(H232、H231,南京建成生物工程研究所试剂盒)测定,具体的测定步骤和计算方法参照试剂盒说明书进行。ACC活性定义为:每小时每毫克组织蛋白质产生1 μmol无机磷的量为1个活性单位。FAS活性定义为:37 ℃中每毫克蛋白质每分钟氧化1 μmol还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)为1个活性单位。
1.3 数据统计分析数据结果以平均值±标准差(X±SD)表示。采用SPSS 11.0软件对不同组间的试验数据进行单因素方差分析和Duncan氏法多重比较,当P<0.05时为差异显著,P>0.05时为差异不显著。
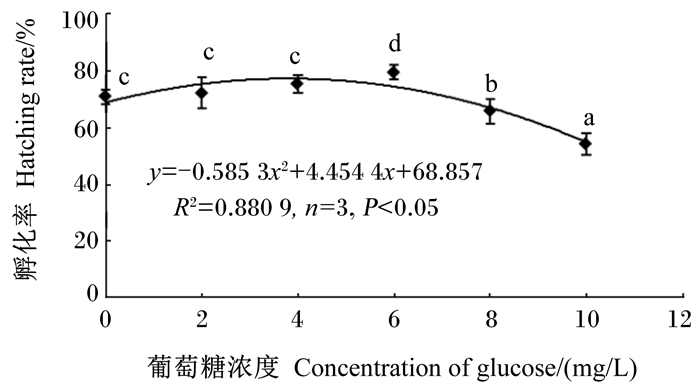
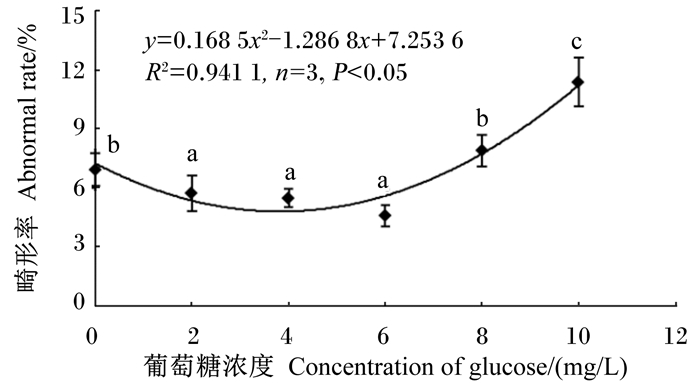
2 结果 2.1 葡萄糖对杂交石斑鱼受精卵孵化率及初孵仔鱼畸形率的影响杂交石斑鱼在不同浓度葡萄糖下受精卵孵化率及初孵仔鱼畸形率见图 1、图 2。由图可知,随着葡萄糖添加浓度的上升,受精卵孵化率呈“升高—降低”的变化,初孵仔鱼畸形率呈“降低—升高”的变化。添加4 mg/L葡萄糖的组受精卵孵化率比对照组提高了6.17%(P>0.05),初孵仔鱼畸形率比对照组下降了21.03%(P<0.05);添加6 mg/L葡萄糖的组中,受精卵孵化率比对照组提高了12.18%(P<0.05),初孵仔鱼畸形率比对照组下降了33.85%(P<0.05)。单因素方差分析表明,葡萄糖浓度对受精卵孵化率及初孵仔鱼畸形率均有显著影响(P<0.05)。葡萄糖浓度分别与受精卵孵化率及初孵仔鱼畸形率的相关性可用一元二次方程描述(图 1、图 2)。由回归方程计算出受精卵孵化率最大值和初孵仔鱼畸形率达最小值时,葡萄糖最适浓度为3.8 mg/L。
|
数据点标注不同字母表示组间差异显著(P<0.05)。图 2同。 Data points with different letters mean significantly difference between groups (P < 0.05). The same as Fig. 2. 图 1 不同葡萄糖浓度下杂交石斑鱼受精卵孵化率的变化 Figure 1 Changes of hatching rate of hybrid grouper (Epinephelus fuscoguttatus ♀× Epinephelus polyphekadion ♂) fertilized egg under different concentrations of glucose |
|
图 2 不同葡萄糖浓度下杂交石斑鱼初孵仔鱼畸形率的变化 Figure 2 Changes of abnormal rate of newly hatched larvae of hybrid grouper (Epinephelus fuscoguttatus ♀× Epinephelus polyphekadion ♂) under different concentrations of glucose |
不同葡萄糖浓度下杂交石斑鱼卵黄囊仔鱼全长测定结果见表 1。由表可知,在孵化后1日龄仔鱼阶段,添加2 mg/L葡萄糖的组与对照组之间无显著差异(P>0.05),其他葡萄糖添加组则显著大于对照组(P<0.05)。在2日龄仔鱼阶段,添加葡萄糖组仔鱼全长均显著大于对照组(P<0.05)。在3日龄仔鱼阶段,添加8和10 mg/L葡萄糖的组与对照组之间无显著差异(P>0.05),其他葡萄糖添加组则显著大于对照组(P<0.05)。葡萄糖浓度低于6 mg/L时,1~3日龄仔鱼全长随着葡萄糖浓度的增加而增加;葡萄糖浓度超过6 mg/L时,仔鱼全长则表现出下降的趋势。
|
|
表 1 不同葡萄糖浓度下杂交石斑鱼卵黄囊仔鱼全长的变化 Table 1 Changes of total length of yolk-sac larvae of hybrid grouper (Epinephelus fuscoguttatus ♀× Epinephelus polyphekadion ♂) under different concentrations of glucose (n=3) |
不同葡萄糖浓度下杂交石斑鱼卵黄囊仔鱼发育过程中ACC活性的变化见表 2。由表可知,1~3日龄仔鱼,各葡萄糖添加组的ACC活性均显著高于对照组(P<0.05)。在1日龄仔鱼阶段,随着葡萄糖浓度的增加,ACC活性呈上升的变化,添加6、8和10 mg/L葡萄糖的组间无显著差异(P>0.05),其他各组差异显著(P<0.05)。在2和3日龄仔鱼阶段,随着葡萄糖浓度的增加,ACC活性呈“上升—下降”的变化,葡萄糖浓度低于6 mg/L时,ACC活性均呈显著上升的变化(P<0.05), 葡萄糖浓度达到8、10 mg/L时,ACC活性则较6 mg/L时显著降低(P<0.05)。添加6 mg/L葡萄糖的组1、2、3日龄ACC活性分别比对照组提高了2.8倍、3.2倍和2.9倍。
|
|
表 2 不同葡萄糖浓度下杂交石斑鱼卵黄囊仔鱼乙酰辅酶A羧化酶活性的变化 Table 2 Changes of ACC activity of yolk-sac larvae of hybrid grouper (Epinephelus fuscoguttatus ♀× Epinephelus polyphekadion ♂) (n=3) |
不同葡萄糖浓度下杂交石斑鱼卵黄囊仔鱼发育过程中FAS活性变化见表 3。由表可知,葡萄糖添加组FAS活性均显著高于对照组(P<0.05),且各组FAS活性在1~3日龄仔鱼阶段均随葡萄糖浓度增加呈上升变化。在1日龄仔鱼阶段,随着葡萄糖浓度的增加,FAS活性呈上升的变化,除了添加8、10 mg/L葡萄糖组差异不显著(P>0.05)外,其他各组差异显著(P<0.05)。在2和3日龄仔鱼阶段,随着葡萄糖浓度的增加,FAS活性呈“上升—平缓”的变化,葡萄糖浓度低于6 mg/L时,FAS活性均呈显著上升的变化(P<0.05),葡萄糖浓度超过6 mg/L时,FAS活性则呈无显著变化(P>0.05)。添加6 mg/L葡萄糖组1~3日龄仔鱼FAS活性分别比对照组提高了2.1倍、1.7倍和1.5倍。
|
|
表 3 不同葡萄糖浓度下杂交石斑鱼卵黄囊仔鱼脂肪酸合成酶活性的变化 Table 3 Changes of FAS activity of yolk-sac larvae of hybrid grouper (Epinephelus fuscoguttatus ♀× Epinephelus polyphekadion ♂) (n=3) |
鱼类在卵细胞发育阶段所累积的糖原库,作为一种能量物质和细胞膜组成,在鱼类受精作用、胚胎发育和能量代谢中发挥重要作用[18]。海水鱼类在胚胎发育和卵黄囊期发育过程中完全依赖内源性营养物质维持正常的生理活动[19-20]。已有的研究资料表明,在鱼类胚胎发育过程中一般依次利用糖类、蛋白质、脂类作为发育所需的供能物质[21],虽然葡萄糖不是胚胎发育中主要的能量来源物质,但其不需要进行分解可被机体吸收利用,利用效率高于其他糖类[22],这对胚胎发育也起到重要的作用[23]。李俊霞[4]、薛凌展[5]和熊铧龙等[6]研究表明,葡萄糖添加到胚胎培养液中可进入胚胎内发挥作用。本研究中,在杂交石斑鱼孵化水体中添加2~6 mg/L的葡萄糖,孵化率随着葡萄糖浓度的增加而逐渐升高,在添加6 mg/L葡萄糖的组中,孵化率显著高于对照组。推测其原因,一是杂交石斑鱼在出膜期,胚胎在卵膜内剧烈抖动,在这个过程需要消耗大量的能量帮助仔鱼出膜,适宜的浓度的葡萄糖进入胚胎内,提供部分能量,从而提高杂交石斑鱼的孵化率。二是可能与杂交石斑鱼早期发育阶段的营养物质代谢特点及卵内含有油球有关。海水鱼的胚胎发育期间脂类始终是主要的代谢能源[24],海水鱼胚胎发育前期阶段,胚胎中存在中性脂的合成代谢,这种可能是糖类或其他营养物质向脂肪转化的结果[20]。在孵化水体中添加适宜的葡萄糖,可促进脂肪合成代谢,提高脂类的累积,为仔鱼出膜提供更多的能量。同时吸收的葡萄糖也是仔鱼组织细胞组成成分以及合成非必需氨基酸的重要原料[25],这也许是添加葡萄糖组仔鱼在同时期内个体较大的主要原因。有研究资料表明,孵化水体中添加葡萄糖浓度为15 g/L对普安银鲫早期发育的促进作用最大[6];孵化水体中添加1.5%葡萄糖溶液能显著加快斑马鱼胚胎孵化时间,且孵化后的仔鱼发育状态良好[4];孵化水体中添加2 mmol/L的葡萄糖可显著提高四倍体栉孔扇贝担轮幼虫的比例,显著降低胚胎的畸形率[5]。本研究在杂交石斑鱼中获得最佳的葡萄糖浓度低于上述的研究结果,这反映了葡萄糖浓度对水产动物的早期发育影响因种而异。有研究资料表明,对于一些海产鱼类,如金头鲷(Sparus aurata)糖代谢对于胚胎正常发育至孵化阶段尤为重要,而缺少足够的糖代谢的胚胎停止发育,最终导致仔鱼受精卵孵化率降低[26]。有关杂交石斑鱼胚胎及卵黄囊仔鱼发育过程中脂类代谢特点有待进一步分析。
本研究中,孵化水体中葡萄糖的浓度达到8 mg/L时,杂交石斑鱼受精卵孵化率降低,初孵仔鱼畸形率增加,这反映高浓度的葡萄糖对其早期发育表现出负作用。高浓度的葡萄糖在斑马鱼[4, 27]、普安银鲫[6]的胚胎发育中也表现严重的负作用现象。推测这一现象的可能原因,一是添加过多的葡萄糖增加水体渗透压,鱼类早期发育阶段渗透压调节机制尚不完善,过高的渗透压导致生理代谢紊乱,从而降低孵化率及增加畸形率。二是高浓度葡萄糖能对胚胎发育造成损伤及阻滞,而这一损伤是通过多种代谢途径产生的活性氧所致[28]。因此,在杂交石斑鱼人工育苗中,通过回归方程计算最大受精卵孵化率时,添加到孵化水体的葡萄糖浓度为3.8 mg/L。
3.2 杂交石斑鱼卵黄囊仔鱼发育过程中ACC和FAS活性的变化特点有研究资料表明,鱼卵内脂质和脂肪酸消耗和转化直接影响仔鱼的成活率[29]。而ACC和FAS与脂质的代谢密切相关,其活性高低影响脂质的消耗和转化。蒋左玉等[30]研究了普安银鲫卵黄囊仔鱼发育过程中脂酶活性的变化特点,结果发现ACC和FAS活性呈升高趋势。Desrosiers等[31]研究了花狼鱼(Anarhichas minor)早期发育的能量代谢,发现各底物的代谢酶系统呈现不同程度的上升。本研究中,杂交石斑鱼1~3日龄卵黄囊仔鱼发育过程中ACC和FAS活性呈上升的变化趋势,这可能是杂交石斑鱼1、2日龄卵黄囊仔鱼为内源营养阶段,仔鱼各器官形成加快,消耗能量较大有关,发育至3日龄卵黄囊仔鱼,仔鱼逐渐开口摄食,其摄食器官和消化器官进一步完善,摄食和消化能力也有所加强,ACC和FAS活性也随之升高。本研究结果与蒋左玉等[30]、Desrosiers等[31]相类似。这说明了随着鱼类胚胎和仔鱼的发育和代谢活动的增强,代谢酶活性上升。有研究资料显示,早期发育过程中一些代谢酶的表达与卵的质量有关,如金头鲷的酸性磷酸酶、腺苷酸激酶可作为卵质量的可靠参数[32];6-磷酸葡萄糖脱氢酶活性可作为细点牙鲷(Dentex dentex L.)卵质量的判断标准[33]。通过研究杂交石斑鱼酶的代谢途径及活性来判断其卵的发育情况、仔鱼存活有待进一步探讨。
3.3 葡萄糖对杂交石斑鱼卵黄囊仔鱼发育过程中ACC和FAS活性的影响作为体内脂肪合成的关键酶之一,ACC参与脂肪酸从头合成的第一步反应,其活性高低可直接影响脂质的合成速度,对脂肪代谢活动具有重要作用[34]。在军曹鱼幼鱼(Rachycentron canadum)的研究中证实,饲料添加适宜量的葡萄糖对葡萄糖-6-磷酸脱氢酶活性有促进作用[9];在虹鳟(Oncorhynchus mykiss)的研究中也证实,适宜浓度的葡萄糖能显著提高葡萄糖-6-磷酸脱氢酶活性[35]。上述研究表明,通过饲料添加适宜浓度的葡萄糖会增加脂质代谢速度,从而增加脂肪的合成作用。本研究中,采用葡萄糖浸泡方法研究了杂交石斑鱼卵黄囊仔鱼发育过程,结果发现葡萄糖添加组ACC和FAS活性均显著高于对照组,这说明外源性葡萄糖进入仔鱼体内,对ACC和FAS有激活作用,从而快速脂肪酸的合成,为体内脂肪酸的沉积提供了保障。这与在普安银鲫上的研究结果[30]相类似。
4 结论① 通过回归方程计算,杂交石斑鱼获得最大受精卵孵化率时,孵化水体葡萄糖浓度为3.8 mg/L。
② 经6 mg/L葡萄糖溶液浸泡能显著提高杂交石斑鱼卵黄囊仔鱼发育中ACC和FAS活性。
| [1] |
宋志东, 李培玉. 卵生鱼类的内源性营养研究进展(一)[J]. 饲料与畜牧, 2014(9): 20-24. |
| [2] |
ROBIN J H, VINCENT B. Microparticulate diets as first food for gilthead sea bream larva (Sparus aurata):study of fatty acid incorporation[J]. Aquaculture, 2003, 225(1/2/3/): 463-474. |
| [3] |
蒋左玉, 姚俊杰, 熊铧龙, 等. 葡萄糖、维生素C对普安银鲫卵黄囊仔鱼发育中LPL和HL活性的影响[J]. 水生生物学报, 2015, 39(1): 73-79. DOI:10.7541/2015.10 |
| [4] |
李俊霞. 葡萄糖、蔗糖、氯化钠对斑马鱼胚胎发育的影响[D]. 硕士学位论文. 济南: 山东师范大学, 2007. http://cdmd.cnki.com.cn/Article/CDMD-10445-2008020726.htm
|
| [5] |
薛凌展. 环境和营养因子对四倍体栉孔扇贝胚胎及早期幼虫的影响[D]. 硕士学位论文. 福州: 福建师范大学, 2008. http://cdmd.cnki.com.cn/article/cdmd-10394-2008170349.htm
|
| [6] |
熊铧龙, 姚俊杰, 安苗, 等. 葡萄糖、维生素C对普安银鲫早期发育的影响[J]. 南方水产科学, 2014, 10(6): 88-92. |
| [7] |
蒋左玉. 普安银鲫早期发育过程中脂质代谢关键酶研究[D]. 硕士学位论文. 贵阳: 贵州大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10657-1015911298.htm
|
| [8] |
毛义波, 刘泓宇, 谭北平, 等. 饲料碳水化合物水平及饥饿处理对斜带石斑鱼生长及葡萄糖耐受能力的影响[J]. 水产学报, 2014, 38(4): 549-558. |
| [9] |
CUI X J, ZHOU Q C, LIANG H O, et al. Effects of dietary carbohydrate sources on the growth performance and hepatic carbohydrate metabolic enzyme activities of juvenile cobia (Rachycentron canadum Linnaeus.)[J]. Aquaculture Research, 2010, 42(1): 99-107. DOI:10.1111/are.2010.42.issue-1 |
| [10] |
SUN Y, GUO C Y, WANG D D, et al. Transcriptome analysis reveals the molecular mechanisms underlying growth superiority in a novel grouper hybrid (Epinephelus fuscogutatus♀× E.lanceolatus ♂)[J]. BMC Genetics, 2016, 17: 24. |
| [11] |
于欢欢, 李炎璐, 陈超, 等. 棕点石斑鱼(♀)×鞍带石斑鱼(♂)杂交F1仔、稚、幼鱼的摄食与生长特性分析[J]. 中国水产科学, 2015, 22(5): 968-977. |
| [12] |
李炎璐, 王清印, 陈超, 等. 云纹石斑鱼(♀)×七带石斑鱼(♂)杂交子一代胚胎发育及仔稚幼鱼形态学观察[J]. 中国水产科学, 2012, 19(5): 821-832. |
| [13] |
杨求华, 黄种持, 郑乐云, 等. 云纹石斑鱼(♀)×赤点石斑鱼(♂)杂交子代胚胎发育及生长[J]. 海洋渔业, 2014, 36(3): 224-231. |
| [14] |
黄建盛, 陈刚, 张健东, 等. 盐度对杂交石斑鱼受精卵孵化和卵黄囊仔鱼形态及活力的影响[J]. 中国水产科学, 2017, 24(3): 507-515. |
| [15] |
黄建盛, 张敬威, 陈刚, 等. 褐点石斑鱼(♀)×清水石斑鱼(♂)杂交子代幼鱼形态性状对体质量影响的通径分析[J]. 广东海洋大学学报, 2017, 37(3): 23-28. |
| [16] |
JAMES C M, AL-THOBAITI S A, RASEM B M, et al. Potential of grouper hybrid (Epinephelus fuscoguttatus×E.polyphekadion) for Aquaculture[J]. NAGA, 1999, 22(1): 19-23. |
| [17] |
施兆鸿, 陈波, 彭士明, 等. 盐度胁迫下点带石斑鱼(Epinephelus malabaricus)胚胎及卵黄囊仔鱼的形态变化[J]. 海洋与湖沼, 2008, 39(3): 222-227. |
| [18] |
FOCARELLI R, LA SALA G, BALASINI M, et al. Carbohydrate-mediated sperm-egg interaction and species specificity:a clue from the unio elongatulus model[J]. Cells Tissues Organs, 2001, 168(1/2): 76-81. |
| [19] |
MOURENTE G, VÁZQUEZ R. Changes in the content of total lipid, lipid classes and their fatty acids of developing eggs and unfed larvae of the Senegal sole, Solea senegalensis Kaup[J]. Fish Physiology and Biochemistry, 1996, 15(3): 221-235. DOI:10.1007/BF01875573 |
| [20] |
黄旭雄, 冯隆峰, 温文, 等. 日本鬼鲉胚胎及卵黄囊仔鱼发育过程中脂肪及脂肪酸特性变化[J]. 水产学报, 2013, 37(4): 526-535. |
| [21] |
RAINUZZO J R, REITAN K I, OLSEN Y. The significance of lipids at early stages of marine fish:a review[J]. Aquaculture, 1997, 155(1/2/3/4): 103-115. |
| [22] |
KROGDAHL Å, HEMRE G I, MOMMSEN T. Carbohydrates in fish nutrition:digestion and absorption in postlarval stages[J]. Aquacult Nutrition, 2005, 11(2): 103-122. DOI:10.1111/anu.2005.11.issue-2 |
| [23] |
何登菊, 姚俊杰, 赵云龙, 等. 瓯江彩鲤胚胎发育过程中脂、蛋白及碳水化合物水平的变化[J]. 动物学杂志, 2011, 46(2): 102-107. |
| [24] |
SARGENT J R, BELL J G, BELL M V, et al. Requirement criteria for essential fatty acids[J]. Joural of Applied Ichthyology, 1995, 11(3/4): 183-198. |
| [25] |
田华梅, 赵云龙, 李晶晶, 等. 中华绒螯蟹胚胎发育过程中主要生化成分的变化[J]. 动物学杂志, 2002, 37(5): 18-21. |
| [26] |
LAHNSTEINER F, PATARNELLO P. Egg quality determination in the gilthead seabream, Sparus aurata, with biochemical parameters[J]. Aquaculture, 2004, 237(1/2/3/4): 443-459. |
| [27] |
梁进涛. 高糖对斑马鱼胚胎心脏发育的影响及机制研究[D]. 博士学位论文. 上海: 复旦大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10246-1011184219.htm
|
| [28] |
张雷, 方南洙, 李井春. 长期氧化应激导致葡萄糖对小鼠胚胎发育损伤的机制[J]. 细胞生物学杂志, 2006, 28(5): 661-666. |
| [29] |
IZQUIERDO M S. Essential fatty acid requirements of cultured marine fish larvae[J]. Aquacult Nutrition, 1996, 2(4): 183-191. DOI:10.1111/anu.1996.2.issue-4 |
| [30] |
蒋左玉, 熊铧龙, 姚俊杰. 葡萄糖和维生素C对普安银鲫卵黄囊仔鱼ACC、FAS及CPTⅠ活性的影响[J]. 动物学杂志, 2014, 49(6): 904-912. |
| [31] |
DESROSIERS V, LE FRANÇOIS N R, TVEITEN H, et al. Ontogenesis of catabolic and energy metabolism capacities during the embryonic development of spotted wolffish (Anarhichas minor)[J]. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 2008, 150(2): 200-206. DOI:10.1016/j.cbpb.2008.03.001 |
| [32] |
LAHNSTEINER F, URBANYI B, HORVATH A, et al. Bio-markers for egg quality determination in cyprinid fish[J]. Aquaculture, 2001, 195(3/4): 331-352. |
| [33] |
SAMAEE S M. Quantitative composition of egg protein, lipid, fatty acid, and free amino acid in common dentex (Dentex dentex L. ) and their relations to viability and larval development[D]. Ph. D. Thesis. Salzburg: University of Salzburg, 2010. http://go.galegroup.com/ps/i.do?id=GALE|A300980987&sid=googleScholar&v=2.1&it=r&linkaccess=fulltext&issn=03990974&p=AONE&sw=w
|
| [34] |
BARBER M C, TRAVERS M T. Cloning and characterisation of multiple acetyl-CoA carboxylase transcripts in ovine adipose tissue[J]. Gene, 1995, 154(2): 271-275. DOI:10.1016/0378-1119(94)00871-O |
| [35] |
HUNG S S, STOREBAKKEN T. Carbohydrate utilization by rainbow trout is affected by feeding strategy[J]. The Journal of Nutrition, 1994, 124(2): 223-230. DOI:10.1093/jn/124.2.223 |




