2. 浙江海洋大学, 舟山 316000
2. Zhejiang Ocean University, Zhoushan 316000, China
鱼粉是最重要的水产饲料蛋白质源,然而,随着水产养殖业的飞速发展,鱼粉需求量日益增大,鱼粉价格也随之飙升,成为水产饲料中成本最高的原料[1],因此寻找可以有效替代鱼粉的廉价蛋白质源成为水产营养研究中的热点问题。植物性蛋白质源由于资源相对丰富、产量稳定,成为鱼粉替代蛋白质源的研究重点,应用较为广泛的植物性蛋白质源集中于豆粕、菜籽粕和棉籽粕等几种原料。然而,植物性蛋白质源适口性差,氨基酸组成不均衡并且含有大量抗营养因子,会导致水产动物的生长性能较差[2]。发酵豆粕是利用有益微生物发酵豆粕后获得,它去除了豆粕中的多种抗营养因子,同时产生了微生物蛋白质,丰富并平衡了豆粕的蛋白质营养水平,最终改善了豆粕的营养品质,提高了饲料效率。发酵豆粕作为新型植物性蛋白质源,具有促进动物生长[3]和提高机体免疫力的功能[4]。很多学者已经就发酵豆粕替代鱼粉对鱼类的影响做了相关研究[5-9],发酵豆粕替代鱼粉的比例由于鱼种、生长阶段、饲料配方(尤其是对照组饲料中鱼粉的含量)、养殖周期等的不同,替代鱼粉的比例也会有所不同。
鱼类的生长主要由生长激素(GH)/类胰岛素生长因子(IGFs)轴调控,而类胰岛素生长因子-Ⅰ(IGF-Ⅰ)作为IGFs家族中的一员[10],主要通过抑制蛋白质分解和抑制萎缩相关泛素酶的表达起促进生长和分化的作用。在鱼类的研究中发现,IGF-Ⅰ基因在肝脏中的表达量受到营养状态的影响[11]。有研究指出,饲喂高比例植物蛋白质饲料的花鲈(Lateolabrax japonicas)[12]和军曹鱼(Rachycentron canadum)[13]肝脏中的IGF-Ⅰ基因的相对表达量显著下降;另有研究发现,摄入低蛋氨酸[14]和赖氨酸[15]含量的饲料也会降低水产动物肝脏中IGF-Ⅰ基因的表达。
黄姑鱼(Nibea albiflora),属鲈形目(Perciformes),石首鱼科(Sciaenidae),黄姑鱼属(Nibea),主要分布于中国沿海、朝鲜半岛及日本南部海域,是我国传统渔业的主要捕捞对象[16]。黄姑鱼肉质鲜美、营养丰富、市场价格高,其人工养殖日益受到人们的重视。目前,我国福建、浙江等地已经开展了黄姑鱼的人工养殖。对黄姑鱼营养方面的研究已有报道[17-20],但发酵豆粕替代鱼粉对黄姑鱼影响的研究尚未见报道。因此,在本课题组前期研究的基础上,本试验以发酵豆粕替代不同比例的鱼粉,研究其对黄姑鱼幼鱼生长性能、饲料利用、血清生化指标及肝脏中IGF-Ⅰ基因表达的影响,旨在确定黄姑鱼幼鱼饲料中发酵豆粕替代鱼粉的适宜比例,为研发黄姑鱼低鱼粉高效配合饲料提供基础数据和理论依据。
1 材料与方法 1.1 试验设计与试验饲料制作以秘鲁鱼粉、豆粕和小麦蛋白粉为主要蛋白质源,鱼油、豆油和大豆卵磷脂为主要脂肪源,配制含45%鱼粉的基础饲料。以发酵豆粕(购自北京市希普正慧生物饲料有限公司)替代基础饲料中0(FSM0组,作为对照组)、10%(FSM10组)、20%(FSM20组)、30%(FSM30组)、40%(FSM40组)和50%(FSM50组)的鱼粉,以对照组饲料中赖氨酸和蛋氨酸含量为依据,在对照组外的各组饲料中添加适量的赖氨酸和蛋氨酸,以保持各组饲料中赖氨酸和蛋氨酸含量的一致,共配制6种等氮(蛋白质水平为50%)等脂(脂肪水平为12%)的试验饲料。鱼粉和发酵豆粕的营养成分和氨基酸组成见表 1,试验饲料组成及营养水平见表 2,试验饲料的氨基酸组成见表 3。所有饲料原料分别粉碎过60目筛,然后按逐级扩大的方法混合均匀,放入搅拌机加水搅拌,使其充分湿润,用双螺杆挤条机(华南理工大学,F-26型)制作成形,然后用制粒机加工成直径为2和4 mm 2种规格的饲料,放入90 ℃烘箱熟化30 min,然后于阴凉处自然风干,最后装于封口袋保存于-20 ℃冰箱待用。
|
|
表 1 鱼粉和发酵豆粕的营养成分和氨基酸组成(干物质基础) Table 1 Nutritional components and amino acid composition of fish meal and FSM (DM basis) |
|
|
表 2 试验饲料组成及营养水平(干物质基础) Table 2 Composition and nutrient levels of experimental diets (DM basis) |
|
|
表 3 试验饲料的氨基酸组成(干物质基础) Table 3 Amino acid composition of experimental diets (DM basis) |
试验鱼为浙江省海洋水产研究所西轩渔业科技岛人工培育的苗种。初步选择600余尾黄姑鱼幼鱼在室内50 m3水泥池中集中暂养2周。暂养结束后,选用大小均匀、健康活泼的初始体重为(31.24±0.02) g的黄姑鱼幼鱼360尾,随机分为6组,每组3个重复,每个重复20尾,分别饲养于500 L钢化玻璃桶中。养殖试验在浙江省海洋水产研究所西轩渔业科技岛的中挪海水鱼类营养与饲料联合实验室的流水系统中进行。每天分别在07:00和16:00各投喂1次,投喂量为鱼体重的3%左右,每2周称重1次,以调整投喂量,养殖试验持续8周。养殖试验期间,水体温度为(27±2) ℃,pH为7.8~8.0,盐度为28‰~29‰,溶解氧浓度>5.5 mg/L,氨氮浓度<0.05 mg/L。
1.3 样品采集和指标测定 1.3.1 样品采集养殖试验结束后,停食24 h后计数,称重,对试验鱼用丁香酚麻醉。每个桶随机取5尾鱼,测量体长、体重后取内脏团和肝脏并称重,用于计算肝体比、脏体比和肥满度;另从每个桶中随机取3尾鱼,用一次性无菌注射器(2 mL)自尾静脉取血,注入2 mL离心管中,于4 ℃条件下离心(3 000 r/min)10 min,取血清并保存于-80 ℃冰箱中,用于血清生化指标测定;采血完毕后,用高温灭菌的镊子和剪刀采集试验鱼的肝脏,放于无菌无RNA酶的2.0 mL的离心管中,迅速置于液氮中冷冻,然后保存于-80 ℃冰箱中,用于肝脏IGF-Ⅰ基因相对表达量的测定。上述所有操作都于冰块上进行。
1.3.2 血清生化指标测定血清生化指标由自动生化仪(Beckman DX-800,美国)测定。
1.3.3 肝脏中IGF-Ⅰ基因的荧光实时定量PCR 1.3.3.1 总RNA提取使用北京索莱宝科技有限公司的总RNA快速提取试剂盒提取肝脏中总RNA,操作步骤见试剂盒说明书。
1.3.3.2 反转录cDNA使用北京全式金生物技术有限公司生产的反转录试剂盒[TransScript All-in-One First-Strand cDNA Synthesis SuperMix for qPCR(One-Step gDNA Removal)]进行反转录,反应体积为20 μL,具体步骤如下:向PCR管中加入4 μL 5×TransScript All-in-One SuperMix for qPCR,1 μL gDNA Remover,6 μL RNase Free dH2O,1 μL总RNA,以上操作在冰浴中完成;将上述物质混匀,短暂离心后于PCR仪上进行反转录,反转录的反应条件为:37 ℃ 15 min;85 ℃ 5 s;4 ℃,反应结束后置于-20 ℃保存备用。
1.3.3.3 引物设计与合成根据本课题组前期获得的黄姑鱼IGF-Ⅰ基因的部分序列设计黄姑鱼IGF-Ⅰ基因特异性引物,以β-肌动蛋白(β-actin)为内参基因,所有引物(表 4)均由上海生物工程技术有限公司合成。
|
|
表 4 黄姑鱼IGF-Ⅰ和β-actin基因引物序列 Table 4 Primer sequences for IGF-Ⅰ and β-actin of yellow drum (Nibea albiflora) |
以各组黄姑鱼幼鱼肝脏的cDNA为模板,使用SYBR GreenⅠ嵌合荧光进行PCR,目的基因IGF-Ⅰ扩增产物为120 bp,内参基因β-actin扩增产物为161 bp。试剂盒为北京全式金生物技术有限公司生产的TransStart Tip Green qPCR SuperMix。反应体系为20 μL,具体如下:10 μL 2×TransStart Tip Green qPCR SuperMix,上、下游引物各0.4 μL,2 μL模板,7.2 μL ddH2O。反应条件为:95 ℃预变性30 s;94 ℃变性5 s;60 ℃退火15 s;72 ℃延伸20 s,共40个循环。反应结束后温度以每5 s 5 ℃的速度从60 ℃上升到95 ℃,绘制熔解曲线,以判断扩增产物的正确性。使用2-ΔΔCt法[21]对目的基因的相对表达量进行计算。
1.4 计算公式

|
所有数据先采用SPSS 19.0的单因素方差分析(one-way ANOVA)程序进行差异显著性分析,差异显著后再采用Turkey’s法进行多重比较,显著水平设为P<0.05。结果以“平均值±标准误”表示。
2 结果 2.1 发酵豆粕替代鱼粉对黄姑鱼幼鱼生长性能的影响由表 5可知,FSM10、FSM20和FSM30组黄姑鱼幼鱼的增重率、特定生长率和饲料系数与对照组(FSM0组)相比没有显著性差异(P>0.05),而FSM40和FSM50组黄姑鱼幼鱼的增重率和特定生长率则显著低于对照组(P<0.05),饲料系数显著高于对照组(P<0.05)。
|
|
表 5 发酵豆粕替代鱼粉对黄姑鱼幼鱼生长性能的影响 Table 5 Effects of replacement of fish meal by FSM on growth performance of juvenile yellow drum (Nibea albiflora) |
由表 6可知,发酵豆粕替代不同比例鱼粉对黄姑鱼幼鱼的肝体比、脏体比和肥满度均未产生显著性影响(P>0.05)。
|
|
表 6 发酵豆粕替代鱼粉对黄姑鱼幼鱼形态学指标的影响 Table 6 Effects of replacement of fish meal by FSM on morphology indices of juvenile yellow drum (Nibea albiflora) |
由表 7可知,发酵豆粕替代不同比例鱼粉对黄姑鱼幼鱼血清中总蛋白(TP)、胆固醇(CHOL)、甘油三酯(TG)、高密度脂蛋白胆固醇(HLD-C)和低密度脂蛋白胆固醇(LDL-C)含量的影响均不显著(P>0.05);FSM40和FSM50组黄姑鱼幼鱼血清中谷草转氨酶(AST)活性显著高于其他4组(P<0.05),同时FSM50组黄姑鱼幼鱼血清中谷丙转氨酶(ALT)活性显著高于对照组和FSM10组(P<0.05)。
|
|
表 7 发酵豆粕替代鱼粉对黄姑鱼幼鱼血清生化指标的影响 Table 7 Effects of replacement of fish meal by FSM on serum biochemical indices of juvenile yellow drum (Nibea albiflora) |
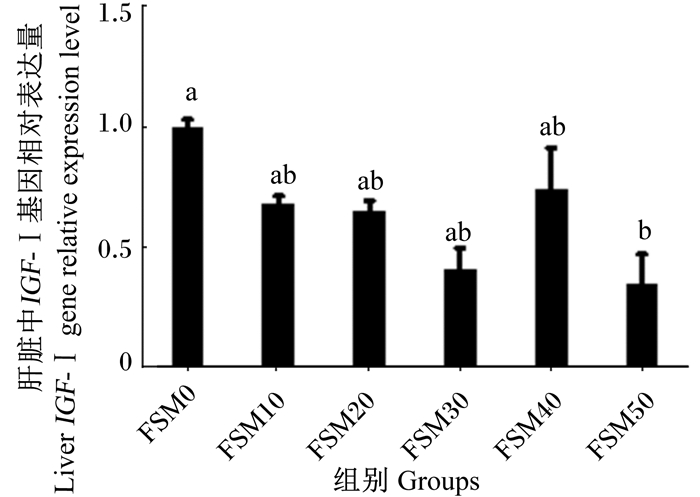
图 1显示,FSM50组黄姑鱼幼鱼肝脏中IGF-Ⅰ基因的相对表达量显著低于对照组(P<0.05),其他组间无显著性差异(P>0.05)。
|
数据柱标注相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。 Date columns with no letter or the same letter superscripts mean no significant difference (P > 0.05), while with different small letter superscripts mean significant difference (P < 0.05). 图 1 发酵豆粕替代鱼粉对黄姑鱼幼鱼肝脏中IGF-Ⅰ基因相对表达量的影响 Figure 1 Effects of replacement of fish meal by FSM on liver IGF-Ⅰ gene relative expression level of juvenile yellow drum (Nibea albiflora) |
在本课题组前期研究的基础上,本试验对发酵豆粕替代鱼粉对黄姑鱼幼鱼生长性能的影响进行了研究,主要目的是研制低鱼粉高效黄姑鱼配合饲料。研究结果发现,各组黄姑鱼幼鱼的成活率没有显著性差异,且成活率均在98%以上。但是随着发酵豆粕替代鱼粉比例的升高,黄姑鱼幼鱼的增重率、特定生长率出现下降趋势,FSM40和FSM50组显著低于对照组,而饲料系数则显著高于对照组。分析其原因可能是含高比例植物性蛋白质源的饲料的适口性较差,降低了黄姑鱼幼鱼的摄食率[6],造成营养物质摄入不足,导致生长性能下降,饲料利用效率降低;另外,与鱼粉相比,植物性蛋白质源存在必需氨基酸不平衡问题,随着发酵豆粕替代鱼粉比例的升高,氨基酸的不平衡性可能对黄姑鱼幼鱼的生长产生了抑制作用[22]。因此,在本饲料配方基础上,发酵豆粕可替代20%~30%的鱼粉而不会影响黄姑鱼幼鱼(初始体重31.2 g左右,养殖周期56 d)的生长。发酵豆粕替代鱼粉的研究在日本尖吻鲈鱼[8](Lateolabrax japonicas)、黑鲷[9](Acanthopagrus schlegeli)、虹鳟[23](Oncorhynchus mykiss)和大黄鱼(Larimichthys crocea)[6]中的结果与本研究结果类似。饲料中发酵豆粕替代鱼粉的比例由于鱼种、生长阶段、饲料配方(尤其是对照组饲料中鱼粉的含量)及饲养周期的不同而会有所不同。Lee等[24]指出许氏鲆鲉(Sebastes schlegeli)幼鱼阶段对发酵豆粕的耐受性要低于成鱼阶段,1.2 g左右的许氏鲆鲉可耐受发酵豆粕替代饲料中10%的鱼粉,而对于生长阶段的许氏鲆鲉(148.2 g左右),发酵豆粕替代饲料中鱼粉的比例可以达到40%。本研究还发现发酵豆粕替代不同比例鱼粉对黄姑鱼幼鱼的肝体比、脏体比和肥满度没有产生显著性影响,这与冯建等[6]的研究结果一致,而与Liang等[8]研究结果不一致。Liang等[8]研究发现,替代50%鱼粉组日本尖吻鲈(L. japonicas)的肥满度、肝体比和脏体比显著低于对照组,值得注意的是,后者的饲养周期为16周,而本试验的饲养周期为8周,后期研究可进一步探讨不同养殖周期对发酵豆粕替代鱼粉养殖效果的影响。
3.2 发酵豆粕替代鱼粉对黄姑鱼幼鱼血清生化指标的影响鱼类血液与机体的代谢、营养状况、疾病有着密切的关系[25]。血清中TP含量与机体健康状况密切相关,血清TP含量降低表明肝功能发生障碍。涂贵雄等[26]研究表明豆粕替代20%鱼粉时显著降低了褐点石斑鱼(Epinephelus fuscoguttatus)血清TP含量;而冯建等[6]研究指出发酵豆粕替代不同比例的鱼粉对大黄鱼血清TP含量无显著影响。本试验发现,随着发酵豆粕替代鱼粉比例的升高,黄姑鱼幼鱼血清中TP含量无显著变化。由于植物蛋白质中异黄酮的存在使得植物性蛋白质源替代鱼粉可降低血清中CHOL的含量[27]。在异育银鲫[28](Carassius auratus gibelio)和牙鲆[29](Paralichthys olivaceus)的研究中发现豆粕替代鱼粉显著降低了血清中CHOL的含量;王文娟等[30]研究报道30%豆粕组异育银鲫血清总胆固醇(TCHO)和HDL-C含量均显著低于鱼粉组;而在大黄鱼的研究中则发现发酵豆粕替代鱼粉对试验鱼血清中CHOL的含量没有产生显著影响[6]。在本试验中也发现发酵豆粕替代不同比例鱼粉对黄姑鱼幼鱼血清中的CHOL、HDL-C和LDL-C含量均没有产生显著影响,可能与养殖种类及养殖周期的长短有关。
AST和ALT主要分布于肝细胞中,它们在血清中的活性很低,只有当肝细胞受损伤时,细胞膜通透性增强或细胞坏死,ALT和AST由肝细胞中释放使其在血清中的活性升高,其升高程度与肝细胞受损程度相一致[31]。本研究发现,发酵豆粕替代40%和50%鱼粉也即FSM40和FSM50组黄姑鱼幼鱼血清中AST活性显著高于其他组,FSM50组黄姑鱼幼鱼血清中ALT活性显著高于对照组和FSM20组,这表明高添加量的发酵豆粕可能对黄姑鱼幼鱼机体有损伤作用,并引起生长性能下降。
3.3 发酵豆粕替代鱼粉对黄姑鱼幼鱼肝脏IGF-Ⅰ基因表达的影响GH/IGFs轴是鱼类生长的重要内分泌调控系统,IGF-Ⅰ在生长内分泌调控中是直接促进生长的激素,能增加机体或细胞对氨基酸的摄取和利用,促进蛋白质和RNA的合成,促进肌肉生长[32]。本研究中发现,随着发酵豆粕替代鱼粉比例的升高,黄姑鱼幼鱼肝脏中IGF-Ⅰ基因相对表达量呈下降趋势,当发酵豆粕替代50%的鱼粉时,IGF-Ⅰ基因相对表达量显著低于对照组,与黄姑鱼幼鱼的生长情况相呼应。这与在金头鲷[33](Sparus aurata)、花鲈[12]和军曹鱼[13]上的研究结果类似,在这些研究中均发现饲喂含高比例植物性蛋白质饲料会导致肝脏中IGF-Ⅰ基因相对表达量下降。有研究指出肝脏中IGF-Ⅰ基因的表达受到营养状态的影响[11],禁食可降低肝脏中IGF-Ⅰ的基因相对表达量,而重新投喂食物后肝脏中IGF-Ⅰ基因的相对表达量又随之上升[34]。本研究中黄姑鱼幼鱼的日摄食率随着发酵豆粕替代鱼粉比例的升高呈下降趋势,这可能是导致黄姑鱼幼鱼肝脏中IGF-Ⅰ基因相对表达量下降的原因之一;另外,氨基酸不平衡可能也是导致肝脏中IGF-Ⅰ基因相对表达量下降的原因[12-13],本研究虽然在对照组外的各组饲料中补充添加了发酵豆粕中的限制性氨基酸(赖氨酸和蛋氨酸),但是晶体氨基酸和饲料中的蛋白质结合态氨基酸的不同步吸收有可能导致不同组间这2种氨基酸的吸收量存在一定差异[13]。有研究指出蛋氨酸[14]和赖氨酸[15]均可提高鱼类肝脏中IGF-Ⅰ基因的表达,因此高比例发酵豆粕组中较低的蛋氨酸和赖氨酸吸收水平有可能是导致黄姑鱼幼鱼肝脏中IGF-Ⅰ基因相对表达量下降的另一原因。因此,黄姑鱼幼鱼饲料中发酵豆粕替代鱼粉的比例不宜过高,后期研究可探讨比较在含高比例植物蛋白质源饲料中添加不同形式的氨基酸单体的同步吸收效果。
4 结论综上,在本试验条件下,发酵豆粕替代饲料中20%~30%的鱼粉较为适宜,过高的替代比例会导致黄姑鱼幼鱼生长性能和饲料利用率下降。
| [1] |
ZHOU Q C, ZHAO J, LI P, et al. Evaluation of poultry by-product meal in commercial diets for juvenile cobia (Rachycentron canadum)[J]. Aquaculture, 2011, 322/323: 122-127. DOI:10.1016/j.aquaculture.2011.09.042 |
| [2] |
YE J D, LIU X H, WANG Z J, et al. Effect of partial fish meal replacement by soybean meal on the growth performance and biochemical indices of juvenile Japanese flounder (Paralichthys olivaceus)[J]. Aquaculture International, 2011, 19(1): 143-153. DOI:10.1007/s10499-010-9348-1 |
| [3] |
李惠, 黄峰, 胡兵, 等. 发酵豆粕替代鱼粉对斑点叉尾生长和饲料表观消化率的影响[J]. 淡水渔业, 2007, 37(5): 41-44. |
| [4] |
陈萱, 梁运祥, 陈昌福. 发酵豆粕饲料对异育银鲫非特异性免疫功能的影响[J]. 淡水渔业, 2005, 35(2): 6-8. |
| [5] |
彭翔, 宋文新, 周凡, 等. 发酵豆粕替代鱼粉对黑鲷胃肠道和血清指标的影响[J]. 江苏农业学报, 2012, 28(5): 1096-1103. |
| [6] |
冯建, 王萍, 何娇娇, 等. 发酵豆粕替代鱼粉对大黄鱼幼鱼生长性能、体成分、血清生化指标及肝脏组织形态的影响[J]. 动物营养学报, 2016, 28(11): 3493-3502. DOI:10.3969/j.issn.1006-267x.2016.11.016 |
| [7] |
林佳洁. 发酵豆粕替代鱼粉对黄金鲫生长、免疫及肠道组织的影响[D]. 硕士学位论文. 长春: 吉林农业大学, 2016: 32-33. http://cdmd.cnki.com.cn/Article/CDMD-10193-1016732974.htm
|
| [8] |
LIANG X F, HU L, DONG Y C, et al. Substitution of fish meal by fermented soybean meal affects the growth performance and flesh quality of Japanese seabass (Lateolabrax japonicas)[J]. Animal Feed Science and Technology, 2017, 229: 1-12. DOI:10.1016/j.anifeedsci.2017.03.006 |
| [9] |
AZARM H M, LEE S M. Effects of partial substitution of dietary fish meal by fermented soybean meal on growth performance, amino acid and biochemical parameters of juvenile black sea bream Acanthopagrus schlegeli[J]. Aquaculture Research, 2014, 45(6): 994-1003. DOI:10.1111/are.2014.45.issue-6 |
| [10] |
RANKE M B, FELDT-RASMUSSEN U, BANG P, et al. How should insulin-like growth factor Ⅰ be measured? A consensus statement[J]. Hormone Research, 2001, 55(Suppl.2): 106-109. |
| [11] |
HEVRØY E M, AZPELETA C, SHIMIZU M, et al. Effects of short-term starvation on ghrelin, GH-IGF system, and IGF binding proteins in Atlantic salmon[J]. Fish Physiology and Biochemistry, 2011, 37(1): 217-232. DOI:10.1007/s10695-010-9434-3 |
| [12] |
MEN K K, AI Q H, MAI K S, et al. Effects of dietary corn gluten meal on growth, digestion and protein metabolism in relation to IGF-Ⅰ gene expression of Japanese seabass, Lateolabrax japonicas[J]. Aquaculture, 2014, 428-429: 303-309. DOI:10.1016/j.aquaculture.2014.03.028 |
| [13] |
LUO Y W, AI Q H, MAI K S, et al. Effects of dietary corn gluten meal on growth performance and protein metabolism in relation to IGF-Ⅰ and TOR gene expression of juvenile cobia (Rachycentron canadum)[J]. Journal of Ocean University of China, 2013, 12(3): 418-426. DOI:10.1007/s11802-013-2021-3 |
| [14] |
ROLLAND M, DALSGAARD J, HOLM J, et al. Dietary methionine level affects growth performance and hepatic gene expression of GH-IGF system and protein turnover regulators in rainbow trout (Oncorhynchus mykiss) fed plant protein-based diets[J]. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 2015, 181: 33-41. DOI:10.1016/j.cbpb.2014.11.009 |
| [15] |
HEVRØY E M, EL-MOWAFI A, TAYLOR R M, et al. Lysine intake affects gene expression of anabolic hormones in Atlantic salmon, Salmo salar[J]. General and Comparative Endocrinology, 2007, 152(1): 39-46. DOI:10.1016/j.ygcen.2007.02.015 |
| [16] |
薛宝贵, 楼宝, 徐冬冬, 等. 密度胁迫对黄姑鱼幼鱼生长、代谢及非特异性免疫的影响[J]. 渔业科学进展, 2013, 34(2): 45-51. |
| [17] |
鲁琼. 黄姑鱼幼鱼配合饲料蛋白质、脂肪需求量及适宜蛋脂比的研究[D]. 硕士学位论文. 舟山: 浙江海洋大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10340-1016127441.htm
|
| [18] |
WANG L G, LU Q, LUO S Y, et al. Effect of dietary lipid on growth performance, body composition, plasma biochemical parameters and liver fatty acids content of juvenile yellow drum Nibea albiflora[J]. Aquaculture Report, 2016, 4: 10-16. DOI:10.1016/j.aqrep.2016.05.002 |
| [19] |
WANG L G, CHEN D X, LOU B, et al. The effects of dietary vitamin C on growth performance, serum enzymes activities and resistance to Vibrio alginolyticus challenge of yellow drum Nibea albiflora[J]. Aquaculture Research, 2017, 48(9): 4684-4695. DOI:10.1111/are.2017.48.issue-9 |
| [20] |
陈东星, 王立改, 楼宝. 饲料中维生素C添加量对黄姑鱼体组成成分和组织中抗氧化酶活力的影响[J]. 浙江海洋学院学报(自然科学版), 2016, 35(6): 472-477. |
| [21] |
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△Ct method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [22] |
代伟伟, 麦康森, 徐玮, 等. 复合植物蛋白源替代鱼粉对半滑舌鳎生长、生理生化指标和肠组织结构的影响[J]. 中国水产科学, 2016, 23(1): 125-137. |
| [23] |
BARNES M E, BROWN M L, NEIGER R. Comparative performance of two rainbow trout strains fed fermented soybean meal[J]. Aquaculture International, 2015, 23(5): 1227-1238. DOI:10.1007/s10499-015-9879-6 |
| [24] |
LEE S M, AZARM H M, CHANG K H. Effects of dietary inclusion of fermented soybean meal on growth, body composition, antioxidant enzyme activity and disease resistance of rockfish (Sebastes schlegeli)[J]. Aquaculture, 2016, 459: 110-116. DOI:10.1016/j.aquaculture.2016.03.036 |
| [25] |
周玉, 郭文场, 杨振国, 等. 鱼类血液学指标研究的进展[J]. 上海水产大学学报, 2001, 10(2): 163-165. |
| [26] |
涂贵雄, 陈刚, 周晖, 等. 3种蛋白源替代鱼粉对褐点石斑鱼幼鱼血液指标的影响[J]. 广东海洋大学学报, 2012, 32(4): 12-19. |
| [27] |
KAUSHIK S J, CRAVEDI J P, LALLES J P, et al. Partial or total replacement of fish meal by soybean protein on growth, protein utilization, potential estrogenic or antigenic effects, cholesterolemia and flesh quality in rainbow trout, Oncorhynchus mykiss[J]. Aquaculture, 1995, 133(3/4): 257-274. |
| [28] |
王崇, 雷武, 解绶启, 等. 饲料中豆粕替代鱼粉蛋白对异育银鲫生长、代谢及免疫功能的影响[J]. 水生生物学报, 2009, 33(4): 740-747. |
| [29] |
刘襄河, 叶继丹, 王子甲, 等. 饲料中豆粕替代鱼粉比例对牙鲆生长性能及生化指标的影响[J]. 水产学报, 2010, 34(3): 450-458. |
| [30] |
王文娟, 叶元土, 蔡春芳, 等. 豆粕及其抗营养因子对异育银鲫血清生化和非特异性免疫指标的影响[J]. 中国饲料, 2010(18): 30-33, 41. DOI:10.3969/j.issn.1004-3314.2010.18.011 |
| [31] |
吉红, 程小飞, 李杰, 等. 蚕蛹替代鱼粉对框鳞镜鲤幼鱼生长性能、体成分及健康状况的影响[J]. 水产学报, 2012, 36(10): 1599-1611. |
| [32] |
孙伟, 马文健, 宋恩亮, 等. 饲喂不同水平热处理大豆对肉牛体组织和血清中类胰岛素生长因子-Ⅰ、生长激素、胰岛素和瘦素水平的影响[J]. 草食家畜, 2011(2): 35-39. |
| [33] |
GÍMEZ-REQUENIA P, MINGARROA M, CALDUCH-GINERA J A, et al. Protein growth performance, amino acid utilization and somatotropic axis responsiveness to fish meal replacement by plant protein sources in gilthead sea bream (Sparus aurata)[J]. Aquaculture, 2004, 232(1/2/3/4): 493-510. |
| [34] |
PEDROSO F L, DE JESUS-AYSON E G, CORTADO H H, et al. Changes in mRNA expression of grouper (Epinephelus coioides) growth hormone and insulin-like growth factor Ⅰ in response to nutritional status[J]. General and Comparative Endocrinology, 2006, 145(3): 237-246. DOI:10.1016/j.ygcen.2005.09.001 |




