维生素D(vitamin D)是类甾醇衍生物,其中最重要的成员是维生素D2(麦角钙化醇)和维生素D3(胆钙化醇)。维生素D是脂溶性维生素,在物质代谢中起着十分重要的作用,是维持水产动物机体正常生命活动所必需的,但动物体内无法合成该类维生素。维生素D的主要生理功能是调节动物的钙、磷代谢过程和促进骨骼的生长和钙化。水产动物缺乏维生素D会出表现出一些缺乏症状,例如:饲料中缺乏维生素D会使虹鳟出现生长缓慢、肝脂增加、钙平衡遭到损坏并会导致肌肉痉挛和轴白肌的亚显微结构发生变化[1]。虹鳟缺乏维生素D时还会表现出类似脊椎前凸下垂和肌肉组织衰弱等症状[2]。用缺乏维生素D的饲料投喂斑点叉尾16周后,会表现出维生素D的缺乏症:生长受阻以及鱼体钙、磷和粗灰分含量降低[3]。杂交罗非鱼[4]缺乏维生素D会表现出生长受阻、饲料系数降低和肝细胞指数下降,血浆中碱性磷酸酶活性和血红蛋白含量也出现下降的趋势。皱纹盘鲍足部肌纤维结构受到缺乏维生素D作用的影响而发生改变[5]。目前关于鱼类饲料中维生素D的需要量开展了一些研究,如虹鳟对维生素D的需要量为1 600~2 400 IU/kg[2],大鳞大马哈鱼对维生素D的需要量为2 400 IU/kg[6],杂交罗非鱼对维生素D的需要量为374.8 IU/kg[4];鲈鱼幼鱼对维生素D的需要量为431.0 IU/kg[7],斑点叉尾对维生素D的需要量为250~500 IU/kg[8]。这些研究结果表明不同养殖种类的水产动物对维生素D的需要量存在较大差异。
吉富罗非鱼(genetically improved farmed tilapia,GIFT,Oreochromis niloticus)是经遗传性状改良后的尼罗罗非鱼,其生长迅速、出肉率高、病害少、遗传性状稳定,在我国南方如广东、广西和海南等地区已大规模人工养殖[9]。目前关于维生素D需要量的研究主要集中于1 g左右的杂交罗非鱼[4],而吉富罗非鱼在养成中期对维生素D需要量的研究还未见报道。由于不同种类鱼以及同种鱼类在不同生长阶段对维生素D的需要量都有一定差异,因此,本试验通过维生素D梯度添加试验,研究不同添加水平的维生素D对养成中期吉富罗非鱼[初始体重(78.58±1.93) g]生长性能、体组成以及血清生化指标的影响,以确定养成中期吉富罗非鱼饲料中维生素D的适宜添加量,丰富不同生长阶段罗非鱼的营养需求数据,同时也为饲料中添加维生素D提供理论依据。
1 材料与方法 1.1 试验饲料将以酪蛋白、明胶为蛋白质源,糊精为糖源,玉米油和豆油为脂肪源配制的纯化饲粮作为基础饲料,其组成及营养水平见表 1。在基础饲料的基础上添加不同水平(0、200、400、800、1 600、3 200 IU/kg)的维生素D(维生素D源为饲料添加用维生素D3微粒,维生素D含量为47.6万IU/g),配制6种试验饲料。所有原料经粉碎后过孔径为0.3 mm的网,充分混匀,然后加适量水后用绞肉机(62型,福安市永特电机有限公司)加工成直径为2.0 mm条状,置于通风阴凉处用电风扇吹干后,用粉碎机(280型,郑州惠诚机械设备有限公司)破碎成长约4.0 mm的圆柱形颗粒,-20 ℃冰柜中保存备用。
|
|
表 1 基础饲料组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
试验用吉富罗非鱼由广西罗非鱼国家级育种试验场提供,试验鱼购回至中国水产研究院长江水产研究所后用聚维酮碘进行消毒,养殖于室内循环水养殖系统的养殖桶(500 L)中,先用基础饲料驯养2周,使其适应试验环境及试验饲料,并消耗体内储存的维生素D。正式试验开始前,先将试验鱼进行24 h饥饿处理,然后挑选体质健壮、规格整齐的吉富罗非鱼270尾,初始均重为(78.58±1.93) g,随机分配于18个桶中,每桶15尾。将18个桶随机分成6组(每组3个重复),分别投喂6种试验饲料,每天按时投喂3次(08:00、12:00、16:00),表观饱食投喂,每天早上换水1/4。每2周称量1次试验鱼的体重,根据其体重变化来调整投喂量,养殖试验持续12周。每日观察记录水温、试验鱼摄食及死亡情况。饲养期间的水体温度27~33 ℃、pH 7.2~7.5,溶解氧浓度在6.0 mg/L以上,氨态氮浓度在0.03 mg/L以下。
1.3 样品采集养殖12周后,将试验鱼进行24 h饥饿处理,然后称量每个桶的试验鱼总重量并记录尾数,计算终末均重、增重率(weight gain rate, WGR)和成活率(survival rate,SR);统计每个重复投喂的饲料量,计算饲料效率(feed efficiency,FE)。从每个桶随机选取3尾鱼,用于全鱼粗蛋白质、粗脂肪、水分和粗灰分等常规营养成分的测定。再从每个桶随机选取3尾鱼,以MS-222麻醉后测量体长和体重,计算肥满度(condition factor,CF);然后从尾部静脉采血,血液在4 ℃冰箱中静置2 h后,3 000 r/min离心10 min,取上清液,用于血清生化指标的检测;最后将试验鱼进行解剖,分离内脏和肝脏,并称重,计算肝体比(hepatosomatic index,HSI)和脏体比(viscerosomatic index,VSI),并保存肝脏样品。血清和肝脏样品均保存于-80 ℃冰柜中,用于后续测定。
1.4 测定方法 1.4.1 常规营养成分的测定饲料和全鱼水分含量采用105 ℃恒温干燥失重法(GB/T 5009.3—2016)测定,粗蛋白质含量采用凯氏定氮法(GB/T 5009.5—2016)测定,粗脂肪含量采用索氏抽提法(GB/T 5009.6—2016)测定,粗灰分含量采用灼烧称重法(GB/T 5009.4—2016)测定。
1.4.2 生长性能指标的测定

|
血清碱性磷酸酶(ALP)活性及总蛋白(TP)、总胆固醇(T-CHO)、白蛋白(ALB)含量均采用希森美康全自动生化分析仪(CHEMIX-800)进行测定,所用试剂均购自Sysmex公司。
1.5 数据处理试验数据采用SPSS 18.0统计软件中one-way ANOVA程序进行方差分析,并采用Duncan氏多重比较法进行差异显著性检验,试验结果均以“平均值±标准差”表示,当P<0.05为差异显著。
2 结果与分析 2.1 维生素D添加水平对养成中期吉富罗非鱼生长性能的影响维生素D添加水平对吉富罗非鱼生长性能的影响见表 2。经过12周的室内养殖,各组的吉富罗非鱼的成活率均为100%。饲料中维生素D的添加促进了吉富罗非鱼的生长,各维生素D添加组的增重率均显著高于对照组(P<0.05);此外,400 IU/kg组显著高于1 600和3 200 IU/kg组(P<0.05),但与200和800 IU/kg组无显著差异(P>0.05)。随着饲料中维生素D添加水平的升高,饲料效率先升高再下降,以400 IU/kg组最高,200、400、800和1 600 IU/kg组显著高于对照组(P<0.05)。随着饲料中维生素D添加水平的升高,吉富罗非鱼的肝体比、脏体比和肥满度均无显著变化(P>0.05)。
|
|
表 2 维生素D添加水平对养成中期吉富罗非鱼生长性能的影响 Table 2 Effects of vitamin D supplemental level on growth performance of GIFT in growth mid-stage |
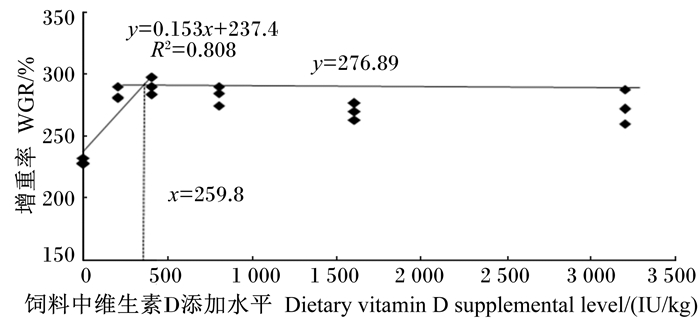
通过折线模型回归分析,得到饲料维生素D添加水平(x)与吉富罗非鱼增重率(y)的回归方程:y=0.153x+237.4,R2=0.808(图 1)。由回归方程得出吉富罗非鱼获得最大生长时饲料中维生素D的添加水平为259.8 IU/kg。
|
图 1 饲料中维生素D添加水平与养成中期吉富罗非鱼的增重率的回归关系 Figure 1 Regression relationship between dietary vitamin D supplemental level and WGR of GIFT in growth mid-stage |
维生素D添加水平对吉富罗非鱼体组成的影响见表 3。随着饲料中维生素D添加水平的升高,全鱼粗脂肪含量呈现先升高后下降的趋势,以200 IU/kg组最高,且200、400和800 IU/kg组显著高于对照组(P<0.05)。全鱼水分和粗蛋白质含量在各组间均无显著差异(P>0.05)。各维生素D添加组的全鱼粗灰分含量均显著高于对照组(P<0.05),但各维生素D添加组之间无显著差异(P>0.05)。
|
|
表 3 维生素D添加水平对养成中期吉富罗非鱼体组成的影响 Table 3 Effects of vitamin D supplemental level on body composition of GIFT in growth mid-stage |
维生素D添加水平对吉富罗非鱼血清生化指标的影响见表 4。饲料中添加维生素D升高了吉富罗非鱼血清中碱性磷酸酶的活性,其中200、400和800 IU/kg组显著高于对照组(P<0.05)。随着饲料中维生素D添加水平的升高,血清中总胆固醇、总蛋白和白蛋白的含量呈现波动变化,均在200 IU/kg组获得最大值,并显著高于对照组(P<0.05)。
|
|
表 4 饲料维生素D水平对养成中期吉富罗非鱼血清生化指标的影响 Table 4 Effects of dietary vitamin D level on serum biochemical indices of GIFT in growth mid-stage |
维生素D对鱼类生长的影响随研究对象的种类、年龄、养殖周期和环境的变化而变化。Lovell等[3]报道,以缺乏维生素D的饲料投喂斑点叉尾16周后,其增重率显著降低;Shiau等[4]报道,杂交罗非鱼缺乏维生素D会表现出生长不良、饲饵效率降低;O’Connell等[11]等研究发现,以添加不同水平维生素D3的饲料投喂蓝罗非鱼24周,饲料中维生素D3的添加水平在前12周对蓝罗非鱼生长的影响较显著,但在后12周对其生长没有表现出显著的影响;He等[12]研究表明,南美白对虾缺乏维生素D3会表现出食欲下降、生长不良和虾壳矿化不完全等缺乏症。本试验发现,饲料中维生素D的添加显著提高了吉富罗非鱼的增重率和特定生长率,对照组吉富罗非鱼未表现出明显的维生素D缺乏症。造成该结果的原因可能是由于采用的试验鱼为养成中期的吉富罗非鱼,其规格相对较大,体内组织中积累了大量维生素D,虽不足以满足试验鱼的最大生长,却可以阻止缺乏症的产生;另外,本试验的养殖周期为12周,在该养殖周期内饲料中维生素D的缺乏对试验鱼生长性能方面的影响可能还没有显著表现出来。同时,饲料中添加高水平的维生素D亦未抑制吉富罗非鱼的生长,这可能是因为本试验选用的吉富罗非鱼的规格较大,对高水平的维生素D具有较高的耐受性。给大西洋鲑幼鱼[13]和斑点叉尾[8]投喂添加高水平维生素D的饲料也没有表现抑制生长,只有少数报道饲料中高水平的维生素D会抑制鱼类生长[14]。
本试验中,饲料中添加不同水平的维生素D对吉富罗非鱼的成活率没有产生显著影响,这与陈四清等[15]对中国对虾的研究结果以及张璐等[7]对鲈鱼幼鱼的研究结果是一致的;但是,Shiau等[16]研究表明饲料中添加维生素D3组的杂交罗非鱼的死亡率显著低于对照组,这一不同结果可能是由于研究对象的种类、年龄、养殖周期和环境不相同所造成的。
3.2 维生素D添加水平对养成中期吉富罗非鱼体组成的影响饲料中缺乏维生素D会引起虹鳟[1]、邹纹盘鲍[5]机体脂肪含量增加和骨骼中粗灰分含量减少。本试验结果显示,未添加维生素D的对照组全鱼粗灰分含量显著低于各维生素D添加组,各维生素D添加组之间则无显著差异,说明饲料的维生素D能够促进矿物质在体内的沉积;但维生素D添加水平过高时全鱼粗灰分含量有所降低,说明过量的维生素D可能会抑制成骨细胞形成,减少对钙和磷的吸收,导致全鱼粗灰分含量降低。对畜禽类的研究表明,饲粮中维生素D3的含量为正常需要量的4~10倍时,长期摄食该种饲粮会引起中毒[17]。本试验中最高水平的维生素D添加组的全鱼粗灰分含量仍较高,可能是由于试验鱼规格较大,耐受能力较强,且饲喂时间不够长。
本试验中,全鱼粗脂肪含量受到饲料中维生素D添加水平的显著影响,全鱼粗脂肪含量随着维生素D添加水平的升高出现先升高后降低的趋势,这说明饲料中维生素D的添加影响了吉富罗非鱼的脂肪代谢,但影响代谢的途径还需进一步的研究。张璐等[7]研究发现,鲈鱼幼鱼的鱼体粗脂肪含量随着饲料中维生素D添加水平的升高而升高,且在肝脏脂肪含量最高组表现出最低的鱼体粗脂肪含量,由此推测饲料中维生素D的过量添加可能会导致鲈鱼肝脏中的维生素D累积过量,从而造成肝脏磷脂合成障碍或载脂蛋白合成障碍,以致于甘油三酯难以转运出肝脏,在肝脏中大量积累引起病变,因此当鲈鱼肝脏脂肪含量异常升高时,鱼体脂肪含量就会显著下降。由此可知,吉富罗非鱼全鱼粗脂肪含量在高水平维生素D添加组出现下降可能是由于肝脏病变造成的;而维生素D添加水平对吉富罗非鱼全鱼水分和粗蛋白质含量无显著影响,说明水分和粗蛋白质对于维生素D是不敏感指标。
3.3 维生素D添加水平对养成中期吉富罗非鱼血清生化指标的影响在生物体内碱性磷酸酶作为一种重要的代谢调控酶,与磷酸基团的转移和钙磷代谢密切相关。碱性磷酸酶存在于肝脏、肠道和骨骼等多种组织中,是反映骨代谢的重要指标,当骨细胞代谢活跃时,碱性磷酸酶分泌量增加,极易释放到血液中,血清中碱性磷酸酶活性即会升高[7]。本试验中,饲料中维生素D的添加导致血清碱性磷酸酶活性显著提高,但是本研究同时发现,过高添加水平的维生素D使得血清,碱性磷酸酶活性有下降趋势。类似的报道也出现在皱纹盘鲍[5]、草鱼[18-19]和斑节对虾[16]的研究中,原因可能在于维生素D对骨细胞代谢具有双向作用,当饲料中维生素D的含量适宜时,可促进骨细胞的代谢,骨中生成的一部分碱性磷酸酶进入血液中提高了血清碱性磷酸酶的活性,但当饲料中维生素D的含量过高时,会产生毒性和抑制作用,所以本试验中高水平维生素D添加组血清碱性磷酸酶活性下降可能是因为过量的维生素D抑制了骨细胞的代谢。
血清中总蛋白和白蛋白的含量反映了蛋白质吸收代谢的状况,白蛋白和球蛋白结合起来称为总蛋白。血清白蛋白可以维持血浆胶体渗透压,还可以修补组织,若肝脏受到损伤,血清白蛋白的含量就会减少[20]。在本试验中,饲料中添加维生素D对血清总蛋白含量产生了显著影响,适宜添加水平(200 IU/kg)的维生素D显著提高试验鱼血清总蛋白含量,其影响机制可能是维生素D的添加促进了吉富罗非鱼对食物中蛋白质的消化吸收,致使血清总蛋白含量上升[21]。但随着维生素D添加水平的进一步升高,血清总蛋白和白蛋白含量降低,可能是由于高添加水平的维生素D造成了吉富罗非鱼的肝脏损伤。血清总胆固醇含量可以反映鱼体脂类代谢的状况,是机体脂肪堆积情况的反映指标,一般认为血液中70%~80%的胆固醇来源于肝脏,少量来源于消化道,当肝脏出现损伤时,血清中胆固醇的含量会发生相应变化[22]。本试验中,血清总胆固醇的含量基本呈现先升高后下降的趋势,可能原因是适量的维生素D促进了鱼类肝脏中脂肪的代谢,加速了其分解,使得饱和脂肪酸的生成量相对增多,提高了机体胆固醇含量,从而使导致血清总胆固醇含量较对照组升高,但是高水平的维生素D可能会造成吉富罗非鱼的肝脏损伤,使脂肪代谢受阻,从而导致进入血清的胆固醇减少。
4 结论饲料中适量添加维生素D可促进养成中期吉富罗非鱼的生长,维生素D添加过量可能会造成肝脏损伤,影响脂肪代谢。以增重率为评价指标,经回归分析得出养成中期吉富罗非鱼饲料中维生素D的适宜添加水平为259.8 IU/kg。
| [1] |
GEORGE J C, BARNETT B J, CHO C Y, et al. Vitamin D3 and muscle function in the rainbow trout[J]. Cytobios, 1981, 31: 7-18. |
| [2] |
BARNETT B J, CHO C Y, SLINGER S J. Relative biopotency of dietary ergocalciferol and cholecalciferol and the role of and requirement for vitamin D in rainbow trout (Salmo gairdneri)[J]. Journal of Nutrition, 1982, 12(11): 2011-2019. |
| [3] |
LOVELL R T, LI Y P. Essentiality of vitamin D in diets of channel catfish (Ictalurus punctatus)[J]. Transactions of the American Fisheries Society, 1978, 107(6): 809-811. DOI:10.1577/1548-8659(1978)107<809:EOVDID>2.0.CO;2 |
| [4] |
SHIAU S Y, HWANG J Y. Vitamin D requirements of juvenile hybrid tilapia Oreochromis niloticus×O.aureus[J]. Nippon Suisan Gakkaishi, 1993, 59(3): 553-558. DOI:10.2331/suisan.59.553 |
| [5] |
周歧存, 麦康森. 皱纹盘鲍维生素D营养需要的研究[J]. 水产学报, 2004, 28(2): 155-160. |
| [6] |
NRC. Nutrient requirements of fish and shrimp[S]. Washington, D. C. : National Academic Press, 2011: 189-198.
|
| [7] |
张璐, 李静, 麦康森, 等. 饲料中不同维生素D含量对鲈鱼幼鱼生长性能和钙磷代谢的影响[J]. 动物营养学报, 2016, 28(5): 1402-1411. |
| [8] |
BROWN P B, ROBINSON E H. Vitamin D studies with channel catfish (Ictalurus punctatus) reared in calcium-free water[J]. Comparative Biochemistry and Physiology Part A:Physiology, 1992, 103(1): 213-219. DOI:10.1016/0300-9629(92)90265-R |
| [9] |
张德锋, 袁伟, 可小丽, 等. 中国罗非鱼主养区无乳链球菌的分子流行特征及其传播方式[J]. 中国水产科学, 2017, 24(3): 606-614. |
| [10] |
任春, 文华, 黄凤, 等. 吉富罗非鱼对饲料中维生素B1的需要量[J]. 水产学报, 2015, 39(4): 539-546. |
| [11] |
O'CONNELL J P, GATLIN D M. Effects of dietary calcium and vitamin D3 on weight gain and mineral composition of the blue tilapia (Oreochromis aureus) in low-calcium water[J]. Aquaculture, 1994, 125(1/2): 107-117. |
| [12] |
HE H Q, LAWRENCE A L, LIU R Y. Evaluation of dietary essentiality of fat-soluble vitamins, A, D, E and K for penaeid shrimp (Penaeus vannamei)[J]. Aquaculture, 1992, 103(2): 177-185. DOI:10.1016/0044-8486(92)90411-D |
| [13] |
许友卿, 刘永强, 刘阳, 等. 维生素D3对鱼类的影响及其机理研究进展[J]. 饲料工业, 2014, 35(16): 26-30. |
| [14] |
VIEHNA J, LALL S P, KOSKELAA J, et al. Effects of dietary phytase and cholecalciferol on phosphorus bioavailability in rainbow trout (Oncorhynchus mykiss)[J]. Aquaculture, 1998, 163(3/4): 309-323. |
| [15] |
陈四清, 李爱杰. 维生素D对中国对虾生长影响的研究[J]. 海洋与湖沼, 1995, 26(1): 42-47. |
| [16] |
SHIAU S Y, HWANG J Y. The dietary requirement of juvenile grass shrimp (Penaeus monodon) for vitamin D[J]. Nutrition, 1994, 124(12): 2445-2450. DOI:10.1093/jn/124.12.2445 |
| [17] |
彭翔, 邵庆均. 维生素D在水产动物中的研究进展[J]. 饲料工业, 2010, 31(22): 47-49. DOI:10.3969/j.issn.1001-991X.2010.22.014 |
| [18] |
谭正江, 李宴兵, 戴炳龙, 等. 饲料中添加维生素D3对草鱼幼鱼生长性能的影响[J]. 北京农业, 2015(24): 157-158. DOI:10.3969/j.issn.1000-6966.2015.24.094 |
| [19] |
蒋明, 吴凡, 文华, 等. 饲料中添加不同水平的维生素D3对草鱼幼鱼生长和体成分的影响[J]. 淡水渔业, 2009, 39(5): 38-42. |
| [20] |
冯建, 王萍, 何娇娇, 等. 大豆浓缩蛋白替代鱼粉对大黄鱼幼鱼生长、体成分、血清生化指标及肝组织学的影响[J]. 中国水产科学, 2017, 24(2): 268-277. |
| [21] |
何娇娇, 王萍, 冯建, 等. 玉米蛋白粉替代鱼粉对大黄鱼生长、血清生化指标及肝脏组织学的影响[J]. 水生生物学报, 2017, 41(3): 506-515. DOI:10.7541/2017.65 |
| [22] |
LERMEN C L, LAPPE R, CRESTANI M, et al. Effect of different temperature regimes on metabolic and blood parameters of silver catfish Rhamdia quelen[J]. Aquaculture, 2004, 239(1/2/3/4): 497-507. |




