2. 江西省畜牧技术推广站, 南昌 330046;
3. 贵州大学动物科学学院, 贵阳 550025
2. Jiangxi Animal Husbandry Technology Extension Station, Nanchang 330046, China;
3. College of Animal Science, Guizhou University, Guiyang 550025, China
随着现代养猪业的发展,生产上通常对仔猪实行早期断奶以提升养殖效率[1]。然而,由于仔猪早期阶段消化道发育尚未完善、消化液和消化酶分泌不足、胃肠道微生态区系不稳定和肠道免疫功能低下,且断奶过程中仔猪还需要经受环境、心理及营养应激等因素的影响,因此仔猪在早期断奶阶段机体能量代谢会发生一定的变化[2]。
目前有研究表明,仔猪在早期断奶后,引起采食量的降低和应激,需要消耗体内的脂肪、糖类和蛋白质以供机体的代谢需要[3]。同时,当动物处于应激状态时,应激系统的激活可导致动物行为和外周器官功能的变化,以提高机体对环境的适应能力,增加自身的生存机会[1]。肝脏是应激系统的重要效应器官,也是能量供应和糖类物质代谢调控的重要器官,与生长、代谢和抗应激能力密切相关。Nafikov等[4]发现,新生仔猪通过肝脏糖异生产生的葡萄糖占血液中葡萄糖总量的70%,所以肝糖异生功能的改善对于仔猪血糖稳态的调节起着极其重要的作用。参与肝脏糖代谢调控的关键酶包括丙酮酸激酶(PK)、线粒体磷酸烯醇式丙酮酸羧激酶(PEPCK-M)、胞质磷酸烯醇式丙酮酸羧激酶(PEPCK-C)和葡萄糖-6-磷酸酶(G-6-P),其中丙酮酸激酶为肝脏糖酵解的关键酶,线粒体磷酸烯醇式丙酮酸羧激酶、胞质磷酸烯醇式丙酮酸羧激酶和葡萄糖-6-磷酸酶为肝脏糖异生的关键酶[5-6]。仔猪早期断奶阶段机体代谢状况必然发生变化,然而其机体的糖类物质含量变化和肝脏糖代谢相关基因的表达水平变化仍然未知。因此,本试验拟研究早期断奶对仔猪机体糖类物质含量及肝脏糖代谢相关基因表达的影响,阐明仔猪早期断奶后机体糖代谢的变化,为仔猪早期断奶的营养调控奠定理论基础。
1 材料与方法 1.1 试验设计选取4头经产母猪,每头母猪哺乳12头健康仔猪(杜×长×大),哺乳阶段母猪饲粮组成及营养水平见表 1。于仔猪18日龄阶段,从每窝仔猪中随机取4头仔猪,共计16头仔猪,进行如下处理:1)分别来自于不同窝的4头仔猪称重、采血后直接用于屠宰取样,作为基础数据;2)另外12头进行断奶处理,为断奶组,饲养在与母猪栏环境相同的小栏中,饲喂配合饲料,其组成及营养水平见表 2。母猪正常哺乳剩余的仔猪,为哺乳组。在断奶后第1天、第3天和第7天(分别对应仔猪19、21、25日龄),从断奶组和哺乳组各取4头仔猪称重、采血后屠宰取样。试验期间自由饮水和采食。
|
|
表 1 哺乳母猪饲粮组成及营养水平(饲喂基础) Table 1 Composition and nutrient levels of the diet for lactating sows (as feed basis) |
仔猪隔夜禁食10 h,于分组处理后1、3和7 d分别从断奶组和哺乳组取4头仔猪前腔静脉采集血液样本,于4 ℃下3 000×g离心10 min得到血清,并屠宰取肝脏与背最长肌[7-8],于-80 ℃保存。
1.3 指标测定 1.3.1 生长性能指标测定对仔猪进行称重,并依据试验不同时间点的体重计算平均日增重。
1.3.2 糖代谢相关物质含量和丙酮酸激酶活性测定使用南京建成生物工程研究所的试剂盒分析血清中葡萄糖和乳酸含量、肝脏和背最长肌中糖原含量以及肝脏中丙酮酸激酶活性,操作按照相应的检测试剂盒说明书进行。
1.3.3 肝脏糖代谢相关基因表达分析采用总RNA抽提试剂盒提取肝脏组织的总RNA,Nano Drop微量分光光度计测定RNA的纯度,并以OD260 nm/OD280 nm评价RNA的纯度,琼脂糖凝胶电泳检测RNA完整性。使用Invitrogen反转录试剂盒SuperscriptTM Ⅱ RTase反转录cDNA。
采用Premier 6.0和Beacon designer软件进行目的基因和18S rRNA内参基因引物的设计,引物序列见表 2。采用TaKaRa SYBR实时荧光定量试剂盒SYBR ® Premix Ex TaqTM进行基因的实时定量检测。实时荧光定量PCR扩增反应体系为25 μL,具体如下:ddH2O 10.5 μL,SYBR Premix Ex TaqTM (2×) 12.5 μL,上、下游引物各1 μL,cDNA模板1.0 μL。反应条件:95 ℃,1 min;45个循环:95 ℃,10 s;62 ℃,25 s;由55 ℃上升到95 ℃,每5 s上升0.5 ℃,以制备熔点曲线。
|
|
表 2 断奶仔猪饲粮组成及营养水平(饲喂基础) Table 2 Composition and nutrient levels of the diet for weanling piglets (as feed basis) |
|
|
表 2 目的基因和内参基因引物 Table 2 Primers of target genes and reference gene |
目的基因的相对表达水平采用2-△△Ct法进行计算[7]。每个待测样品设置3个重复,对得到的3个Ct值取算术平均值。
1.4 数据处理与分析试验数据采用SPSS 16.0软件进行t检验分析,结果以平均值±标准误表示,P<0.05为差异显著性水平。
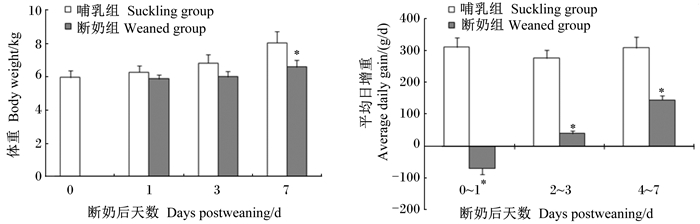
2 结果与分析 2.1 早期断奶对仔猪生长性能的影响如图 1所示,早期断奶处理对仔猪的生长性能产生了一定的影响,尤其是断奶后第1天和第3天,体重呈负增长。在断奶后第3天和第7天,断奶组仔猪的体重分别比哺乳组仔猪减少了11.89%(P>0.05)和16.16%(P<0.05)。在断奶后0~1 d和2~3 d阶段,断奶组仔猪的平均日增重分别为-70.01和40.07 g/d,较哺乳组仔猪显著降低(P<0.05);在断奶后4~7 d阶段,断奶组仔猪的平均日增重为145.09 g/d,与哺乳组比较,其降低了52.85%(P<0.05)。
|
断奶组数据柱标注*表示与哺乳组相比有显著差异(P<0.05)。图 2同。 Date columns in suckling group with * meant significant difference compared with suckling group (P < 0.05). The same as Fig. 2. 图 1 早期断奶仔猪和同日龄哺乳仔猪体重和平均日增重变化 Figure 1 Changes of body weight and average daily gain in early-weaned and age-matched suckling piglets |
由表 3可知,与哺乳组仔猪比较,在断奶后第1天、第3天和第7天,断奶组仔猪血清中葡萄糖含量分别降低了8.33%(P>0.05)、17.81%(P<0.05)和20.99%(P<0.05)。而对于葡萄糖的代谢产物乳酸而言,与哺乳组仔猪比较,在断奶后第1天和第3天,断奶组仔猪血清中乳酸含量分别上升了16.83%(P<0.05)和22.75%(P<0.05);断奶后第7天,断奶组仔猪血清中乳酸含量也略有升高,幅度为12.06%(P>0.05)。对于断奶仔猪体内的糖原而言,肝糖原和肌糖原含量表现出相同的变化趋势。与哺乳组仔猪相比,在断奶后第1天、第3天和第7天,断奶组仔猪肝糖原含量分别降低了24.94%(P<0.05)、48.99%(P<0.05)和36.51%(P<0.05),肌糖原含量分别降低了44.49%(P<0.05)、39.68%(P<0.05)和25.52%(P<0.05)。
|
|
表 3 早期断奶仔猪和同日龄哺乳仔猪糖代谢相关物质含量变化 Table 3 Changes of contents of metabolites related to glycometabolism in early-weaned and age-matched suckling piglets |
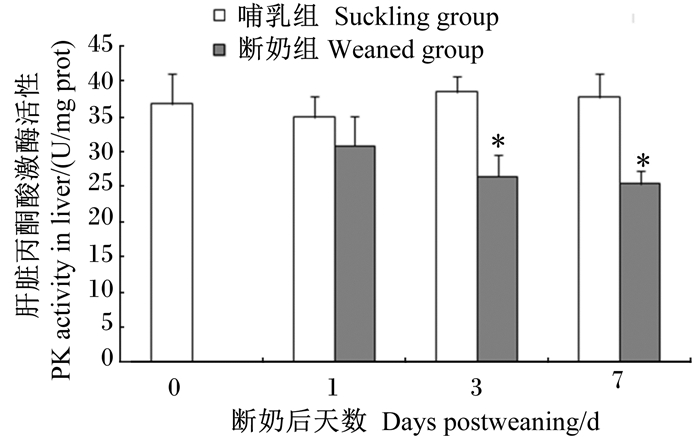
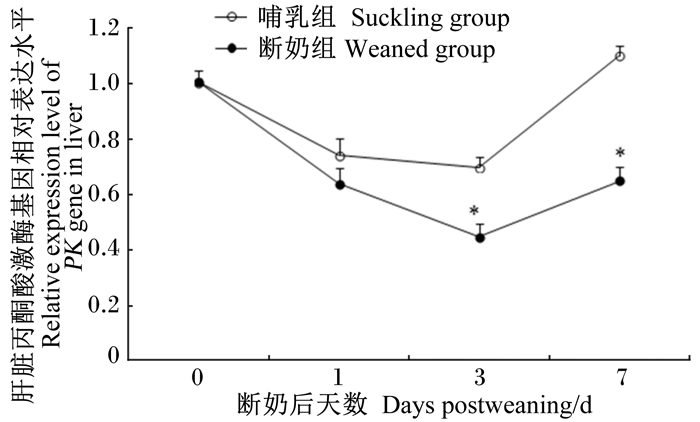
如图 2和图 3所示,与哺乳组仔猪相比,断奶组仔猪肝脏丙酮酸激酶活性在断奶后第3天和第7天分别降低了31.33%(P<0.05)和32.63%(P<0.05),其基因的相对表达水平在断奶后第3天和第7天分别降低了35.71%(P<0.05)和40.91%(P<0.05)。
|
图 2 早期断奶仔猪和同日龄哺乳仔猪肝脏丙酮酸激酶活性变化 Figure 2 Change of PK activity in liver of early-weaned and age-matched suckling piglets |
|
断奶组数据点标注*表示与哺乳组相比有显著差异(P<0.05)。 Date points in suckling group with * meant significant difference compared with suckling group (P < 0.05). 图 3 早期断奶仔猪和同日龄哺乳仔猪肝脏丙酮酸激酶基因相对表达水平变化 Figure 3 Changes of relative expression level of PK gene in liver of early-weaned and age-matched suckling piglets |
由表 4可知,与哺乳组仔猪相比,断奶组仔猪肝脏线粒体磷酸烯醇式丙酮酸羧激酶基因的相对表达水平在断奶后第1天提高了57.75%,且其肝脏胞质磷酸烯醇式丙酮酸羧激酶基因的相对表达水平在断奶后第1天、第3天和第7天分别提高了65.57%、97.74%和68.60%,差异均达到显著水平(P<0.05)。与哺乳组仔猪相比,断奶组仔猪肝脏葡萄糖-6-磷酸酶基因的相对表达水平在断奶后第1天和第3天均显著提高(P<0.05),分别提高了67.57%和128.43%。
|
|
表 4 早期断奶仔猪与同日龄哺乳仔猪肝脏线粒体磷酸烯醇式丙酮酸羧激酶、胞质磷酸烯醇式丙酮酸羧激酶和葡萄糖-6-磷酸酶基因相对表达水平变化 Table 4 Changes of relative expression levels of PEPCK-M, PEPCK-C and G-6-P genes in liver of early-weand and age-matched suckling piglets |
早期断奶的仔猪由于受环境、心理及营养应激等因素的影响,常常会表现出一系列的不良症状,使生长迟滞和消化代谢紊乱[9]。本研究表明,早期断奶可使仔猪的生长性能下降,特别是在断奶后的前3天,仔猪基本处于负增长状态。本课题组的前期研究也发现,在21~28日龄阶段,与哺乳仔猪比较,对21日龄断奶仔猪的体重和平均日增重分别下降了16.53%和127.98%[8]。导致此结果的原因可能是仔猪由摄食富含乳糖、乳蛋白和乳脂等易于消化的液态奶转变成摄食玉米-豆粕型固体饲粮,营养物质的可消化性下降。研究发现,猪乳中的乳糖含量较高,在泌乳第20天时猪乳中乳糖含量高达5.77 g/dL;同时,猪乳中含有丰富的易被肠道消化吸收谷氨酰胺、精氨酸、赖氨酸和缬氨酸等氨基酸以及精胺、亚精胺和腐胺等多胺物质[10-11],这些氨基酸对促进仔猪的肠道发育和维持肠黏膜的完整性具有重要的作用[12],而玉米-豆粕型固体饲粮中这些相应的营养成分含量相差较大。另外,断奶应激本身可使得仔猪的采食量下降,并损伤仔猪肠道组织的形态结构,阻碍免疫系统和酶系统发育[1-2],干扰消化道微生态区系的平衡[13],使仔猪肠道的消化吸收性能受到影响。
断奶后的短时期内,仔猪小肠长度、重量、微绒毛高度、隐窝深度、黏膜屏障等肠道结构发生变化,同时小肠绒毛刷状缘消化酶活性和吸收能力降低,从而对肠道氨基酸和糖类的吸收能力产生影响[8]。本课题组的前期研究发现,早期断奶后仔猪血清、肌肉和肝脏中的游离赖氨酸及血清中的必需氨基酸、苏氨酸含量显著降低[7-8]。Hampson等[14]发现仔猪断奶后小肠中乳糖酶和蔗糖酶活性均显著降低,断奶后第4~5天时上述酶活性至少降低了50%,此后小肠各个位点乳糖酶活性持续下降,而蔗糖酶活性在断奶后第11天才开始恢复。Pié等[15]指出28日龄断奶仔猪近端小肠蔗糖酶活性在断奶后第1天下降了85%,远端小肠蔗糖酶活性在断奶后第2天与断奶后第1天比较,其活性下降了30%。本研究发现,18日龄早期断奶使仔猪血清葡萄糖含量降低,与哺乳仔猪相比,在断奶后的第1天、第3天和第7天,断奶仔猪肝糖原含量分别降低了24.94%、48.99%和36.51%,肌糖原含量分别降低了44.49%、39.68%和36.01%,与此相对应的是肌糖原的代谢产物乳酸含量升高。其原因是,在早期断奶过程中,仔猪摄入的碳水化合物、脂类等能量物质含量急剧减少[16],且处于烦躁状态的仔猪运动量加大,导致体内糖原分解供能。
肝脏糖代谢调节在动物饥饿状态下占据重要地位,主要是通过糖原分解和葡萄糖异生途径完成内源性葡萄糖产出过程[17]。由于仔猪在出生后糖原很快被耗尽[15],肝糖异生作用对新生仔猪变得异常重要,是仔猪在断奶应激情况下的主要能量来源。磷酸烯醇式丙酮酸羧激酶(PEPCK)主要存在于动物肝脏、肾脏与脂肪组织中,催化草酰乙酸转变成磷酸烯醇式丙酮酸与二氧化碳。磷酸烯醇式丙酮酸羧激酶包括线粒体磷酸烯醇式丙酮酸羧激酶和胞质磷酸烯醇式丙酮酸羧激酶2个同工酶,分别位于细胞胞质和线粒体中,对血糖的稳定具有重要意义[5]。本试验中,早期断奶后,断奶仔猪肝脏线粒体磷酸烯醇式丙酮酸羧激酶、胞质磷酸烯醇式丙酮酸羧激酶和葡萄糖-6-磷酸酶基因相对表达水平均有不同程度的升高,反映肝脏的糖原异生作用增强,以增加机体的葡萄糖含量,适应机体对葡萄糖代谢的需要[6]。丙酮酸激酶作为糖酵解途径中最后一步限速酶,在糖酵解系统里,为催化形成第2个ATP反应的酶[18]。本试验中,在断奶仔猪肝脏中,丙酮酸激酶的基因表达水平和活性均显著下降,表明糖酵解能力下降,可能是由于体内葡萄糖含量下降,阻止糖酵解的发生进而维持机体糖代谢的平衡。
4 结论仔猪在早期断奶阶段,机体能量摄入严重匮乏,由此血清中葡萄糖含量下降,导致机体动用肝脏和肌肉中的糖原,促进其分解供能,由此使得血清乳酸含量上升。同时,肝脏糖异生的相关酶磷酸烯醇式丙酮酸羧激酶、葡萄糖-6-磷酸酶基因相对表达水平升高,糖酵解关键酶丙酮酸激酶基因相对表达水平和活性均降低,反映了仔猪早期断奶阶段通过增强肝脏的糖异生作用和减弱肝脏的糖酵解作用来维持体内的糖代谢平衡。
| [1] |
MOESER A J, KLOK C V, RYAN K A, et al. Stress signaling pathways activated by weaning mediate intestinal dysfunction in the pig[J]. American Journal of Physiology:Gastrointestinal and Liver Physiology, 2007, 292(1): 173-181. DOI:10.1152/ajpgi.00197.2006 |
| [2] |
WIJTTEN P J, VAN DER MEULEN J, VERSTEGEN M W. Intestinal barrier function and absorption in pigs after weaning:a review[J]. British Journal of Nutrition, 2011, 105(7): 967-981. DOI:10.1017/S0007114510005660 |
| [3] |
张文飞, 刘苹苹, 管武太, 等. 饲粮中添加卵黄抗体对断奶仔猪生长性能、血清生化指标、肠道形态及肠道微生物菌群的影响[J]. 动物营养学报, 2017, 29(1): 271-279. |
| [4] |
NAFIKOV R A, BEITZ D C. Carbohydrate and lipid metabolism in farm animals[J]. The Journal of Nutrition, 2007, 137(3): 702-705. DOI:10.1093/jn/137.3.702 |
| [5] |
SHE P X, BURGESS S C, SHIOTA M, et al. Mechanisms by which liver-specific PEPCK knockout mice preserve euglycemia during starvation[J]. Diabetes, 2003, 52(7): 1649-1654. DOI:10.2337/diabetes.52.7.1649 |
| [6] |
HANSON R W, GARBER A J. Phosphoenol pyruvate carboxykinase Ⅰ:its role in gluconeogenesis[J]. American Journal of Clinical Nutrtition, 1972, 25(10): 1010-1021. DOI:10.1093/ajcn/25.10.1010 |
| [7] |
王龙生, 杨华, 代兵, 等. 早期断奶对仔猪血清、肌肉及肝脏氨基酸代谢的影响[J]. 中国畜牧杂志, 2016, 52(21): 65-71. DOI:10.3969/j.issn.0258-7033.2016.21.015 |
| [8] |
XIAO Y P, WU T X, HONG Q H, et al. Response to weaning and dietary L-glutamine supplementation:Metabolomic analysis in piglet by gas chromatography/mass spectrometry[J]. Journal of Zhejiang University:Science B, 2012, 13(7): 567-578. DOI:10.1631/jzus.B1100343 |
| [9] |
JIAO L F, KE Y L, XIAO K, et al. Effects of cello-oligosaccharide on intestinal microbiota and epithelial barrier function of weanling pigs[J]. Journal of Animal Science, 2015, 93(3): 1157-1164. DOI:10.2527/jas.2014-8248 |
| [10] |
WU G, KNABE D A. Free and protein-bound amino acids in sow's colostrum and milk[J]. The Journal of Nutrition, 1994, 124(3): 415-424. DOI:10.1093/jn/124.3.415 |
| [11] |
CHENG Z B, LI D F, GE C R, et al. Polyamines in sow colostrum and milk at different stages of lactation[J]. Animal Science, 2006, 82(1): 95-99. |
| [12] |
WANG J J, CHEN L X, LI P, et al. Gene expression is altered in piglet small intestine by weaning and dietary glutamine supplementation[J]. The Journal of Nutrition, 2008, 138(6): 1025-1032. DOI:10.1093/jn/138.6.1025 |
| [13] |
孔祥杰, 姜海龙, 蔡维北, 等. 黄芪茎叶对断奶仔猪盲肠微生物区系的影响[J]. 中国畜牧杂志, 2017, 53(3): 117-120, 124. |
| [14] |
HAMPSON D J, KIDDER D E. Influence of creep feeding and weaning on brush borsh border enzyme activities in the piglet small intestine[J]. Research in Veterinary Science, 1986, 40(1): 24-31. |
| [15] |
PIÉ S, LALLẼS J P, BLAZY F, et al. Weaning is associated with an upregulation of expression of inflammatory cytokines in the intestine of piglets[J]. The Journal of Nutrition, 2004, 134(3): 641-647. DOI:10.1093/jn/134.3.641 |
| [16] |
XIAO Y P, LI X Y, WU T X, et al. Effects of dietary glutamine supplementation on nutrient absorption and activity of enzymes involved in glutamine metabolism and energy production in the jejunum of weaned piglets[J]. Journal of Animal and Veterinary Advance, 2012, 11(9): 1441-1449. DOI:10.3923/javaa.2012.1441.1449 |
| [17] |
VAN POELJE P D, POTTER S C, CHANDRAMOULI V C, et al. Inhibition of fructosel, 6-bisphoshatase reduces excessive endogenous glucose production and attenuates hyperglycemia in Zuekerdiabetic fatty rats[J]. Diabetes, 2006, 55(6): 1747-1754. DOI:10.2337/db05-1443 |
| [18] |
LE DIVIDICH J, ESNAULT T, LYNCH B, et al. Effect of colostral fat level on fat deposition and plasma metabolites in the newborn pig[J]. Journal of Animal Science, 1991, 69(6): 2480-2488. DOI:10.2527/1991.6962480x |




