2. 中国科学院亚热带农业生态研究所, 亚热带农业生态过程重点实验室, 长沙 410125
2. Key Laboratory for Agro-Ecological Processes in Subtropical Region, Institute of Subtropical Agriculture, Institute of Subtropical Agriculture, Chinese Academy of Sciences, Changsha 410125, China
脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON),属于单端孢霉烯族类化合物,主要由禾谷镰刀菌、尖孢镰刀菌、雪腐镰刀菌等镰刀菌产生。另外,头孢菌属、木霉属等都可产生该毒素。由于它可以引起猪的呕吐,故又名呕吐毒素[1-2]。该毒素最初是1970年在日本香川县的霉病大麦病毒中发现,1972年,日本的学者首次从赤霉病大麦中分离得到并阐明了这种新的真菌毒素的化学结构,将其命名为DON[3]。当人食用了被DON污染的食物后,会导致厌食、呕吐、发烧、腹泻、站立不稳、反应迟钝等急性中毒症状,严重时影响造血系统甚至死亡[4]。中国传统饮食习惯中粮谷比例远远高于西方,使得DON的危害更为突出。1998年,在国际癌症研究机构公布的评价报告中,DON被列为3类致癌物。欧盟要求饲料中DON浓度要小于0.75 mg/kg,中国饲料DON浓度限量值为1 mg/kg[5-6]。
猪摄入DON以后,对脑神经产生麻痹作用。而且,即使是低浓度的DON也能引起猪脑中5-羟吲哚乙酸含量的提高[7]。不同浓度DON对大鼠红细胞的溶血作用不同,其溶血作用有一个阈值,低于此浓度则红细胞不会发生溶血反应[8]。DON可能通过3种不同的方式对原核细胞产生毒性作用:1)通过渗透磷脂双层,作用于亚细胞水平;2)通过与细胞膜相互作用;3)通过自由基介导的脂质过氧化作用。DON可能以1种或1种以上的方式同时发挥毒性作用[7]。研究发现,DON可作用于骨髓造血细胞而产生细胞毒性。其免疫毒性作用依赖于DON的浓度、淋巴细胞亚型、组织来源和糖皮质激素[9]。另外,DON可以抑制胸腺细胞的蛋白质合成。多数研究都表明DON具有胚胎毒性和致畸作用。动物试验表明,长期小剂量饲喂含DON的饲料,可以诱发不同器官的肿瘤[10]。小鼠经口服给药5和25 mg/kg DON,结果显示细胞炎症因子白细胞介素-6(IL-6)、白细胞介素-1β(IL-1β)和肿瘤坏死因子-α(TNF-α)的mRNA的表达量升高,高浓度DON可抑制体外培养的人外周淋巴细胞的增殖及免疫球蛋白的产生,并且该抑制作用有剂量依赖性;而低浓度则使免疫球蛋白含量升高[11-12]。
由于猪肠上皮细胞在免疫系统中起重要作用,通过不同的机制参与肠的先天免疫反应,例如屏障功能、抗菌肽合成、黏液分泌和参与细胞因子趋化。而目前关于肠细胞功能的大多数知识来自人类癌症或从经典动物模型产生的细胞培养物进行的研究。但是,物种在响应特异性环境时选择不同的细胞因子,所以在猪活体上需要谨慎的运用基于小鼠和人的免疫功能模型[13]。因此,基于分子水平的基础研究至关重要。
本文选取猪空肠上皮细胞系IPEC-J2细胞,通过Cell Counting Kit-8(CCK-8试剂盒)检测DON对细胞的增殖毒性,筛选合适的DON浓度和作用时间,进而检测DON对细胞周期和凋亡的影响。通过这些指标来观测DON对IPEC-J2细胞凋亡的影响。
1 材料与方法 1.1 试验材料DON(Sigma-Aldrich公司,美国),青霉素、链霉素(碧云天生物技术研究所),胎牛血清(FBS)、高糖培养基(DMEM)、25%胰蛋白酶-乙二胺四乙酸(Trypsin-EDTA)、苯酚红(phenol red)、胰蛋白酶(Gibco公司,美国),磷酸盐缓冲液(phosphate buffered saline,PBS)(HyClone公司,美国),CCK-8试剂盒(同仁化学研究所,日本),Annexin V-FITC/PI双染细胞凋亡检测试剂盒(江苏凯基生物技术股份有限公司),碘化丙啶(propidium iodide,PI)(Sigma公司,美国)。
1.2 试验仪器Memmert-CO2培养箱、Leica倒置荧光显微镜、Eppendort离心机(德国),SW-CJ-IF型单人双面净化工作台(苏州净化设备有限公司),多功能酶标仪(瑞士)。
1.3 细胞来源IPEC-J2细胞由中国科学院亚热带农业生态研究所单胃动物研究组提供。
1.4 试验方法 1.4.1 DON配制将原装DON粉末溶解在二甲基亚砜(DMSO)中,配成1 mg/mL母液,用0.22 μm滤膜过滤。再分别用含有10% FBS和1%青-链霉素的完全培养基配成浓度分别为200和2 000 ng/mL的DON溶液,整个过程在超净台完成。
1.4.2 细胞培养IPEC-J2细胞培养液为含体积分数10% FBS及1%双抗的DMEM培养基,接种量为每毫升3.0×106个细胞。细胞接种于10 cm细胞培养皿,再转移至温度为37 ℃、体积分数为5%的CO2细胞培养箱内培养。
1.4.3 CCK-8试剂盒试验接种和DON处理取对数生长期的IPEC-J2细胞,用2.5 g/L胰蛋白酶消化,接种于3块96孔板,分别标明24、48、72 h,每孔约1×104个细胞,每板A、B、C、D 4个组,每个组2列10个重复,待细胞生长到合适密度,更换加药物处理的培养液,具体分组见表 1。第1列为清零组,加100 μL培养液,其他列加入不同药物处理的等量100 μL培养液。
|
|
表 1 组别与DON浓度 Table 1 Groups and DON concentration |
待加入DON 24、48、72 h后,更换含有10% CCK-8试剂盒的培养液,放培养箱孵育2 h,之后用酶标仪检测吸光度(OD)值,检测波长为450 nm。
细胞存活率计算公式(与对照组比较):
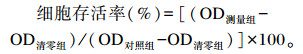
|
IPEC-J2细胞接种于10 cm细胞培养皿,置于温度为37 ℃、体积分数5%的CO2细胞培养箱内培养。待6、12、24 h各组细胞长到合适浓度,更换含有0、200、2 000 ng/mL DON的培养液。
1.5.2 细胞收集和检测配制70%乙醇,放置在-20 ℃冰箱预冷备用,准备一盒冰备用,2.5 g/L胰蛋白酶消化细胞,收集在15 mL离心管中,1 000 r/min、20 ℃离心5 min,收集细胞,去上清培养基;15 mL离心管中加入3~5 mL PBS,枪头轻轻吹打混匀细胞,1 000 r/min、20 ℃离心5 min,去上清,留200 μL左右的PBS上清液,枪头轻轻吹打混匀。吸取800 μL预冷的70%乙醇到1.5 mL离心管中,将200 μL混匀的细胞悬液一滴滴地加至70%酒精中固定,细胞周期样品可在-20 ℃冰箱中保存3~4 d。
取出固定的样品,800 r/min离心5 min,弃上清。加入1 mL预冷PBS重悬细胞,800 r/min离心5 min,收细胞。可重复1~2次,以除去乙醇。加入150 μL PI工作液,4 ℃避光染色30 min。转至流式检测管,上机检测,PI用488 nm氩离子激光器激发,由630带通滤光片接收,通过FSC/SSC散点图收集10 000个细胞,采用设门技术排除粘连细胞和碎片,分析PI荧光直方图上细胞各周期的百分率。
1.6 不同浓度DON处理后细胞凋亡检测 1.6.1 细胞培养和DON处理同1.5.1。
1.6.2 细胞收集和检测待不同浓度DON处理6、12、24 h后,去掉培养液,用适量PBS洗涤细胞1遍,2.5 g/L胰蛋白酶消化细胞,1 000 r/min、20 ℃离心5 min,收集于15 mL离心管,用PBS洗涤细胞2次,每次2 000 r/min、20 ℃离心5 min,收集1×105~5×105个细胞,加入500 μL的结合缓冲液(binding buffer)悬浮细胞加入5 μL细胞凋亡检测试剂(Annexin V-FITC)混匀后,加入5 μL PI,混匀。室温、避光,反应5~15 min,1 h内在流式细胞仪观察检测。
1.7 数据统计分析所有数据用使用SPSS 22.0一般线性模型进行单变量分析,因变量为生存率,固定因子为浓度和时间。P<0.05为差异显著,P<0.01为差异极显著。
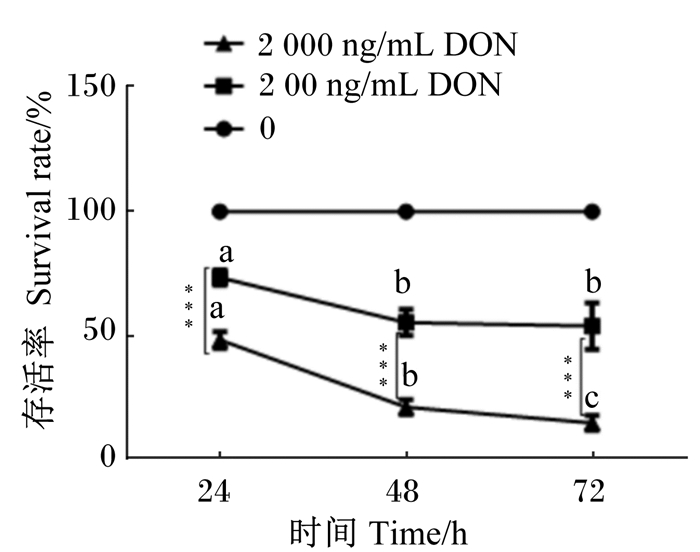
2 结果与分析 2.1 不同浓度DON和时间对IPEC-J2细胞存活率的影响不同浓度DON和时间对IPEC-J2细胞存活率影响的结果如图 1。在同一时间与对照组相比,200和2 000 ng/mL DON组细胞存活率均极显著降低(P<0.01),且2 000 ng/mL DON组细胞存活率极显著低于200 ng/mL DON组(P<0.01)。不同时间的细胞存活率相比,相同DON浓度随着时间的增加呈现剂量依赖性增加的规律;200和2 000 ng/mL DON浓度下,48和72 h的细胞存活率显著低于24 h(P<0.05);200 ng/mL DON浓度下,48 h和72 h相比无显著差异(P>0.05)。
|
不同时间下,数据点标注不同小写字母表示差异显著(P<0.05),相同字母表示差异不显著(P>0.05);不同DON浓度下,数据点标注***表示差异极显著(P<0.01)。 At different time, value points with different small letters mean significant difference (P < 0.05), while with the same small letters mean no significant difference (P > 0.05). Value points with *** mean significant difference in different DON concentrations (P < 0.01). 图 1 不同浓度DON和时间对IPEC-J2细胞存活率的影响 Figure 1 Effects of different DON concentration and time on survival rate of IPEC-J2 cells |
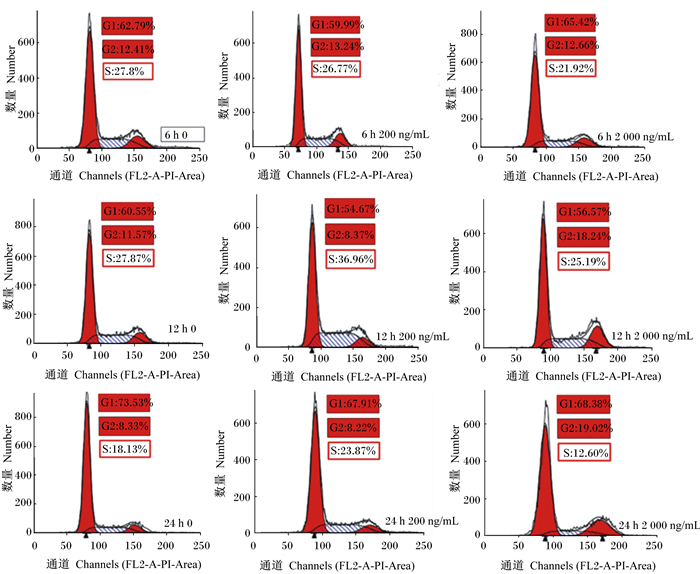
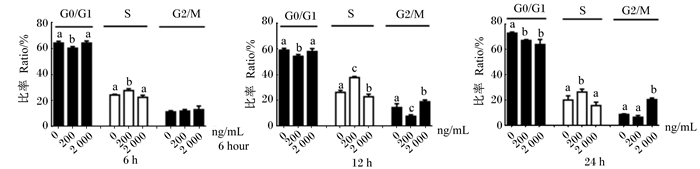
不同浓度DON和时间下IPEC-J2细胞生长周期状态见图 2,不同浓度DON和时间对IPCE-J2细胞周期的影响见图 3。不同DON浓度对细胞周期影响不同,低浓度DON主要作用于细胞有丝分裂S期,干扰DNA的复制;而高浓度DON主要作用于细胞有丝分裂G2/M期,干扰有关酶与纺锤丝蛋白质的合成。
|
G0、G1表示细胞有丝分裂前期,S表示细胞有丝分裂中期,G2、M表示细胞有丝分裂后期。图 3同。 G0 and G1 indicates cell mitosis prophase, S indicates cell mitosis metaphase, and G2 and M indicates cell mitosis anaphase. The same as Fig. 3. 图 2 不同浓度DON和时间下IPEC-J2细胞周期直方图 Figure 2 IPEC-J2 cell cycle histograms under different DON concentrations and time |
|
数据柱上标无或相同小写字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。 Value columns with no or the same small letter superscripts mean no significant difference (P > 0.05), while with different small letter superscripts mean significant difference (P < 0.05). 图 3 不同浓度DON和时间对IPCE-J2细胞周期的影响 Figure 3 Effects of different DON concentration and time on cell cycle of IPEC-J2 cells |
DON对细胞凋亡的影响见图 4及表 2、表 3。其中在6 h,早期凋亡率和总凋亡率都随着DON浓度升高而升高,200和2 000 ng/mL DON组显著高于对照组(P<0.05);在12 h,2 000 ng/mL DON组早期凋亡率和总凋亡率显著高于对照组和200 ng/mL DON组(P<0.05);在24 h,各组间早期凋亡率和总凋亡率无显著差异(P<0.05)。200 ng/mL DON浓度下,12和24 h早期凋亡率和总凋亡率显著低于6 h (P<0.05);2 000 ng/mLDON浓度下,24 h早期凋亡率和总凋亡率显著低于6和12 h (P<0.05)。
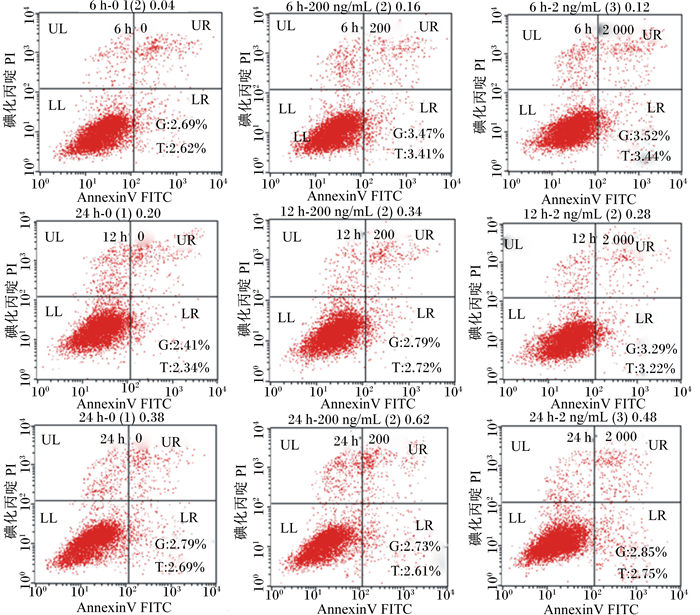
|
UL区为细胞坏死(上左),LL区为细胞存活(下左),UR区为晚期凋亡细胞(上右),LR为早期凋亡细胞(下右),G为早期凋亡率,T为总凋亡率。 UL region was merornecrosis (upper left), LL region was cell survival (lower left), UR region was non-viable apoptotic cell (upper right), LR region was viable apoptotic cell (lower right), G was early apoptosis rate, T was total apoptosis rate. 图 4 不同浓度DON和时间下IPEC-J2细胞凋亡散点图 Figure 4 IPEC-J2 cell apoptosis scatter plot under different DON concentrations and time |
|
|
表 2 不同浓度DON和时间对IPCE-J2细胞早期凋亡率和总凋亡率的影响 Table 2 Effects of different DON concentration and time on early apoptosis rate and total apoptosis rate of IPEC-J2 cells |
|
|
表 3 不同浓度DON和时间对IPCE-J2细胞早期凋亡率和总凋亡率的影响 Table 3 Effects of different DON concentration and time on early apoptosis rate and total apoptosis rate of IPEC-J2 cells |
研究表明,DON对原核细胞、真核细胞均具有明显的毒性作用,特别是对于生长较快的细胞如胃肠道黏膜细胞、淋巴细胞、胸腺细胞、脾细胞、骨髓造血细胞等均有损伤作用,并且抑制蛋白质合成。Alm等[14]、Tiemann等[15]研究表明,DON能影响细胞周期的分布,抑制细胞进入S期,使细胞阻滞在G0、G1期,具有显著的抗增殖作用。本试验结果表明,DON具有明显的抑制细胞生长的作用,在24 h内作用显著,超过48 h后低浓度(200 ng/mL)DON作用趋势平稳,高浓度(2 000 ng/mL)DON持续抑制;IPEC-J2细胞存活率随着DON浓度增高而极显著下降。低浓度DON主要作用于细胞有丝分裂S期,干扰DNA的复制;高浓度DON主要作用于细胞有丝分裂G2/M期,干扰有关酶与纺锤丝蛋白质的合成。此结果与前人报道[16]相似。
细胞凋亡指为维持内环境稳定,由基因控制的细胞自主的有序的死亡。凋亡分为3个步骤:凋亡起始、凋亡小体形成、凋亡小体被邻近的细胞或体内吞噬细胞所吞噬;机理为接受凋亡信号→凋亡调控分子间的相互作用→蛋白水解酶的活化→进入连续反应过程。凋亡细胞的残余物质被消化后重新利用。本试验的凋亡试验结果显示,IPEC-J2细胞在DON作用6 h后,200和2 000 ng/mL DON组的早期凋亡率和总凋亡率显著升高;12 h后,2 000 ng/mL DON组的早期凋亡率和总凋亡率显著升高;24 h后作用不再显著。相同浓度DON处理不同时间,低浓度DON作用12和42 h后早期凋亡率和总凋亡率显著降低;高浓度DON作用24 h后早期凋亡率和总凋亡率显著降低。与低浓度不同的是,高浓度DON促进凋亡作用持续到12 h,这与启动了不同的凋亡机制有关[17]。
4 结论① DON对IPEC-J2细胞生长有明显抑制作用,其抑制作用效果随着DON浓度增高而增强,其中抑制细胞增殖主要作用在24 h。
② 不同DON浓度对细胞周期影响不同,低浓度DON主要作用于细胞有丝分裂S期,干扰DNA的复制;高浓度DON主要作用于细胞有丝分裂G2/M期,干扰有关酶与纺锤丝蛋白质的合成。
③ DON促使细胞早期凋亡,使总凋亡率上升,且促凋亡作用随DON浓度升高而增强。
| [1] |
PESTKA J J. Deoxynivalenol-induced proinflammatory gene expression:mechanisms and pathological sequelae[J]. Toxins, 2010, 2(6): 1300-1317. |
| [2] |
PESTKA J J, SMOLINSKI A T. Deoxynivalenol:toxicology and potential effects on humans[J]. Journal of Toxicology and Environmental Health:Part B, 2005, 8(1): 39-69. DOI:10.1080/10937400590889458 |
| [3] |
YOSHIZAWA T, TAKEDA H, OHI T. Structure of a novel metabolite from deoxynivalenol, a tricho-thecene mycotoxin, in animals[J]. Agricultural and Biological Chemistry, 1983, 47(9): 2133-2135. |
| [4] |
COPPICK R W, SWANSON S P, GELBERG H B, et al. Preliminary study of the pharmacokinetics and toxicopathy of deoxynivalenol (vomitoxin) in swine[J]. American Journal of Veterinary Research, 1985, 46(1): 169-174. |
| [5] |
PESTKA J J. Deoxynivalenol:mechanisms of action, human exposure, and toxicological relevance[J]. Archives of Toxicology, 2010, 84(9): 663-679. DOI:10.1007/s00204-010-0579-8 |
| [6] |
ZHANG H, VAN DER LEE T, WAALWIJK C, et al. Population analysis of the Fusarium graminearum species complex from wheat in China show a shift to more aggressive isolates[J]. PLoS One, 2012, 7(2): e31722. DOI:10.1371/journal.pone.0031722 |
| [7] |
PRELUSKY D B, VEIRA D M, TRENHOLM H L, et al. Excretion profiles of the mycotoxin deoxynivalenol, following oral and intravenous administration to sheep[J]. Fundamental and Applied Toxicology, 1986, 6(2): 356-363. DOI:10.1016/0272-0590(86)90251-4 |
| [8] |
RIZZO A F, ATROSHI F, AHOTUPA M, et al. Protective Effect of Antioxidants against Free Radical-Mediated Lipid Peroxidation Induced by DON or T-2 Toxin[J]. Transboundary and Emerging Diseases, 1994, 41(1/2/3/4/5/6/7/8/9/10): 81-90. |
| [9] |
LAUTRAITE S, PARENT-MASSIN D, RIO B, et al. In vitro toxicity induced by deoxynivalenol (DON) on human and rat granulomonocytic progenitors[J]. Cell Biology and Toxicology, 1997, 13(3): 175-183. DOI:10.1023/A:1007306212898 |
| [10] |
CHUNG Y J, ZHOU H R, PESTKA J J. Transcriptional and posttranscriptional roles for p38 mitogen-activated protein kinase in upregulation of TNF-α expression by deoxynivalenol (vomitoxin)[J]. Toxicology and Applied Pharmacology, 2003, 193(2): 188-201. DOI:10.1016/S0041-008X(03)00299-0 |
| [11] |
甄阳光, 柏凡, 张克英, 等. 我国主要饲料原料及产品中呕吐毒素污染分布规律研究[J]. 中国畜牧杂志, 2009, 45(8): 21-24, 28. |
| [12] |
VARGE E, MALACHOVA A, SCHWARTZ H, et al. Survey of deoxynivalenol and its conjugates deoxynivalenol-3-glucoside and 3-acetyl-deoxynivalenol in 374 beer samples[J]. Food Additives & Contaminants:Part A, 2013, 30(1): 137-146. |
| [13] |
MARIANI V, PALERMO S, FIORENTINI S, et al. Gene expression study of two widely used pig intestinal epithelial cell lines:IPEC-J2 and IPEC-1[J]. Veterinary Immunology and Immunopathology, 2009, 131(3/4): 278-284. |
| [14] |
ALM H, GREISING T, BRVSSOW K P, et al. The influence of the mycotoxins deoxynivalenol and zearalenol on in vitro maturation of pig oocytes and in vitro culture of pig zygotes[J]. Toxicology in Vitro, 2002, 16(6): 643-648. DOI:10.1016/S0887-2333(02)00059-0 |
| [15] |
TIEMANN U, VIERGUTZ T, JONAS L, et al. Influence of the mycotoxins α-and β-zearalenol and deoxynivalenol on the cell cycle of cultured porcine endometrial cells[J]. Reproductive Toxicology, 2003, 17(2): 209-218. DOI:10.1016/S0890-6238(02)00141-7 |
| [16] |
DIESING A K, NOSSOL C, DANICKE S, et al. Vulnerability of polarised intestinal porcine epithelial cells to mycotoxin deoxynivalenol depends on the route of application[J]. PLoS One, 2011, 6(2): e17472. DOI:10.1371/journal.pone.0017472 |
| [17] |
DIESING A K, NOSSOL C, PANTHER P, et al. Mycotoxin deoxynivalenol (DON) mediates biphasic cellular response in intestinal porcine epithelial cell lines IPEC-1 and IPEC-J2[J]. Toxicology Letters, 2011, 200(1/2): 8-18. |




