围产期奶牛因干物质采食量(DMI)下降,胎儿后期生长和泌乳对能量的需求增多,导致体脂动员增强,过度的体脂动员产生的非酯化脂肪酸(NEFA)在肝脏中难以全部氧化供能,进而在肝脏中再酯化为甘油三酯(TG),最终引发脂肪肝等能量代谢病,损坏肝脏功能,影响健康状况,降低生产性能[1-3]。胆碱(需包被才能有效吸收利用)在机体内能合成磷脂酰胆碱,后者能促进极低密度脂蛋白(VLDL)合成,进而促进肝脏组织中TG的利用而有效防止TG的沉积,保护肝脏功能,提高泌乳性能[4-7]。郑家三等[8]的研究表明,围产期奶牛饲粮添加过瘤胃胆碱能延缓血浆葡萄糖(Glu)含量的下降,显著降低奶牛血浆β-羟丁酸(BHBA)、NEFA和总胆固醇含量。Cooke等[9]的研究也表明,过瘤胃保护胆碱可降低肝脏组织中TG沉积。Elek等[10]也证明,饲粮添加60 g/d的过瘤胃保护胆碱可有效降低奶牛围产期肝脏脂肪和TG含量。此外,围产期奶牛肝脏组织中NEFA氧化供能过程中会产生氧化产物,会造成机体氧化应激,也会损伤肝脏功能[11-12]。硒能促进抗氧化蛋白酶的合成而清除肝脏组织中氧化产生的氧化产物,从而起到抗氧化作用,维护奶牛机体健康[13-14]。而奶牛养殖中,常常忽视围产期奶牛发生能量代谢病的同时也遭受着氧化应激。本研究团队组合了胆碱和硒,研发出富硒和过瘤胃胆碱的新型护肝专用的添加剂,在理论上具有胆碱和硒的双重功能,在防治能量代谢病的同时清除自由基等氧化产物,维护肝功能,促进奶牛机体健康。本试验在围产期奶牛饲粮中添加该富硒和过瘤胃胆碱新型添加剂,研究对生产性能和健康状况的影响,为此新型添加剂在奶牛生产上的推广应用提供理论依据和数据支持。
1 材料与方法 1.1 主要试剂富硒和过瘤胃胆碱新型添加剂:由光明牧业有限公司生产,其中过瘤胃胆碱含量≥95%(胆碱含量≥25%,有效利用率≥75%),硒含量≥0.2%。
1.2 试验动物与饲养管理 1.2.1 试验地点及试验动物试验地点:上海市星火奶牛二场。
试验动物:96头健康的荷斯坦奶牛,产前21 d左右、(2.17±0.21)胎次、体况评分为3.47±0.11、上一胎次总产奶量为(10.82±0.56) t。
1.2.2 基础饲粮及饲养管理奶牛双列对尾栓系式饲养,自由饮水。参照NRC(2001)奶牛营养需要并结合生产实践配制基础饲粮,以全混合日粮(TMR)形式饲喂[15]。基础饲粮组成及营养水平见表 1,每天分3次(06:00、13:30和19:00)饲喂,采用机械发料车发料,每日保留有5%剩料量以便DMI检测。每个饲喂时间点挤奶1次。
|
|
表 1 基础饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of basal diets (DM basis) |
采用完全随机区组设计,根据胎次、上一泌乳周期总产奶量、体况评分、预产期等将96头受试奶牛分为4组,分别为对照组、低剂量(LD)组、中剂量(MD)组和高剂量(HD)组,每组24头,分组信息见表 2。对照组及LD、MD和HD组奶牛基础饲粮中分别添加0、40、80和120 g/(头·d)的富硒和过瘤胃胆碱新型添加剂,于晨饲前将添加剂拌于1/3的基础饲粮中饲喂。预试期为产前21 d至产前15 d,正试期为产前14 d至产后28 d,每周为1个采样周期。
|
|
表 2 试验奶牛分组信息 Table 2 Grouping information of dairy cows |
挤奶采用真空管道式挤奶设备,记录产犊后每天早中晚的产奶量。于产后每个采样周期的最后3 d连续采集早、中、晚3次的乳样,按4 : 3 : 3混合后,取50 mL,加入5%重铬酸钾防腐,迅速置于4 ℃恒温冰箱内送检。
1.4.2 血浆样品的采集与处理于产前14、7 d,分娩当天,产后7、14、21和28 d晨饲前采集尾根静脉血,肝素钠抗凝,4 ℃下3 500 r/min离心15 min,分离血浆,血浆样于-20 ℃下冷冻保存送检。
1.4.3 肝脏组织样品的采集与处理产后14 d,从每组中随机挑选5头牛,空腹条件下站立保定,用穿刺针从髋结节到右前肢肘关节的连线与第10根和第11根肋骨间隙(体型较短的奶牛,为第11根和第12根肋骨间隙)交叉点上移2.5~3.5 cm穿刺采集肝脏组织,用预冷灭菌的生理盐水冲洗组织,并分装于冻存管中,液氮保存[16]。样品用于测定肝脏组织中硒含量、TG含量、抗氧化指标及关键抗氧化蛋白和脂质转运蛋白的mRNA相对表达量。
1.5 指标测定 1.5.1 DMI正试期内每天采集饲粮,分别记录各组奶牛每天的发料量和剩料量,每天的采食量通过发料量减去剩料量获得。正试期结束后,将采集的饲粮样品解冻并充分混合,按照四分法采样,放置于55 ℃恒温烘箱内烘干至恒重,测定饲粮中的干物质含量,再根据采食量和干物质含量计算DMI。
1.5.2 体重、体况评分与产犊系数评分正试期第1天和最后1 d测定各组奶牛的晨饲前的体重,分别进行体况评分,评分方式采用5分制,参照Wildman等[17]的方法。受试奶牛产犊时,对奶牛产犊系数进行评分,评分制如下:1分为产犊容易;2分为轻微困难;3分为需要助产;4分为相当困难;5分为需剖宫产[18]。
1.5.3 乳成分采用FOSS多功能乳成分自动分析仪测定乳脂率、乳蛋白率、乳糖率、乳固形物含量、乳尿素氮含量和乳体细胞数等。采用以下公式计算4%乳脂校正乳产量:
4%乳脂校正乳产量=0.4×产奶量(kg/d)+0.15×乳脂率(%)×产奶量(kg/d)。
1.5.4 血浆生化指标和肝脏组织抗氧化指标血浆生化指标和肝脏组织抗氧化指标均采用南京建成生物工程研究所试剂盒进行测定。血浆生化指标:Glu、NEFA、BHBA、TG含量及谷草转氨酶(AST)和谷丙转氨酶(ALT)活性的检测所用试剂盒编号分别为F006、A042-1、H169、F001、C010-1和C009;肝脏组织抗氧化指标:总抗氧化能力(T-AOC), 超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活性,丙二醛(MDA)和过氧化氢(H2O2)含量的检测所用试剂盒编号分别为A015、A001-1、A005、A003-1和A064。样品检测均采用比色法,测定波长遵照各试剂盒检测要求,用酶标仪(iMark,美国BIO-RAD公司)进行测定。
1.5.5 血浆、肝脏组织和乳中硒含量血浆、肝脏组织和乳中硒含量的检测参照吴显实[19]的方法。
1.5.6 肝脏组织中TG含量肝脏组织中的TG含量采用比色酶联免疫检测方法测定,具体步骤参照Schwartz等[20]的方法。
1.5.7 肝脏组织中关键抗氧化蛋白和脂质转运蛋白的mRNA相对表达量取肝脏组织样品采用RNAiso Plus提取总RNA;总RNA用PrimeScriptTM RT Master Mix进行逆转录;以逆转录产物cDNA为模板,用试剂Premix TaqTM(TaKaRa)进行引物验证;最后以逆转录产物cDNA为模板,利用试剂UltraSYBR Mixture(北京康为世纪生物科技有限公司)实时定量PCR检测肝脏组织中细胞型谷胱甘肽过氧化物酶(GPx1)、磷脂氢谷胱甘肽过氧化物酶(GPx4)、微粒体甘油三酯转运蛋白(MTTP)和载脂蛋白B100(ApoB100)的mRNA相对表达量,以β-肌动蛋白(β-actin)为内参基因,采用2-△△ CT法分析目的基因mRNA的相对表达量,具体操作参照叶耿坪等[16]的方法,所用引物序列见表 3。
|
|
表 3 实时定量PCR引物序列 Table 3 Primers for real-time qPCR |
数据采用SAS 9.2的Mixed模型进行复合对称协方差结构(compound symmetry covariance structure)分析,结果以Duncan氏法进行多重比较,结果以平均值±标准误表示,P < 0.05表示差异显著,0.05≤P < 0.15表示具有作用趋势。
2 结果与分析 2.1 生产性能由表 4可知,各组奶牛产前、产后及全期DMI差异不显著(P>0.05),各组体重变化和体况评分变化及产犊系数评分差异均不显著(P>0.05)。
|
|
表 4 富硒和过瘤胃胆碱新型添加剂对围产期奶牛生产性能的影响 Table 4 Effects of a new type of additive with Se and rumen-protected choline on production performance of dairy cows in transition period |
由表 5可知,各组间产奶量、4%乳脂校正乳产量、乳脂率、乳蛋白率、乳糖率及乳中总固形物和尿素氮含量差异均不显著(P>0.05),MD和HD组产奶量分别比对照组高1.8和1.6 kg/d,有增加产奶量的趋势,但组间差异不显著(P>0.05)。
|
|
表 5 富硒和过瘤胃胆碱新型添加剂对围产期奶牛泌乳性能的影响 Table 5 Effects of a new type of additive with Se and rumen-protected choline on lactation performance of dairy cows in transition period |
由表 6可知,饲粮添加富硒和过瘤胃胆碱新型添加剂对围产期奶牛血浆中Glu、NEFA和BHBA浓度无显著性影响(P>0.05)。在产前,饲粮添加富硒和过瘤胃胆碱新型添加剂对奶牛血浆中TG含量及AST和ALT活性也无显著性影响(P> 0.05),但在产后,与对照组和LD组相比,MD组和HD组血浆TG含量及AST和ALT活性显著降低(P < 0.05),从全期来看,与对照组和LD组相比,MD组和HD组血浆TG含量及AST活性显著降低(P < 0.05)。
|
|
表 6 富硒和过瘤胃胆碱新型添加剂对围产期奶牛血浆生化指标的影响 Table 6 Effects of a new type of additive with Se and rumen-protected choline on plasma biochemical indexes of dairy cows in transition period |
由表 7可知,与对照组相比,MD组和HD组血浆、肝脏组织和乳中的硒含量显著提高(P < 0.05),MD组与HD组之间无显著差异(P>0.05),LD组与其他各组差异不显著(P>0.05)。
|
|
表 7 富硒和过瘤胃胆碱新型添加剂对围产期奶牛血浆、肝脏组织和乳中硒含量的影响 Table 7 Effects of a new type of additive with Se and rumen-protected choline on Se content in plasma, liver tissue and milk of dairy cows in transition period |
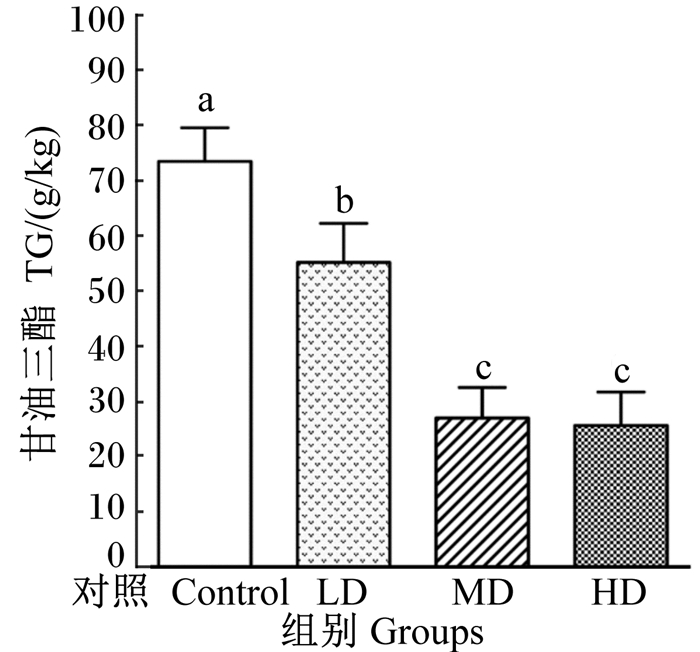
由图 1可知,与对照组相比,LD组、MD组和HD组奶牛肝脏组织中的TG含量均显著下降(P < 0.05)。与LD组相比,MD组和HD组奶牛肝脏组织中TG含量也显著下降(P < 0.05),MD组与HD组差异不显著(P>0.05)。
|
数据柱形标注不同小写字母表示差异显著(P < 0.05)。下图同。 Data columns with different small letters mean significant difference (P < 0.05).The same as below. 图 1 富硒和过瘤胃胆碱新型添加剂对围产期奶牛肝脏组织中TG硒含量的影响 Figure 1 Effects of a new type of additive with Se and rumen-protected choline on TG content in liver tissue of dairy cows in transition period |
由表 8可知,与对照组相比,LD、MD和HD组肝脏组织T-AOC及SOD和GSH-Px活性显著升高(P < 0.05),而H2O2和MDA含量显著降低(P < 0.05)。与LD组奶牛相比,MD和HD组肝脏组织T-AOC、SOD和GSH-Px活性也显著升高(P < 0.05),H2O2和MDA含量也显著降低(P < 0.05),MD组与HD组各肝脏组织抗氧化指标无显著差异(P>0.05)。
|
|
表 8 富硒和过瘤胃胆碱新型添加剂对围产期奶牛肝脏组织抗氧化指标的影响 Table 8 Effects of a new type of additive with Se and rumen-protected choline on liver tissue antioxidant capacity of dairy cows in transition period |
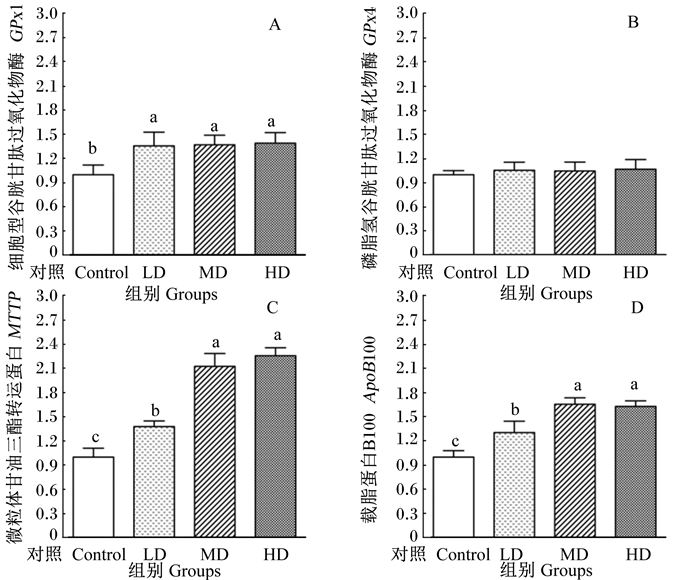
由图 2可知,与对照组相比,试验组奶牛肝脏组织中GPx1的mRNA相对表达量显著升高(P < 0.05),各试验组之间差异均不显著(P>0.05)。各组肝脏组织中GPx4的mRNA表达量无显著差异(P>0.05)。与对照组相比,试验组肝脏组织中MTTP和ApoB100的mRNA相对表达量显著提高(P < 0.05),且MD组和HD组显著高于LD组(P < 0.05),但MD组与HD组奶牛之间无显著差异(P>0.05)。
|
图 2 富硒和过瘤胃胆碱新型添加剂对围产期奶牛肝脏组织GPx1(A)、GPx4(B)、MTTP(C)和ApoB100 mRNA相对表达量(D)的影响 Figure 2 Effects of a new type of additive with Se and rumen-protected choline on mRNA relative expression levels of GPx1(A), GPx4(B), MTTP(C) and ApoB100 (D) in liver tissue of dairy cows in transition period |
处于围产期的奶牛,由于体内胎牛的快速发育及奶牛本身内分泌的急剧变化而使DMI下降,加之产后泌乳的需要,出现围产期奶牛能量负平衡,严重影响奶牛的机体健康,给奶牛养殖造成很大的经济损失。如何维持奶牛能量负平衡下机体的健康,是保证奶牛生产性能发挥的关键。
本试验中,各组间奶牛的DMI、体重变化、体况评分变化、产犊系数评分及乳成分无显著差异。与对照组相比,添加80 g/(头·d)的富硒和过瘤胃胆碱新型添加剂对产奶量的影响虽然不显著,但能增加1.6 kg/d的产奶量,说明在DMI相同的条件下,有增加产奶量的趋势。这可能是因为富硒和过瘤胃胆碱新型添加剂中的过瘤胃胆碱有效清除了肝脏组织中的TG,硒有效清除了肝脏组织内的自由基,从而维护了肝脏功能,健康状况得到改善,增加了产奶量。本试验中,血浆TG含量及AST和ALT活性显著下降,说明肝脏功能得到有效维护;肝脏组织中TG含量显著下降,抗氧化能力显著提高,都印证了富硒和过瘤胃胆碱新型添加剂充分发挥了胆碱和硒的作用。Sharma等[22]给产犊后的奶牛灌注50 g/d的胆碱,能显著提高奶牛的产奶量。徐国忠等[23]在对泌乳初期的奶牛试验时发现,过瘤胃胆碱能够使产奶量提升,但是对乳成分的影响不大。以上结果与本试验一致。
GPx1和GPx4是硒蛋白,受硒调控,是机体清除氧化产物的重要硒蛋白酶。本试验中,添加富硒和过瘤胃胆碱新型添加剂显著提高了奶牛肝脏组织中GPx1的mRNA相对表达量,但对GPx4的mRNA相对表达量无显著影响,说明机体GPx1的mRNA相对表达量达到平台值时对饲粮硒的需求大于GPx4,而本试验在基础饲粮中添加的富硒和过瘤胃胆碱新型添加剂,使饲粮硒含量满足了肝脏组织GPx1的mRNA相对表达量达到平台值时的硒需求量。Christensen等[24]在研究大鼠硒蛋白mRNA表达时,发现缺硒导致肝脏组织GPx1的mRNA相对表达量下降89%。Sunde等[25]的试验证实饲粮硒含量改变对大鼠肝脏组织GPx4 mRNA相对表达量没有显著影响。而周媛丽等[26]在酮病奶牛饲粮中补硒的研究发现,饲粮硒含量达到0.3 mg/kg时,再补硒奶牛的GPx1的mRNA相对表达量会显著增加,而GPx4的mRNA相对表达量无显著变化,与本试验结果相一致。
MTTP是在肝脏细胞内质网上起作用,是将TG包装到VLDL中并将其从肝脏中分泌出肝脏。而ApoB100是VLDL的组件部分,参与VLDL的分泌。据孙菲菲[7]报道,胆碱可能通过改变ApoB100的mRNA相对表达量而控制处于围产期的奶牛体内肝脏脂肪的转运。本试验中,试验组奶牛的ApoB100和MTTP的mRNA相对表达量与对照组相比均显著提高,这可能是因为富硒和过瘤胃胆碱新型添加剂中的过瘤胃胆碱被奶牛机体吸收,促进了磷脂酰胆碱的合成,进而促进VLDL的合成和分泌,引起ApoB100和MTTP的mRNA相对表达量增加,本试验中各试验组奶牛的肝脏组织中TG含量均显著低于对照组可充分说明这点。
4 结论① 富硒和过瘤胃胆碱新型添加剂能显著降低肝脏组织中TG含量,有效维护肝功能,减少肝脏损伤。
② 在一定程度上可提高围产期奶牛的产奶量,显著提高奶牛肝脏组织抗氧化能力。
③ 饲粮中富硒和过瘤胃胆碱新型添加剂的最适添加量是80 g/(头·d)。
| [1] |
GRUMMER R R. Impact of changes in organic nutrient metabolism on feeding the transition dairy cow[J]. Journal of Animal Science, 1995, 73(9): 2820-2833. DOI:10.2527/1995.7392820x |
| [2] |
BELL A W. Regulation of organic nutrient metabolism during transition from late pregnancy to early lactation[J]. Journal of Animal Science, 1995, 73(9): 2804-2819. DOI:10.2527/1995.7392804x |
| [3] |
BERTICS S J, GRUMMER R R, CADORNIGA-VALINO C, et al. Effect of prepartum dry matter intake on liver triglyceride concentration and early lactation[J]. Journal of Dairy Science, 1992, 75(7): 1914-1922. DOI:10.3168/jds.S0022-0302(92)77951-X |
| [4] |
ZEISEL S H. Choline:an important nutrient in brain development, liver function and carcinogenesis[J]. Journal of the American College of Nutrition, 1992, 11(5): 473-481. DOI:10.1080/07315724.1992.10718251 |
| [5] |
张继慧, 禚梅, 李戍江. 过瘤胃氯化胆碱在奶牛上的应用研究进展[J]. 中国畜牧兽医, 2008, 35(5): 76-79. |
| [6] |
LIMA F S, SÁ FILHO M F, GRECO L F, et al. Effects of feeding rumen-protected choline on incidence of diseases and reproduction of dairy cows[J]. Veterinary Journal, 2012, 193(1): 140-145. DOI:10.1016/j.tvjl.2011.09.019 |
| [7] |
孙菲菲. 胆碱和蛋氨酸对奶牛围产期营养平衡和机体健康的影响及机制[D]. 博士学位论文. 杨凌: 西北农林科技大学, 2017.
|
| [8] |
郑家三, 夏成, 张洪友, 等. 过瘤胃胆碱对围产期奶牛生产性能和能量代谢的影响[J]. 中国农业大学学报, 2012, 17(3): 114-120. |
| [9] |
COOKE R F, DEL RÍO N S, CARAVIELLO D Z, et al. Supplemental choline for prevention and alleviationof fatty liver in dairy cattle[J]. Journal of Dairy Science, 2007, 90(5): 2413-2418. DOI:10.3168/jds.2006-028 |
| [10] |
ELEK P, GAÁL T, HUSVÉTH F. Influence of rumen-protected choline on liver composition and blood variables indicating energy balance in periparturient dairy cows[J]. Acta Veterinaria Hungarica, 2013, 61(1): 59-70. DOI:10.1556/AVet.2012.053 |
| [11] |
PREGEL P, BOLLO E, CANNIZZO F, et al. Antioxidant capacity as a reliable marker of stress in dairy calves transported by road[J]. Veterinary Record, 2005, 156(2): 53-54. DOI:10.1136/vr.156.2.53 |
| [12] |
STEEN A, GRØNSTØL H, TOIJESEN P A. Glucose and insulin responses to glucagon injection in dairy cows with ketosis and fatty liver[J]. Journal of Veterinary MedicineA, 1997, 44(9/10): 521-530. |
| [13] |
DANESI F, MALAGUTI M, NUNZIOM D, et al. Counteraction of adriamycin-induced oxidative damage in rat heart by selenium dietary supplementation[J]. Journal of Agricultural and Food Chemistry, 2006, 54(4): 1203-1208. DOI:10.1021/jf0518002 |
| [14] |
BRZEZINSKA-SLEBODZINSKA E, MILLER J K, QUIGLEY J D, et al. Antioxidant status of dairy cows supplemented prepartum with vitamin E and selenium[J]. Journal of Dairy Science, 1994, 77(10): 3087-3895. DOI:10.3168/jds.S0022-0302(94)77251-9 |
| [15] |
N RC. Nutrient requirements of dairy cattle[M]. 7th ed. Washington, D.C.: National Academy Press, 2001.
|
| [16] |
叶耿坪. 富甘油酵母菌制剂对围产期奶牛能量平衡的影响及机理研究[D]. 博士学位论文. 南京: 南京农业大学, 2014: 83-100.
|
| [17] |
WILDMAN E E, JONES G M, WAGNER P E, et al. A dairy cow body condition scoring system and its relationship to selected production characteristics[J]. Journal of Dairy Science, 1982, 65(3): 495-501. DOI:10.3168/jds.S0022-0302(82)82223-6 |
| [18] |
DE FRAIN J M, HIPPEN A R, KALSCHEUR K F, et al. Feeding glycerol to transition dairy cows:effects on blood metabolites and lactation performance[J]. Journal of Dairy Science, 2004, 87(12): 4195-4206. DOI:10.3168/jds.S0022-0302(04)73564-X |
| [19] |
吴显实. 富硒益生菌在奶牛生产上的应用效果及其作用机理研究[D]. 博士学位论文. 南京: 南京农业大学, 2009: 61-70.
|
| [20] |
SCHWARTZ D M, WOLINS N E. A simple and rapid method to assay triacylglycerol in cells and tissues[J]. Journal of Lipid Research, 2007, 48(11): 2514-2520. DOI:10.1194/jlr.D700017-JLR200 |
| [21] |
孙玉成, 王雪莹, 李红梅, 等. 干乳期能量摄入水平对围产期奶牛肝载脂蛋白B100 mRNA丰度的影响[J]. 中国兽医学报, 2006, 26(3): 320-322, 325. |
| [22] |
SHARMA B K, ERDMAN R A. Effects of dietary and abomasally infused choline on milk production responses of lactating dairy cows[J]. The Journal of Nutrition, 1989, 119(2): 248-254. DOI:10.1093/jn/119.2.248 |
| [23] |
徐国忠, 金华明, 梅银财, 等. 日粮中添加保护氯化胆碱对奶牛泌乳性能的初步研究[J]. 乳业科学与技术, 2003, 26(1): 32-33, 16. |
| [24] |
CHRISTENSEN M J, CAMMACK P M, WRAY C D. Tissue specificity of selenoprotein gene expression in rats[J]. The Journal of Nutritional Biochemistry, 1995, 6(7): 367-372. DOI:10.1016/0955-2863(95)80004-V |
| [25] |
SUNDE R A, DYER J A, MORAN T V, et al. Phospholipid hydroperoxide glutathione peroxidase:full-length pig blastocyst cDNA sequence and regulation by selenium status[J]. Biochemical and Biophysical Research Communications, 1993, 193(3): 905-911. DOI:10.1006/bbrc.1993.1711 |
| [26] |
周媛丽, 叶耿坪, 刘光磊. 饲粮硒含量对酮病奶牛氧化应激的缓解作用[J]. 动物营养学报, 2016, 28(12): 4029-4035. |




