2. 浙江农林大学动物科技学院, 临安 311300
2. College of Animal Science and Technology, Zhejiang Agriculture and Forestry University, Lin'an 311300, China
随着养殖业的快速发展,集约化、高密度养殖成为养殖主要的模式,这种养殖模式导致病毒、细菌引起的养殖病害问题不断增加,严重影响生产效益,病害的预防和治疗成为蛙类养殖的关键问题[1]。长期以来,抗生素一直被认为是无可比拟的解决方案,抗生素作为促生长剂取得了重大的经济贡献[2]。然而,由于过度使用抗生素引起的动物产品的耐药性和药物残留,威胁人类的健康,引起人们的高度关注,因此,寻找可代替传统抗生素的抗菌肽(antimicrobial peptides),成为分子生物学和生物化学研究领域的热点之一[1, 3-4]。抗菌肽也称为抗微生物肽,是广泛分布的小分子肽[5],具有免疫调节特性,是天然免疫系统的重要组成部分,可以抑制细菌、病毒、真菌和寄生虫等病原体的活动[6-7]。抗菌肽的许多新功能,如抗肿瘤[8]、促进增长[9]以及免疫改善[10-11]等已被报道。关于抗菌肽作为饲料添加剂的应用研究主要集中在畜类[12]、禽类[1, 13]、鱼类[14-16]和虾类[17-18]养殖产业,抗菌肽对蛙类生长的影响还未见报道。
超氧化物歧化酶(superoxide dismutase,SOD)是酶促抗氧化系统的重要成员,是机体内一种清除超氧化物自由基的酶,它可以抵消活性氧的作用,直接清除超氧阴离子、羟基自由基、过氧自由基和一氧化氮[19]。生物机体内的氧化应激及其引起的脂质过氧化可加重自由基连锁反应,破坏细胞膜的完整性,激活炎症介质[20-21]。所以机体SOD活性可以反映体内抗氧化酶的能力,是健康状况和免疫能力的关键因素,可应用于辅助和检测诊断病害的生理指标。
镇海林蛙(Rana zhenhaiensis),隶属于两栖纲(Amphibian),无尾目(Anura),其蝌蚪主要生活在低洼、临时水体和沟渠中[22]。目前仅围绕镇海林蛙开展了生活史特征[23-24]、皮肤抗菌肽的提取[25]等方面的研究。因此,本试验在基础饲料中添加不同浓度的抗菌肽,旨在研究其对镇海林蛙蝌蚪生长发育的影响,以期为蛙类资源的保护、开发和利用提供基础数据。
1 材料与方法 1.1 试验材料2016年12月28日,从浙江丽水学院校园内水坑采集5窝新产的镇海林蛙卵团,带回实验室,分别放入不透明塑料箱(700 mm×500 mm×400 mm,水深200 mm)并置于恒温气侯室内[(20.00±0.22) ℃]孵化,待蝌蚪长至Gosner 26~27期[26],随机挑选500尾蝌蚪用于后续试验。抗菌肽为华北制药股份有限公司生产的天蚕素(国药准字H13021322)。
1.2 试验设计选取镇海林蛙蝌蚪(Gosner 26~27期)500只,随机分为5个组,每组5个重复,每个重复20尾。在基础饲料(牛蛙饲料,宁波天邦股份有限公司提供,主要原料包括鱼粉、豆粕、棉籽粕、菜籽粕、小麦粉、鱼油、磷酸二氢钙、维生素预混料、矿物质预混料等;产品成分分析保证值为粗蛋白质含量≥40.0%,粗脂肪含量≥3.0%,粗纤维含量≤4.0%,粗灰分含量≤18.0%,水分含量≤12.0%,总磷含量≥1.0%,赖氨酸含量≥2.2%)中添加抗菌肽粉剂,用粉碎机粉碎,多次(约20次)过筛(200目)混匀形成粉料(蝌蚪需要粉料),5组饲料中抗菌肽的浓度分别为0、1、2、4和8 mg/g。蝌蚪饲养在塑料箱(18 cm×13 cm×6 cm,水深6 cm)中,置于人工气候室内[(20±1) ℃],光周期为12 : 12。每2 d足量喂食1次,喂食前用曝气的自来水完全换水。每天观察蝌蚪的存活情况,若出现死亡,用捞网捞出后用个体大小相似的断尾蝌蚪进行补充以保持密度不变。试验至林蛙蝌蚪全部完全变态结束。
1.3 检测指标 1.3.1 镇海林蛙蝌蚪形态测定分别在第1天和第18天用电子分析天平称取其湿重,用NikonXTS30体视显微镜鉴定蝌蚪的发育历期,通过照片分析蝌蚪的体长(吻端到泄殖腔的距离)。当蝌蚪出现前肢时则认为达到变态(Gosner 42期),并记录变态时间(从试验开始到蝌蚪出现前肢所经历的时间)。将变态个体捞出,单独放入盛有水深为5 mm的塑料杯内,杯口用网眼为1 mm的纱布封住,放置于气候室内,直到其尾部完全消失即完全变态(Gosner 46期)。
1.3.2 镇海林蛙幼蛙形态与运动能力的测定将全部完全变态的幼蛙个体分别捞出,用吸水纸吸干体表水分后,用电子分析天平称取其湿重(±0.000 1 g),分别用数显游标卡尺(±0.01 mm)测定其体长(从吻端到尾杆骨之间的距离)。2 h之后,对幼蛙运动表现进行测定。测定前,先将幼蛙置于室内[(20±1) ℃]适应10~15 min,然后将其放入1%的红色食用色素溶液中浸湿其四肢,取出置于铺有白色纱布的地面上,用柳树枝条轻轻触碰其尾杆骨来刺激其跳跃,测量其跳跃距离(从上一个后肢印迹的末端到下一个后肢印迹的末端之间的距离为一个跳跃),每只幼蛙重复5次。通过涂料痕迹来确定跳跃距离,用直尺测量出最长3次的跳跃距离(±0.01 cm),取其平均值。
1.3.3 SOD活性的测定运动试验结束后5 h,从各试验组分别取7只幼蛙用于SOD活性的检测。幼蛙迅速处死后取大腿肌肉组织并置于-80 ℃冰箱保存。试验时,取出大腿肌肉样品融化解冻,用预冷任氏液冲洗3次,立即用滤纸吸干其表面水分,称取0.04 g(湿重),按照湿量(g) :体积(mL)=1 : 9的比例加入预冷任氏液,在冰浴中快速剪碎研磨制备10%的肌肉组织匀浆,低速离心10 min(3 000 r/min),取上清液。用考马斯亮蓝法测定蛋白质含量。大腿肌肉SOD活性检测参见试剂盒说明书,试剂盒购自南京建成生物工程研究所。
1.4 数据统计分析用Statistica 10统计软件包完成所有数据的统计分析。统计分析前,检验数据正态性(Kolmogorov-Smirnov test)和方差同质性(F-max test)。经检验,数据无需转换符合参数统计的条件。用方差分析和多重比较、回归和相关分析处理比较相应的数据。描述性统计值用平均值±标准误表示,以0、1、2、4、8代表不同抗菌肽浓度组,上标不同小写字母表示差异显著(P < 0.05),相同小写字母表示差异不显著(P>0.05)。
2 结果与分析试验开始前镇海林蛙蝌蚪的初始湿重为(20.93±0.89) mg,体长为(8.45±0.08) mm,发育历期为Gonser 26~27期。
2.1 抗菌肽对镇海林蛙蝌蚪生长发育的影响由图 1-A可见,抗菌肽对镇海林蛙蝌蚪的发育历期(F4,244=14.99,P <0.001;0ab、1a、2bc、4cd、8d)、体长(F4, 244=14.99,P < 0.002;0a、1ab、2b、4b、8ab)影响显著,抗菌肽浓度与镇海林蛙蝌蚪的发育历期呈显著的负相关(r=-0.40,F1,247=46.20,P < 0.001),即抗菌肽浓度越大,镇海林蛙蝌蚪的发育历期越小。由图 1-B可见,抗菌肽浓度与镇海林蛙蝌蚪的体长相关性不显著(r=0.06,F1,247=0.98,P=0.324)。
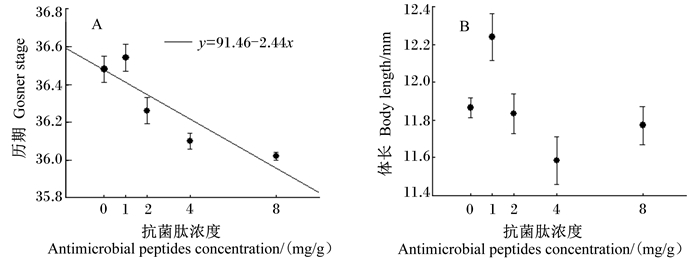
|
图 1 抗菌肽对镇海林蛙蝌蚪生长发育的影响:发育历期(A)和体长(B) Figure 1 Effects of antimicrobial peptides on growth and development of Rana zhenhaiens tadpoles: developmental stage (A) and body length (B) |
由图 2-A可见,各组镇海林蛙蝌蚪的变态率平均值为94.6%,组间差异不显著(F4,20=0.78,P=0.549),与抗菌肽浓度的相关性不显著(r= 0.16,F1,23=0.63,P=0.434)。由图 2-B可见,抗菌肽对镇海林蛙蝌蚪的变态时间影响显著(F4,485=66.24,P < 0.001;0d、1b、2c、4a、8a),抗菌肽浓度与镇海林蛙蝌蚪的变态时间呈显著的正相关(r=0.49,F1,488=152.41,P < 0.001),即抗菌肽的浓度越大,镇海林蛙蝌蚪的变态时间越长。
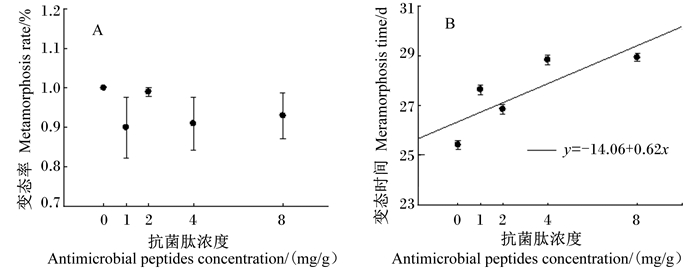
|
图 2 抗菌肽对镇海林蛙蝌蚪的变态率(A)和变态时间(B)的影响 Figure 2 Effects of antimicrobial peptides on metamorphosis rate (A) and metamorphosis time (B) of Rana zhenhaiens tadpoles |
由图 3-A、图 3-B可见,抗菌肽对镇海林蛙刚变态幼蛙的体长(F4,446=14.78,P < 0.001;0c、1bc、2bc、4b、8a)和体重(F1,445=11.20,P < 0.001;0b、1a、2a、4a、8a)影响均显著,抗菌肽浓度与镇海林蛙刚变态幼蛙体长(r=0.33,F1,489=55.72,P < 0.001)和体重(r=0.24,F1,488=28.04,P < 0.001)均呈显著的正相关,即抗菌肽浓度越大,镇海林蛙刚变态幼蛙的体长和体重越大。
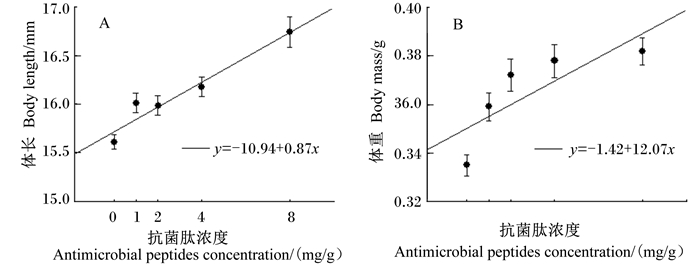
|
图 3 抗菌肽对镇海林蛙刚变态幼蛙体长(A)和体重(B)的影响 Figure 3 Effects of antimicrobial peptides on body length (A) and body mass (B) of Rana zhenhaiens abnormal froglets |
由图 4可见,抗菌肽对镇海林蛙刚变态幼蛙的跳跃距离影响不显著(F4,453=0.91,P=0.458),抗菌肽浓度与镇海林蛙刚变态幼蛙的跳跃距离相关性不显著(r=0.03,F1,456=0.31,P=0.578),即未检测到抗菌肽对镇海林蛙刚变态幼蛙的运动能力的影响。
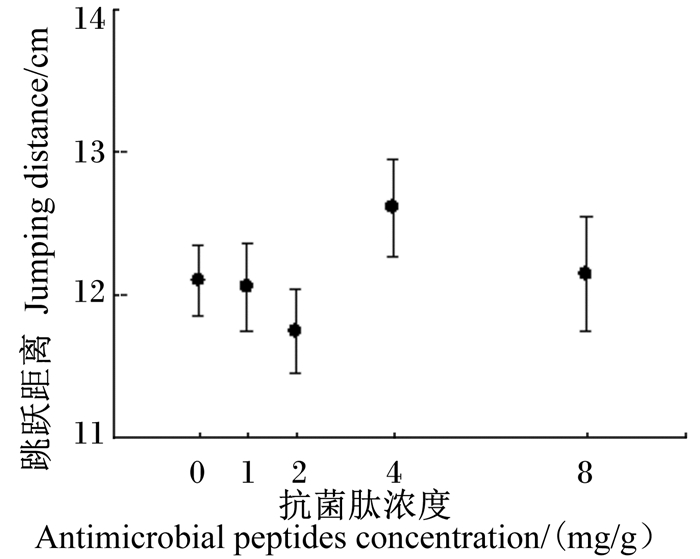
|
图 4 抗菌肽对镇海林蛙刚变态幼蛙跳跃距离的影响 Figure 4 Effects of antimicrobial peptides on jumping distance of Rana zhenhaiens abnormal froglets |
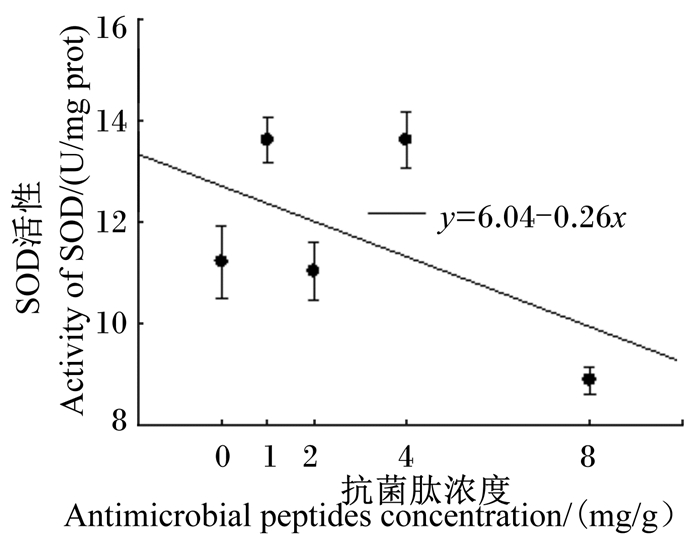
由图 5可见,抗菌肽对镇海林蛙刚变态幼蛙大腿肌肉SOD活性影响显著(F4,155=15.39,P <0.001;0bc、1ab、2cd、4a、8d),抗菌肽浓度与镇海林蛙刚变态幼蛙大腿肌肉的SOD活性呈显著的负相关(r=-0.30,F1,138=13.71,P < 0.001),即抗菌肽浓度越大,镇海林蛙刚变态幼蛙大腿肌肉SOD活性越低。
|
图 5 抗菌肽对镇海林蛙刚变态幼蛙大腿肌肉SOD活性的影响 Figure 5 Effects of antimicrobial peptides on thigh muscle SOD activity of Rana zhenhaiens abnormal froglets |
对生活史复杂的无尾两栖类来说,个体生长发育速度和变态时个体大小是其进入陆生阶段适合度的关键[23],当蝌蚪遇到有利环境条件时会推迟变态发育,抓住机会进行生长,而当蝌蚪暴露在恶劣环境条件下时会进行快速发育尽早离开水体环境[27]。本研究结果表明,在本试验条件下,抗菌肽浓度与镇海林蛙蝌蚪的发育历期呈显著的负相关,与镇海林蛙蝌蚪的变态时间呈显著的正相关,即抗菌肽浓度越大,蝌蚪的发育越慢,变态时间越长,抗菌肽降低了蝌蚪生长发育的速度。此外,抗菌肽浓度与镇海林蛙刚变态幼蛙体长和体重均呈显著的正相关,即抗菌肽浓度越大,变态幼蛙的体长和体重越大,对于环境的适合度更高。较大体型的无尾两栖类通常在代谢速率和耐受力、跳跃能力(较大个体跳的更远或具有更高的运动耐力和爆发力)、觅食(更高的猎物攻击频率和捕获成功率,对猎物体型大小要求更为宽泛)和躲避天敌等方面具有性能优势[28-29]。这种对养殖有利性的表现与其他动物试验的表现存在一定的差异。在肉鸡饲粮中添加浓度为3.4~3.7 mL/kg的复合抗菌肽促进了肉鸡生长[13],饲料中添加低浓度的抗菌肽提高了锦鲤的生长性能[14],饲料中添加100 mg/kg抗菌肽促进了石斑鱼的生长[16],饲料中添加100 mg/kg NT-6抗菌脂肽使凡纳滨对虾的生长性能显著提高[30]。由此说明,抗菌肽的种类和动物种类会影响抗菌肽使用的适宜浓度,对镇海林蛙来说,高浓度的抗菌肽降低了发育速度,使变态个体增大,增加了个体的适合度。
镇海林蛙刚变态幼蛙大腿肌肉SOD活性与抗菌肽浓度呈显著的负相关,说明本试验抗菌肽浓度范围内低浓度的抗菌肽促进了SOD活性,而高浓度的抗菌肽则会抑制SOD活性[14],与另外一些研究结果不同。例如,饲粮中添加适宜浓度范围的复合抗菌肽,仔猪SOD活性随着抗菌肽浓度增加而增大[31-32]。SOD活性数据一定程度上说明,在本试验的浓度范围内,饲料中添加抗菌肽使蝌蚪生长发育具有更好的条件和环境。
4 结论抗菌肽的添加降低了镇海林蛙的发育速度,增加了变态时间,同时增加了变态个体的大小,从而提高了幼蛙的适合度。
| [1] |
HU F, GAO X, SHE R, et al. Effects of antimicrobial peptides on growth performance and small intestinal function in broilers under chronic heat stress[J]. Poultry Science, 2017, 96(4): 798-806. |
| [2] |
CHENG G Y, HAO H H, XIE S Y, et al. Antibiotic alternatives:the substitution of antibiotics in animal husbandry?[J]. Frontiers in Microbiology, 2014, 5: 217. |
| [3] |
BOZKURT M, GIANNENAS I, KVÇVKYILMAZ K, et al. An update on approaches to controlling coccidia in poultry using botanical extracts[J]. British Poultry Science, 2013, 54(6): 713-727. DOI:10.1080/00071668.2013.849795 |
| [4] |
CHERNYSH S, GORDYA N, SUBOROVA T. Insect antimicrobial peptide complexes prevent resistance development in bacteria[J]. PLoS One, 2015, 10(7): e0130788. DOI:10.1371/journal.pone.0130788 |
| [5] |
ZASLOFF M. Antimicrobial peptides of multicellular organisms[J]. Nature, 2002, 415(6870): 389-395. DOI:10.1038/415389a |
| [6] |
KANG H K, KIM C, CHANG H S, et al. The therapeutic applications of antimicrobial peptides (AMPs):a patent review[J]. Journal of Microbiology, 2017, 55(1): 1-12. DOI:10.1007/s12275-017-6452-1 |
| [7] |
ELHAG O, ZHOU D, SONG Q, et al. Screening, expression, purification and functional characterization of novel antimicrobial peptide genes from Hermetia illucens (L.)[J]. PLoS One, 2017, 12(1): e0169582. DOI:10.1371/journal.pone.0169582 |
| [8] |
HOSKIN D W, RAMAMOORTHY A. Studies on anticancer activities of antimicrobial peptides[J]. Biochimica et Biophysica Acta:Biomembranes, 2008, 1778(2): 357-375. DOI:10.1016/j.bbamem.2007.11.008 |
| [9] |
BAO H, SHE R, LIU T, et al. Effects of pig antibacterial peptides on growth performance and intestine mucosal immune of broiler chickens[J]. Poultry Science, 2009, 88(2): 291-297. DOI:10.3382/ps.2008-00330 |
| [10] |
YANG Y R, JIANG Y B, SHE R P, et al. Effects of chicken intestinal antimicrobial peptides on humoral immunity of chickens and antibody titres after vaccination with infectious bursal disease virus vaccine in chicken[J]. Archives of Animal Nutrition, 2006, 60(5): 427-435. DOI:10.1080/17450390600884484 |
| [11] |
LIU T, SHE R, WANG K, et al. Effects of rabbit sacculus rotundus antimicrobial peptides on the intestinal mucosal immunity in chickens[J]. Poultry Science, 2008, 87(2): 250-254. DOI:10.3382/ps.2007-00353 |
| [12] |
WU S D, ZHANG F R, HUANG Z M, et al. Effects of the antimicrobial peptide cecropin AD on performance and intestinal health in weaned piglets challenged with Escherichia coli[J]. Peptides, 2012, 35(2): 225-230. DOI:10.1016/j.peptides.2012.03.030 |
| [13] |
WEN L F, HE J G. Dose-response effects of an antimicrobial peptide, a cecropin hybrid, on growth performance, nutrient utilisation, bacterial counts in the digesta and intestinal morphology in broilers[J]. British Journal of Nutrition, 2012, 108(10): 1756-1763. DOI:10.1017/S0007114511007240 |
| [14] |
DONG X Q, ZHANG D M, CHEN Y K, et al. Effects of antimicrobial peptides (AMPs) on blood biochemical parameters, antioxidase activity, and immune function in the common carp (Cyprinus carpio)[J]. Fish & Shellfish Immunology, 2015, 47(1): 429-434. |
| [15] |
姜珊, 王宝杰, 刘梅, 等. 饲料中添加重组抗菌肽对吉富罗非鱼生长性能及免疫力的影响[J]. 中国水产科学, 2011, 18(6): 1308-1314. |
| [16] |
ZHAI S W, SUN X W, CHEN X H. Effects of antimicrobial peptides surfactin administration on growth performance, intestinal digestive enzymes activities and some serum biochemical parameters of orange-spotted grouper (Epinephelus coioides) juveniles[J]. The Israeli Journal of Aquaculture-Bamidgeh, 2017, 69: 1380-1387. |
| [17] |
DESTOUMIEUX D, BULET P, STRUB J M, et al. Recombinant expression and range of activity of penaeidins, antimicrobial peptides from penaeid shrimp[J]. European Journal of Biochemistry, 1999, 266(2): 335-346. DOI:10.1046/j.1432-1327.1999.00855.x |
| [18] |
LIU M, WANG B J, JIANG K Y, et al. Rice bran expressing a shrimp antimicrobial peptide confers delayed spoilage of fish feed and resistance of Tilapia to Aeromonas hydrophila[J]. Journal of the World Aquaculture Society, 2014, 45(3): 269-278. DOI:10.1111/jwas.2014.45.issue-3 |
| [19] |
GOC Z, SZAROMA W, KAPUSTA E, et al. Protective effects of melatonin on the activity of SOD, CAT, GSH-Px and GSH content in organs of mice after administration of SNP[J]. Chinese Journal of Physiology, 2017, 60(1): 1-10. DOI:10.4077/CJP.2017.BAF435 |
| [20] |
MAITRA I, MARCOCCI L, DROY-LEFAIX M T, et al. Peroxyl radical scavenging activity of Ginkgo biloba extract EGb 761[J]. Biochemical Pharmacology, 1995, 49(11): 1649-1655. DOI:10.1016/0006-2952(95)00089-I |
| [21] |
SAKARCAN A, SEHIRLI O, VELIOGLU-OVVNÇ A, et al. Ginkgo biloba extract improves oxidative organ damage in a rat model of thermal trauma[J]. The Journal of Burn Care & Rehabilitation, 2005, 26(6): 515-524. |
| [22] |
费梁, 叶昌媛, 江建平. 中国两栖动物及其分布彩色图鉴[M]. 四川: 科学技术出版社, 2012: 316-317.
|
| [23] |
WEI L, DING G H, GUO S N, et al. Toxic effects of three heavy metallic ions on Rana zhenhaiensis tadpoles[J]. Asian Herpetological Research, 2015, 6(2): 132-142. |
| [24] |
丁国骅, 林植华, 樊晓丽, 等. 不同程度的尾损伤对镇海林蛙(Rana zhenhaiensis)蝌蚪游泳速度的影响[J]. 生态学报, 2016, 36(7): 1840-1845. |
| [25] |
XU B H, CHE H L, KANG L M, et al. Molecular cloning and functional characterization of novel antimicrobial peptides from the skin of brown frog, Rana zhenhaiensis[J]. Zoological Science, 2012, 29(9): 553-558. DOI:10.2108/zsj.29.553 |
| [26] |
GOSNER K L. A simplified table for staging anuran embryos and larvae with notes on identification[J]. Herpetologica, 1960, 16(3): 183-190. |
| [27] |
WILBUR H M, COLLINS J P. Ecological aspects of amphibian metamorphosis[J]. Science, 1973, 182(4119): 1305-1314. DOI:10.1126/science.182.4119.1305 |
| [28] |
RICHTER-BOIX A, LLORENTE G A, MONTORI A. A comparative analysis of the adaptive developmental plasticity hypothesis in six Mediterranean anuran species along a pond permanency gradient[J]. Evolutionary Ecology Research, 2006, 8(6): 1139-1154. |
| [29] |
KÖHLER A, SADOWSKA J, OLSZEWSKA J, et al. Staying warm or moist? Operative temperature and thermal preferences of common frogs (Rana temporaria), and effects on locomotion[J]. Herpetological Journal, 2011, 21(1): 17-26. |
| [30] |
SHI Q C, LU J J, LU P, et al. Effects of antimicrobial lipopeptides supplementation on growth performance and intestinal digestive enzyme activities of genetic improvement of farmed Tilapia(GIFT, Oreochromis niloticus)[J]. Feed Industry, 2014, 35(12): 6-10. |
| [31] |
WANG J H, WU C C, FENG J. Effect of dietary antibacterial peptide and zinc-methionine on performance and serum biochemical parameters in piglets[J]. Czech Journal of Animal Science-UZEI, 2011, 56(1): 30-36. |
| [32] |
但启雄, 袁威, 李刚, 等. 复合抗菌肽对断奶仔猪血清抗氧化功能的影响[J]. 中国兽医学报, 2015, 35(5): 804-808. |




