2. 内蒙古农牧业科学院动物营养与饲料研究所, 呼和浩特 010031
2. Research Institute of Animal Nutrition, Inner Mongolia Academy of Animal Sciences, Hohhot 010031, China
近年来,随着奶制品和肉产品的消费量逐渐增大,我国奶牛以及肉牛、肉羊养殖业正逐步向规模化、集约化养殖模式发展。为了达到高效生产,养殖者通过不断增加精料的使用来满足动物能量需求,进而提高生产性能。殊不知,在提高生产性能的同时也大大增加了营养代谢疾病发生的风险,使得各类代谢疾病发生率高居不下,尤其是亚急性瘤胃酸中毒(subacute ruminal acidosis,SARA)、酮病、蹄叶炎、脂肪肝等[1-2]。其中SARA的发生最为突出,尤为盛行,是当前反刍动物养殖业危害最大、最常见,经济损失最严重的疾病之一[3]。但其预防、界定和诊断仍然比较困难,主要受限于不明显的临床症状与复杂的病因,由此给畜牧业生产带来重大的损失[4]。因此,为保障反刍动物机体健康和提高生产性能,研究反刍动物SARA的发病机理、病理变化及如何正确预防和控制SARA尤为重要。
1 SARA概述SARA是牛羊快速育肥和高产奶牛生产中普遍存在的一种亚健康疾病,具有群发性、高发性[5],其典型特征是瘤胃低pH、高挥发性脂肪酸(VFA)。高产奶牛与围产期奶牛是高发群体[6]。
随着现代奶牛、肉牛和肉羊等养殖业向高效化发展,人们为了提高生产效率而增大高精料饲粮的投喂。与北美洲和欧洲相比,我国缺乏优质粗料,除了大型养殖场购买进口苜蓿、羊草外,我国大部分地区依然以秸秆作为主要粗料,生产中不得不大量饲喂淀粉含量高的精料来满足反刍动物营养需要,从而增加了以SARA为代表的营养代谢疾病的发病率。欧洲有多达26%的泌乳中期奶牛和19%的泌乳早期奶牛患有SARA[7],北美地区的奶业每年由SARA造成的经济损失达5亿~10亿美元[8]。而在我国,SARA造成的损失更为严重,这些损失主要是由于产奶量下降、奶产品减少、奶牛淘汰和死亡率增加所致[2, 4]。
经过大量研究,SARA在诊断、治疗及发病机制方面已取得长足进展,其中毒机制可总结为以下几种:内毒素(又称脂多糖)和组胺(histamine,HIS)中毒机制[3]、乳酸中毒机制、有机酸中毒机制。但是由于技术手段不够先进与完善,国内外关于饲粮因素引发SARA的研究大多数集中于瘤胃单一代谢产物(如乳酸、VFA、内毒素等)的研究,而对于不同饲粮条件下诱发瘤胃发生亚急性酸中毒与机体综合代谢特征及不同代谢产物之间的内在联系也缺乏了解。因此,反刍动物SARA的发生和调控机制是一个重要的科学问题。
2 SARA对反刍动物瘤胃上皮的影响 2.1 SARA对瘤胃上皮结构的影响瘤胃上皮为多层鳞片状(stratified squamous epithelium,SSE)结构,从黏膜层到浆膜层依次为角质层(stratum corneum,SC)、颗粒层(stratum granulosum,SG)、棘突层(stratum spinosum,SS)和基底层(stratum basale,SB)[9]。成年反刍动物瘤胃上皮角质层细胞随着与食物的摩擦和细菌的附着会不断脱落,并进行定期更新[10]。而颗粒层细胞间存在紧密连接(tight junction,TJ),是维持黏膜屏障的重要结构[9]。基底层与肌层相连,富含全功能的线粒体,是瘤胃主要代谢部位。
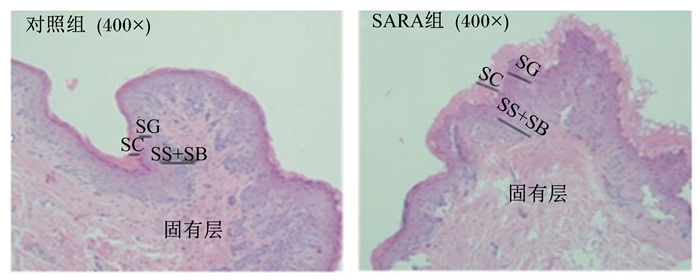
有研究者通过逐渐递增饲粮非纤维性碳水化合物(NFC)/中性洗涤纤维(NDF)的方式诱导奶山羊发生SARA,发现瘤胃上皮角质层出现明显的脱落和损伤,且瘤胃乳头长度、宽度及角质层厚度较对照组显著降低[11]。杨淑青[12]和刘军花[13]的研究结果与上述一致,即SARA发生后奶山羊瘤胃上皮棘突层和上皮总厚度降低,颗粒层厚度显著降低,瘤胃乳头长度减小。在此基础上,程萌[14]用40倍光镜观察瘤胃上皮乳头,结果显示SARA致上皮形态结构的完整性破坏,角质化严重(图 1)。其他研究同样证实高精料饲粮下对瘤胃上皮结构的破坏非常严重。例如,Steele等[15]研究表明,与高粗料饲粮相比,高精料饲粮饲喂使瘤胃上皮角质层严重脱落,深长的裂缝逐渐消失,基底层、棘突颗粒层和上皮总厚度降低。翁秀秀[16]通过饲喂单一秸秆及高水平精料,发现瘤胃乳头角质层有少量蜕变,角质层下的细胞层加速迁移,颗粒层的细胞连接退化。
|
SC:角质层stratum corneum;SG:颗粒层stratum granulosum;SS:棘突层stratum spinosum;SB:基底层stratum basale。 图 1 SARA对奶山羊瘤胃乳头形态学的影响 Figure 1 Effects of subacute ruminal acidosis on the morphology of rumen papilla in dairy goats[14] |
反刍动物瘤胃上皮细胞间的连接,从顶端到基膜依次为紧密连接、桥粒连接(desmosome junction,DJ)、黏着连接(adhesion junction,AJ,又称锚定连接)和间隙连接(gap junction,GJ,又称缝隙连接)。它们共同作用、相互协调,保证瘤胃上皮屏障功能。
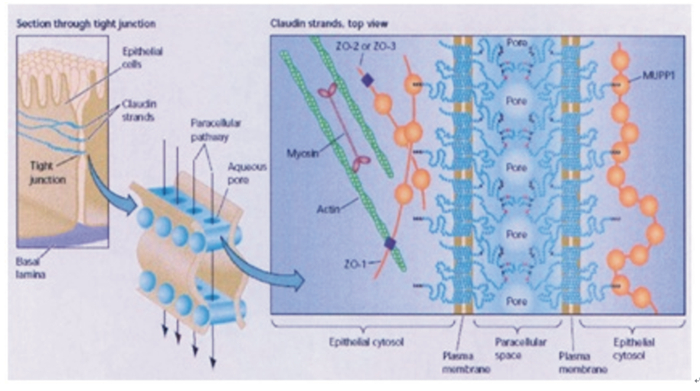
2.2.1 SARA对瘤胃上皮紧密连接的影响紧密连接是上皮细胞顶端连接复合物的重要组成部分,其结构如图 2[17]所示。瘤胃上皮细胞中,紧密连接主要是以环状形式位于基底外侧膜的顶端[17-18]。紧密连接可以分为3种功能:屏障功能——有效阻止基底外侧膜蛋白和上皮细胞顶端的混合,防止有害物质入侵;门控作用——控制离子与其他溶质流通量的细胞间隙途径;相邻细胞间联系功能——传递胞间信息和维持整体生理动态稳衡效应[19]。
|
Section through tight junction:紧密连接切面;Epithelial cells:上皮细胞;Claudin strands:Claudin连接蛋白;Tight junction:紧密连接;Basal lamina:基底层;Paracellular pathway:细胞旁路;Aqueous pore:水性空隙;Claudin strands, top view:Claudin连接蛋白俯视图;Epithelial cytosol:上皮细胞溶质;Plasma membrane:质膜;Paracellular space:细胞间隙;ZO-1:带状闭合蛋白1 Zonula occluden 2;ZO-1:带状闭合蛋白2 Zonula occluden 2;ZO-3:带状闭合蛋白3 Zonula occluden 3;Myosin:肌球蛋白;Actin:肌动蛋白;Pore:孔;MUPP1:多重PDZ结构域蛋白1型multi-PDZ domain protein 1。 图 2 紧密连接结构图 Figure 2 Tight junction structural representation[17] |
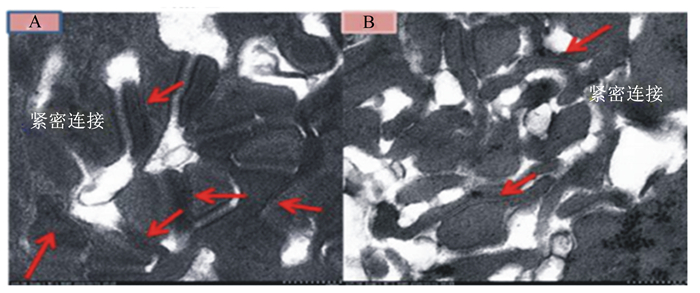
上皮细胞可以通过控制溶质和流体透过细胞,实现细胞间隙途径的屏障功能,即细胞间隙顶端的紧密连接蛋白能调控小分子电中性溶质通过细胞间隙运输。如图 3[20]所示,在透射电镜下观察与健康奶山羊(图 3-A)相比,SARA奶山羊瘤胃上皮的超微结构(图 3-B)有显著变化,紧密连接数量明显减少,结构变得模糊不清,细胞间隙增大,棘突层的线粒体降解,上皮完整性遭到了破坏。
|
图 3 SARA对奶山羊瘤胃上皮超微结构的影响 Figure 3 Effects of subacute ruminal acidosis on the ultrastructure of rumen epithelium in dairy goats[20] |
紧密连接主要由紧密连接相关蛋白组成,其中包括闭合蛋白(Claudin)家族成员、咬合蛋白(Occludin)和带状闭合蛋白(Zonula occluden,ZO)家族成员等[21-23]。Steel等[24]首次测定了绵羊瘤胃上皮中紧密连接蛋白Claudin-1、Claudin-4及Claudin-7基因的全部编码序列。随后Aschenbach等[25]报道了紧密连接蛋白Claudin-1、Claudin-4、Claudin-7、Occludin和ZO-1的表达和分布样式。有研究者利用高精料诱导山羊发生SARA后测得紧密连接蛋白Claudin-4基因表达量升高[20],从相关机制可以解释瘤胃上皮通透性的变化原因。
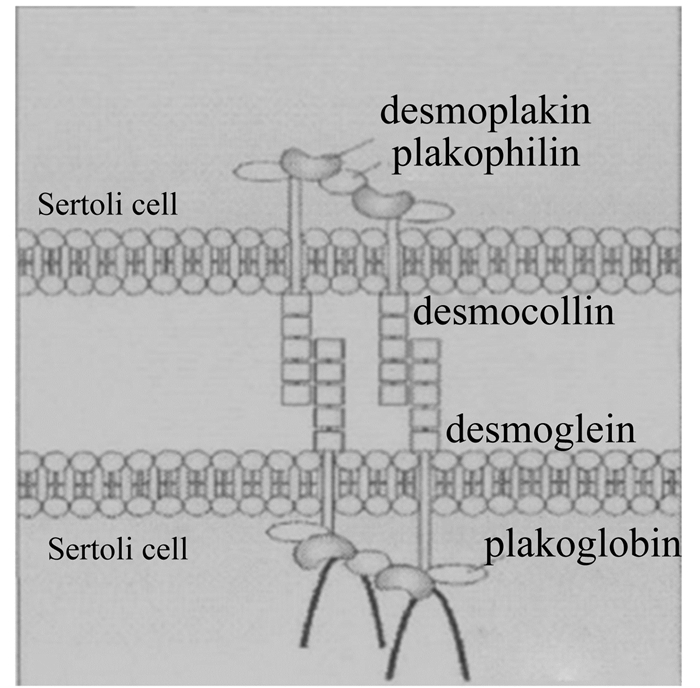
2.2.2 SARA对瘤胃上皮桥粒连接的影响桥粒连接结构图 4[26]所示,它是存在于相邻细胞间的一种类似纽扣的点状结构,起到连接细胞作用;半桥粒连接存在于上皮细胞与胞外基质接触面上,同样呈现点状结构,它可以将上皮细胞基膜与基底连接起来,使细胞之间连接更加牢固。反刍动物瘤胃上皮的桥粒连接位于棘突层与颗粒层间,加大了瘤胃上皮的韧性,起到支撑,抗压力与张力的重要功能,有效的维持瘤胃上皮组织结构。
|
Sertoli cell:支持细胞;desmoplakin:桥粒;plakophilin:桥粒斑;desmocollin:钙黏素;desmoglein:桥粒芯蛋白;plakoglobin:桥粒蛋白。 图 4 桥粒连接结构图 Figure 4 Desmosome junction structural representation[26] |
桥粒斑是相邻细胞间存在桥粒连接部位处的致密斑,主要起到连接细胞的作用。桥粒斑由锚定蛋白组成,相连于胞内的中间丝。桥粒连接将各个细胞间的中间丝又连接起来,即形成了紧密的细胞间连接[27]。目前反刍动物瘤胃上皮确定下来的桥粒连接有桥粒芯蛋白1(desmoglein 1)和桥粒钙黏蛋白1(DSG1)。饲喂奶牛高精料饲粮(精粗比为70 : 30)可以显著下调desmoglein 1基因的表达量[26]。山羊在饲喂高精料饲粮(精粗比为60 : 40)后也表现出瘤胃上皮desmoglein 1基因的表达量下调。说明反刍动物在高精料饲喂的条件下,瘤胃上皮细胞连接功能下降。之后又有学者在研究SARA时,给山羊饲喂NFC/NDF为3.23的高精料饲粮,检测到SARA组瘤胃上皮桥粒连接蛋白desmoglein 1基因表达量显著低于对照组。这提示随着饲粮精粗比的逐渐递增,山羊瘤胃上皮的结构也在逐渐改变,而当SARA发生时,对瘤胃上皮桥粒连接产生显著影响,严重破坏细胞间连接[14],引起炎症反应。
2.2.3 SARA对瘤胃上皮黏着连接的影响黏着连接是借助于细胞骨架系统把细胞与基质或者细胞之间连接成有序而坚固的细胞群体,它的存在为细胞与基质间、细胞间抵抗机械张力提供牢固黏合力。黏着连接广泛分布在上皮组织。
黏着连接主要存在于细胞颗粒层,它基本分为2种,一种是与微丝相连的黏着连接,包含黏合带与黏合斑[28],它们统称为黏合连接。黏合连接通过细胞内黏合蛋白与跨膜黏附蛋白连接成片状跨细胞网,将组织连成整体。另一种是与中间丝相连的黏着连接,包括桥粒(desmosome)和半桥粒(hemidesmosome),共同参与到营养物质转运过程中。反刍动物的瘤胃在迷走神经控制下,不断的进行蠕动,并受到持续的机械牵拉,黏着连接能够保证相邻细胞质膜间互相黏合,从而有效的抵抗这种牵拉。当瘤胃酸中毒时,黏着连接蛋白基因的表达会下调,加大细胞间隙,具体调节基质需要深入探索[14]。
2.2.4 SARA对瘤胃上皮间隙连接的影响间隙连接是目前为止发现的细胞间直接进行物质交流的唯一膜通道结构[29]。这种特殊的连接通道可以实现细胞间电信号与化学信号的通讯联系,使细胞系群体间顺利完成协调与合作。
间隙连接普遍存在于脊椎动物颗粒层与棘突层细胞间,是细胞连接的一种,间隙连接形成的特殊通道不是持续开放的,在不同情况下关闭与开启的状态不同,细胞可以通过调控通道开关,来调节物质进出细胞,由此调控胞内外的信号传递。间隙连接的这种细胞间通道,在完成无机离子与小分子的胞间转移中实现细胞间电化学与代谢偶联。间隙连接的细胞间偶联作用不仅在信息与物质转导起作用以外,还被应用与胚胎发育和肿瘤治疗中。人体内已发现21种间隙连接蛋白,小鼠体内已发现20种。而反刍动物瘤胃上皮确定下来的间隙连接蛋白只有Connexin 43。有研究表明,当反刍动物提高精料饲喂量后,瘤胃液pH下降,同时瘤胃上皮间隙连接蛋白Connexin 43的基因表达也下调,瘤胃屏障功能受损[23]。程萌[14]的试验结果验证了以上说法,SARA组的Connexin 43基因的表达量显著低于对照组,间隙连接蛋白功能破坏。体外对瘤胃上皮细胞培养后研究也是应用比较广泛的方法,王娟[26]利用培养的瘤胃上皮原代细胞为对象,观察培养液中pH和VFA对Connexin 43连接蛋白的影响,发现低pH显著增加其基因表达量,而VFA的结果相反。这可能是由于体外研究双因素培养液pH和VFA对瘤胃上皮细胞的影响无法完全拟合体内的环境与代谢状态,而表现出与体内的结果不一致,同时山羊的品种、瘤胃上皮组织的采样部位以及试验设计等都可能成为影响结果的原因。
2.3 SARA对瘤胃上皮电生理的影响瘤胃上皮通透性增高是反映早期瘤胃上皮屏障损伤的重要标志。最早丹麦学者Ussing首次利用尤斯灌流系统(Ussing chamber)研究上皮组织的离子转运[30],如今利用Ussing chamber研究胃肠道上皮通透性已经成为研究热点。Ussing chamber中的电生理指标可反映瘤胃上皮组织的通透性,如短路电流(Isc)主要反映离子通过上皮的转运能力,Isc增加意味着离子通过上皮的转运能力增强;组织导电性(Gt)反映上皮细胞对离子的通透性,主要体现的是上皮屏障的完整性,Gt增大表示黏膜上皮完整性受损,上皮通透性增大;跨膜电位差(PD)主要说明瘤胃上皮组织的活性,这些电生理指标体现了上皮组织的屏障通透性[31]。在Ussing chamber中利用同位素标记或分子标记物通过胃肠道上皮的比例来检测其上皮通透性已成为比较常用且非常重要的一种手段[32],常用的标记物如辣根过物氧化酶(horseradish peroxidase,HRP)、异硫氰酸荧光素(fluorescein Isothiocyanate,FITC)、3H-甘露醇等[33]。随着Ussing Chamber的不断应用和改良,目前这一技术已成为评价胃肠道屏障功能的“金标准”[14]。
Klevenhusen等[33]利用Ussing chamber研究瘤胃上皮通透性的试验发现,高精料饲粮能显著提高瘤胃上皮Isc和Gt,显著增加大分子标记物HRP和小分子标记物FITC的流速,说明该研究中高精料饲粮使瘤胃上皮通透性显著增加。杨淑青[12]研究SARA对瘤胃上皮电生理的影响,结果得出,SARA组和恢复组的瘤胃上皮Isc、Gt以及HRP流速显著高于对照组,SARA组和恢复组瘤胃上皮PD显著低于对照组。本课题组曾采用HRP和FITC作为分子标记物,发现SARA的发生在短期和长期内均提高了奶山羊瘤胃上皮Isc和Gt,显著降低了PD,也显著提高了HRP和FITC通过瘤胃上皮的流速[34]。这与Klevenhusen等[33]和杨淑青[12]研究结果基本一致,说明SARA对奶山羊瘤胃上皮的完整性造成破坏,使瘤胃上皮对分子标记物HRP和FITC的通透性增大,长期削弱了瘤胃上皮屏障功能。
3 SARA对瘤胃内环境的影响 3.1 pH反刍动物的瘤胃处于一个动态的稳恒体系,瘤胃液pH是最基本最重要的生理指标。当反刍动物发生SARA后瘤胃液pH会在5.0~5.6波动[35]。前人研究发现,通过饲喂反刍动物高精料饲粮导致瘤胃液pH降低,从而使瘤胃黏膜角质层脱落,损伤瘤胃上皮细胞黏附功能。也有研究报道,瘤胃液pH降低可以增加瘤胃上皮通透性[36]。奶牛在泌乳前期需要大量能量,饲粮中富含碳水化合物的精料增加,进入瘤胃后很快产生大量VFA,积累过多后会降低瘤胃液pH,破坏微生物菌群结构及活性。乳酸的产生进一步增加了瘤胃内酸度,致使pH降低到5.5以下,引起SARA。王娟[26]研究发现,低pH显著促进Claudin-1基因表达,同时与VFA结合后共同降低ZO-1基因表达量。Gozho等[37]曾指出瘤胃液pH在5.2~5.6每天持续3 h以上就会发生SARA,此后动物采食量下降,出现炎症反应等。胡红莲等[38]将饲粮NFC/NDF增加到3.23时,瘤胃液pH降低到5.5持续3 h以上,成功诱导奶山羊发生SARA。
3.2 VFA反刍动物通过瘤胃厌氧微生物将碳水化合物降解成VFA。瘤胃上皮具有强大的VFA吸收能力,大多数VFA以被动吸收方式经由瘤胃上皮吸收后提供能量。它可以用来提供机体60%~80%的所需能量。VFA主要是C2~C6的短链脂肪酸,其中总挥发性脂肪酸(TVFA)的95%左右为乙酸、丙酸、丁酸[39]。丙酸是肝脏进行糖异生的有效前体物,能够提供给机体代谢所需的葡萄糖。反刍动物通过咀嚼和反刍促进唾液分泌,高产奶牛瘤胃中产生79.8~90.0 mol/d的VFA,瘤胃中30%~40% H+可被唾液中和,而达到瘤胃内酸碱稳衡的状态[40]。
Khafipour等[41]以精料诱导SARA,结果得出瘤胃液乙酸浓度降低,丙酸、丁酸浓度提高,乙酸/丙酸由3.0 : 1.0降至2.1 : 1.0。邬宇航[15]诱导奶山羊发生SARA过程中,随着饲粮中NFC/NDF的递增,瘤胃液TVFA浓度升高,其中,乙酸、丙酸、丁酸浓度都有升高趋势,但在整个试验中乳酸浓度持续较低。Costa等[42]研究也得出饲喂高精料饲粮后瘤胃液VFA浓度增加。也有研究表明,随着饲粮NFC/NDF的升高,瘤胃液乙酸浓度及乙酸/丙酸下降,而TVFA浓度呈递增趋势,直到NFC/NDF达到2.58时SARA诱导成功,瘤胃液乙酸浓度、乙酸/丙酸显著降低,TVFA浓度显著增加,说明瘤胃液丁酸浓度的升高与SARA密切相关。
翁秀秀[16]从分子层面揭示了高精料饲喂反刍动物对瘤胃内VFA吸收的变化,采用不同饲粮饲喂奶牛,与添加62.9%精料+单一玉米秸秆粗料相比,添加41.4%精料+混合粗料下调了奶牛瘤胃乳头中VFA转运载体基因钠-氢交换子(Na+/H+ exchanger,NHE)1、NHE3和NHE4基因表达量,显著上调单羧酸转运载体1(monocarboxylate transporter-1, MCT-1)基因表达量,同时下调瘤胃乳头中乙酰辅酶A合成酶短链家族1(acyl-CoA synthetase short-chain family member1,ACSS-1)基因的表达。
3.3 瘤胃异常产物内毒素是革兰氏阴性菌的细胞壁的组成成分,具有渗透性屏障功能[43]。当反刍动物机体发生SARA后,瘤胃内革兰氏阴性菌破裂,细胞壁中的内毒素释放进入瘤胃,损伤瘤胃上皮细胞,破坏瘤胃屏障功能[44]。随后通过瘤胃屏障迁移进入血液[45],使血液中的内毒素浓度增加,引发全身性炎症反应,并增加机体免疫活化状态[46]。当内毒素的浓度积累到一定程度后将引起内毒素血症。本课题组以往研究表明,当增加饲粮NFC/NDF后,血浆内毒素浓度升高,并引发奶山羊内毒素血症[47]。也有资料显示,高精料诱导反刍动物发生SARA时往往会伴随血浆或者瘤胃液中内毒素浓度的增加[37]。本课题组前期研究发现,饲粮NFC/NDF由1.40增加到3.23时,血浆中内毒素的浓度也逐渐增加,由15.76×103 EU/mL显著增加到85.55×103 EU/mL,与前人报道[48]相符。Chin等[49]对小肠上皮细胞研究发现,内毒素增加同时会增加一氧化氮(NO)的生成,破坏紧密连接蛋白ZO-1,改变紧密连接蛋白的结构和功能。章森[50]研究了不同饲粮模式对血浆内毒素浓度及血浆代谢产物的影响规律,结果表明,血浆中的内毒素浓度主要受饲粮精粗比影响,而血浆代谢产物与奶牛免疫变化、生产性能变化密切相关[51]。
HIS是重要的生物活性物质之一,也是Ⅰ型变态反应的重要介质,参与变态反应、过敏反应、血管收缩和舒张;同时也是炎症反应和免疫损伤的重要介质。当发生SARA时,瘤胃内环境发生紊乱,瘤胃内长期处于低pH状态,组氨酸脱羧形成HIS,异常代谢产物HIS等增多[51],造成瘤胃黏膜损伤,降低了瘤胃屏障功能。异常代谢产物HIS就会在这种情况下通过破损的瘤胃黏膜进入血液引起机体炎症反应[1]。郭鹏等[52]指出血液中HIS浓度随饲粮NFC/NDF增加而表现增加趋势。Aschenbach等[25]调查显示,HIS诱导细胞凋亡,或增加细胞脱落,或干涉细胞核分裂和细胞成熟,这些变化意味着在SARA过程中异常代谢产物HIS能干扰上皮细胞的再生,进而造成细胞损伤,引发炎症反应。同时,也有报道指出,当奶牛饲粮NFC/NDF达到2.58时发生SARA,瘤胃液中HIS的浓度升至116.74 ng/mL,而血浆中的HIS浓度呈先升高后降低的变化[1]。HIS浓度升高与机体的病理改变明显相关,能够引起炎症反应,成为SARA发生的重要因素之一,并具有加重病情发展的作用。
3.4 瘤胃微生物区系瘤胃内存在大量的真菌,细菌及原虫等微生物群体,它们互利共生构成了瘤胃内稳定的发酵系统。当反刍动物过量采食易发酵碳水化合物时。瘤胃微生物的生长速率会显著提高,加快瘤胃发酵,产生过多的有机酸进而降低瘤胃液pH引发SARA。发生SARA后瘤胃内微生物结构与数量产生变化:原虫大量死亡,纤维分解菌数量降低,革兰氏阴性菌大量死亡[53]。韩昊奇[54]诱导奶山羊发生SARA的试验表明,当NFC/NDF为1.24时,瘤胃内原虫数量最高,但随着NFC/NDF的递增,原虫数量极显著下降,到SARA期降至最低值。郭鹏等[52]的研究同样发现,SARA发生过程中变化最明显的是淀粉分解菌数量,它随NFC/NDF增加而增加。当瘤胃内pH进一步降低,瘤胃菌群平衡受到破坏,耐酸菌大量繁殖,产生乳酸等一些有害物质,加重了SARA的病情。同时坏死杆菌数量剧增,高达正常期的十几倍。而普雷沃氏菌(P.ruminicola)有较宽的酸度缓冲能力。多数纤维分解菌在pH为6.0时失去活性,但采用遗传工程技术后的P.ruminicola B.4菌株可以对抗pH=5.5的生存环境,因此采用基因调控重组抗酸的纤维分解菌成为调控瘤胃微生物的最有效方法之一[40]。
3.5 其他因素SARA对反刍动物的健康造成潜移默化的影响,干扰机体免疫功能,使细胞免疫处于主导作用,炎性细胞分泌增加[38]。采食量下降,产奶量降低,造成严重经济损失。随着SARA的发展,动物会引起腹泻、肠黏膜损伤、蹄叶炎、肝损伤脓肿及其他炎症反应[55]。
4 小结SARA的发生不仅导致反刍动物瘤胃上皮结构功能的改变,同时造成瘤胃内发酵紊乱,微生物菌群结构改变,异常代谢产物增多,进而破坏瘤胃黏膜的完整性,使瘤胃上皮屏障结构遭到损伤。目前,多数研究都集中在SARA的预防、判定、治疗及其发生发展的病理学问题上,而SARA对反刍动物瘤胃上皮的损伤机制与作用途径并不十分清晰。为此,有必要深入开展研究,探索SARA发生后对瘤胃上皮屏障功能与分子调控机制的影响。同时,随着大数据时代的到来,各种测序分析的相关研究琳琅满目,其中瘤胃微生物宏基因组的测序与分析方兴未艾,这为更好地了解SARA发生相关功能基因的调控网络和微生态环境、挖掘关键信号通路等具有指导意义,更为研究高精料饲粮条件下如何提高饲料的利用率,保证瘤胃健康有效的营养调控技术提供理论依据。
| [1] |
KHAFIPOUR E, KRAUSE D O, PLAIZIER J C. A grain-based subacute ruminal acidosis challenge causes translocation of lipopolysaccharide and triggers inflammation[J]. Journal of Dairy Science, 2009, 92(3): 1060-1070. DOI:10.3168/jds.2008-1389 |
| [2] |
胡红莲, 高民. 肠道屏障功能及其评价指标的研究进展[J]. 中国畜牧杂志, 2012, 48(17): 78-82. DOI:10.3969/j.issn.0258-7033.2012.17.021 |
| [3] |
SLYTER L L. Influence of acidosis on rumen function[J]. Journal of Animal Science, 1976, 43(4): 910-929. DOI:10.2527/jas1976.434910x |
| [4] |
苑学. 肉牛亚急性瘤胃酸中毒微生态制剂的研制及其效果评价[D]. 博士学位论文. 长春: 吉林大学, 2011.
|
| [5] |
MASHUKOVA A, WALD F A, SALAS P J. Tumor necrosis factor alpha and inflammation disrupt the polarity complex in intestinal epithelial cells by a posttranslational mechanism[J]. Molecular and Cellular Biology, 2011, 31(4): 756-765. DOI:10.1128/MCB.00811-10 |
| [6] |
CUI W, LI L X, SUN C M, et al. Tumor necrosis factor alpha increases epithelial barrier permeability by disrupting tight junctions in Caco-2 cells[J]. Brazilian Journal of Medical and Biological Research, 2010, 43(4): 330-337. DOI:10.1590/S0100-879X2010007500020 |
| [7] |
KLEEN J L, HOOLUER G A, REHAGE J, et al. Subacute ruminal acidosis in Dutch dairy herds[J]. Veterinary Record, 2009, 164(22): 681-684. DOI:10.1136/vr.164.22.681 |
| [8] |
KLEEN J L, STOKMAN P, NOORDHUIZEN J, et al. Sub-acute ruminal acidosis (SARA) in dairy cows[M]. [S.l.]: Ministry Agriculture Food and Rural Affairs, 2003: 30-31.
|
| [9] |
HARHAJ N S, ANTONETTI D A. Regulation of tight junctions and loss of barrier function in pathophysiology[J]. The International Journal of Biochemistry & Cell Biology, 2004, 36(7): 1206-1237. |
| [10] |
GRAHAM C, SIMMONS N L. Functional organization of the bovine rumen epithelium[J]. American Journal of Physiology:Regulatory, Integrative and Comparative Physiology, 2005, 288(1): R173-R181. DOI:10.1152/ajpregu.00425.2004 |
| [11] |
邬宇航. 亚急性瘤胃酸中毒对瘤胃、瓣胃上皮细胞增殖与凋亡的影响[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2013.
|
| [12] |
杨淑青. 亚急性瘤胃酸中毒对奶山羊瘤胃上皮屏障功能影响机制的研究[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2014.
|
| [13] |
刘军花. 亚急性瘤胃酸中毒对山羊瘤胃上皮屏障功能的影响及其机制[D]. 硕士学位论文. 南京: 南京农业大学, 2014.
|
| [14] |
程萌. 亚急性瘤胃酸中毒对奶山羊瘤胃上皮通透性及细胞连接蛋白表达的影响[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2016.
|
| [15] |
STEELE M A, CROOM J, KAHLER M, et al. Bovine rumen epithelium undergoes rapid structural adaptation during grain-induced subacute ruminal acidosis[J]. American Journal of Physiology:Regulatory, Integrative and Comparative Physiology, 2011, 300(6): R1515-R1523. DOI:10.1152/ajpregu.00120.2010 |
| [16] |
翁秀秀. 饲喂不同日粮奶牛瘤胃发酵和VFA吸收特性及其相关基因表达的研究[D]. 博士学位论文. 兰州甘肃农业大学, 2013.
|
| [17] |
CEREIJIDO M, CONTRERAS R G, SHOSHANI L, et al. Tight junction and polarity interaction in the transporting epithelial phenotype[J]. Biochimica et Biophysica Acta:Biomembranes, 2008, 1778(3): 770-793. DOI:10.1016/j.bbamem.2007.09.001 |
| [18] |
BALDA M S, MATTER K. Epithelial cell adhesion and the regulation of gene expression[J]. Trends in Cell Biology, 2003, 13(6): 310-318. DOI:10.1016/S0962-8924(03)00105-3 |
| [19] |
余长松. 胰高血糖素样肽-2对IPEC-J2细胞紧密连接表达与屏障功能的影响及其分子机制研究[D]. 硕士学位论文. 雅安: 四川农业大学, 2014.
|
| [20] |
程萌. 亚急性瘤胃酸中毒对奶山羊瘤胃上皮通透性及细胞连接蛋白表达的影响[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2016.
|
| [21] |
何雯. 缺氧对LIMK1介导的cofilin磷酸化的影响及其在肠上皮屏障功能损害中的作用研究[D]. 硕士学位论文. 重庆: 第三军医大学, 2015.
|
| [22] |
SHEN L, WEBER C R, RALEIGH D R, et al. Tight junction pore and leak pathways:a dynamic duo[J]. Annual Review of Physiology, 2011, 73(1): 283-309. DOI:10.1146/annurev-physiol-012110-142150 |
| [23] |
MARCHIANDO A M, GRAHAM W V, TURNER J R. Epithelial barriers in homeostasis and disease[J]. Annual Review of Pathology, 2010, 5(1): 119-144. DOI:10.1146/annurev.pathol.4.110807.092135 |
| [24] |
STEEL M A, ALZAHAL O, HOOK S, et al. Ruminal acidosis and the rapid onset of ruminal parakeratosis in a mature dairy cow:a case report[J]. Acta Veterinaria Scandinavica, 2009, 51(1): 39-44. DOI:10.1186/1751-0147-51-39 |
| [25] |
ASCHENBACH J R, PENNER G B, STUMPFF F, et al. Ruminant nutrition symposium:role of fermentation acid absorption in the regulation of ruminal pH[J]. Journal of Animal Science, 2011, 89(4): 1092-1107. DOI:10.2527/jas.2010-3301 |
| [26] |
王娟. 不同精粗比日粮对奶牛和山羊瘤胃上皮屏障的影响[D]. 硕士学位论文. 南京: 南京农业大学, 2012.
|
| [27] |
MEUK D D, SILVESTRINI B, CHENG C Y. Anchoring junctions as drug targets:role in contraceptive development[J]. Pharmacological Reviews, 2008, 60(2): 146-180. DOI:10.1124/pr.107.07105 |
| [28] |
JAMORA C, FUCHS E. Intercellular adhesion, signalling and the cytoskeleton[J]. Nature Cell Biology, 2002, 4(4): E101-E108. DOI:10.1038/ncb0402-e101 |
| [29] |
RUCH R J. The role of gap junctional intercellular communication in neoplasia[J]. Annals of Clinical & Laboratory Science, 1994, 24(3): 216-231. |
| [30] |
USSING H H, ZERAHN K. Active transport of sodium as the source of electric current in the short-circuited isolated frog skin[J]. Acta Physiologica Scandinavica, 1951, 23(2/3): 110-127. |
| [31] |
LODEMANN U, MARTENS H. Effects of diet and osmotic pressure on Na+ transport and tissue conductance of sheep isolated rumen epithelium[J]. Experimental Physiology, 2006, 91(3): 539-550. DOI:10.1113/expphysiol.2005.032078 |
| [32] |
MAEKAWA M, BEAUCHEMIN K A, CHRISTENSEN D A. Effect of concentrate level and feeding management on chewing activities, saliva production, and ruminal pH of lactating dairy cows[J]. Journal of Dairy Science, 2002, 85(5): 1165-1175. DOI:10.3168/jds.S0022-0302(02)74179-9 |
| [33] |
KLEVENHUSEN F, HOLLMANN M, PODSTATZKY-LICHTENSTEIN L, et al. Feeding barley grain-rich diets altered electrophysiological properties and permeability of the ruminal wall in a goat model[J]. Journal of Dairy Science, 2013, 96(4): 2293-2302. DOI:10.3168/jds.2012-6187 |
| [34] |
孙燕勇. 亚急性瘤胃酸中毒对奶山羊瘤胃上皮通透性的影响及其机制研究[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2017.
|
| [35] |
陈渊, 朱家增, 邓立新, 等. 牛瘤胃酸中毒发病机制与防治的研究进展[J]. 中国畜牧兽医, 2011, 38(6): 132-135. |
| [36] |
PENNER G B, TANIGUCHI M, GUAN L L, et al. Effect of dietary forage to concentrate ratio on volatile fatty acid absorption and the expression of genes related to volatile fatty acid absorption and metabolism in ruminal tissue[J]. Journal of Dairy Science, 2009, 92(6): 2767-2781. DOI:10.3168/jds.2008-1716 |
| [37] |
GOZHO G N, KRAUSE D O, PLAIZIER J C. Ruminal lipopolysaccharide concentration and inflammatory response during grain-induced subacute ruminal acidosis in dairy cows[J]. Journal of Dairy Science, 2007, 90(2): 856-866. DOI:10.3168/jds.S0022-0302(07)71569-2 |
| [38] |
胡红莲, 谢天宇, 杨淑青, 等. 亚急性瘤胃酸中毒对奶山羊血浆细胞因子和激素含量的影响[J]. 动物营养学报, 2015, 27(2): 418-425. |
| [39] |
李文. 瘤胃液pH、渗透压、挥发性脂肪酸(VFAs)浓度对绵羊瘤胃上皮VFAs吸收影响的研究[D]. 硕士学位论文. 泰安: 山东农业大学, 2014.
|
| [40] |
卢德勋. 新版系统动物营养学导论[M]. 北京: 中国农业出版社, 2016.
|
| [41] |
KHAFIPOUR E, KRAUSE D O, PLAIZIER J C. Alfalfa pellet-induced subacute ruminal acidosis in dairy cows increases bacterial endotoxin in the rumen without causing inflammation[J]. Journal of Dairy Science, 2009, 92(4): 1712-1724. DOI:10.3168/jds.2008-1656 |
| [42] |
COSTA S F, PEREIRA M N, MELO L Q, et al. Lactate, propionate, and butyrate induced morphological alterations on calf ruminal mucosa and epidermis:Ⅱ.Ultra-structurals aspects[J]. Aequivo Brasileiro de Medicina Veterinaria e Zootecnia, 2008, 60(1): 10-18. DOI:10.1590/S0102-09352008000100002 |
| [43] |
PLAIZIER J C, KHAFIPOUR E, LI S, et al. Subacute ruminal acidosis (SARA), endotoxins and health consequences[J]. Animal Feed Science and Technology, 2012, 172(1/2): 9-21. |
| [44] |
ENEMARK J M D, JØRGENSEN R J, ENEMARK P, et al. Rumen acidosis with special emphasis on diagnostic aspects of subclinical rumen acidosis:a review[J]. Veterinarijair ir Zootechnika, 2002, 20(42): 16-29. |
| [45] |
EMMANUEL D G V, MADSEN K L, CHURCHILL T A, et al. Acidosis and lipopolysaccharide from Escherichia coli B:055 cause hyperpermeability of rumen and colon tissues[J]. Journal of Dairy Science, 2007, 90(12): 5552-5557. DOI:10.3168/jds.2007-0257 |
| [46] |
周俊. 不同日粮模式对奶牛瘤胃内毒素释放和乳腺免疫活化状态的影响[D]. 硕士学位论文. 西安: 西南大学, 2013.
|
| [47] |
赵培厅. 日粮不同NFC/NDF比对奶山羊瘤胃发酵功能和微生物区系变化的影响[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2011.
|
| [48] |
孙燕勇, 胡红莲, 高民, 等. 亚急性瘤胃酸中毒对奶山羊血浆异常代谢产物及生化指标的影响[J]. 动物营养学报, 2017, 29(3): 1046-1055. |
| [49] |
CHIN A C, FLYNN A N, FEDWICH J P, et al. The role of caspase-3 in lipopolysaccharide-mediated disruption of intestinal epithelial tight junctions[J]. Canadian Journal of Physiology and Pharmacology, 2006, 84(10): 1043-1050. DOI:10.1139/y06-056 |
| [50] |
章森. 不同日粮模式对奶牛血浆内毒素、代谢产物和激素含量的影响[D]. 硕士学位论文. 重庆: 西南大学, 2013.
|
| [51] |
胡红莲. 奶山羊亚急性瘤胃酸中毒营养生理机制的研究[D]. 博士学位论文. 呼和浩特: 内蒙古农业大学, 2008.
|
| [52] |
郭鹏, 刘大程, 赵培厅, 等. 不同NFC/NDF比日粮对奶山羊瘤胃细菌及瘤胃和血浆中内毒素及组胺含量的影响[J]. 畜牧兽医学报, 2015, 46(1): 96-103. |
| [53] |
NAGARAJA T G, TITGEMEYER E C. Ruminal acidosis in beef cattle:the current microbiological and nutritional outlook[J]. Journal of Dairy Science, 2007, 90(Suppl.1): E17-E38. |
| [54] |
韩昊奇. 日粮不同NFC/NDF比对奶山羊瘤胃细菌种群及有机酸流通的影响[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2011.
|
| [55] |
STONE W C. Nutritional approaches to minimize subacute ruminal acidosis and laminitis in dairy cattle[J]. Journal of Dairy Science, 2004, 87(Suppl.1): E13-E26. |




