2. 中国科学院大学, 北京 100039;
3. 湖南农业大学动物科技学院, 长沙 410125;
4. 广东旺大集团猪清洁饲料技术研发院士工作站, 广州 510663;
5. 华南农业大学动物科学学院, 广州 510642;
6. 湖南畜禽安全生产协同创新中心, 长沙 410128
2. University of Chinese Academy of Sciences, Beijing 100039, China;
3. Department of Animal Science, Hunan Agriculture University, Changsha 410125, China;
4. Guangdong Wangda Group Academician Workstation for Clean Feed Technology Research and Development in Swine, Guangzhou 510663, China;
5. College of Animal Science of South China Agricultural University, Guangzhou 510642, China;
6. Hunan Co-Innovation Center of Animal Production Safety, Changsha 410128, China
谷氨酸(Glu)和天冬氨酸(Asp)等电点都小于7,属于酸性氨基酸,在传统营养学认为Glu和Asp属于非必需氨基酸[1]。并且,在神经系统中,Glu和Asp作为兴奋性神经递质,被认为是兴奋性氨基酸[2]。但近年来研究表明,Glu和Asp作为功能性氨基酸在体内发挥重要作用[3-4]。Glu和Asp作为机体组织器官能量的主要来源之一,或者通过脱羧基或转氨基作用转化为其他营养物质,如谷氨酰胺、谷胱甘肽、瓜氨酸、α-酮戊二酸、二氧化碳等,在改善组织器官结构和功能[5]及缓解应激方面发挥重要作用[3, 6]。石海峰等[5]研究表明,仔猪注射脂多糖(LPS)后,基础饲粮中添加0.5%或1.0% Asp能够显著缓解LPS刺激导致的平均日增重下降。吴苗苗等[7]的研究表明,饲粮中添加2% Glu对脱氧雪腐镰刀菌烯醇(DON)导致的仔猪平均日采食量下降有一定缓解作用,并能显著提高饲喂DON饲粮的仔猪平均日增重和降低料重比。段杰林[8]研究也表明,饲粮中添加1% Asp和2% Glu显著缓解了应激带来的生长性能的抑制。本课题组前期研究表明,饲粮Asp水平为1.3%~1.5%、Glu水平为2.6%~2.9%时,可促进断奶仔猪的生长,有利于氨基酸的利用;而饲粮Glu水平为3.2%~3.5%或Asp水平为1.7%时,抑制断奶仔猪的生长。而且利用尤氏灌流技术可知Asp和Glu在转运过程中高Glu或Asp含量会抑制Asp或Glu的吸收[9]。这预示着Glu和Asp可作为功能性氨基酸在机体内发挥重要的作用。然而饲粮不同Glu和Asp水平对健康的断奶仔猪器官指数、血清生化指标和激素含量的影响,则鲜有研究报道。因此,本试验探讨了饲粮不同Glu和Asp水平对断奶仔猪器官指数、血清生化指标和激素含量的影响,以期为饲粮中合理利用Glu和Asp提供科学依据。
1 材料与方法 1.1 试验设计选取35日龄健康三元杂交(杜×长×大)断奶仔猪42头[公母各占1/2,体重(13.24±0.25) kg],随机分为6个组,每组7个重复,每个重复1头猪,单栏饲养。饲粮Glu和Asp水平分别设计为:对照组(control group,NC组)Glu和Asp水平分别为2.9%和1.5%,低Asp组(low Asp group,LA组)Glu和Asp水平分别为2.9%和1.3%,高Asp组(high Asp group,HA组)Glu和Asp水平分别为2.9%和1.7%,低Glu组(low Glu group,LG组)Glu和Asp水平分别为2.6%和1.5%,高Glu组(high Glu group,LG组)Glu和Asp水平分别为3.2%和1.5%,极高Glu组(highly high Glu group,HHG组)Glu和Asp水平分别为3.5%和1.5%。试验饲粮组成及营养水平见表 1。
|
|
表 1 试验饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of experimental diets (air-dry basis) |
本试验在中科院亚热带农业生态研究所动物饲养室进行,全封闭式猪舍,漏缝金属材质底面,不锈钢可调式料槽,乳头式饮水器。仔猪单笼饲养,并按照猪场标准饲养管理程序对试验猪进行驱虫与免疫处理。仔猪自由饮水和采食,粉料饲喂。整个圈舍采取自然通风,保持清洁,在养殖期内对所在圈舍进行不定期消毒。试验期21 d。
1.3 测定指标及方法 1.3.1 器官指数的检测于饲养试验结束后,每组随机选取6头猪,共42头猪,禁食24 h后,称取宰前活重,再进行屠宰解剖,取出心脏、肝脏、脾脏和肾脏,吸干表面水分后进行称重。器官指数按以下公式计算:
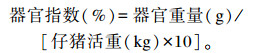
|
于饲养试验结束后对断奶仔猪空腹采集前腔静脉血液10 mL,3 000 r/min、4 ℃离心10 min,-20 ℃冻存。用CX4型全自动生化分析仪(Beckman公司,美国)测定血清中总蛋白(total protein,TP)、白蛋白(albumin,ALB)、尿素氮(urea nitrogen,UN)、葡萄糖(glucose,GLU)和甘油三酯(triglyceride,TG)含量。测定方法按照试剂盒(南京建成生物工程研究所)操作说明进行。
1.3.3 血清激素含量的检测采用酶联免疫吸附测定(enzyme linked immune sorbent assay, ELISA)法(南京华东电子集团医疗装备有限责任公司)测定血清中胰岛素(insulin,INS)、胰高血糖素(glucagon,GC)、胃抑素(gastric inhibitory polypeptide,GIP)、胰高血糖素样肽-Ⅰ(glucagon-like peptide Ⅰ,GLP-Ⅰ)、生长激素(growth hormone,GH)以及胰岛素样生长因子-Ⅰ(insulin-like growth factor Ⅰ,IGF-Ⅰ)的含量。测定方法按照ELISA试剂盒(南京建成生物工程研究所)操作说明进行。
1.4 数据统计分析所有数据用Excel 2010软件进行归纳整理,采用SPSS 18.0软件中的单因素方差分析(one-way ANOVA)进行统计分析,差异显著者用Duncan氏法进行多重比较,数据以平均值±标准误表示,以P<0.05作为差异显著性判断标准。
2 结果 2.1 饲粮不同Glu和Asp水平对仔猪器官指数的影响如表 2所示,饲粮不同Asp水平对仔猪心脏指数、肝脏指数、脾脏指数以及肾脏指数均无显著影响(P>0.05)。
|
|
表 2 饲粮不同Asp水平对仔猪器官指数的影响 Table 2 Effects of dietary different Asp levels on organ indexes of piglets |
如表 3所示,饲粮不同Glu水平对仔猪心脏指数、肝脏指数、脾脏指数以及肾脏指数均无显著影响(P>0.05)。
|
|
表 3 饲粮不同Glu水平对仔猪器官指数的影响 Table 3 Effects of dietary different Glu levels on organ indexes of piglets |
如表 4所示,饲粮不同Asp水平对仔猪血清中TP、ALB、UN、GLU含量均无显著影响(P>0.05),LA组和NC组血清TG含量显著低于HA组(P<0.05)。
|
|
表 4 饲粮不同Asp水平对仔猪血清生化指标的影响 Table 4 Effects of dietary different Asp levels on serum biochemical parameters of piglets |
如表 5所示,饲粮不同Glu水平对仔猪血清中TP和UN含量无显著影响(P>0.05),LG组血清ALB含量显著低于NC组和HG组(P<0.05),LG组和HG组血清GLU含量显著低于HHG组(P<0.05),HG组和HHG组血清TG含量显著低于LG组(P<0.05)。
|
|
表 5 饲粮不同Glu水平对仔猪血清生化指标的影响 Table 5 Effects of dietary different Glu levels on serum biochemical parameters of piglets |
如表 6所示,饲粮不同Asp水平对仔猪血清中INS、GC、GLP-Ⅰ、GH以及IGF-Ⅰ含量无显著影响(P>0.05),HA组血清GIP含量显著低于LA组(P<0.05)。
|
|
表 6 饲粮不同Asp水平对仔猪血清激素含量的影响 Table 6 Effects of dietary different Asp levels on serum hormone contents of piglets |
如表 7所示,饲粮不同Glu水平对仔猪血清中GIP、GLP-Ⅰ以及IGF-Ⅰ含量无显著影响(P>0.05),LG组和HG组血清INS含量显著高于HHG组(P<0.05),血清GC含量趋势与之刚好相反,LG组和HG组血清GC含量显著低于HHG组(P<0.05),LG组和NC组血清GH含量显著低于HHG组(P<0.05)。
|
|
表 7 饲粮不同Glu水平对仔猪血清激素含量的影响 Table 7 Effects of dietary different Glu levels serum hormone contents of piglets |
器官指数是内脏器官的相对重量,是反映动物机体健康的直观指标[10]。陈明洪[10]研究表明,在霉变饲粮中添加2%的Glu对器官具有显著的保护作用。吴苗苗等[7]研究也表明,Glu对肝脏、肾脏、胰腺和脾脏都具有一定保护修复作用。本研究中,饲粮不同Glu和Asp水平对仔猪各器官指数均无显著影响,可能是因为仔猪为35日龄,内脏器官发育高峰期已过,内脏正常发育,饲粮对其影响不大[11]。
3.2 饲粮不同Glu和Asp水平对仔猪血清生化指标的影响血清生化指标受饲粮营养水平的影响,可反映机体营养代谢和生理机能的情况。其中血清ALB含量的变化可直接反映机体内蛋白质的合成代谢[12-13]。血清GLU含量在病理以及应激情况下会出现过高或过低的情况,在正常情况下保持相对稳定[14]。TG直接参与胆固醇的合成,是血脂的主要成分之一[15]。伍力等[16]研究表明,饲粮添加306.64 mg/kg的谷氨酰胺对大鼠血清ALB含量的提高有一定的作用。吴苗苗等[7]研究表明,饲粮中添加2%的Glu能够显著缓解由于呕吐毒素带来的血清GLU含量的升高。本试验中,饲粮Asp水平为1.7%时,显著降低了血清TG含量;饲粮Glu水平为3.2%时,显著升高了血清ALB含量,显著降低了GLU和TG含量。但是本实验室前期研究表明,当饲粮Glu水平为3.2%或者Asp水平为1.7%时,对生长性能具有抑制作用,这可能是因为Glu和Asp作为机体重要的供能物质,大量氧化,维持肠道健康[17],但是未促进机体生长。
3.3 饲粮不同Glu和Asp水平对仔猪血清激素含量的影响GIP是在进食后释放的重要的饱感激素,可增强葡萄糖依赖的INS的合成与分泌,同时抑制GC的分泌,延缓胃排空,减少胃肠蠕动和胃酸的分泌[18]。本试验中,随着饲粮Asp水平的升高,血清GIP含量降低。而本试验室前期研究也表明,生长性能与血清GIP含量趋势一致。在一定范围内,Glu可以作为信使诱导细胞分泌INS[19]。彭彰智[11]研究表明,在基础饲粮中添加1%的Glu,血清GH含量显著增高[11]。本试验中,当饲粮Glu水平为3.5%时,降低了血清INS含量,但是升高了血清GC和GH含量,这与彭彰智[11]研究结果一致。本试验结果也与Matsunaga等[20]的研究结果类似,说明饲粮Glu水平的升高可以促进机体内GH的分泌,降低血清GLU和INS含量。
4 结论① 饲粮不同Glu和Asp水平对仔猪器官指数无显著影响。
② 饲粮Asp水平为1.7%时,显著降低了血清TG含量。饲粮Glu水平为3.2%时,显著升高了血清ALB含量,降低了血清GLU和TG含量。
③ 随着饲粮Asp水平的升高,血清GIP含量降低。饲粮Glu水平为3.5%时,降低了血清INS含量,升高了血清GC和GH含量。
致谢: 感谢中国科学院亚热带农业生态研究所公共技术服务中心对本试验的大力支持。| [1] |
WU G Y, BAZER F W, DAVIS T A, et al. Important roles for the arginine family of amino acids in swine nutrition and production[J]. Livestock Science, 2007, 112(1/2): 8-22. |
| [2] |
BARB C R, CAMPBELL R M, ARMSTRONG J D, et al. Aspartate and glutamate modulation of growth hormone secretion in the pig:possible site of action[J]. Domestic Animal Endocrinology, 1996, 13(1): 81-90. DOI:10.1016/0739-7240(95)00047-X |
| [3] |
WANG H B, LIU Y L, SHI H F, et al. Aspartate attenuates intestinal injury and inhibits TLR4 and NODs/NF-κB and p38 signaling in weaned pigs after LPS challenge[J]. European Journal of Nutrition, 2016, 56(4): 1433-1443. |
| [4] |
DUAN J L, YIN J, WU M M, et al. Dietary glutamate supplementation ameliorates mycotoxin-induced abnormalities in the intestinal structure and expression of amino acid transporters in young pigs[J]. PLoS One, 2014, 9(11): e112357. DOI:10.1371/journal.pone.0112357 |
| [5] |
石海峰. 天冬氨酸对脂多糖刺激断奶仔猪肠道损伤的调控作用[D]. 硕士学位论文. 武汉: 武汉轻工大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10496-1015537445.htm
|
| [6] |
YIN J, LIU M, REN W, et al. Effects of dietary supplementation with glutamate and aspartate on diquat-induced oxidative stress in piglets[J]. PLoS One, 2015, 10(4): e0122893. DOI:10.1371/journal.pone.0122893 |
| [7] |
吴苗苗, 肖昊, 印遇龙, 等. 谷氨酸对脱氧雪腐镰刀菌烯醇刺激下的断奶仔猪生长性能、血常规及血清生化指标变化的干预作用[J]. 动物营养学报, 2013, 25(7): 1587-1594. |
| [8] |
段杰林. 酸性氨基酸缓解过氧化氢介导仔猪肠道氧化损伤机制研究[D]. 硕士学位论文. 北京: 中国科学院大学, 2016. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y3056195
|
| [9] |
王利剑. 酸性和碱性氨基酸对断奶仔猪肠道氨基酸吸收及转运的影响研究[D]. 硕士学位论文. 北京: 中国科学院大学, 2017.
|
| [10] |
陈明洪. 呕吐毒素对育肥猪的影响及酸碱性氨基酸干预效应[D]. 硕士学位论文. 长沙: 湖南农业大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10537-1014182519.htm
|
| [11] |
彭彰智. 谷氨酸对断奶仔猪的营养及肠道神经系统的影响[D]. 硕士学位论文. 南昌: 南昌大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10403-1013135072.htm
|
| [12] |
辛亮. 不同日粮类型对仔猪生产性能及血清生化指标的影响[D]. 硕士学位论文. 南京: 南京农业大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10307-1014216906.htm
|
| [13] |
管武. 理想氨基酸模式提高猪生产性能的机理[D]. 博士学位论文. 北京: 中国农业大学, 1997. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y236065
|
| [14] |
SHIRAYAMA H, OHSHIRO Y, KINJO Y, et al. Acute brain injury in hypoglycaemia-induced hemiplegia[J]. Diabetic Medicine, 2004, 21(6): 623-624. DOI:10.1111/dme.2004.21.issue-6 |
| [15] |
杨小婷. 饲粮蛋白、能量和纤维水平对圩猪生产性能、肉质和血清生化指标的影响[D]. 硕士学位论文. 合肥: 安徽农业大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10364-1014147937.htm
|
| [16] |
伍力, 尹杰, 何流琴, 等. 谷氨酰胺对缓解呕吐毒素刺激大鼠损伤作用的研究[J]. 肠外与肠内营养, 2012, 19(3): 159-163. |
| [17] |
WATFORD M. Glutamine metabolism and function in relation to proline synthesis and the safety of glutamine and proline supplementation[J]. Journal of Nutrition, 2008, 138(10): 2003S-2007S. DOI:10.1093/jn/138.10.2003S |
| [18] |
宋燕青, 张四喜, 孙丽蕊, 等. 新一代降血糖药——肠促胰素[J]. 现代预防医学, 2012, 39(18): 4887-4889. |
| [19] |
MAECHLER P, WOLLHEIM C B. Mitochondrial glutamate acts as a messenger in glucose-induced insulin exocytosis[J]. Nature, 1999, 402(6762): 685-689. DOI:10.1038/45280 |
| [20] |
MATSUNAGA N, KUBOTA I, ROH S G, et al. Effect of mesenteric venous volatile fatty acids (VFA) infusion on GH secretion in sheep[J]. Endocrine Journal, 1997, 44(5): 707-714. DOI:10.1507/endocrj.44.707 |




