小麦是世界上种植最多的农作物之一,因其可消化纤维和能量较高,全株小麦适合作为高产奶牛或肉牛的优质饲料作物,饲喂价值接近玉米青贮[1]。全株小麦营养价值高,在以色列、土耳其以及美国的一些地区被广泛用于奶牛饲料。2016年《中央一号文件》提出:扩大粮改饲试点,加快建设现代饲草料产业体系。近年,随着我国奶牛业的发展,国产优质粗饲料难以满足牧场发展的需要,因此充分开发利用本地粗饲料资源是大势所趋,小麦在奶牛生产上的应用逐渐受到关注。
将全株小麦应用于奶牛饲料,必须要明确全株小麦成长过程中营养价值的特性及其变化规律,以确定全株小麦最佳刈割时期,但关于小麦的很多研究结果存在着差异[2-4],目前我国对全株小麦的研究很少,关于全株小麦瘤胃降解率方面的研究仍未见报道。因此,本试验旨在通过对全株小麦生长过程中营养成分及瘤胃降解特性变化规律的研究,为全株小麦在奶牛饲粮上的应用提供数据参考,希望本研究能够在开发本地粗饲料资源和减少进口粗饲料方面具有一定的借鉴意义。
1 材料与方法 1.1 试验材料的采集试验所用小麦于2014年10月10日在山东农业大学农学院试验田的2个地块播种,2个地块的小麦品种分别属于山农22026(SN22026)和山农82567(SN82567),播种量每亩(1亩≈666.67 m2)15万株,播种地在山东泰安。
样品的采集时间为2015年3月下旬(拔节期)至6月中旬(成熟收割),采样期共11个周,拔节期(1、2周)、抽穗期(3、4周)、开花期(5、6周)、乳熟期(7、8、9周)、腊熟期(10、11周),每周四采样1次,采样时,从距离地头2 m处开始纵向采样,随机采集植株,但避免采集相邻的植株。每个地块每次采集100个植株,每个地块的小麦样品分成2份,分别用于测定营养成分含量和瘤胃降解参数。
采样后,立即将样品放入65 ℃电热恒温烘箱内烘至恒重,然后回潮24 h测定植株初水分含量。使用植物样品粉碎机将回潮后的风干样品分别粉碎至40和7目,分别用于测定常规营养成分含量和瘤胃降解参数。
1.2 瘤胃降解率的测定瘤胃降解率的测定采用尼龙袋法:2个品种小麦在2个地块播种,每个地块的小麦样品分成2份,使用电子分析天平准确称量粉碎至7目的全株小麦样品(3 g左右)和尼龙袋(孔径:50 μm,大小:8 cm×12 cm)的重量,并将样品放于尼龙袋内。将装有样品的尼龙袋固定在橡胶软塞上,然后放入尼龙网兜(长度约50 cm)内。
试验动物为3头健康的泌乳中期经产荷斯坦奶牛,体重500 kg左右,装有永久性瘤胃瘘管,平均产奶量25 kg/d。每天挤奶2次(06:30和18:30),饲喂2次(08:30和15:30),自由采食和饮水,饲粮组成见表 1。
|
|
表 1 饲粮组成(干物质基础) Table 1 Composition of the diet (DM basis) |
在晨饲前1 h将尼龙网兜放入瘤胃内,固定网兜另一端于奶牛瘤胃瘘管上。每个样品分成3份分别放入3头奶牛的瘤胃。根据测定所需样品残渣量,每隔相应时间取出一定数量的尼龙袋。样品的培养时间为2、4、8、12、24、48和72 h 7个时间点。每个时间点饲料样品设2个重复,每个尼龙袋中的样品为1个重复。样品取出后立即用清水冲洗尼龙袋至水清,冲洗过程中严格防止尼龙袋中残渣样品的逃逸。将冲洗干净的尼龙袋置于电热恒温烘箱内,65 ℃烘干样品至恒重,然后称重。测定分析残渣样品中的营养成分含量。每个品种的计算指标取各成熟期测定平均值。
1.3 降解率参数的计算根据t时间待测样品中目标成分的实时瘤胃降解率,使用SAS 8.2中的非线性回归程序和冯仰廉[5]提出的瘤胃降解率的指数曲线计算:
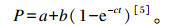
|
式中:P为t时间点(h)蛋白质的瘤胃降解率(%);a为快速降解部分(%);b为慢速降解部分(%);c为b的降解速率(%/h)。
1.4 有效降解率(effective degradability)的计算利用上述计算结果中a、b、c的值,计算待测样品目标成分的有效降解率,公式如下:
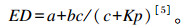
|
式中:ED为蛋白质有效降解率(%);Kp为瘤胃外流速度(%/h)。
其中瘤胃外流速率采用NRC(2001)中的预测方程计算:
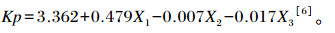
|
式中:Kp为瘤胃外流速度(%/h);X1为干物质采食量占试验动物体重的比例(%);X2为试验饲粮中精料所占的比例(%);X3为试验饲粮干物质中中性洗涤纤维(NDF)所占的比例(%)。
本试验中所用试验奶牛为中等体重的荷斯坦奶牛,干物质采食量占动物体重的3.4%,饲粮中精料含量为50%,饲粮干物质(DM)中NDF含量为25%,根据上述公式计算得到瘤胃外流速度Kp为4.2%/h。
1.5 饲料相对饲喂价值(relative feed value,RFV)的计算RFV是一种被广泛接受的饲料质量指标,在美国干草市场已经成为确定干草质量的常用工具。它是由美国饲草和草原理事会下属的干草市场特别工作组(Hay Marketing Task Force of the American Forage and Grassland Council)开发的,RFV是由酸性洗涤纤维(ADF)和NDF估算而来的,计算公式如下:
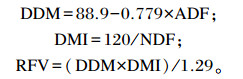
|
式中:DMI(dry matter intake)为粗饲料的干物质采食量,用占体重(BW)的百分比表示;DDM(digestible dry matter)为可消化干物质含量,用占DM的百分比表示;1.29是基于大量动物试验数据所预期的盛花期苜蓿DDM,以占体重的百分比表示,除以1.29,目的是使得盛花期的苜蓿RFV为100。
1.6 瘤胃和小肠指标的计算瘤胃和小肠指标的计算参考冯仰廉主编的《奶牛营养需要和饲料成分》[7]。
饲料瘤胃发酵产生的能量以瘤胃可发酵有机物(FOM)、可消化有机物(DOM)等形式表达,并影响瘤胃微生物蛋白质(MCP)产量。在我国的小肠蛋白质体系中,每千克FOM可支持合成136 g MCP(MCPE)。由瘤胃降解蛋白质(RDP)产量及其转化为MCP的效率计算饲料氮源可支持的MCP产量。两者的最小值即是MCP的理论产量(MCPN)。
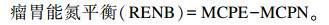
|
MCP(FOM)为根据FOM测算的MCP产量。MCP(RDP)为根据RDP测算的MCP产量。单个饲料和饲粮的RDP转化物为MCP的效率均按90%计算,即MCP=RDP×0.9。

|
瘤胃可降解饲料氮(RDN)转化为瘤胃微生物氮(MN)的效率可由RDN(g)与饲料FOM(kg)含量之比预测,公式为:

|
小肠蛋白质消化率:MCP消化率取0.7,饲料非降解蛋白质消化率取0.65。小肠可消化蛋白质的转化效率:生长奶牛取0.6,泌乳奶牛取0.7。
1.7 全株小麦样品及瘤胃降解残渣的测定DM含量测定参照GB 6435—1986的方法,粗蛋白质(CP)含量的测定参照GB/T 6432—1994的方法,粗灰分(Ash)含量的测定参照GB/T 6438—1986的方法,粗脂肪(EE)含量的测定参照GB/T 6433—2006的方法,NDF、ADF、酸性洗涤木质素(ADL)含量的测定参照Van Soest(1991)提出的方法;全株小麦样品的淀粉含量的测定使用蒽酮比色法,参考陈钧辉编著的《生物化学实验》。非纤维性碳水化合物(NFC)含量按以下公式计算:
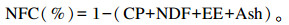
|
根据测定的CP、Ash、EE、NDF和ADF含量,参考法国国家农业研究院(INRA)(1978、1988、2000)的公式计算出总能(GE)、泌乳净能(NEL):
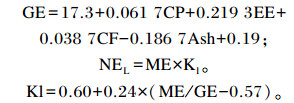
|
式中:CF为粗纤维含量;ME为代谢能。
1.8 数据统计分析测定结果使用Excel 2016进行预处理,然后使用SAS 8.2软件进行线性模型方差分析和多重比较。P<0.05表示差异显著,P>0.10表示差异不显著,0.05≤P≤0.10表示差异有显著趋势。
2 结果与分析 2.1 不同成熟阶段及品种对全株小麦营养成分的影响由表 2可知,随着小麦的成熟,全株小麦DM含量逐渐增加,而且增加速度逐渐加快,特别是在蜡熟期,全株小麦的DM含量显著增加(P<0.05)。全株小麦的CP含量在成熟过程中逐渐减少,拔节期最高,抽穗期和开花期显著减少(P<0.05),开花期后CP含量保持稳定。随着小麦的成熟,全株小麦的NDF、ADF和ADL含量都是呈现先增加后减少的趋势;NDF含量在抽穗期最高,而ADF和ADL含量在开花期最高。NFC含量变化呈现先减少后增加的趋势,而淀粉含量在开花期及以前保持稳定,开花期以后显著增加(P<0.05)。不同品种之间的营养成分无显著差异(P>0.10)。
|
|
表 2 不同成熟阶段及品种对全株小麦营养成分的影响 Table 2 Effects of different maturity stages and breeds on nutritional components of whole crop wheat |
由表 3可知,随着小麦的成熟,全株小麦单位DM的GE呈下降趋势。随着小麦的成熟,泌乳净能呈先下降后增加的趋势,抽穗期和开花期泌乳净能最低,显著低于其他各期(P<0.05);乳熟期和蜡熟期最高,显著高于其他各期(P<0.05)。随着小麦的成熟,单株小麦的DM产量增加,拔节期最低,显著低于其他各期(P<0.05);乳熟期和蜡熟期最高,显著高于其他各期(P<0.05)。全株小麦在拔节期有最高RFV,抽穗期和开花期显著降低(P<0.05),乳熟期和蜡熟期逐渐升高(P>0.05)。不同品种之间全株小麦的能量、产量和RFV无显著差异(P>0.10)。
|
|
表 3 不同成熟阶段及品种对全株小麦能量、产量和RFV的影响 Table 3 Effects of different maturity stages and breeds on energy, yield and RFV of whole crop wheat |
由表 4可知,不同成熟阶段显著影响全株小麦的瘤胃降解率(P<0.05)。DM、CP和NDF有效降解率在拔节期最高,抽穗期和开花期显著降低(P<0.05),乳熟期和蜡熟期又显著升高(P<0.05)。GE有效降解率呈现不规律性,拔节期最高,显著高于其他各期(P<0.05);抽穗期和蜡熟期最低,显著低于其他各期(P<0.05)。全株小麦在拔节期有较高的有机物质降解率,抽穗期和开花期显著降低(P<0.05),而在乳熟期和蜡熟期又显著增加(P<0.05)。
|
|
表 4 不同成熟阶段及品种对全株小麦瘤胃降解率特性的影响 Table 4 Effects of different maturity stages and breeds on characteristics of rumen degradation rate of whole crop wheat |
由表 5可知,全株小麦的RDP含量在拔节期最高,显著高于其他各期(P<0.05),抽穗期显著降低(P<0.05),开花期降至最低(P<0.05),开花期后逐渐升高(P>0.05);而瘤胃非降解蛋白质(RUP)的含量随着小麦的成熟逐渐下降,蜡熟期最低,显著低于其他各期(P<0.05)。根据FOM测算的MCP产量和根据RDP测算的MCP产量都呈现先降低后升高的趋势,但是前者的最高值在蜡熟期,后者的最高值在拔节期。瘤胃能氮平衡(RENB)在拔节期和抽穗期为负值,开花期以及开花期后为正值,且开花期最接近0。全株小麦的小肠蛋白质和小肠可消化蛋白质含量随着小麦的成熟逐渐降低,在拔节期最高,显著高于其他各期(P<0.05),蜡熟期最低。
|
|
表 5 不同成熟阶段及品种对全株小麦RDP和小肠蛋白质含量的影响 Table 5 Effects of different maturity stages and breeds on rumen degradation protein and small intestinal protein contents of whole crop wheat |
根据小麦籽粒形成的阶段和灌浆期小麦增重的特点,小麦自开花到成熟可以大致分为3个阶段:籽粒形成、灌浆增重和迅速脱水。小麦籽粒的形成过程决定了籽粒内胚乳细胞的数量,这和成熟后籽粒重量有着密切的联系。在籽粒形成期间,主要是籽粒体积的快速膨胀,小麦籽粒的含水量最高,DM的增加也慢。在小籽粒形成后,籽粒增重逐渐加快,进入灌浆增重的过程,这个过程会一直持续到小麦籽粒干重的最大值,在这个过程中小麦植株中的营养成分会快速地转移到小麦粒中。籽粒灌浆过程中,体积继续增大,增大至高峰后进入迅速脱水期,这个时期较短,水分快速散失,进入蜡熟期后,小麦植株叶片和茎干也会发黄,干枯,最后蜡熟末期至完熟期,全株小麦的DM含量会逐渐增加。Crovetto等[3]用孕穗期、开花期、乳熟期和蜡熟期小麦进行试验,发现小麦成熟度越高,DM含量越高;秦梦臻等[8]的研究也证明了随着成熟期全株小麦的含水量减少,也就是DM含量增加,这与本研究的结果一致。
随着小麦的成熟,全株小麦的CP含量降低,成熟阶段越晚,植株的光合作用越弱,抑制了蛋白质的合成。Throop[9]、秦梦臻等[8]、Crovetto等[3]和Xie等[4]的试验中也报道了植株的成熟会降低全株小麦的CP含量,但Oltjen等[10]报道,蜡熟期的全株小麦青贮比乳熟期的CP含量更高。
不同成熟阶段全株小麦纤维素类物质(NDF、ADF和ADL)含量不同。大量的研究表明,随着植株的成熟,牧草中细胞壁成分增加,纤维素类物质含量也会增加。在本试验中,纤维素类物质含量先增加后减少,开花期之后,乳熟期、蜡熟期有更低的纤维类物质含量,这可能是小麦籽粒形成后,在灌浆过程中,籽粒中淀粉不断沉积使纤维素含量相对下降。Crovetto等[3]报道了全株小麦的NDF和ADF含量在抽穗期至乳熟期相对稳定,在蜡熟期减少,而ADL含量逐渐增加。Xie等[4]的试验中发现,乳熟期的粗纤维(CF)、NDF和ADF含量显著低于开花期和蜡熟期。
NFC含量变化呈现先减少后增加的趋势,而淀粉含量在开花期及以前保持稳定,开花期后显著增加。这说明开花期以前全株小麦NFC中淀粉以外的糖类会减少,而开花后植株的大部分糖类转移到籽粒中以淀粉的形式存在。Beck等[11]用全株小麦调制成干草作为肉犊牛粗饲料,也发现蜡熟期的全株小麦比孕穗期有更高的NFC含量,而且在孕穗期,调制成干草比制成青贮饲料的全株小麦有更高的洗涤纤维含量,但NFC的含量较低,这可能是因为水溶性碳水化合物在固化过程中被消耗损失了,或通过美拉德反应并入到NDF中,又或者因为暴露在空气中流失了。而这种损失在小麦乳熟期和蜡熟期会变小,因为在成熟后期,大部分NFC以淀粉这种更稳定的形式存在于小麦籽粒中。
3.2 不同成熟阶段及品种对全株小麦能量、产量和RFV的影响饲料的GE是单位DM的饲料经过氧化燃烧后释放的热量,而碳、氢、氧的比例决定了有机物质的氧化程度,饲料GE的大小由其单位DM有机物质的含量和有机物质的碳、氢、氧比例确定。成熟过程中全株小麦单位DM的GE呈下降趋势,但是在每个阶段的能量都很高。Crovetto等[3]的试验中GE在各个阶段也都很高,并且随着小麦成熟逐渐减少,这与本试验的研究结果一致。特别的是,Crovetto等[3]的试验中GE高于本试验中的值,比INRA[12]报道的类似的成熟阶段还要高,这可能是由于地域差异或者测定方法不同造成的。
反刍动物对饲料能量的消化吸收和利用比单胃动物复杂的多,瘤胃微生物发酵、消化道的消化吸收和生产动物产品的器官的转化效率都会影响反刍动物对饲料能量的利用。而且奶牛对各种饲料的利用率的差异也很大。因此,奶牛饲料不能只用消化能或者代谢能来评定,还要用净能(NE)加以矫正。饲料的泌乳净能的评定方法比较复杂,一般是以一定数量有代表性的饲料的实测数据为基础,回归出泌乳净能和消化能或代谢能的关系,根据回归公式计算饲料的泌乳净能。本试验中全株小麦单位DM的泌乳净能在抽穗开花期最低,乳熟期和蜡熟期最高。这主要是因为在成熟后期,随着小麦淀粉的沉积,非纤维性的营养物质含量增加,纤维素类物质的含量下降,因为高NDF的饲料比低NDF饲料的净能含量低,所以乳熟期蜡熟期有较高的泌乳净能。
随着植株的成熟,单株DM产量增加,特别是在乳熟期和蜡熟期迅速增加,这主要来自植株生物产量的增加和营养成分的沉积。在此基础上计算出的亩产量很高,在实际收割全株小麦时是达不到的,因为小麦种子发芽率、收割时的留茬高度和调制时的损失都会影响实际的产量。本试验的结果与许多的研究结果相一致,Edmisten等[13]报道,蜡熟期阶段谷粒贡献了56%的小麦DM产量;Coblentz等[14]报告,蜡熟期和谷粒成熟期,小麦穗贡献了58%和60%的DM;Ashbell等[15]研究了以色列全麦产量的变化,结果表明,从乳熟期到蜡熟期DM产量的增加约为40%。这也说明,麦穗出现后,在籽粒灌浆过程中,小麦籽粒对牧草整体营养品质有相当大的贡献。
全株小麦在拔节期有最高的RFV,抽穗期和开花期降低,乳熟期和蜡熟期升高。Xie等[4]使用开花期、乳熟期和蜡熟期3个时期的全株小麦制作青贮饲料,乳熟期得到最高的RFV,其次是蜡熟期和开花期。本试验中,蜡熟期的RFV高于乳熟期,这与Xie等[4]的结果不一致,可能是全株小麦的调制方式不同造成的,全株小麦调制成青干草时,一些水溶性化合物会在固化中损失,或者经过美拉德反应并入到NDF中。而青贮时乳酸发酵会使饲料中的碳水化合物发酵成乳酸,乳酸发酵会引起养分的流失,一些可能性养分也会溶解到青贮中,这些都会导致饲料营养价值的变化。
本试验中,品种对全株小麦的营养成分没有影响。可能与本试验中所用的2个品系小麦的遗传特性相近有关。
3.3 不同成熟阶段及品种对全株小麦的瘤胃降解特性的影响DM降解率是影响反刍动物DM采食量的重要因素,粗饲料的DM在瘤胃中降解率随着降解时间的延长会不同程度地增加,但不同品质的粗饲料降解率的增加幅度存在差异。粗饲料中的纤维类物含量(纤维素含量和木质化程度等)会影响饲料的降解特性,一般来说,相比于NFC,纤维素的降解速率较慢,而木质素在瘤胃中很难被消化,不同牧草中的木质素还会与牧草中的其他营养成分结合,降低其他营养成分的降解率。随着小麦的生长,小麦的茎秆和叶片比例逐渐增大,叶片和茎秆老化,细胞壁成分增加,植株内的纤维素类成分的含量增加,降低各营养成分的降解速度,DM降解率就会降低。而小麦开始灌浆后,随着籽粒中淀粉的沉积,更多的营养物质转移到容易被降解的籽粒中,成熟后期淀粉含量增加,纤维素类物质所占的比重下降,会大大提高全株小麦的瘤胃降解率。
牧草中蛋白质在瘤胃中被微生物利用产生MCP,进入小肠被消化吸收。饲料中蛋白质发酵的难易程度和在瘤胃中的滞留时间决定了其在瘤胃中的降解率[16]。牧草中蛋白质主要是含氮化合物,存在于细胞内容物中,而细胞壁中纤维素的结构影响蛋白质的降解速度,随着植物的成熟老化,木质化程度加深也会影响氮的释放和分解。饲料中的蛋白质可分为快速降解、慢速降解和不易降解3部分,不同饲料各部分所占的比例不同,回归公式中a、b、c的值即表示这3部分的含量。不同成熟阶段的全株小麦不易降解部分的含量很少,说明全株小麦中的绝大部分蛋白质都能在瘤胃中降解。从试验结果可以看出,全株小麦的CP瘤胃有效降解率受成熟阶段的影响很大。刘大林等[17]研究认为,牧草CP含量高有利于CP的降解,在本试验中,成熟过程中全株小麦的CP含量是逐渐降低的,而CP的有效降解率呈先降低后增高的趋势,也就是说,全株小麦开花前的CP有效降解率与刘大林等[17]的研究结果一致,在开花期后的CP有效降解率与之相反。这主要是因为开花期后,植株中大部分的蛋白质成分转移到小麦籽粒中去,小麦籽粒中纤维类物质含量和木质化程度很低,更容易被降解。
粗饲料中NDF的瘤胃降解率是评定粗饲料品质的重要指标之一。饲粮中的NDF在维持反刍动物正常反刍和瘤胃健康中发挥着重要作用。NDF的组成不同,会影响NDF瘤胃降解率,所以不同饲料原料的NDF在瘤胃中的降解率不同。随着植株的成熟,叶片与茎的比率和茎的木质化程度(影响纤维的消化率)会发生改变,从而影响干草的纤维消化率和蛋白质组分[18-19]。木质素影响牧草纤维消化的程度和速度[20-22],其影响程度取决于木质素的含量和组成[23-24]、组织分布[23]和酚类的功能[25-26]。木质素,因其特有的酚类成分,不能在厌氧条件下消化,并能减少牧草中潜在可消化纤维的比例[27]。因此本试验中,全株小麦的NDF有效降解率在拔节期最高,随着小麦的成熟NDF有效降解率下降,虽然乳熟期的NDF有效降解率显著低于拔节期和抽穗期,但是显著高于蜡熟期。这可能是因为蜡熟期小麦已经变得枯黄,木质化程度升高,小麦粒也开始发黄变硬,可能会潜在地降低NDF有效降解率。
全株小麦的GE有效降解率随着成熟度的变化与NDF含量相似,这也说明NDF的含量会影响瘤胃中饲料中能量的降解。
饲料在反刍动物瘤胃中的发酵产物和小肠中的消化产物是不同的,而且许多研究表明瘤胃FOM产量与瘤胃发酵产生的挥发性脂肪酸(VFA)以及MCP的产量呈正比[28],因此饲料中有机物质在瘤胃中的降解率(FOM/OM)是评定饲料品质的重要参数。本试验中,全株小麦在拔节期有较高的有机物质降解率,抽穗开花期降低,而乳熟期和蜡熟期又显著增加。这说明灌浆后全株小麦本身有机物质会变得更加容易降解,这可能因为在开花期后小麦进入灌浆期,植株中的养分逐渐向小麦籽粒中转移,籽粒和籽粒中的养分特别是非纤维性的营养成分在整个植株DM中所占的比例逐渐增加,这也印证了姜军等[29]和徐萍等[30]的研究。姜军等[29]和徐萍等[30]的研究表明,瘤胃表观有机物质降解量随着饲粮中精料含量的增加而增加,精料含量增多时,全消化道有机物表观消化率也会增加。但是,也有研究表明瘤胃有机物质和全消化道有机物的表观消化率不受饲粮有机物质含量的影响[31-33];灌浆后全株小麦有机物会变得更加容易降解,也有可能是因为籽粒中的淀粉等容易被降解的营养物质在瘤胃中降解,可以为瘤胃微生物生长提供能量。Russell等[34]的研究认为,瘤胃微生物的生长随着碳水化合物的发酵速度升高而加快,大量生长的瘤胃微生物又可以反过来分解更多的有机物。
3.4 不同成熟阶段及品种对全株小麦RDP和小肠蛋白质含量的影响随着对反刍动物蛋白质营养的深入研究,传统的蛋白质体系已经不能完全解释反刍动物对蛋白质的消化代谢。饲粮中蛋白质经过反刍动物的瘤胃的降解后才进入小肠,此时蛋白质结构和数量已经发生改变,进入小肠中的蛋白质包括饲粮非降解蛋白质和瘤胃MCP,如果考虑瘤胃微生物对饲粮蛋白质的降解和利用,就要以小肠蛋白质体系来评价饲粮的蛋白质营养。
饲粮中的蛋白质在瘤胃中的降解是影响反刍动物瘤胃发酵的重要因素之一,按照功能不同可以分为RDP和RUP 2部分,RDP为瘤胃微生物的生长和MCP的合成提供必需的肽、氨基酸和氨等,而RUP不经过瘤胃降解,或者经瘤胃微生物分解但未利用,直接进入小肠,在小肠中与MCP一起被消化吸收,是反刍动物吸收利用蛋白质类营养物质的重要途径之一。有研究表明,奶牛对蛋白质营养需要量的60%由RDP提供,40%由RUP提供[35]。控制反刍动物饲粮合理的RDP与RUP的比例,既能满足瘤胃微生物降解的需要又能使宿主得到充足的小肠氨基酸(RUP可以为小肠利用提供氨基酸,是小肠氨基酸来源的第二大途径)。拔节期的全株小麦RDP和RUP含量都很高,说明此生长阶段的全株小麦中蛋白质含量较高,而且瘤胃微生物可以利用的蛋白质和不可利用的蛋白质含量都很高;在小麦成熟后期,RDP的含量增加,而RUP的含量减少,说明全株小麦蛋白质组分中可被瘤胃微生物降解利用的部分增加,不被瘤胃微生物利用直接进入小肠的蛋白质组分减少。
不同饲料的RDP含量不同,会造成瘤胃MCP的合成数量存在差异。高蛋白质饲料比高能量饲料的RDP含量高,以RDP评定出的瘤胃MCP合成量就高,但用高能量饲料以FOM评定出的MCP合成量也很高。因此用RENB的原理来评价饲粮,才可以同时满足瘤胃微生物对RDP和FOM的需要,使饲粮的配合更加合理。如果饲粮的RENB值为0,表明平衡良好;如果饲粮的RENB值为负值,表明瘤胃RDP富余,能量(FOM)不足,应增加瘤胃中的RDP;如果饲粮RENB值为正值,表明瘤胃RDP不足,能量(FOM)有富余,应增加瘤胃中的能量(FOM)。本试验结果表明,开花期前,全株小麦的RDP充足,FOM不足,开花后则相反,在开花期,RENB值接近0,能氮平衡良好。与能氮平衡的结果相对应,在RDP富余的成熟阶段(拔节期和抽穗期,RENB<0),小肠蛋白质和小肠可消化蛋白质的含量很高,FOM富余的成熟阶段(开花期、乳熟期和蜡熟期,RENB>0)小肠蛋白质和小肠可消化蛋白质的含量降低,但是在这些阶段可降解的能量很高,能量有富余。
4 结论① 不同品系全株小麦的差异较小,仅在几个指标中有显著差异,而且每个成熟阶段的全株小麦饲养价值都很高,但是不同成熟阶段的全株小麦的营养价值、产量和瘤胃降解特性存在显著的差异。
② 从营养价值和瘤胃降解特性来看,拔节期、乳熟期、蜡熟期均优于抽穗开花期,而且乳熟期、蜡熟期有更高的DM产量。在华北地区,提前收割小麦可以减免病虫害和恶劣天气的风险,并且对下一季玉米的种植和产量有利。
| [1] |
ADAMSON A H, REEVE A. Nutritional evaluation of whole-crop wheat[C]//STARK B A, WILKINSON J M. Whole-crop cereals. Aberystwyth: Chalcombe Publication, 1992: 85-96.
|
| [2] |
ARIELI A, ADIN G. Effect of wheat silage maturity on digestion and milk yield in dairy cows[J]. Journal of Dairy Science, 1994, 77(1): 237-243. DOI:10.3168/jds.S0022-0302(94)76946-0 |
| [3] |
CROVETTO G M, GALASSI G, RAPETTI L, et al. Effect of the stage of maturity on the nutritive value of whole crop wheat silage[J]. Livestock Production Science, 1998, 55(1): 21-32. DOI:10.1016/S0301-6226(98)00125-0 |
| [4] |
XIE Z L, ZHANG T F, CHEN X Z, et al. Effects of maturity stages on the nutritive composition and silage quality of whole crop wheat[J]. Asian-Australasian Journal of Animal Sciences, 2012, 25(10): 1374-1380. DOI:10.5713/ajas.2012.12084 |
| [5] |
冯仰廉. 反刍动物营养学[M]. 北京: 科学出版社, 2004.
|
| [6] |
(美)国家科学研究委员会. 奶牛营养需要[M]. 孟庆翔, 译. 北京: 中国农业大学出版社, 2002.
|
| [7] |
冯仰廉. 奶牛营养需要和饲料成分[M]. 3版. 北京: 中国农业出版社, 2007.
|
| [8] |
秦梦臻, 沈益新. 生育期对小麦全株青贮发酵品质的影响[J]. 中国农业科学, 2012, 45(8): 1661-1666. |
| [9] |
THROOP H L. Nitrogen deposition and herbivory affect biomass production and allocation in an annual plant[J]. OIKOS, 2005, 111(1): 91-100. DOI:10.1111/oik.2005.111.issue-1 |
| [10] |
OLTJEN J W, BOLSEN K K BOLSEN. Wheat, barley, oat, and corn silages for growing steers[J]. Journal of Animal Science, 1980, 51(4): 958-965. DOI:10.2527/jas1980.514958x |
| [11] |
BECK P A, STEWART C B, GRAY H C, et al. Effect of wheat forage maturity and preservation method on forage chemical composition and performance of growing calves fed mixed diets[J]. Journal of Animal Science, 2009, 87(12): 4133-4142. DOI:10.2527/jas.2009-2184 |
| [12] |
INRA. Alimentation des bovins, ovins et caprins[M]. Paris: INRA, 1988: 476.
|
| [13] |
EDMISTEN K L, GREEN J T, Jr, MUELLER J P, et al. Winter annual small grain forage potential:Ⅱ.Quantification of nutritive characteristics of four small grain species at six growth stages[J]. Communications in Soil Science and Plant Analysis, 1998, 26(7/8): 881-899. |
| [14] |
COBLENTZ W K, COFFEY K, PTURNER J E, et al. Effect of maturity on degradation kinetics of sod-seeded cereal grain forage grown in Northern Arkansas[J]. Journal of Dairy Science, 2000, 83(11): 2499-2511. DOI:10.3168/jds.S0022-0302(00)75142-3 |
| [15] |
ASHBELL G, WEINBERG Z G, HEN Y. Interactions between wheat and vetch during co-ensiling[J]. Meshek Habakar Vehachalav, 1997, 272: 20-22. |
| [16] |
刁其玉, 屠焰. 奶牛常用饲料蛋白质在瘤胃的降解参数[J]. 乳业科学与技术, 2005, 27(2): 70-74. |
| [17] |
刘大林, 赵国琦, 王学峰, 等. 豆科与禾本科牧草在山羊瘤胃内的降解率比较试验[J]. 四川畜牧兽医, 2000, 27(3): 19-21. |
| [18] |
WEIR W C, JONES L G, MEYER J H. Effect of cutting interval and stage of maturity on the digestibility and yield of alfalfa[J]. Journal of Animal Science, 1960, 19(1): 5-19. DOI:10.2527/jas1960.1915 |
| [19] |
YU P, CHRISTENSEN D A, MCKINNON J J, et al. Effect of variety and maturity stage on chemical composition, carbohydrate and protein subfractions, in vitro rumen degradability and energy values of timothy and alfalfa[J]. Canadian Journal of Animal Science, 2003, 83(2): 279-290. DOI:10.4141/A02-053 |
| [20] |
ALBRECHT K A, WEDIN W F, BUXTON D R. Cell-wall composition and digestibility of alfalfa stems and leaves[J]. Crop Science, 1987, 27(4): 735-741. DOI:10.2135/cropsci1987.0011183X002700040027x |
| [21] |
VAN SOEST P J. Nutritional ecology of the ruminant[M]. 2nd ed. Ithaca, NY: Cornell University Press, 1994.
|
| [22] |
SEWALT V J H, NI W T, JUNG H G, et al. Lignin impact on fiber degradation:increased enzymatic digestibility of genetically engineered tobacco (Nicotiana tabacum) stems reduced in lignin content[J]. Journal of Agricultural & Food Chemistry, 1997, 45(5): 1977-1983. |
| [23] |
BUXTON D R, RUSSELL J R. Lignin constituents and cell-wall digestibility of grass and legume stems[J]. Crop Science, 1988, 28(3): 553-558. DOI:10.2135/cropsci1988.0011183X002800030026x |
| [24] |
BUXTON D R, BRASCHE M R. Digestibility of structural carbohydrates in cool-season grass and legume forages[J]. Crop Science, 1991, 31(5): 1338-1345. DOI:10.2135/cropsci1991.0011183X003100050052x |
| [25] |
AKIN D E. Histological and physical factors affecting digestibility of forages[J]. Agronomy Journal, 1989, 81(1): 17-25. DOI:10.2134/agronj1989.00021962008100010004x |
| [26] |
SEWALT V J H, GLASSER W G, BEAUCHEMIN K A. Lignin impact on fiber degradation.3.Reversal of inhibition of enzymatic hydrolysis by chemical modification of lignin and by additives[J]. Journal of Agricultural and Food Chemisitry, 1997, 45(5): 1823-1828. DOI:10.1021/jf9608074 |
| [27] |
JUNG H G, ALLEN M S. Characteristics of plant cell walls affecting intake and digestibility of forages by ruminants[J]. Journal of Animal Science, 1995, 73(9): 2774-2790. DOI:10.2527/1995.7392774x |
| [28] |
冯仰廉. 肉牛营养需要和饲养标准[M]. 北京: 中国农业大学出版社, 2000: 7-10.
|
| [29] |
姜军, 莫放, 高博, 等. 日粮蛋白质补充料来源对肉牛消化道营养物质流量和表观消化率的影响[J]. 中国农学通报, 2008, 24(3): 9-14. |
| [30] |
徐萍, 莫放, 陈瑶, 等. 日粮精料进食水平对肉牛消化道营养物质流量和表观消化率的影响[J]. 中国草食动物, 2007, 27(4): 12-15. |
| [31] |
BRODERICK G A. Effects of varying dietary protein and energy levels on the production of lactating dairy cows[J]. Journal of Dairy Science, 2003, 86(4): 1370-1381. DOI:10.3168/jds.S0022-0302(03)73721-7 |
| [32] |
ROTGER A, FERRET A, CALSAMIGLIA S, et al. Effects of nonstructural carbohydrates and protein sources on intake, apparent total tract digestibility, and ruminal metabolism in vivo and in vitro with high-concentrate beef cattle diets[J]. Journal of Animal Science, 2006, 84(5): 1188-1196. DOI:10.2527/2006.8451188x |
| [33] |
IVAN S K, GRANT R J, WEAKLEY D, et al. Comparison of a corn silage hybrid with high cell-wall content and digestibility with a hybrid of lower cell-wall content on performance of holstein cows[J]. Journal of Dairy Science, 2005, 88(1): 244-254. DOI:10.3168/jds.S0022-0302(05)72682-5 |
| [34] |
RUSSELL A D. Mycobactericidal agents[C]//RUSSELL A D, HUGO W B, AYLIFFE G A J. Principles and practice of disinfection, preservation and sterilization. 2nd ed. Oxford: Blackwell Scientific, 1992: 246253.
|
| [35] |
杨效民, 李军, 闫春轩, 等. 奶牛瘤胃非降解蛋白质日粮应用研究[J]. 山西农业科学, 1997, 25(4): 80-83. |




