2. 中国农业科学院北京畜牧兽医研究所, 北京 100193
2. Beijing Institute of Animal Science and Veterinary Medicine, Chinese Academy of Agricultural Sciences, Beijing 100193, China
对于奶牛乳腺炎症,特别是亚临床乳腺炎的诊断通常是基于体细胞数(SCC)和细菌学检查。SCC是基于牛奶中细胞总数量对炎症进行度量。细菌学检查虽然可以指出感染的确切病因,但是耗时且需要经验丰富的人员操作。现已经提出聚合酶链反应作为细菌学检查的替代方法,检测快速,但费用昂贵[1]。已有大量文献对区分感染和未感染乳腺的几种不同SCC临界值进行了评估和讨论[2]。欧盟规定奶牛健康乳腺的SCC<200 000个/mL,而德国兽医协会(DVG)建议将SCC阈值定为100 000个/mL[3-4]。我国的生鲜奶收奶标准为SCC<400 000个/mL[5]。不同的地域环境、自然气候对SCC影响较大,且SCC会因哺乳期的状况、年龄、挤奶的时间和频率,特别是乳腺感染状态而随时发生变化[6]。因此,需要更为敏感的炎症指示物来加强奶牛场乳腺炎的管理。最近有几项研究揭示了鉴别牛奶中免疫细胞在诊断奶牛乳腺炎症中的优势。Loken等[7]研究表明,除了SCC的确定外,体细胞的分型更有利于对奶牛乳腺的实际健康状况进行更详细的描述。在乳腺中,乳免疫细胞的数量和分布在乳腺内的炎症反应中起重要作用。淋巴细胞调节免疫反应的诱导和抑制,通过入侵病原体的特异性生物膜受体识别抗原。巨噬细胞能够摄取细菌、细胞碎片和残留乳成分。多形核嗜中性白细胞(PMN)的主要任务是在急性炎症过程开始时抵御入侵细菌。然而每种细胞类型的比例随炎症程度不同变化很大。Auldist等[8-9]研究表明,在健康牛奶中,巨噬细胞是主要的细胞类型,淋巴细胞是健康乳腺内的主要细胞群体。不同的细胞分型技术对体细胞分型结果会造成一定的影响。Bannerman等[10]研究了不同病原体感染以及不同感染过程中的细胞模式。结果表明,以金黄色葡萄球菌(Staphylococcus aureus)为主的病原体引起的急性炎症乳腺中,PMN是主要的细胞类型,占乳腺总白细胞总数的90%。相比之下,在由凝固酶阴性葡萄球菌(CNS)引起的慢性乳腺炎中,PMN数量甚至低于未感染乳区,而巨噬细胞数量较高。乳腺健康程度与泌乳性能有密切联系,不同的病原体在乳腺中引起不同的免疫应答。根据病因,在SCC变化趋势和乳成分中都能观察到明显差异。尽管有关SCC与乳成分间关联的文献很丰富,但很少有研究涉及乳腺炎特定病原体与乳成分变化之间的关系。因此,本试验通过研究不同牛奶SCC下牛奶体细胞分型特点,进而对奶牛乳腺健康状况以及奶牛泌乳性能做出更详细的评估。
1 材料与方法 1.1 试验动物与样品采集本试验采用的牛奶样品采集自北京诚远盛隆养殖有限责任公司的荷斯坦奶牛。排除具有明显临床症状的奶牛(例如子宫炎、临床乳腺炎、腹部置换、子宫脱垂、乳热、临床酮症)。选择102头临床健康荷斯坦奶牛[胎次(2~3胎)、泌乳天数(152±27) d、产奶量(27±3) kg/d],收集牛奶样品。收集时间为2017年6月5日,共挤奶2次,分别为08:00和19:00。采集牛奶样品前,对乳腺外部进行药浴消毒,用单独的毛巾擦拭清洗,然后再次用酒精清洗。弃去头3把奶后,将约50 mL来自每头奶牛4个乳区的牛奶样品混合收集在无菌管中,随后将牛奶样品分装成3个子样品,分别用于牛奶体细胞分型、细菌学检查及乳成分检测,最后将所有样品储存于-80 ℃冰箱中。
1.2 试验材料 1.2.1 主要仪器流式细胞仪(NovoCyte 3130,美国ACEA公司)、微量加样器和加样头、流式上样管、15 mL离心管、离心机、乳成分分析仪(Fossomatic 5000、Milkoscan FT6000,丹麦FOSS公司)、恒温培养箱[(36±1) ℃、(30±1) ℃]、冰箱(-80 ℃、2~5 ℃)、恒温水浴锅[(46±1) ℃]、电子天平(精度0.01 g)、微量移液器、无菌锥形瓶(250和500 mL)、无菌培养皿(直径90 mm)、pH计(精度0.01)、菌落计数器。
1.2.2 主要试剂体细胞分型检测所用试剂:Anti-CD11b抗体(货号:ab75476);Anti-CD14抗体[Tuk4](货号:ab27545);Anti-mouse IgG (H+L), F(ab’)2 Fragment (Alexa Fluor® 488 Conjugate);Anti-rabbit IgG (H+L), F(ab’)2 Fragment (Alexa Fluor® 647 Conjugate)。细菌分离鉴定所用试剂:胰蛋白胨、酵母浸膏、葡萄糖、琼脂、蒸馏水、食盐。
1.3 测定指标与方法 1.3.1 牛奶SCC及乳成分使用乳成分分析仪(Fossomatic 5000,丹麦FOSS公司)测定SCC。使用乳成分分析仪(Milkoscan FT6000,丹麦FOSS公司)在24 h内测定乳脂、乳蛋白、乳糖、酪蛋白和尿素氮含量,采用脱脂乳通过反相-高效液相色谱(RP-HPLC)法测定乳蛋白组分含量[11]。
1.3.2 牛奶体细胞分型使用流式细胞仪进行体细胞分型。取14 mL的牛奶加入15 mL的离心管中;690×g离心10 min。离心后,去掉上层的乳脂,然后弃掉上清。在离心管底加入1 mL的磷酸盐缓冲液(PBS),转移到新的15 mL离心管中,并在离心管中加10 mL PBS,混匀,690×g离心10 min,弃掉上清;重复3次。细胞重悬在1 mL的PBS中。取400 μL细胞悬液于5 mL流式管1中,进行细胞计数。取100 μL细胞悬液于5 mL流式管2中,加入10 μL碘化丙啶(PI),进行活性检测[12]。
1.3.3 牛奶菌落总数测定分别称取5.0 g胰蛋白胨、2.5 g酵母浸膏、1.0 g葡萄糖和15 g琼脂,溶于1 000 mL蒸馏水中,调节pH至7.0±0.2,煮沸溶解,分装于锥形瓶中,121 ℃高压蒸汽灭菌15 min,用以制备琼脂培养基。称取8.5 g食盐,溶于1 000 mL蒸馏水中,121 ℃高压蒸汽灭菌15 min,用以制备无菌生理盐水。用无菌微量移液器吸取1 mL牛奶样品置于盛有9 mL无菌生理盐水试管中,充分混匀,制成1:10的样品匀液。用微量移液枪吸取1 mL 1:10的样品匀液,缓慢注入盛有9 mL的无菌生理盐水的无菌试管中,振荡混匀,制成1:100的样品匀液。按此方法,制备10倍系列稀释样品匀液,共制备4个稀释梯度,分别为1:10、1:100、1:1 000、1:10 000。在制备10倍递增稀释液时,吸取500 μL样品匀液于无菌琼脂平皿内,每个稀释梯度做2个平皿。同时,分别吸取500 μL空白稀释液加入2个无菌琼脂平皿内作为空白对照。待琼脂平板冷却凝固后,将平板翻转并封口,在恒温培养箱(36±1) ℃培养48 h[13]。参照GB 4789.2—2010《食品安全国家标准食品微生物学检验菌落总数测定》统计菌落总数,菌落总数的计算公式为:
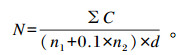
|
式中:N为菌落总数(个);C为每个稀释度的菌落数(个);n为每个稀释度的平行次数;d为稀释因子(第1稀释度)。
1.3.4 牛奶细菌学检查将每个牛奶样品10 μL涂布到含有5%脱纤维蛋白绵羊血液的血琼脂上。将平板在(37±1) ℃下有氧培养并在24和48 h后检查。根据国家乳腺炎委员会指南(NMC,1999)鉴定细菌,其中包括形态学、革兰氏染色、过氧化氢酶和凝固酶反应、氧化酶反应、生化特性和溶血模式。革兰阳性细菌通过过氧化氢酶反应划分为葡萄球菌和链球菌。使用兔血浆中的凝固酶试管用于区分将金黄色葡萄球菌与CNS。通过氧化酶测试以及麦康凯琼脂和曙红亚甲基蓝琼脂上的生长特征鉴定革兰氏阴性细菌[14]。
1.4 统计分析使用Excel 2007对初始数据进行整理和可视化。使用graPhPad Prism 6.01进行图表数据统计分析,计算Pearson相关系数(r)。使用SAS 9.2中的MIXED程序分析体细胞分型与SCC、亚临床乳腺炎特异性病原体以及乳成分之间的关联。使用one-way ANOVE法进行单因素方差分析,试用Duncan氏法进行平均值的多重比较,P<0.05为差异显著判定标准,P<0.01为差异极显著判定标准。
2 结果与分析 2.1 牛奶中的SCC及体细胞分型由表 1和表 2可知,102份牛奶样品中,SCC的平均值为351 720个/mL,其中有44份牛奶样品SCC<100 000个/mL,划分为低SCC组;有28份牛奶样品SCC在100 000~400 000个/mL,为中等SCC组;有30份牛奶样品SCC>400 000个/mL,为高SCC组。由表 2可知,在102份牛奶样品中,牛奶SCC为13 000~1 024 000个/mL,其中PMN的比例在4.48%~87.29%[(39.76±32.44)%]变化;淋巴细胞比例在3.37%~91.07%[(48.50±23.39)%]变化;巨噬细胞比例在2.37%~55.71%[(21.74±12.07)%]变化。
|
|
表 1 牛奶样品中的SCC Table 1 SCC in milk samples (n=102) |
|
|
表 2 牛奶样品中体细胞类型分布 Table 2 Distribution of somatic cell types in milk samples (n=102) |
在体细胞群体中存在广泛的细胞变异,特别是淋巴细胞和PMN。因此,试验分析了体细胞分型与SCC的相关性。由图 1-a可知,SCC<200 000个/mL时,PMN比例较低,仅为27.4%,随SCC的增加PMN比例显著增加,当SCC>400 000个/mL时,PMN比例高达87.29%,是炎症牛奶样品中的主要细胞群体;由图 1-b可知,当SCC<200 000个/mL,淋巴细胞为主要的细胞群体,比例高达91.07%,随SCC的增加淋巴细胞比例显著减少;由图 1-c可知,巨噬细胞的比例在2.37%~55.71%,并且随着SCC的增加,巨噬细胞比例并没有出现与SCC有较强的相关性(r=-0.167 2,P>0.05)。
|
图 1 牛奶样品中多形核嗜中性白细胞(a)、淋巴细胞(b)及巨噬细胞(c)的比例 Figure 1 The ratios of PMN (a), lymphocyte (b) and macrophage (c) in milk samples (n=102) |
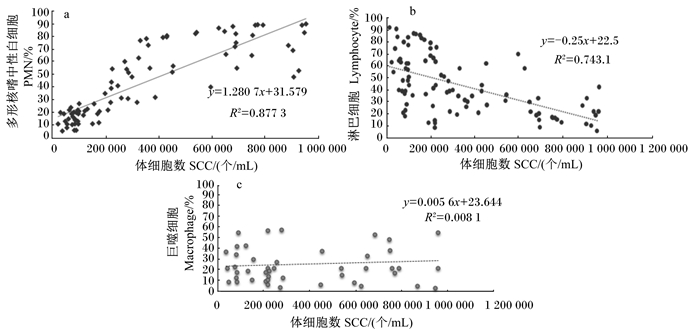
为了测试奶牛健康乳腺内免疫学状态是否有统计学差异,将所有SCC<100 000个/mL的牛奶样品根据SCC分为4组,Ⅰ组SCC为13 000~34 000个/mL,共9个样品,Ⅱ组SCC为34 000~55 000个/mL,共11个样品;Ⅲ组SCC为55 000~76 000个/ mL,共10个样品;Ⅳ组SCC为76 000~100 000个/ mL,共14个样品。
由图 2可知,在健康乳腺内,随着牛奶SCC升高,淋巴细胞比例降低,PMN比例升高。Ⅰ~Ⅲ组淋巴细胞比例(59.35%~81.26%)极显著高于Ⅳ组(22.17%)(P<0.01)。4组之间巨噬细胞比例无显著差异(19.15%~32.13%)(P>0.05)。Ⅰ~Ⅲ组的PMN比例(19.17%~31.22%)差异并不显著(P>0.05),但均极显著低于Ⅳ组(82.68%)(P<0.01)。
|
**表示差异极显著(P<0.01);*表示差异显著(P<0.05);NS表示差异不显著(P>0.05)。下图同。 ** indicated significant difference (P < 0.01);* indicated significant difference (P < 0.05);NS indicated no significant difference (P > 0.05). The same as below. 图 2 健康乳腺牛奶SCC范围(≤100 000个/mL)内体细胞分型的比较 Figure 2 Comparison of differential cell counts within the SCC range of healthy mammary glands (SCC≤100 000 cells/mL) |
由表 3可知,牛奶样品中的不同SCC之间,菌落总数差异较大。SCC<100 000个/ mL的牛奶样品中,菌落总数只有8.08×104 CFU/mL;在100 000~400 000个/mL的牛奶样品,其菌落总数达到46.04×104 CFU/mL;当SCC>400 000个/ mL时,菌落总数急剧上升,已高达94.95×104 CFU/mL。但各SCC牛奶样品的菌落总数各均在正常范围内。
|
|
表 3 牛奶样品中的菌落总数 Table 3 Total number of colonies in milk samples (n=102) |
试验检测的102份牛奶样品中,有13.72%的样品为细菌培养阴性,83.34%为培养阳性,有3个样品受到污染。根据引起奶牛乳腺炎病原体的传播特点,将分离鉴定的细菌分类为传染型、环境型和机会型病原体。由表 4可知,在培养阳性的牛奶样品中,分离出的机会型病原体为CNS(占总样品的34.32%,占培养阳性样品的39.77%)。而感染CNS的牛奶样品中平均SCC为71 850个/mL;分离出的传染型病原体(占总样品的27.45%,占培养阳性样品的31.81%)中金黄色葡萄球菌和无乳链球菌(Streptococcus agalactiae)是最主要的病原体,感染传染型病原体的牛奶样品平均SCC为824 280个/mL。环境型病原体(占总样品的21.57%;占培养阳性样品的25.00%)包括变形菌属(Proteus spp.)、绿脓杆菌(Pseudomonas aeruginosa)、肺炎克雷伯菌(Klebsiella spp.)、芽孢杆菌(Bacillus spp.)、大肠杆菌(Escherichia coli)、乳酸乳球菌(Lactococcus lactis)等,环境型病原体平均SCC为338 670个/mL。
|
|
表 4 牛奶样品中的细菌鉴定及分类 Table 4 Identification and classification of bacteria in milk samples |
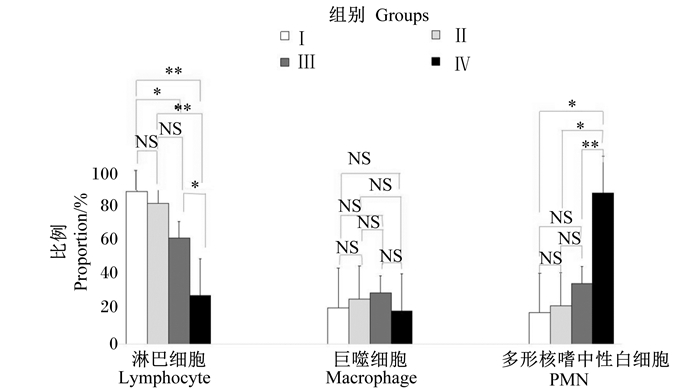
根据牛奶样品中检测到的不同乳腺炎病原体,分析了不同乳腺炎病原体状态下的体细胞分型。将102份牛奶样品分为3组:无病原体组、次要病原体组和主要病原体组。在102份牛奶样品中有14个(13.72%)没有检测到病原体,即细菌培养阴性。在47个样品(46.07%)中分离出主要病原体(如CNS、金黄色萄球菌、大肠杆菌、无乳链球菌),而在24个样品(23.53%)中检测到次要的病原体(如芽孢杆菌、绿农芽孢杆菌、肺炎克雷伯菌)。
由图 3可知,与主要病原体组牛奶样品(31.45%)相比,无病原体组的牛奶样品中淋巴细胞比例(59.48%)极显著升高(P<0.01),是健康乳腺的主要细胞群体。牛奶样品中巨噬细胞的比例(21.03%)没有与病原体状态呈现显著相关性(P>0.05)。主要病原体组的牛奶样品中PMN比例(48.93%)极显著高于无病原体组(17.23%)(P<0.01),显著高于次要病原体组(P<0.05)。
|
图 3 不同病原体状态下牛奶样品中体细胞分型比较 Figure 3 Comparison of somatic cell types in milk samples under different bacterial states |
虽然培养阴性样品只有13.72%,但其平均SCC>200 000个/mL(表 4),因此对细菌培养阴性的14个牛奶样品进行进一步的体细胞分型比较,根据SCC将其分为3组,即培养阴性-H组(无病原体生长且高SCC,SCC>400 000个/mL)(4个)、培养阴性-M组(无病原体生长且中等SCC,SCC 100 000~400 000个/mL)(5个)以及培养阴性-L组(无病原体生长且低SCC,SCC<100 000个/mL)(5个)。
由图 4可知,在培养阴性-L组中,淋巴细胞为优势细胞群体,比例显著高于培养阴性-M组(P<0.05),极显著高于培养阴性-H组(P<0.01)。巨噬细胞比例在培养阴性-L组和培养阴性-H组中分别为53.1%和48.72%,而培养阴性-M组显著低于其他2组(P<0.05)。PMN是培养阴性-H组和培养阴性-M组的主要细胞群体(72.48%、61.32%),培养阴性-L组显著或极显著低于其他2组(P<0.05或P<0.01)。
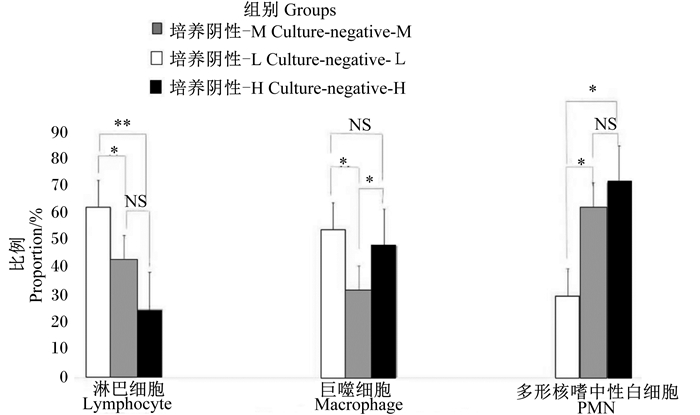
|
图 4 培养阴性牛奶样品中体细胞分型比较 Figure 4 Comparison of somatic cell types in culture-negative milk samples |
由表 5可知,产奶量为26.92 kg/d,变异性较大,变异系数(CV)为36.87%。在对乳成分的分析中发现,酪蛋白/乳蛋白是变异性最小的,CV为1.60%。通过RP-HPLC分析确定的详细乳蛋白组分的CV都在15.80%~26.20%波动,乳铁蛋白除外(CV为53.50%)。
|
|
表 5 产奶量、乳成分及乳蛋白成分分析 Table 5 Analysis of milk production, milk composition and milk protein composition |
由表 6可知,与健康组相比,细菌培养阳性(传染型、环境型和机会型病原体组)和培养阴性(培养阴性-L组、培养阴性-M组、培养阴性-H组)都对产奶量、乳成分及乳蛋白组分有不同程度的影响。与健康组相比,细菌培养阳性的牛奶样品中,传染型病原体危害最大;感染传染型病原体的奶牛,产奶量显著下降(P<0.05),酪蛋白/乳蛋白及乳糖含量显著减少(P<0.05);对乳蛋白组分的也造成了不利影响,其中,乳蛋白、酪蛋白、αs1-酪蛋白及β-酪蛋白含量有所下降,但差异不显著(P>0.05)。环境型病原体对β-酪蛋白含量的影响较大,使其显著减少(P<0.05)。
|
|
表 6 奶牛乳腺健康状况与产奶量、乳成分及乳蛋白组分的关系 Table 6 Relationship between breast health status and milk yield, milk composition and protein composition of dairy cows |
与健康组相比,在培养阴性(培养阴性-L组、培养阴性-H组、培养阴性-M组)牛奶样品中产奶量略有下降,但变化不显著(P<0.05);培养阴性-H组、培养阴性M组乳糖含量的显著降低(P<0.05),培养阴性-H组酪蛋白/乳蛋白显著降低(P<0.05),培养阴性-H组pH显著升高(P<0.05);对于乳蛋白组分而言,培养阴性-H组与培养阴性-M组中,酪蛋白、αs1-酪蛋白及β-酪蛋白含量显著减少(P<0.05),培养阴性-H组中,乳蛋白和αs2-酪蛋白含量显著降低(P<0.05)。
3 讨论奶牛乳腺内感染(IMI)的诊断一直以来主要基于SCC和细菌学检查。目前认为SCC<100 000个/mL的牛奶样品是健康的或处于正常的生理学范围内[14]。但近来有研究表明,在这些健康乳腺内也可能已经发生了炎症反应[15]。实际上,SCC在炎症反应的初始阶段很低,直到入侵的病原体被释放化学引诱物的免疫细胞识别,从而刺激PMN的迁移[16]。体细胞分型可能是监测乳腺炎症过程的一种更详细的方法,因为它能够识别出在炎症过程中发生SCC增加之前相对细胞群体的变化。
3.1 牛奶中的SCC和体细胞分型本研究结果表明,在SCC>400 000个/mL时,随SCC增加,PMN比例显著增加,成为乳腺内的主要细胞群体,标志着明显的IMI。淋巴细胞作为健康乳腺内的优势细胞群体,随SCC增加而显著减少。而巨噬细胞并未与SCC有显著相关性。这一结果与Kester等[17]研究结果一致。而1项细胞分型研究表明,淋巴细胞在整个炎症过程中的比例相当稳定,而巨噬细胞比例随SCC增加而显著下降[18]。这种不同的结果可能是由于不同的细胞分型技术间的差异造成。Geary等[19]通过研究技术因素对牛奶中体细胞分型的影响,结果显示,采样瓶的材质对细胞数量有明显影响,塑料材质的离心管通过减少巨噬细胞的数量显著影响了牛奶中巨噬细胞/淋巴细胞,原因在于巨噬细胞具有黏附性,它可以黏附到塑料材质表面。淋巴细胞几乎不受采样瓶材质的影响;另一个技术因素是牛奶样品的离心次数。本试验所使用的流式细胞术中牛奶样品与单克隆抗体的组合需要4个离心步骤。有研究表明,离心次数显著影响细胞分型结果。离心次数越少,淋巴细胞丢失越少,因为这些细胞密度低,巨噬细胞可以在乳脂层和离心牛奶的上清液中发现,因此巨噬细胞的比例相对稳定,很少受到离心因素的影响[20]。体细胞分型可以通过流式细胞仪或光学显微镜获得。Miller等[21]报道了PMN和淋巴细胞比例的鉴定结果在以上2种方法之间的相关性较高,而巨噬细胞和上皮细胞比例的相关性较低。本试验发现在健康乳腺和患病乳腺中巨噬细胞比例没有显著变化。Miller等[21]研究表明,巨噬细胞是健康乳腺主要的细胞群体。这2种结果的差异可通过对健康乳腺的不同定义来解释。本试验从SCC的角度定义健康乳腺,而Miller等[21]基于将细菌学检查结果为阴性的乳腺定义为健康乳腺,但没有指明任何SCC。另有一些研究指出,上皮细胞是未感染乳腺中发现的主要细胞类型[22]。Le Roux等[23]研究指出,鉴定巨噬细胞和上皮细胞存在一定的难度,原因可能是上皮细胞是由巨噬细胞吞噬一些不能被消化的细菌或受到其他抗原物质的长期刺激转化而来。因此,二者的区分并不明显,因而在计数过程中是有可能将一些巨噬细胞计数为上皮细胞。此外,由于上皮细胞的免疫学特性尚不清楚,因此本试验没有考虑上皮细胞的影响。
前人关于奶牛乳腺的研究几乎都集中在感染乳腺上。而健康乳腺内的免疫状态鲜有涉及。本试验研究结果表明,在SCC<100 000个/mL范围内,只有在极低SCC(13 000~76 000个/mL)的牛奶样品中淋巴细胞比例高达59.35%~81.26%,是健康乳腺内的优势细胞群体。当SCC继续升高,达到76 000~100 000个/mL时,PMN比例极显著增加,达到82.68%,表明炎症已经开始发生,并且低于健康乳腺的SCC阈值。Leitner等[24]研究表明,SCC在6 250~25 000个/mL时,PMN比例仅为17.0%,而当SCC增加到90 000个/mL时,PMN比例已升高到54.6%。牛奶中高PMN比例被认为是炎症反应的重要指标,同时,PMN也可以成功地抵御病原体并预防乳腺炎。因而本试验结果表明,在SCC<100 000个/mL时,乳腺内早期炎症过程可能已经出现。可能引发PMN比例升高的另一个因素是压力,然而本试验没有考虑压力的因素,因为整个采样过程中,均是奶牛保持在最佳条件下,并严格按照挤奶标准流程,因此奶牛没有明显的压力症状。Dos Reis等[25]研究指出,体细胞分型是用于鉴定具有极低SCC的牛奶样品中炎症过程的有效工具。鉴于哺乳期乳腺不断受到压力以及免疫系统的影响,体细胞分型的短期重复性信息对于评估乳腺炎及炎症控制方案中的适用性至关重要。
3.2 奶牛乳腺内病原体状态和体细胞分型本试验细菌学检查结果显示,在102份牛奶样品中分离出的机会型病原体,即CNS占总样品的34.32%,其对应样品的SCC为71 850个/mL,这说明在SCC<100 000个/mL时,PMN比例的显著增加可能是因为大量CNS的存在,并且CNS有可能成为引发早期乳腺炎症的潜在致炎病原体。传染型病原体,特别是金黄色葡萄球菌的高比例出现与前人研究结果一致。这些样品的平均SCC为824 280个/mL,说明传染型病原体相比于其他2类病原体的致病力强,且病原体持续存在。约13.72%的培养样品为培养阴性,然而,这些样品的平均SCC为324 600个/mL,远大于100 000个/mL。可能的解释是,一些牛在采样时处于愈合过程中,感染被自发消除。在这种情况下,即使炎症反应仍然活跃,病原体也会被清除。Mazal等[26]研究表明,由于CNS通常在乳头皮肤上发现,一些培养阳性的样品可能是由牛奶样品采集期间的乳腺皮肤污染导致的,而不是真正的腺体感染。此外,在对这些牛奶样品的细菌学检查中可能产生假阴性结果[27]。部分阴性细菌学检查结果可能是因为病原体的间歇性脱落或脱落的量低于检测方法的最低限度;也有可能是牛奶中抗菌剂或其他抑制剂的存在;在细菌培养阴性乳腺中,大多数细菌被吞噬或杀死,或者仅在宿主细胞内存活才能存活,病原体大量减少或停止生长可能是阴性细菌学检查结果的另一个原因[28];此外,由于试验所分析的牛奶样品是4个乳区的复合牛奶样品,因而一定比例的假阴性结果可能是由于健康乳区的稀释效应,所以受感染乳区的少数菌落无法通过细菌培养分析来检测。因此,即使没有细菌也存在炎症过程,这一点可以通过增加的SCC和高比例出现的PMN得知。本试验将培养阴性样品根据SCC高低分为3组,在高SCC的培养阴性样品中,炎症状态可能处于最高水平,但病原体被巨噬细胞吞没,因此不能被分离鉴定出。在其他文献中也有关于个体乳腺中的感染、炎症过程和免疫反应的相互依赖关系的讨论[29]。
3.3 乳腺状态与产奶量、乳成分及乳蛋白组成的关系本试验结果发现,感染传染型病原体可显著降低感染奶牛的产奶量,而环境型和机会型病原体引起的亚临床乳腺炎感染所导致的产奶量的损失并不大。这与Politis等[30]研究结果一致。这可能归因于为金黄色葡萄球菌的发病机、病原体的持续存在以及较低的治愈率。与健康乳区相比,金黄色葡萄球菌诱发的感染乳区,由于蛋白酶活性增加,降低生物合成以及炎症反应期间血-乳屏障的损害[31]。此外,在金黄色葡萄球菌诱发乳腺炎症的牛奶中,发现乳蛋白含量的升高。其原因可能为炎症的发生,导致可溶性蛋白质从血液流入乳腺。Pyörälä等[32]研究表明,牛奶中乳脂、乳蛋白和酪蛋白含量不受引起亚临床IMI的病原体影响。已有文献报道了低产奶量与亚临床IMI之间的关联是由传染型病原体和链球菌属引起的。在这些研究中,发现大肠杆菌引起的产奶量大幅下降。然而,金黄色葡萄球菌和克雷伯氏菌属也会对初产和多产奶牛的产奶量产生负面影响,但CNS感染对牛奶生产没有不利影响[33]。Piccinini等[33]研究指出,与未感染奶牛相比,通过链球菌诱导IMI后观察到的牛奶中脂蛋比无显著变化。而Riollet等[34]研究发现,感染和未感染乳区的比较表明,由不同细菌(金黄色葡萄球菌、CNS、链球菌属和棒状杆菌属)引起的IMI,其牛奶中总固形物、非脂肪固形物、乳脂、乳蛋白含量会发生不同程度的改变。此外,由于来自血液的可溶性蛋白质的流入,葡萄球菌、链球菌和大肠杆菌引起的临床乳腺炎的乳蛋白含量较高。本试验通过脱脂乳的RP-HPLC分析对乳蛋白组成的详细分析发现,乳清蛋白含量不受乳腺健康状态的影响,但αS1-酪蛋白、αS2-酪蛋白和β-酪蛋白含量受到影响。具有高SCC的牛奶的特征具有更高的蛋白质水解活性。在乳腺先天免疫反应感染期间,纤溶酶原系统的激活导致β-酪蛋白降解成γ-酪蛋白和蛋白质胨。因此,在本试验中,培养阴性-H组中明显炎症状态可能是高SCC牛奶样品中酪蛋白的更多酶分解有关,这就解释了与正常牛奶相比,培养阴性-H组中酪蛋白/乳蛋白降低了约1%。在感染环境型病原体的牛奶样品中也观察到显著降低的β-酪蛋白含量。
通过鉴别乳免疫细胞在奶牛乳腺不同感染阶段的比例在有助于对奶牛乳腺健康进行更详细的评估,但由于检测技术的差异可能会导致检测结果的偏差,体细胞分型的短期可重复性是十分重要的评判依据。此外,还应考虑重复采样以确定确切的感染阶段。在今后的研究中,除了关注牛奶中免疫细比例的高低变化外,还应更加注重免疫平衡这一概念,这对于保障奶牛健康有极其重要的意义。
4 结论① 体细胞分型可用于对奶牛乳腺健康状况做出更详细分析,特别是在低SCC的牛奶中更早地识别炎症起始发生。
② 乳腺早期炎症反应的发生明显低于目前公认的健康乳腺牛奶SCC阈值(<100 000个/mL),并且CNS可能是诱发早期乳腺炎症的潜在病原体。
③ 细菌培养阴性样品中,炎症导致高SCC牛奶中酪蛋白/乳蛋白和乳糖含量的显著降低。
| [1] |
HARMON R J. Physiology of mastitis and factors affecting somatic cell counts[J]. Journal of Dairy Science, 1994, 77(7): 2103-2112. DOI:10.3168/jds.S0022-0302(94)77153-8 |
| [2] |
HOWARD C J, NAESSENS J. Summary of workshop findings for cattle (tables 1 and 2)[J]. Veterinary Immunology and Immunopathology, 1993, 39(1/2/3): 25-47. |
| [3] |
KEHRLI K M, Jr, SHUSTER D E. Factors affecting milk somatic cells and their role in health of the bovine mammary gland[J]. Journal of Dairy Science, 1994, 77(2): 619-627. DOI:10.3168/jds.S0022-0302(94)76992-7 |
| [4] |
KOESS C, HAMANN J. Detection of mastitis in the bovine mammary gland by flow cytometry at early stages[J]. Journal of Dairy Research, 2008, 75(2): 225-232. |
| [5] |
LEE C S, WOODING F B P, KEMP P. Identification, properties, and differential counts of cell populations using electron microscopy of dry cows secretions, colostrum and milk from normal cows[J]. Journal of Dairy Research, 1980, 47(1): 39-50. DOI:10.1017/S0022029900020860 |
| [6] |
LEITNER G, ELIGULASHVILY R, KRIFUCKS O, et al. Immune cell differentiation in mammary gland tissues and milk of cows chronically infected with Staphylococcus aureus[J]. Journal of Veterinary Medicine, 2003, 50(1): 45-52. DOI:10.1046/j.1439-0450.2003.00602.x |
| [7] |
LOKEN M R, STALL A M. Flow cytometry as an analytical and preparative tool in immunology[J]. Journal of Immunological Methods, 1982, 50(3): R85-R112. DOI:10.1016/0022-1759(82)90161-2 |
| [8] |
AULDIST M J, COATS S, SUTHERLAND B J, et al. Effects of somatic cell count and stage of lactation on raw milk composition and the yield and quality of Cheddar cheese[J]. Journal of Dairy Research, 1996, 63(2): 269-280. DOI:10.1017/S0022029900031769 |
| [9] |
AULDIST M J, HUBBLE I B. Effects of mastitis on raw milk and dairy products[J]. Australian Journal of Dairy Technology, 1998, 53(1): 28-36. |
| [10] |
BANNERMAN D D, PAAPE M J, LEE J W, et al. Escherichia coli and Staphylococcus aureus elicit differential innate immune responses following intramammary infection[J]. Clinical and Diagnostic Laboratory Immunology, 2004, 11(3): 463-472. |
| [11] |
MAURMAYR A, CECCHINATO A, GRIGOLETTO L, et al. Detection and quantification of αs1-, αs2-, β-, κ-casein, α-lactalbumin, β-lactoglobulin and lactoferrin in bovine milk by reverse-phase high-performance liquid chromatography[J]. Agriculturae Conspectus Scientificus, 2013, 78(3): 201-205. |
| [12] |
LI N, ROMAIN R, MARIE-HÉLÈNE P, et al. Flow cytometry approach to quantify the viability of milk somatic cell counts after various physico-chemical treatments[J]. PLoS One, 2015, 10(12): e0146071. DOI:10.1371/journal.pone.0146071 |
| [13] |
王素英. 细菌平板菌落计数的改进方法[J]. 生物学通报, 2003, 28(2): 41. |
| [14] |
陈艳. 微生物鉴定方法的比较[J]. 中国水产, 2005(1): 69. |
| [15] |
HISS S, MUELLER U, NEU-ZAHREN A, et al. Haptoglobin and lactate dehydrogenase measurements in milk for the identification of subclinically diseased udder quarters[J]. Veterinarni Medicina, 2007, 52(6): 245-252. |
| [16] |
HORTET P, SEEGERS H. Calculated milk production losses associated with elevated somatic cell counts in dairy cows:review and critical discussion[J]. Veterinary Research, 1998, 29(6): 497-510. |
| [17] |
KESTER H J, SORTER D E, HOGAN J S. Activity and milk compositional changes following experimentally induced Streptococcus uberis bovine mastitis[J]. Journal of Dairy Science, 2014, 98(2): 999-1004. |
| [18] |
KITCHEN B J. Review of the progress of dairy science:bovine mastitis:milk compositional changes and related diagnostic tests[J]. Journal of Dairy Research, 1981, 48(1): 167-188. DOI:10.1017/S0022029900021580 |
| [19] |
GEARY U, LOPEZ-SHALLOO L, O'BRIEN B, et al. Meta-analysis to investigate relationships between somatic cell count and raw milk composition, Cheddar cheese processing characteristics and cheese composition[J]. Irish Journal of Agricultural and Food Ressearch, 2013, 52(2): 119-133. |
| [20] |
LABEN R C. Factors responsible for variation in milk composition[J]. Journal of Dairy Science, 1963, 46(11): 1293-1301. DOI:10.3168/jds.S0022-0302(63)89264-4 |
| [21] |
MILLER R H, PAAPE M J, FILEP R, et al. Flow cytometric analysis of neutrophils in cows' milk[J]. American Journal of Veterinary Research, 1993, 54(12): 1975-1979. |
| [22] |
LE MARÉCHAL C, THIÉRY R, VAUTOR E, et al. Mastitis impact on technological properties of milk and quality of milk products-a review[J]. Dairy Science & Technology, 2011, 91(3): 247-282. |
| [23] |
LE ROUX Y, GIRARDET J M, HUMBERT G, et al. Proteolysis in samples of quarter milk with varying somatic cell counts.2.component PP3 and β-casein-lP (f29-105 and f29-107) of the proteose-peptone fraction[J]. Journal of Dairy Science, 1995, 78(6): 1298-1305. DOI:10.3168/jds.S0022-0302(95)76750-9 |
| [24] |
LEITNER G, MERIN U, SILANIKOVE N. Effects of glandular bacterial infection and stage of lactation on milk clotting parameters:comparison among cows, goats and sheep[J]. International Dairy Journal, 2011, 21(4): 279-285. DOI:10.1016/j.idairyj.2010.11.013 |
| [25] |
DOS REIS C B M, BARREIRO J R, MESTIERI L, et al. Effect of somatic cell count and mastitis pathogens on milk composition in Gyr cows[J]. BMC Veterinary Research, 2013, 9: 67. DOI:10.1186/1746-6148-9-67 |
| [26] |
MAZAL G, VIANNA P C, SANTOS M V, et al. Effect of somatic cell count on Prato cheese composition[J]. Journal of Dairy Science, 2007, 90(2): 630-636. DOI:10.3168/jds.S0022-0302(07)71545-X |
| [27] |
MERIN U, FLEMINGER G, KOMANOVSKY J, et al. Subclinical udder infection with Streptococcus dysgalactiae impairs milk coagulation properties:the emerging role of proteose peptones[J]. Dairy Science & Technology, 2008, 88(4/5): 407-419. |
| [28] |
NEWBOULD F H S, NEAVE F K. The recovery of small numbers of Staphylococcus aureus infused into the bovine teat cistern[J]. Journal of Dairy Research, 1965, 32(2): 157-162. DOI:10.1017/S0022029900018483 |
| [29] |
PARADIS M È, BOUCHARD É, SCHOLL D T, et al. Effect of nonclinical Staphylococcus aureus or coagulase-negative staphylococci intramammary infection during the first month of lactation on somatic cell count and milk yield in heifers[J]. Journal of Dairy Science, 2010, 93(7): 2989-2997. DOI:10.3168/jds.2009-2886 |
| [30] |
POLITIS I, NG-KWAI-HANG K F. Effects of somatic cell count and milk composition on cheese composition and cheese making efficiency[J]. Journal of Dairy Science, 1988, 71(7): 1711-1719. DOI:10.3168/jds.S0022-0302(88)79737-4 |
| [31] |
PYÖRÄLÄ S. Indicators of inflammation in the diagnosis of mastitis[J]. Veterinary Research, 2003, 34(5): 565-578. DOI:10.1051/vetres:2003026 |
| [32] |
REKSEN O, SØLVERØD L, ØSTERÅS O. Relationships between milk culture results and milk yield in Norwegian dairy cattle[J]. Journal of Dairy Science, 2007, 90(10): 4670-4678. DOI:10.3168/jds.2006-900 |
| [33] |
PICCININI R, BINDA E, BELOTTI M, et al. Comparison of blood and milk non-specific immune parameters in heifers after calving in relation to udder health[J]. Veterinary Research, 2005, 36(5/6): 747-757. |
| [34] |
RIOLLET C, RAINARD P, POUTREL B. Cells and cytokines in inflammatory secretions of bovine mammary gland[M]//MOL J A, CLEGG R A. Biology of the Mammary Gland. Advances in Experimental Medicine and Biology. Boston, MA: Springer, 2000.
|




