2. 天津市农业科学院, 天津市畜牧兽医研究所, 天津 300381;
3. 天津大学化工学院, 天津 300072
2. Tianjin Institute of Animal Husbandry and Veterinary Medicine, Tianjin Academy of Agricultural Sciences, Tianjin 300381, China;
3. Institute of Chemical Technology, Tianjin University, Tianjin 300072, China
脊椎动物的肌肉细胞与脂肪细胞已经被确认来自共同的中胚层细胞,并且通过自分泌和旁分泌在调节动物的生长发育中有紧密的联系[1-2]。研究脂肪与肌肉间的相互作用有助于探究细胞因子、营养因素和激素调节脂肪沉积与肌肉发育的作用机制。另外,脂肪与肌肉间的相互作用还可能将在人类新陈代谢的疾病机制和动物的肉质性状方面有广泛的应用。为了探讨脂肪与肌肉组织在机体发育过程中的相互影响,许多研究者间接建立细胞培养体系。Dodson等[3]首次建立了3T3-L1前脂肪细胞与不同分化程度的羊肌肉细胞体外共培养体系。由于共培养体系比单独培养细胞能够更好地模拟动物体内的生理环境,因而受到学者们的广泛关注。近年来,为了探讨脂肪和肌肉组织在体内发育过程中的相互作用。研究者们分别建立了绵羊、人、老鼠、天鹅和牛的脂肪与肌肉细胞的共培养体系[4-8]。本试验通过分离培养猪骨骼肌卫星细胞和肌内前体脂肪细胞,进行体外间接共培养,研究2种细胞的增殖和分化特性,探讨在间接共培养体系中猪肌肉细胞分化对脂肪细胞分化以及脂肪细胞内脂质沉积的调控作用,为进一步揭示脂肪与肌肉组织之间的相互作用提供理论依据。
1 材料与方法 1.1 试验材料主要材料包括:0.25%胰酶消化液、0.02%乙二胺四乙酸(EDTA)(1:使用,Sigma公司,美国)、台盼蓝、0.2%胶原酶、细胞冻存液、DMEM/F12培养基(Gibco公司,美国)、胎牛血清(Gibco公司,美国)、胰蛋白酶、磷酸缓冲盐溶液(PBS)(北京索莱宝科技有限公司)、胰岛素、地塞米松、特级马血清(Gibco公司,美国)、青链霉素混合液(100×,北京索莱宝科技有限公司)、3-异丁基-1-甲基黄嘌呤(IBMX)(Sigma公司,美国)、油红O、TacoTM DNA/RNA取试剂盒(瑞基海洋生物科技股份有限公司)、PrimeScriptTM Ⅱ 1st Strand cDNA Synthesis Kit(TaKaRa公司,日本)、All-in-OneTMqPCR Mix(GeneCopoeia公司,美国)、TGX Stain-FreeTM FastCastTM Acrylamide Kit(12%,Bio-Rad公司,美国)。
主要仪器包括:无菌培养皿、二氧化碳细胞培养箱、倒置荧光显微镜、Transwell细胞小室共培养板、SW-CJ-1D型超净工作台高速离心机、DT5-2型低速离心机、实时定量PCR仪。
1.2 试验设计3日龄健康大白仔猪购自天津市武清农康生猪养殖有限公司,用于原代猪骨骼肌卫星细胞和肌内前体脂肪细胞分离。供试细胞分为2个组,即对照组(单独培养肌内前体脂肪细胞组)和试验组(间接共培养骨骼肌卫星细胞和肌内前体脂肪细胞组),每组4个重复。
1.3 试验方法 1.3.1 猪骨骼肌卫星细胞和肌内前体脂肪细胞分离培养无菌条件下,分离3日龄仔猪皮下背最长肌,去除背最长肌结缔组织和血管,剪成1~2 mm3大小的组织块,0.2% Ⅱ型胶原酶消化液37 ℃水浴消化2 h,200目网筛过滤,1 500 r/min离心5 min,弃上清液。用DMEM/F12培养液漂洗沉淀,经400目网筛过滤,1 500 r/min离心10 min,弃上清液,再用含10%胎牛血清和1%青链霉素的DMEM/F12完全培养基重悬细胞,接种到10 cm无菌细胞培养皿,置于37 ℃、5% CO2培养箱培养,利用差速贴壁法纯化细胞,细胞培养2 h后,弃培养液,用PBS清洗贴壁细胞2次,得到纯化的肌内前体脂肪细胞[9]。骨骼肌卫星细胞的分离培养参照Yang等[10]和Yan等[11]的试验方法。2种细胞分别接种到10 cm的无菌培养皿中,置于37 ℃、5% CO2的培养箱培养,培养液每2 d更换1次,细胞数量用血球计数板计数。
1.3.2 猪骨骼肌卫星细胞和肌内前体脂肪细胞鉴定骨骼肌卫星细胞鉴定:在培养皿中放入无菌盖玻片进行细胞爬片,当细胞密度达到70%~80%时,分化培养基(2%马血清+1%双抗+DMEM/F12)培养3 d。弃掉分化培养基,PBS清洗3次,丙酮室温固定20 min,PBS洗3次,Triton-X 100(1:000)处理15 min,PBS洗3次,牛血清白蛋白(BSA)封闭2 h,加入Desmin抗体(1:50)于4 ℃过夜,PBS洗3次,加入荧光标记的二抗(1:2 000)于暗室中孵育1 h,PBS洗3次,最后1 μg/mL的4, 6-二脒基-2-苯基吲哚(DAPI)染核10 min(避光),PBS洗3次,封片后荧光显微镜下观察。
肌内前体脂肪细胞细胞鉴定:培养皿中的细胞达到完全汇合,接触抑制2 d,用含有10 μg/mL胰岛素的完全培养液诱导分化培养2 d,更换完全培养液继续培养4 d,油红O染色,在显微镜下观察细胞形态[12]。
1.3.3 猪骨骼肌卫星细胞和肌内前体脂肪细胞共培养2种原代细胞培养密度达到80%~90%时,0.25%胰蛋白酶37 ℃消化,DMEM/F12培养液重悬细胞,记数后接种于Transwell细胞小室共培养板进行共培养。肌内前体脂肪细胞以2.0×104个/cm2的密度接种于上室,骨骼肌卫星细胞以1.0×105个/cm2的密度接种于下室,使用含有4%胎牛血清的完全培养液培养。待骨骼肌卫星细胞密度达到80%时,更换含有2%马血清的DMEM/F12培养液诱导分化,48 h换液1次。待肌内前体脂肪细胞接触抑制2 d后,更换含有10 μg/mL胰岛素的完全培养液诱导分化培养2 d,更换完全培养液继续培养,直至出现肉眼可见明显脂滴。
1.3.4 实时定量PCR参照TaKaRa公司RNA试剂盒方法提取出总的RNA。第1条链cDNA反转录试剂盒购自Fermentas公司(美国)。各基因及引物序列如下:过氧化物酶体增殖物激活受体γ(PPARγ)(5′-ACCACTCGCATTCCTTTGAC-3′,5′-CCACAGACT CGGCACTCAAT-3′)、CCAAT增强子结合蛋白α(C/EBPα)(5′ -ATGGAGCAAGC CA ACTTCTAC-3′,5′-GCCAGGAACTCGTCGTTGAA-3′)、乙酰辅酶A羧化酶(ACC)(5′-CTCCTAACTGCTGAGCTGTCTCTCT-3′,5′-AGTCTTTCTCTTCAAT TCTTGCCT-3′)、脂肪酸合成酶(FAS)(5′-AAGGAGG AGTCAACGGG-3′,5′-GATGGTGAGGAGTCGGAT-3′)、脂蛋白脂酶(LPL)(5′-CGAAGTATTGGCATC CAGAAA C-3′,5′-TTGATCTCATAGCCCAAGTTGTT-3′)、β-肌动蛋白(β-actin)(5′-ACCAC AGCCGAGAGAGAAAT 3′,5′GACCTGACCATCAG-GGAGTT-3′)。PCR扩增引物均由上海生物工程技术服务有限公司合成。PCR扩增的条件是95 ℃ 5 min,94 ℃ 60 s,55~60 ℃ 40 s,72 ℃ 40 s (30个循环),72 ℃ 10 min和4 ℃反应结束,进行熔解曲线的绘制。利用2-ΔΔCt法进行相对实时定量分析。
1.3.5 免疫印迹试验(Western Blot)将培养的细胞在冰上用裂解缓冲液溶解,并在4 ℃、10 000×g离心10 min取上清液测定蛋白浓度。提取的总蛋白通过10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PGEA)进行分离,将蛋白转移至聚偏二氟乙烯(PVDF)硝酸纤维膜上。并在膜上与一抗β-actin、C/EBPα、PPARγ、FAS、ACC(Abcom公司,英国)进行孵育,5%的脱脂奶粉封闭1 h。将膜与耦联二抗37 ℃孵育1 h,使用化学发光液ChemiDoc XRS(Millipore公司,美国)和Bio-Rad凝胶成像系统进行检测分析,分析灰度值,进行相对定量分析。
1.4 数据统计及分析采用SPSS 17.0软件进行统计分析数据,利用单因素方差(one-way ANOVA)分析显著性差异,P<0.05为差异显著,P<0.01为差异极显著。试验数据以平均值±标准差(mean±SD)表示。
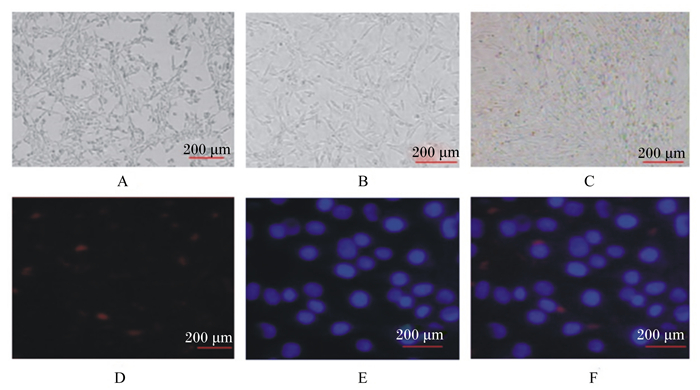
2 结果与分析 2.1 细胞形态及鉴定 2.1.1 骨骼肌卫星细胞形态及鉴定倒置显微镜下观察原代肌卫星细胞,细胞贴壁后逐渐形成梭形或纺锤形(图 1-A);细胞相互融合后按一定方向呈有序排列(图 1-B);细胞分化2 d后形成多核的肌管,核位于中央,肌管呈长条形,平行排列(图 1-C)。采用猪骨骼肌卫星细胞的特异标记Desmin进行免疫荧光鉴定(图 1-D),结果发现Desmin在细胞质中的表达呈阳性,证实所培养的细胞为猪骨骼肌卫星细胞(图 1-E、图 1-F)。
|
A、B、C:猪骨骼肌卫星细胞培养;D:Desmin在细胞质中免疫荧光染色;E:DAPI染色;F:D与E叠加。 A, B and C: porcine skeletal muscle satellite cell culture; D: Desmin immunofluorescence staining in cytoplasm; E: DAPI staining; F: the merge of A and B. 图 1 猪骨骼肌卫星细胞培养及鉴定 Figure 1 Culture and identification of porcine skeletal muscle satellite cells (100×) |
肌内前体脂肪细胞贴壁生长,细胞接触抑制2 d后(图 2-A),改用诱导液Ⅰ诱导分化48 h,细胞逐渐变圆(图 2-B),再用诱导液Ⅱ诱导分化48 h,然后换含有10%胎牛血清的完全培养基继续培养4 d,在倒置显微镜下观察,含有大量有脂滴样的圆形细胞时用油红O染色鉴定,结果显示细胞内出现了大量脂滴(图 2-C)。以上结果表明所培养的细胞为肌内前体脂肪细胞。

|
图 2 猪肌内前体脂肪细胞形态及鉴定 Figure 2 Morphology and identification of intramuscular preadipocytes (100×) |
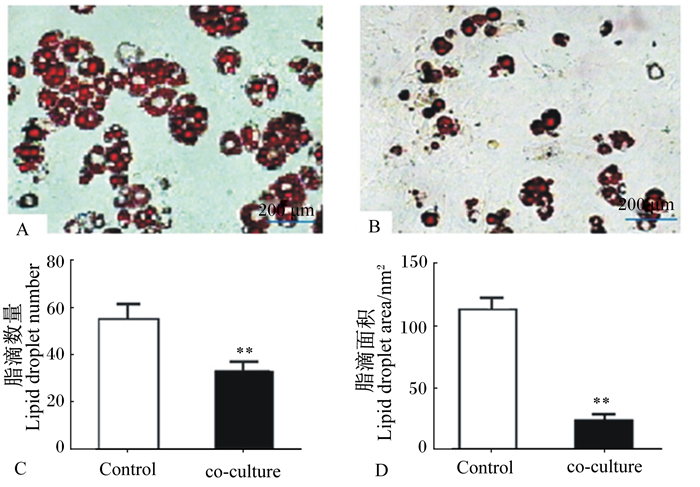
肌内前体脂肪细胞诱导分化第8天,细胞内出现大量脂滴,经油红O染色后,对照组细胞中脂滴数量多,脂滴面积大(图 3-A);试验组细胞中脂滴数量较少,细胞着色明显变浅、发暗(图 3-B)。定量分析结果表明,共培养组的脂滴数量和脂滴面积都极显著低于对照组(P<0.01)(图 3-C、图 3-D)。以上结果表明,骨骼肌卫星细胞与肌内前体脂肪细胞共培养下对肌内前体脂肪细胞分化和脂质沉积具有抑制作用。
|
A:对照组;B:共培养组;C:脂滴数量;D:脂滴面积。Control: 对照组 control group;co-culture:共培养组 co-culture group;数据柱标**表示差异极显著(P<0.01),下图同。 A: control group ;B: co-culture group; C: lipid droplets number; D: lipid droplet area. Value columns with ** mean significant difference (P < 0.01), the same as below. 图 3 骨骼肌卫星细胞对肌内前体脂肪细胞脂质沉积的影响 Figure 3 Effects of skeletal muscle satellite cells on lipid deposition in intramuscular preadipocytes (100×) |
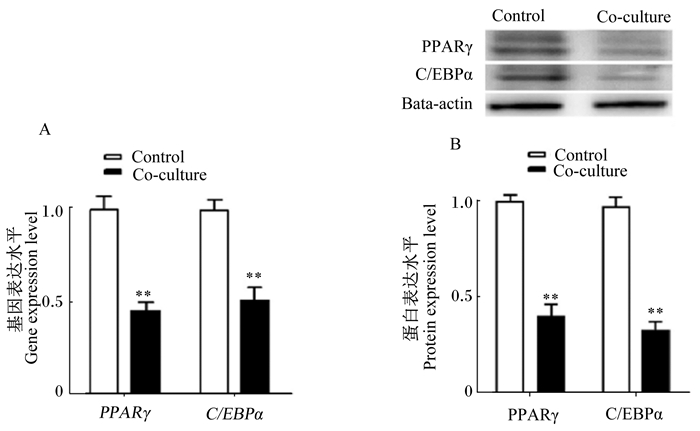
为了验证骨骼肌卫星细胞对肌内前体脂肪细胞增殖分化的影响,检测了肌内前体脂肪细胞增殖分化转录因子C/EBPα、PPARγ的基因和蛋白的表达水平。如图 4所示,共培养组肌内前体脂肪细胞PPARγ、C/EBPα的基因和蛋白的表达水平极显著低于对照组(P<0.01)。以上结果表明,骨骼肌卫星细胞抑制肌内前体脂肪细胞分化标志基因的表达。
|
A:肌内前体脂肪细胞增殖分化标志基因表达水平;B:肌内前体脂肪细胞增殖分化相关蛋白表达水平。PPARγ:过氧化物酶体增殖物激活受体γ;C/EBPα:CCAAT增强子结合蛋白α;Bata-actin: β-肌动蛋白。 A: intramuscular preadipocytes proliferation and differentiation marker gene expression level; B: intramuscular preadipocytes proliferation and differentiation related protein expression level. PPARγ: peroxisome proliferators-activated receptor γ; C/EBPα: CCAAT enhancer binding protein α; Bata-actin: β-actin. 图 4 骨骼肌卫星细胞对肌内前体脂肪细胞增殖分化转录因子表达的影响 Figure 4 Effects of skeletal muscle satellite cells on proliferation and differentiation transcription factor expression of intramuscular preadipocytes |
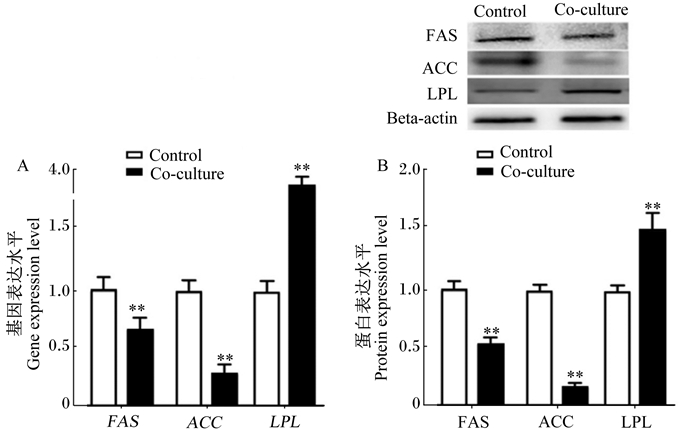
为了进一步研究猪骨骼肌卫星细胞对肌内前体脂肪细胞脂质代谢的影响,检测了猪肌内前体脂肪细胞脂质代谢关键酶FAS、ACC和LPL的基因和蛋白表达水平。如图 5所示,共培养组肌内前体脂肪细胞FAS、ACC的基因和蛋白的表达水平极显著低于对照组(P<0.01),LPL的基因和蛋白的表达水平极显著高于对照组(P<0.01)。以上结果表明,骨骼肌卫星细胞抑制肌内前体脂肪细胞脂质代谢。
|
A:肌内前体脂肪细胞中脂质代谢基因表达水平;B:肌内前体脂肪细胞中脂质代谢相关蛋白表达水平。FAS:脂肪酸合成酶;ACC:乙酰辅酶A羧化酶;LPL:脂蛋白脂酶;Bata-actin: β-肌动蛋白。 A: expression of lipid metabolism genes in intramuscular preadipocytes; B: expression of lipid metabolism related proteins in intramuscular preadipocytes. FAS: fatty acid synthase; ACC: acetyl CoA carboxylase; LPL: lipoprteinlipase; Bata-actin: β-actin。 图 5 骨骼肌卫星细胞对肌内前体脂肪细胞脂质代谢关键酶表达的影响 Figure 5 Effects of skeletal muscle satellite cells on lipid metabolism key enzyme expression in intramuscular preadipocytes |
近年来,有使用肌细胞和脂肪细胞共培养的方法来研究细胞的生长特性和分泌功能。体外共培养的骨骼肌卫星细胞和肌内前体脂肪细胞对研究肌肉组织与脂肪组织的相互作用具有重要意义。Ailhaud等[13]报道,在胚胎发育过程中肌细胞与前体脂肪细胞联系密切。Hausman等[6]首次尝试直接将肌内前体脂肪细胞和骨骼肌卫星细胞混合培养。虽然这种培养方法接近体内生长环境,但获得的脂肪细胞较少并且混合其他类型的细胞。因此,混合培养的细胞不能用于试验的定性和定量分析。Dodson等[3-4]研究表明,共培养的3T3-L1脂肪细胞和肌肉细胞可以促进脂肪细胞的存活、生长和增殖,抑制其分化。Yan等[11]研究了猪前体脂肪细胞和肌卫星细胞体外直接共培养,检测2种细胞增殖分化特征,结果表明共培养体系可以促进脂肪细胞的生长和增殖,同时抑制脂肪细胞分化。
本研究探讨了猪骨骼肌卫星细胞与肌内前体脂肪间接共培养体系下,肌内前体脂肪细胞的分化特性。与共培养体系相比,单独培养的肌内前体脂肪细胞中脂滴数量多,脂滴面积大,定量分析表明共培养组的肌内前体脂肪细胞中脂滴数量与脂滴面积都极显著低于对照组。这表明肌细胞对肌内前体脂肪细胞分化和脂肪沉积具有抑制作用,与Yan等[11]研究结果一致。有研究表明,FAS是乙酰辅酶A和丙二酰辅酶A转化为甘油三酯的关键酶,调控哺乳动物体内长链脂肪酸的合成。ACC是脂质代谢中的关键酶,LPL是三酰甘油分解代谢中的关键酶,在脂质代谢过程中发挥重要的作用[14]。PPARγ和C/EBPα在脂肪组织中具有很高的表达量,在脂肪形成和脂质储存中起着重要作用[8, 15-16]。本研究发现,与对照组相比,在共培养体系下猪肌内前体脂肪细胞PPARγ和C/EBPα的基因和蛋白的表达水平均极显著降低,前体脂肪细胞FAS和ACC的基因和蛋白的表达水平也极显著降低,而前体脂肪细胞LPL的基因和蛋白的表达水平显著增加,表明共培养体系内的猪骨骼肌卫星细胞抑制了肌内前体脂肪细胞的分化,促进了脂肪细胞分解代谢,证实了肌肉细胞对脂肪细胞发育的调控具有重要的作用[17-18]。
4 结论本试验通过分离培养猪骨骼肌卫星细胞和肌内前体脂肪细胞,建立了骨骼肌卫星细胞和肌内前体脂肪细胞间接共培养体系,证实了共培养体系中骨骼肌卫星细胞对肌内前体脂肪细胞脂质沉积具有抑制作用。
| [1] |
KOKTA T, DODSON M V, GERTLER A, et al. Intercellular signaling between adipose tissue and muscle tissue[J]. Domestic Animal Endocrinology, 2004, 27(4): 303-331. DOI:10.1016/j.domaniend.2004.05.004 |
| [2] |
QUINN L S, STRAIT-BODEY L, ANDERSON B G, et al. Interleukin-15 stimulates adiponectin secretion by 3T3-L1 adipocytes:evidence for a skeletal muscle-to-fat signaling pathway[J]. Cell Biology International, 2005, 29(6): 449-457. DOI:10.1016/j.cellbi.2005.02.005 |
| [3] |
DODSON M V, HOSSNER K L, VIERCK J L. Intercellular communication between muscle cells and 3T3-L1 preadipocytes[J]. Basic & Applied Myology Bam, 1996, 6(6): 503-512. |
| [4] |
DODSON M V, VIERCK J L, HOSSNER K L, et al. The development and utility of a defined muscle and fat co-culture system[J]. Tissue & Cell, 1997, 29(5): 517-524. |
| [5] |
DIETZE D, KOENEN M, RÖHRIG K, et al. Impairment of insulin signaling in human skeletal muscle cells by co-culture with human adipocytes[J]. Diabetes, 2002, 51(8): 2369-2376. DOI:10.2337/diabetes.51.8.2369 |
| [6] |
HAUSMAN G J, POULOS S P. A method to establish co-cultures of myotubes and preadipocytes from collagenase digested neonatal pig semitendinosus muscles[J]. Journal of Animal Science, 2005, 83(5): 1010-1016. DOI:10.2527/2005.8351010x |
| [7] |
SASAO N, HIRAYAMA E, KIM J. Formation and characterization of spontaneously formed heterokaryons between quail myoblasts and 3T3-L1 preadipocytes:correlation between differential plasticity and degree of differentiation[J]. European Journal of Cell Biology, 2004, 83(1): 35-45. DOI:10.1078/0171-9335-00357 |
| [8] |
CHOI S H, CHUNG K Y, JOHNSON B J, et al. Co-culture of bovine muscle satellite cells with preadipocytes increases PPARγ and C/EBPα gene expression in differentiated myoblasts and increases GPR43 gene expression in adipocytes[J]. Journal of Nutritional Biochemistry, 2013, 24(3): 539-543. DOI:10.1016/j.jnutbio.2012.01.015 |
| [9] |
陈妍, 张国华, 陆会宁, 等. 八眉猪肌内前体脂肪细胞的分离培养及诱导分化[J]. 广东农业科学, 2014, 41(13): 110-113, 123. DOI:10.3969/j.issn.1004-874X.2014.13.024 |
| [10] |
YANG J J, LIY H, WANG K F, et al. Isolation, culture and biological characteristics of multipotent porcine skeletal muscle satellite cells[J]. Cell and Tissue Banking, 2017, 18(4): 513-525. DOI:10.1007/s10561-017-9614-9 |
| [11] |
YAN J, GAN L, YANG H L, et al. The proliferation and differentiation characteristics of co-cultured porcine preadipocytes and muscle satellite cells in vitro[J]. Molecular Biology Reports, 2013, 40(4): 3197-3202. DOI:10.1007/s11033-012-2395-0 |
| [12] |
SUN C, QI R L, WANG L, et al. p38 MAPK regulates calcium signal-mediated lipid accumulation through changing VDR expression in primary preadipocytes of mice[J]. Molecular Biology Reports, 2012, 39(3): 3179-3184. DOI:10.1007/s11033-011-1084-8 |
| [13] |
AILHAUD G, GRIMALDI A P, NÉGREL R. Cellular and molecular aspects of adipose tissue development[J]. Annual Review of Nutrition, 1992, 12(1): 207-233. DOI:10.1146/annurev.nu.12.070192.001231 |
| [14] |
LI X Z, YAN C G, YU J, et al. Dietary whole and cracked linseed increases the proportion of oleic and α-linolenic acids in adipose tissues and decreases stearoyl-coenzyme A desaturase, acetyl-coenzyme A carboxylase, and fatty acid synthase gene expression in the longissimus thoracis muscle of Yanbian yellow cattle[J]. Journal of Animal Science, 2017, 95(2): 718-726. DOI:10.2527/jas.2016.1050 |
| [15] |
FERRAND N, BÉREZIAT V, MOLDES M, et al. WISP1/CCN4 inhibits adipocyte differentiation through repression of PPARγ activity[J]. Scientific Reports, 2017, 7: 1749. DOI:10.1038/s41598-017-01866-2 |
| [16] |
CHOI S K, PARK S, JANG S B, et al. Cascade regulation of PPARγ and C/EBPα signaling pathways by celastrol impairs adipocyte differentiation and stimulates lipolysis in 3T3-L1 adipocytes[J]. Metabolism, 2016, 65(5): 646-654. DOI:10.1016/j.metabol.2016.01.009 |
| [17] |
PARK S, BAEK K, CHOI C. Suppression of adipogenic differentiation by muscle cell-induced decrease in genes related to lipogenesis in muscle and fat co-culture system[J]. Cell Biology International, 2013, 37(9): 1003-1009. DOI:10.1002/cbin.v37.9 |
| [18] |
HAN H Y, WEI W, CHU W W, et al. Muscle conditional medium reduces intramuscular adipocyte differentiation and lipid accumulation through regulating insulin signaling[J]. International Journal of Molecular Sciences, 2017, 18(8): 1799. DOI:10.3390/ijms18081799 |




