杂交鳢(hybrid snakehead, Channa maculate ♀×Channa argus ♂)是由广东引进的原种斑鳢(雌)与浙江本地乌鳢(雄)进行杂交获得的子一代,其克服了传统乌鳢养殖投喂冰鲜杂鱼为主、驯食人工配合饲料难度大的问题,以及斑鳢生长速度较慢且不耐低温、养殖区域受到限制的缺点。经过多年的养殖试验,杂交鳢体现出了生长速度快、抗逆性强、产量高、出肉率高、饲料系数低、生长周期短、便于开展规模化养殖等优点[1]。近年来,杂交鳢在珠江三角洲、长江三角洲地区的养殖规模逐步扩大,成为我国重要的养殖品种之一[2]。然而,杂交鳢高密度、集约化的养殖模式,使得其养殖环境不断恶化,导致了生长缓慢和病害频发,疾病所造成的抗生素残留等问题严重影响了杂交鳢产业的健康可持续发展。目前,一些学者通过在饲料中添加中草药、微量元素和维生素等来提高动物机体的免疫力从而降低发病率,并取得了一定进展[3-4]。
黄芪多糖(Astragalus polysaccharin, APS)是中药黄芪的提取物,由葡萄糖、半乳糖等组成,具有调节体液免疫、细胞免疫等免疫调节功能,同时具有增加机体抵抗各种应激和氧化的能力,还具有改善肠道结构等生物学功能[5-7]。随着黄芪多糖工业化生产技术的突破以及黄芪多糖药理作用研究的深入,目前黄芪多糖已广泛应用于畜禽生产,均显示其良好的效果,并其在一些水产动物上的应用也取得了不错的效果。向枭等[6]研究表明饲料中添加0.040%~0.074%的黄芪多糖能提高齐口裂腹鱼的生长性能和免疫能力,其他学者也在鲤鱼[8]、罗非鱼[9]和异育银鲫[10]上证实了黄芪多糖具有提高鱼体非特异性免疫能力的作用。但是,还未见黄芪多糖在提高肉食性鱼类生长性能、消化性能、免疫能力和抗氧化能力等方面的报道。本试验通过在杂交鳢饲料中添加不同水平的黄芪多糖,来研究其对杂交鳢生长性能和机体免疫力等的影响,探讨黄芪多糖增强机体免疫力降低疾病发生的机制,旨在开发出一种杂交鳢绿色环保、无副作用、增强机体免疫力的功能型配合饲料,在降低疾病爆发的同时还有一定促进生长和改善肉质的作用。
1 材料与方法 1.1 黄芪多糖的来源和饲料制作本试验中用到的黄芪多糖购自北京生泰尔生物技术有限公司,其纯度为64.5%。选用鱼粉、豆粕、棉籽粕、菜籽粕为蛋白质源,按1:1混合的鱼油和豆油作为脂肪源,面粉为糖源配制基础饲料,基础饲料组成及营养水平见表 1。在基础饲料中分别添加0、0.25、0.50、1.00、1.50和2.00 g/kg的黄芪多糖,制成6种试验饲料。在饲料配制过程中首先把原料粉碎并过60目筛,然后按比例称重,接着使用混匀机混合均匀,添加适量水后加工成粒径为2 mm的颗粒饲料,自然晾干,保存于-20 ℃冰箱中备用。
|
|
表 1 基础饲料组成及营养水平(干物质基础) Table 1 Composition and nutrient levels ofexperimental diets (DM basis) |
试验用杂交鳢购自杭州余杭区黑鱼研究所,初重为(24.5±0.5)g,试验鱼先驯化2周,前期先用新鲜鱼糜捏成团投喂于水面,然后在鱼糜中逐步添加试验饲料直到幼鱼能全部摄食试验饲料。驯化摄食结束后,每个网箱(尺寸:1 m×1 m×1 m)挑选大小均一、健康无伤的杂交鳢鱼苗30尾,共6组,每组4个网箱。网箱固定于特制的2个内径4 m×4 m的钢架浮筏上,钢架置于0.3 hm2未进行生产养殖的池塘,池塘无增氧设施。
1.3 试验设计和饲养管理试验开始后,6个试验组分别投喂在基础饲料中添加0(APS0组,作为对照组)、0.25(APS0.25组)、0.50(APS0.50组)、1.00(APS1.00组)、1.50(APS1.50组)和2.00 g/kg(APS2.00组)黄芪多糖的试验饲料,每天投饲3次(07:00、12:00、17:00),日投饲率为体重的3%~5%。试验周期为60 d。试验期间,水温(27±3) ℃,pH在6.8~8.0,氨氮浓度<0.2 mg/L,溶解氧浓度>5 mg/L。
1.4 样品采集饲养试验结束后,禁食24 h,计数每个网箱中的试验鱼并全部称重,然后计算增重率和成活率。统计每组饲料的投喂总量,计算饲料系数。每个网箱随机抽取3尾鱼,测量体长和个体重后采血,采血部位为尾静脉,血液采集后置于抗凝管中,其中一部分立刻用于进行全血呼吸爆发强度的测定,剩余部分4 ℃下3 500 r/min离心10 min,取上清液放入-80 ℃保存;每个网箱另随机取3尾鱼,解剖后取肝脏和肠道,用4 ℃预冷的生理盐水清洗后用滤纸吸干,-80 ℃保存备用;每个网箱再随机取2尾鱼,取肠道中部切成1 mm3小块放入固定液中,用于电镜分析。
1.5 样品分析称取全部肠道和肝脏的重量,然后按1:4的质量体积比加入生理盐水进行匀浆,匀浆后放入离心机中,在4 ℃、3 000×g条件下进行离心,然后吸取上清液于-20 ℃保存,以备分析肠道中蛋白酶(protease)、脂肪酶(lipase)和淀粉酶(amylase)活性以及肝脏中过氧化氢酶(catalase, CAT)、超氧化物歧化酶(superoxide dismutase, SOD)活性和丙二醛(malondialdehyde, MDA)含量。
肠道中脂肪酶和淀粉酶活性,血浆和肝脏中CAT、SOD活性与MDA含量以及血浆中溶菌酶(lysozyme, LSZ)、酸性磷酸酶(acid phosphatase, ACP)活性及总抗氧化能力(total antioxidant capacity, T-AOC)均采用南京建成生物工程研究所生产的试剂盒测定,详细操作步骤见说明书。肠道中蛋白酶活性采用福林-酚试剂法[11]测定。血浆中补体3(complement 3,C3)、补体4(complement 4,C4)和免疫球蛋白M(immunoglobulin M, IgM)含量的测定采用南京建成生物工程研究所生产的酶联免疫吸附试验(ELISA)试剂盒测定,详细操作步骤见说明书。
采用Anderson等[12]所描述的硝基四氮唑蓝(nitro-blue tetrazolium, NBT)方法进行全血呼吸爆发活力的测定,具体如下:1)在100 μL抗凝血中加入100 μL 0.2%NBT(将0.2 g NBT溶于100 mL的无菌0.65%~0.70%的生理盐水中制得NBT染液),25 ℃孵育30 min(EP管中)。2)取50 μL上述反应液,加入1 mL N, N-二甲基甲酰胺,混匀后在2 000 r/min下离心5 min。3)取离心后的上清液1 mL,在540 nm下读取光密度(OD)值,以1 mL N, N-二甲基甲酰胺作为空白对照。全血呼吸爆发强度以NBT反应的OD值表示。
肠道透射电镜样品的制备和测量:取肠道中部组织,切成0.5~1.0 mm3的小块用磷酸盐缓冲液(PBS)漂洗2次后直接加入2.5%戊二醛固定24 h;用1%的锇酸固定直至成为黑色;送电镜室脱水、包埋、切片后置透射电镜(HT-7700,日立透射电子显微镜)下观察。最后每组选取3个样品进行电镜观察,使用Imagepro-plus软件测量肠道微绒毛长度,每个样品随机测量10根,每组得出30个数据后进行统计分析。
1.6 生长性能指标计算公式

|
采样结束后,在每个网箱中选择规格基本相近的试验鱼15尾进行攻毒试验,每组3个网箱。攻毒使用的嗜水气单胞菌由中国水产科学研究院淡水渔业研究中心提供,将其用无菌生理盐水稀释至1×106 CFU/mL(通过预试验得出的杂交鳢半致死浓度)。按每100 g腹腔注射菌液1 mL的剂量注射后放回网箱,继续正常投饵,观察其在96 h内的累积死亡率,每天观察3次。
累积死亡率(%)=100×死亡鱼尾数/攻毒鱼尾数。
1.8 数据统计和分析采用SPSS 18.0对数据进行单因素方差分析(one-way ANOVA),并采用Duncan氏法进行组间的多重比较,显著水平为P<0.05。数据用平均值±标准误(mean±SE)形式表示。
2 结果与分析 2.1 黄芪多糖对杂交鳢生长性能的影响从表 2中可以得出,APS1.50和APS2.00组的末重和增重率显著高于APS0、APS0.25、APS0.50和APS1.00组(P<0.05),APS1.00组的末重和增重率显著高于APS0.25组(P<0.05),APS0、APS0.50和APS1.00之间末重和增重率无显著差异(P>0.05)。饲料系数在各组之间无显著差异(P>0.05),但是随着饲料中黄芪多糖添加量的增加,饲料系数先有下降趋势,在APS1.50组达到最低,当黄芪多糖添加量再增加后饲料系数则略有上升。成活率在各组之间无显著差异(P>0.05)。
|
|
表 2 黄芪多糖对杂交鳢生长性能的影响 Table 2 Effects of APS on growth performance of hybrid snakehead |
由表 3可知,在饲料中添加不同水平的黄芪多糖对杂交鳢肠道淀粉酶活性没有产生显著影响(P>0.05)。肠道蛋白酶和脂肪酶活性均随饲料中黄芪多糖添加量的增加呈先上升后下降趋势,APS1.50组显著高于APS0和APS0.25组(P<0.05),但与APS1.00和APS2.00组差异不显著(P>0.05)。
|
|
表 3 黄芪多糖对杂交鳢肠道消化酶活性和微绒毛长度的影响 Table 3 Effects of APS on digestive enzyme activities and microvilli length in intestine of hybrid snakehead |
图 1和表 3可以看出,随着饲料中黄芪多糖添加量的增加,杂交鳢肠道微绒毛长度先随之增长,在添加量为1.50 g/kg时有最高值,继续增加添加量则出现下降,同时APS1.50和APS2.00组显著高于APS0、APS0.50和APS0.25组(P<0.05)。
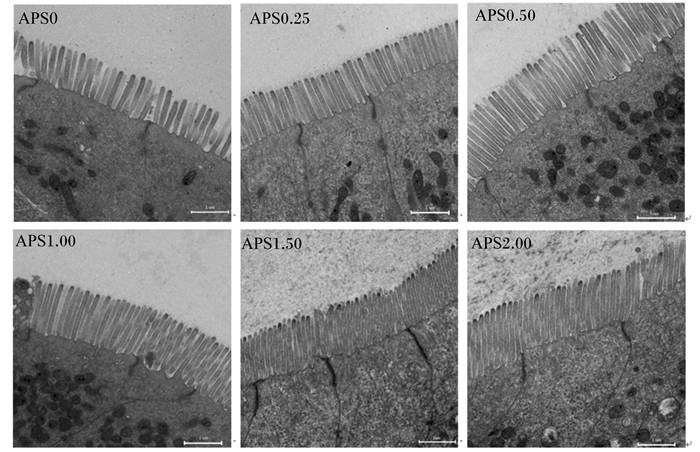
|
图 1 杂交鳢的肠道微绒毛的透射电镜显微图 Figure 1 TEM micrographs of intestinal microvilli of hybrid snakehead (3 000×) |
由表 4可知,血浆中LSZ活性与C3、C4含量以及全血呼吸爆发活力均随着饲料中黄芪多糖添加量的增加先升高后降低,最高值均出现在APS1.50组,显著高于APS0组(P<0.05),除C3含量与APS1.00组差异显著(P<0.05)外,其他指标与APS1.00和APS2.00组差异均不显著(P>0.05)。血浆中ACP活性的变化趋势与LSZ类似,但ACP活性最高值出现在APS1.00组,显著高于APS0组(P<0.05),与其他各组差异不显著(P>0.05)。
|
|
表 4 黄芪多糖对杂交鳢血液免疫指标的影响 Table 4 Effects of APS on blood immune indexes of hybrid snakehead |
由图 2可知,血浆中IgM含量在APS0组最低(1.22 g/L),显著低于APS0.50、APS1.00、APS1.50和APS2.00组(P<0.05),但与APS0.25组差异不显著(P>0.05)。血浆中IgM含量最高值出现在APS1.50组,为1.75 g/L,显著高于APS0和APS0.25组(P<0.05),与其他各组差异不显著(P>0.05)。
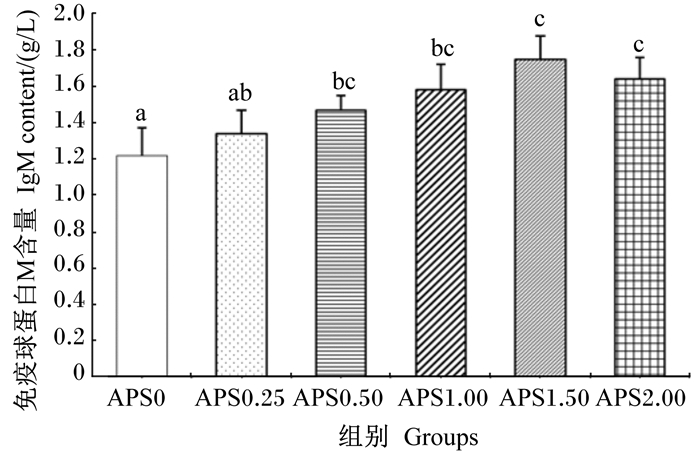
|
数据柱标注不同字母表示差异显著(P<0.05)。 Date columns with different letters were significantly different (P < 0.05). 图 2 黄芪多糖对杂交鳢血浆中IgM含量的影响 Figure 2 Effects of APS on plasma IgM content of hybrid snakehead |
由表 5可知,杂交鳢血浆中CAT活性随着饲料中黄芪多糖添加量的增加先不断升高,当添加量达到0.25 g/kg后又有所降低,APS0.50、APS1.00、APS1.50和APS2.00组均显著高于APS0和APS0.25组(P<0.05),同时APS1.00和APS1.50组还显著高于APS0.50和APS2.00组(P<0.05)。血浆中SOD活性和T-AOC的变化趋势与CAT相似,表现为APS1.00和APS1.50组显著高于其他4组(P<0.05),其中APS1.50组有最高值。血浆中MDA含量随饲料中APS添加量的增加先降低后升高,最低值出现在APS1.50组,显著低于APS0、APS0.25和APS0.50组(P<0.05),但与APS1.00和APS2.00组差异不显著(P>0.05)。
|
|
表 5 黄芪多糖对杂交鳢血浆抗氧化指标的影响 Table 5 Effects of APS on plasma antioxidant indexes of hybrid snakehead |
由表 6可知,杂交鳢肝脏中CAT活性随饲料中黄芪多糖添加量的增加先升高后降低,当添加量为1.50 g/kg时达到最高,APS1.50组显著高于APS0、APS0.25、APS0.50组(P<0.05),略高于APS1.00和APS2.00组(P>0.05)。APS2.00组杂交鳢肝脏中SOD活性最高,显著于其他5组(P<0.05)。肝脏中MDA含量随饲料中黄芪多糖添加量的增加先降低后增加,APS1.50组为所有组中最低,且APS1.50和APS2.00组显著低于其他4组(P<0.05)。
|
|
表 6 黄芪多糖对杂交鳢肝脏抗氧化指标的影响 Table 6 Effects of APS on liver antioxidant indexes of hybrid snakehead |
注射嗜水气单胞菌后杂交鳢累积死亡率的趋势如图4所示,杂交鳢累积死亡率最低的为APS1.50组,显著低于APS0、APS0.50和APS0.25组(P<0.05),但与APS1.00和APS2.00组差异不显著(P>0.05)。
3 讨论 3.1 黄芪多糖对杂交鳢生长性能的影响从已发表的研究结果来看,黄芪多糖在水产动物上的应用具有显著的促生长作用,如在齐口裂腹鱼[6]、罗非鱼[13]、克氏原螯虾[14]和尼罗罗非鱼[15]上。本试验结果表明,当黄芪多糖的添加量为1.50或2.00 g/kg时,杂交鳢的生长性能显著高于未添加黄芪多糖的对照组。这可能与以下几个方面有关:1)黄芪多糖是从中药黄芪中提取的具有特殊生物活性的多糖,在饲料中适量添加能促进肠道内乳酸菌、酵母菌、假单胞菌、双歧杆菌等有益菌的增殖,而有益菌自身能产生各种消化酶,最终提高了鱼体的消化酶活性[16];2)黄芪多糖通过促进鱼体消化液的分泌,提高了机体对营养物质的消化和吸收[17];3)黄芪多糖可显著提高肠道绒毛长度、皱褶深度和肌层厚度,增加肠道黏液细胞和上皮内淋巴细胞的数量[18],从而提高鱼体的消化吸收能力,促进生长;4)黄芪多糖中某些活性物质可促进动物蛋白质的合成,使动物所吸收的营养物质合成其本身蛋白质能力增强,从而提高动物的生长速度[6, 19]。本试验结果表明,黄芪多糖能促进杂交鳢肠道微绒毛的发育,同时增强了肠道消化酶的活性,提高了机体对饲料中营养物质的消化和吸收,加快了生长速度,并降低了饲料系数。作为肉食性鱼类的杂交鳢,在本试验条件下促生长效果较佳的黄芪多糖添加量为1.50~2.00 g/kg,与其他学者得出的齐口裂腹鱼[6]饲料中适宜黄芪多糖添加量为0.040%~0.074%、罗非鱼需要黄芪多糖脂质体100~200 mL/kg[13]、克氏原螯虾饲料中黄芪多糖适宜添加量为0.40%~0.80%[14]和尼罗罗非鱼添加1 500 mg/kg的黄芪多糖生长速度最快[15]的结果存在差异,这可能与试验鱼的食性、生长阶段以及黄芪多糖的纯度等有关,因此在生产养殖中添加应用时还需对以上因素进行考虑。
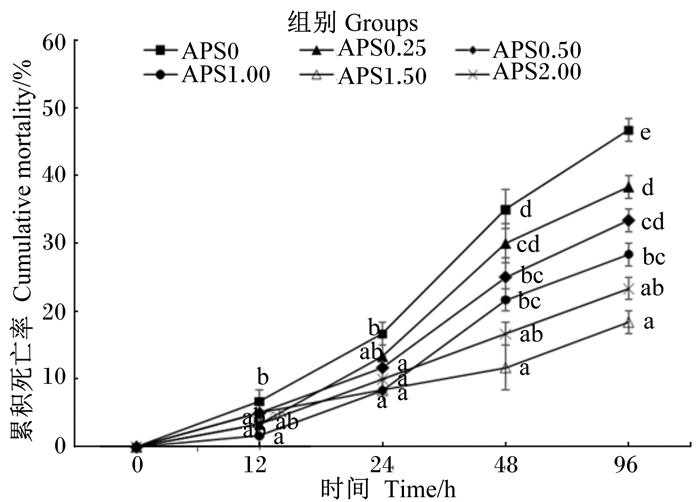
|
数据点标注不同字母表示差异显著(P<0.05)。 Date points with different letters were significantly different (P < 0.05). 图 3 黄芪多糖对杂交鳢累积死亡率的影响 Figure 3 Effects of APS on cumulative mortality of hybrid snakehead |
鱼类的特异性免疫系统相对不完善,因此主要是非特异性免疫在免疫系统中发挥主要作用,其主要包括LSZ、ACP、补体和抗菌肽等物质。LSZ能水解致病菌中的黏多糖,起到杀灭外界细菌的作用,是动物机体重要的非特异性免疫因子[20],它的活性是衡量动物体非特异性免疫力的一个重要量化指标[21]。ACP是巨噬细胞内溶酶体的标志酶,在动物血细胞进行吞噬和包围化的免疫反应中,会伴随有ACP的释放[22]。补体是鱼类免疫系统的重要组成部分,具有对抗微生物侵入和清除免疫复合物的功能[23]。本试验结果表明,饲料中添加适量的黄芪多糖能促进杂交鳢机体的非特异性免疫力,增强机体的抗病力,当添加量为1.50 g/kg时效果达到最佳。这与在罗非鱼饲料中添加1 000和1 500 mg/kg的黄芪多糖能提高鱼体的非特异性免疫力的研究结果[24]相似。柏冬志等[25]认为黄芪多糖能提高机体免疫能力的原因在于黄芪多糖能增加细胞的代谢能力,促进免疫器官的发育,对体内T细胞、B细胞、自然杀伤(NK)细胞等免疫细胞的功能和活性有促进作用。在基因层面则表现为黄芪多糖能促进细胞中DNA及RNA的合成与转录,以及蛋白质的合成与表达,尤其是与某些疾病的发生发展密切相关核转录因子-κB(NF-κB)、白细胞介素-1β(IL-1β)及肿瘤坏死因子-α(TNF-α)等细胞因子mRNA的表达水平[26]。
免疫球蛋白主要参与鱼类的体液免疫,而IgM是鱼体内重要的免疫球蛋白,在免疫应激中发挥着重要的作用,其含量的上升代表着机体免疫机能的提高。陈强等[27]的研究发现,在肉鸡饲粮中添加300 mg/kg的黄芪多糖,在21日龄时,其血清中IgM的含量较其他各组有显著增加。本试验发现杂交鳢血浆中IgM的含量随饲料中黄芪多糖添加量的增加先升高后降低,在添加量为1.50 g/kg时达到最高值,由此可见适宜添加量的黄芪多糖能提高杂交鳢的体液免疫能力。
3.3 黄芪多糖对杂交鳢抗氧化能力的影响当鱼体处在病理或者应激状态时,体内会产生过量的活性氧和自由基,它们能够通过攻击蛋白质、DNA和细胞膜等,从而使机体的代谢系统出现紊乱,最终将导致鱼体的生长发育缓慢、免疫机能下降、饲料系数增加,并危害水产品的质量[28-29]。当机体内活性氧和自由基含量上升时,血液中SOD和CAT的活性都会出现升高以清除这些有害物质[30]。张伟妮等[24]研究发现,在罗非鱼饲料中添加适量黄芪多糖能显著提高其血浆中SOD和CAT的活性,提高肝脏和心脏等各组织中SOD和CAT的活性,同时还能降低这些组织中MDA的含量;Jia等[31]研究显示,在罗非鱼饲料中添加1.5、3.0 g/kg的黄芪多糖可以显著降低四氯化碳(CCl4)损伤肝细胞培养液和血清中SOD的活性和T-AOC,并且能显著抑制肝脏组织中MDA的合成量;陈亚军等[32]研究表明,黄芪多糖能显著降低环磷酰胺(一种免疫抑制剂)对大鳞副泥鳅肝胰脏抗氧化体系的损伤作用,对机体免疫功能具有较好的调节作用。本试验结果表明,在饲料中添加适量的黄芪多糖能够显著提高杂交鳢血浆和肝脏中SOD和CAT活性,同时能显著抑制血浆和肝脏中MDA合成,这些表明在饲料中添加适量的黄芪多糖能提高杂交鳢机体抗氧化酶的活性,降低氧自由基对机体的损伤,从而增加机体的抗氧化能力,与Yan等[33]、Li等[34]和Elabd等[35]所得结论类似。
3.4 黄芪多糖对杂交鳢抗病力的影响鱼类急性攻毒试验可通过统计短期内累积死亡率来评价鱼体的抗病力。洪徐鹏等[36]在给克氏原螯虾注射白斑病毒(WSSV)后,与阳性对照组相比,添加0.8%的黄芪多糖可提高26.67%的存活率,因此表明黄芪多糖可提高克氏原螯虾抗WSSV的能力;此外,在鲤鱼[9]和鲶鱼[37]上的攻毒试验也证明黄芪多糖同样起到了增强鱼体抗病力的作用。本试验结果与之类似,饲料中添加黄芪多糖能降低杂交鳢经嗜水气单胞菌攻毒后的累积死亡率,进一步说明黄芪多糖在提高鱼体的免疫能力和抗氧化能力后,增强了对疾病的抵抗能力,降低了发病率和死亡率。许明等[38]发现在草鱼饲料中添加黄芪多糖和维生素等对出血病能起到很好的治疗效果,这又从实践应用上验证了黄芪多糖能提高鱼体的抗病能力。
4 结论在饲料中添加黄芪多糖能提高杂交鳢的生长性能、免疫能力、抗氧化能力和抗病力,当添加量大于1.00 g/kg时表现出较明显的效果,但达到2.00 g/kg时作用效果又略有下降,因此,杂交鳢饲料中黄芪多糖的适宜添加量为1.50 g/kg。
| [1] |
张新铖, 陈昆慈, 朱新平. 乌鳢、斑鳢及杂交种养殖研究现状[J]. 广东农业科学, 2011, 32(22): 132-134. DOI:10.3969/j.issn.1004-874X.2011.22.044 |
| [2] |
张诚, 刘年锋, 杨小强, 等. 闽香鳢(斑鳢♀×乌鳢♂)及其亲本染色体组型的比较[J]. 上海水产大学学报, 2005, 14(2): 103-107. |
| [3] |
马恒甲, 刘新轶, 冯晓宇, 等. 补充有机硒对杂交鳢生长性能及抗氧化能力的影响[J]. 饲料研究, 2013(4): 57-59. |
| [4] |
周立斌, 张伟, 王安, 等. 利饲料维生素E添加量对花鲈生长、组织中维生素E积累量和免疫指标的影响[J]. 水产学报, 2009, 33(1): 95-102. |
| [5] |
NEJATIAN M, HATAMI M, MOHAMMADIFAR M A. Effect of gum tragacanth exuded by three Iranian Astragalus on mixed milk protein system during acid gelation[J]. International Journal of Biological Macromolecules, 2013, 53: 168-176. DOI:10.1016/j.ijbiomac.2012.11.001 |
| [6] |
向枭, 陈建, 周兴华, 等. 黄芪多糖对齐口裂腹鱼生长、体组成和免疫指标的影响[J]. 水生生物学报, 2011, 35(2): 291-299. |
| [7] |
KALLON S, LI X R, JI J, et al. Astragalus polysaccharide enhances immunity and inhibits H9N2 avian influenza virus in vitro and in vivo[J]. Journal of Animal Science and Biotechnology, 2013, 4(1): 22. DOI:10.1186/2049-1891-4-22 |
| [8] |
YIN G J, JENEY G, RACZ T, et al. Effect of two Chinese herbs (Astragalus radix and Scutellaria radix) on nonspecific immune response of tilapia, Oreochromis niloticus[J]. Aquaculture, 2006, 253(1/2/3/4): 39-47. |
| [9] |
YIN G J, ARDO L, THOMPSON K D, et al. Chinese herbs (Astragalus radix and Ganoderma lucidum) enhance immune response of carp, Cyprinus carpio, and protection against Aeromonas hydrophila[J]. Fish & Shellfish Immunology, 2009, 26(1): 140-145. |
| [10] |
胡兵, 刘军, 侯永清, 等. 黄芪多糖对异育银鲫非特异性免疫力的影响[J]. 水利渔业, 2008, 28(3): 108-111. |
| [11] |
北京大学生物系生物化学教研室. 生物化学实验指导[M]. 北京: 人民教育出版社, 1979: 73-74.
|
| [12] |
ANDERSON D P, SIWICKI A K. Basic hematology and serology for fish health programs[J]. Diseases in Asian Aquaculture, 1995, 2: 185-202. |
| [13] |
彭婷, 胡庭俊, 林勇, 等. 黄芪多糖脂质体对吉富罗非鱼生长性能的影响[J]. 西南农业学报, 2012, 25(6): 2368-2371. |
| [14] |
洪徐鹏, 夏思瑶, 唐嘉荩, 等. 黄芪多糖对克氏原螯虾生长和非特异性免疫指标的影响[J]. 上海海洋大学学报, 2013, 22(4): 571-576. |
| [15] |
ZAHRAN E, RISHA E, ABDELHAMID F, et al. Effects of dietary Astragalus polysaccharides (APS) on growth performance, immunological parameters, digestive enzymes, and intestinal morphology of Nile tilapia (Oreochromis niloticus)[J]. Fish & Shellfish Immunology, 2014, 38(1): 149-157. |
| [16] |
陈勇, 周洪琪. 三种多糖对异育银鲫肠道、肝胰脏蛋白酶和淀粉酶活性的影响[J]. 上海水产大学学报, 2005, 14(4): 468-471. |
| [17] |
肖拉. 枯草芽孢杆菌JS01和黄芪多糖对建鲤生长及免疫功能的影响[D]. 硕士学位论文. 雅安: 四川农业大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10626-1013157359.htm
|
| [18] |
黄玉章. 黄芪多糖对奥尼罗非鱼生长性能和免疫功能的影响[D]硕士学位论文. 福州: 福建农林大学, 2009. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1512126
|
| [19] |
李宏全, 赵万国, 吕小虎. 动物免疫增效剂黄芪多糖化学组分及其结构分析[J]. 中兽医医药杂志, 2008, 27(5): 5-9. |
| [20] |
SAURABH S, SAHOO P K. Lysozyme:an important defense molecule of fish innate immune system[J]. Aquaculture Research, 2008, 39(3): 223-239. DOI:10.1111/are.2008.39.issue-3 |
| [21] |
隋虎辰, 谢国驷, 边慧慧, 等. 两种多糖作为迟缓爱德华氏菌(Edwardsiella tarda)灭活疫苗佐剂对大菱鲆(Scophthalmus maximus)的免疫保护效果[J]. 海洋与湖沼, 2012, 43(5): 1001-1007. DOI:10.11693/hyhz201205018018 |
| [22] |
刘岩, 江晓路, 吕青, 等. 聚甘露糖醛酸对中国对虾免疫相关酶活性和溶菌溶血活性的影响[J]. 水产学报, 2000, 24(6): 549-553. |
| [23] |
MERRIFIELD D L, DIMITROGLOU A, FOEY A, et al. The current status and future focus of probiotic and prebiotic applications for salmonids[J]. Aquaculture, 2010, 302(1/2): 1-18. |
| [24] |
张伟妮, 林旋, 王寿昆, 等. 黄芪多糖对罗非鱼非特异性免疫和胃肠内分泌功能的影响[J]. 动物营养学报, 2010, 22(2): 401-409. |
| [25] |
柏冬志, 东方, 唐文婷, 等. 黄芪多糖药理作用的研究进展[J]. 黑龙江医药, 2014, 27(1): 103-106. |
| [26] |
李钦, 胡继宏, 高博, 等. 黄芪多糖在免疫调节方面的最新研究进展[J]. 中国实验方剂学杂志, 2017, 23(2): 199-206. |
| [27] |
陈强, 姜莉莉, 肖银霞, 等. 黄芪多糖对肉鸡生产性能及血清免疫球蛋白的影响[J]. 饲料研究, 2013(3): 50-52. |
| [28] |
MARTÍNEZ-ÁLVAREZ RM, MORALES ZAE, SANZ A. Antioxidant defenses in fish:biotic and abiotic factors[J]. Reviews in Fish Biology and Fisheries, 2005, 15(1/2): 75-88. |
| [29] |
MADEIRA D, NARCISO L, CABRAL H N, et al. Influence of temperature in thermal and oxidative stress responses in estuarine fish[J]. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 2013, 166(2): 237-243. |
| [30] |
王雅慧, 王裕玉, 麦康森, 等. 饲料中添加姜黄素对大菱鲆幼鱼生长、体组成及抗氧化酶活力的影响[J]. 水产学报, 2016, 40(9): 1299-1308. |
| [31] |
JIA R, CAO L P, XU P, et al. In vitro and in vivo hepatoprotective and antioxidant effects of Astragalus polysaccharides against carbon tetrachloride-induced hepatocyte damage in common carp (Cyprinus carpio)[J]. Fish Physiology and Biochemistry, 2012, 38(3): 871-881. DOI:10.1007/s10695-011-9575-z |
| [32] |
陈亚军, 李义, 张若澜, 等. 黄芪多糖对免疫抑制大鳞副泥鳅非特异免疫功能的调节作用[J]. 粮食与饲料工业, 2016(4): 60-62, 69. |
| [33] |
YAN H, XIE Y P, SUN S G, et al. Chemical analysis of Astragalus mongholicus polysaccharides and antioxidant activity of the polysaccharides[J]. Carbohydrate Polymers, 2010, 82(3): 636-640. DOI:10.1016/j.carbpol.2010.05.026 |
| [34] |
LI R, CHEN W C, WANG W P, et al. Antioxidant activity of Astragalus polysaccharides and antitumour activity of the polysaccharides and siRNA[J]. Carbohydrate Polymers, 2010, 82(2): 240-244. DOI:10.1016/j.carbpol.2010.02.048 |
| [35] |
ELABD H, WANG H P, SHAHEEN A, et al. Astragalus membranaceus (AM) enhances growth performance and antioxidant stress profiles in bluegill sunfish (Lepomis macrochirus)[J]. Fish Physiology and Biochemistry, 2016, 42(3): 955-966. DOI:10.1007/s10695-015-0188-9 |
| [36] |
洪徐鹏, 陆宏达, 张庆华, 等. 黄芪多糖对克氏原螯虾抗白斑综合征病毒(WSSV)感染的效果研究[J]. 上海海洋大学学报, 2014, 23(3): 423-428. |
| [37] |
BAI D Q, WU X, ZHU G X, et al. Astragalus polysaccharides enhance cellular immune response and disease resistance in yellow catfish[J]. Israeli Journal of Aquaculture, 2012, 64(55): 688-695. |
| [38] |
许明, 马贵华. 黄芪多糖防治草鱼出血病的研究[J]. 安徽农业科学, 2008, 36(30): 13202-13230. DOI:10.3969/j.issn.0517-6611.2008.30.083 |



