2. 华中农业大学动物遗传育种与繁殖教育部重点实验室, 武汉 430070;
3. 武汉市动物疫病预防控制中心, 武汉 430016
2. Key Lab of Agricultural Animal Genetics, Breeding and Reproduction of Ministry of Education, Huazhong Agricultural University, Wuhan 430070, China;
3. Wuhan Center For Animal Disease Control and Prevention, Wuhan 430016, China
用于动物生产中的抗生素在提高生长性能的同时也引入许多问题[1]。无论是治疗还是预防上,抗生素使用导致的细菌耐药性、正常微生物区系的不平衡、食品中药物残留等问题在全球不断提升。目前,益生菌作为抗生素的替代品被成功应用,动物饲粮中添加益生菌具有预防疾病、促进生长的作用。益生菌的出现也使得现代畜禽养殖业的疾病治疗手段发生了巨大改变,从以前抗生素主导的化学治疗手段进入微观生物免疫的新领域。研究表明,益生菌不仅可以调节保持肠内稳态的共生细菌,而且还可以增强肠上皮细胞的屏障功能以及促进肠道健康[2-5]。在动物饲粮中添加益生菌可以减少肠道大肠杆菌、沙门氏菌以及梭菌等病原菌的数量[6-8]。芽孢杆菌作为一种新型的益生菌,因其内生孢子性质稳定,能够抵抗低温、化学、紫外线辐射等大量物理应激因子;同时可以产生较强的蛋白酶、脂肪酶和淀粉酶等,能够有效降解复杂的碳水化合物[9];以及具有耐酸、耐盐、耐高温、易储存加工和运输的特性[10];除此之外还具有消除病原菌、抗氧化、广谱抗菌、免疫调节和食品发酵的能力,是畜禽养殖中研究和使用较多的一类益生菌[11-14]。其中枯草芽孢杆菌(Bacillus subtilis)和地衣芽孢杆菌等已在我国得到批准可用作饲料添加剂。已有研究表明,枯草芽孢杆菌具有促进畜禽对营养物质的消化吸收、提高饲料利用率、减少肠道中有害菌群、调节胃肠道微生态平衡以及提高抗病力等多种功效[15-17]。但枯草芽孢杆菌对肉鸭系统性的研究报道相对较少。因此,本试验通过利用前期筛选出的一株枯草芽孢杆菌作为益生菌添加到肉鸭饲粮中,并以商品化复合芽孢杆菌为对照,研究其对肉鸭生长性能、免疫器官指数、肠道形态及肠道菌群等的影响,旨在为该益生菌在肉鸭配合饲料中的应用和研究提供科学依据。
1 材料与方法 1.1 试验材料枯草芽孢杆菌(活菌数量为1×109 CFU/g)由实验室分离筛选并制备;复合芽孢杆菌(含有枯草芽孢杆菌和地衣芽孢杆菌,活菌数量≥3×1010 CFU/g)由某公司提供。
1.2 试验设计选取2周龄体重相近、健康的樱桃谷肉鸭600只,随机分为3组,每组4个重复,每个重复50只。对照组饲喂基础饲粮,试验组分别在基础饲粮中添加2 g/kg枯草芽孢杆菌(BS组)和1 g/kg复合芽孢杆菌(CB组)。基础饲粮组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
试验在武汉市农科院试验鸭场进行,采用发酵床网上养殖模式,自由采食和饮水,其他饲养管理措施、免疫程序按鸭场常规管理程序进行。试验期为4周。
1.4 指标检测 1.4.1 生长性能测定于试验的第1、2、3、4周末空腹称重,每个重复随机抽取30只鸭逐只称重,并记录每周饲料消耗和死亡鸭只数,计算试验期间的平均日采食量、平均日增重、料重比和死亡率。
1.4.2 免疫器官指数和肠道菌群的测定于42日龄时,每个重复选取3只,每组共12只体况相近的健康鸭屠宰,分别采集胸腺、脾脏及法氏囊,剔除脂肪后称重,计算胸腺指数、脾脏指数和法氏囊指数。
免疫器官指数=免疫器官重量(g)/活重(kg)。
在超净台内稀释采集的盲肠内容物,选择2~3个适宜稀释度分别接种于营养琼脂、乳酸细菌培养基(MRS)琼脂、伊红美蓝琼脂平板(所用培养基均购自青岛海博生物技术有限公司),测定菌落总数及乳酸菌、大肠杆菌数量;选择2~3个适宜稀释度,80 ℃水浴15 min后,接种于营养琼脂平板,测定芽孢杆菌的数量。采用平板菌落计数法进行统计,结果用1 g肠道内容物中细菌数量的对数值[lg(CFU/g)]表示。
1.4.3 肠道形态的测定于42日龄时,每个重复选取3只,每组共12只体况相近的健康鸭屠宰,分别采集十二指肠、空肠和盲肠中段各2 cm组织样,生理盐水冲洗干净,置于4%多聚甲醛溶液中固定,按照常规方法制作石蜡切片,每个肠段取5张不连续切片,每张切片随机选5个典型视野(绒毛完整、走向平直),选取5个最长绒毛测量绒毛高度、隐窝深度和黏膜厚度,并计算绒毛高度/隐窝深度(V/C)。
1.5 数据处理试验数据用Excel 2007和SPSS 18.0进行统计分析,结果用“平均值±标准差”表示。P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析 2.1 枯草芽孢杆菌对肉鸭生长性能的影响枯草芽孢杆菌对肉鸭生长性能的影响见表 2。第3~6周,各组平均日增重、平均日采食量及料重比均呈现增加的趋势。其中,第3周,BS组料重比显著高于对照组(P<0.05),CB组与BS组之间料重比差异不显著(P>0.05);第5周,对照组平均日采食量极显著高于BS组和CB组(P<0.01),对照组料重比显著高于BS组和CB组(P<0.05);第6周,CB组平均日采食量极显著低于对照组和BS组(P<0.01)。总体来看,第3~6周,对照组平均日采食量极显著高于BS组和CB组(P<0.01),对照组料重比显著高于CB组(P<0.05),各组之间平均日增重和死亡率差异均不显著(P>0.05)。
|
|
表 2 枯草芽孢杆菌对肉鸭生长性能的影响 Table 2 Effects of Bacillus subtilis on growth performance of meat ducks |
由此可见,饲粮中添加枯草芽孢杆菌、复合芽孢杆菌均能够促进肉鸭后期生长发育。
2.2 枯草芽孢杆菌对肉鸭免疫器官指数的影响枯草芽孢杆菌对肉鸭免疫器官指数的影响见表 3。42日龄时,BS组和CB组的胸腺指数显著高于对照组(P<0.05),各组之间脾脏指数和法氏囊指数差异不显著(P>0.05),但BS组和CB组脾脏指数和法氏囊指数均有增加的趋势。
|
|
表 3 枯草芽孢杆菌对肉鸭免疫器官指数的影响 Table 3 Effects of Bacillus subtilis on immune organ indices of meat ducks |
由此可见,饲粮中添加枯草芽孢杆菌、复合芽孢杆菌均能够提高免疫器官指数,刺激肉鸭免疫器官发育。
2.3 枯草芽孢杆菌对肉鸭肠道菌群数量的影响枯草芽孢杆菌对肉鸭肠道菌群的影响见表 4。42日龄时,BS组和CB组盲肠内菌落总数和芽孢杆菌数量均显著高于对照组(P<0.05),大肠杆菌数量显著低于对照组(P<0.05),且BS组与CB组之间差异不显著(P>0.05);BS组乳酸菌数量显著高于对照组(P<0.05),CB组略高于与对照组,但差异不显著(P>0.05)。
|
|
表 4 枯草芽孢杆菌对肉鸭肠道菌群数量的影响 Table 4 Effects of Bacillus subtilis on intestineal flora number of meat ducks |
由此可见,饲粮中添加枯草芽孢杆菌能够促进乳酸菌的生长,抑制大肠杆菌的繁殖,维持肠道微生物区系的平衡,促进肉鸭生长。
2.4 枯草芽孢杆菌对肉鸭肠道形态的影响枯草芽孢杆菌对肉鸭肠道形态的影响见表 5。42日龄时,BS组和CB组肉鸭十二指肠的V/C极显著高于对照组(P<0.01),绒毛高度和黏膜厚度显著高于对照组(P<0.05);BS组隐窝深度显著低于对照组(P<0.05);CB组隐窝深度低于对照组,但差异不显著(P>0.05)。BS组和CB组肉鸭空肠的隐窝深度显著低于对照组(P<0.05),黏膜厚度显著高于对照组(P<0.05);CB组V/C显著高于对照组(P<0.05);BS组V/C略高于对照组,但差异不显著(P>0.05)。CB组肉鸭回肠的V/C极显著高于对照组(P<0.01);BS组V/C略高于对照组,但差异不显著(P>0.05)。
|
|
表 5 枯草芽孢杆菌对肉鸭肠道形态的影响 Table 5 Effects of Bacillus subtilis on intestinal morphology of meat ducks |
由图 1可见,BS组和CB组肉鸭绒毛结构较整齐规则,层次分明,绒毛较长且紧密,隐窝较浅。对照组绒毛较短且稀疏,隐窝较深。
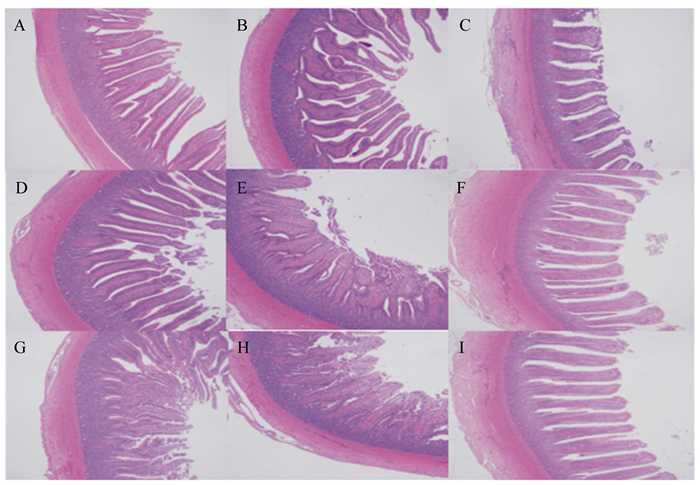
|
A、B、C:对照组;D、E、F:枯草芽孢杆菌组;G、H、I:复合芽孢杆菌组;A、D、G:十二指肠;B、E、H:空肠;C、F、I:回肠。 A, B and C: control group; D, E and F: BS group; G, H and I: CB group; A, D and G: duodenum; B, E and H: jejunum; C, F and I: ileum. 图 1 肉鸭十二指肠、空肠、回肠形态 Figure 1 Morphology of duodenum, jejunum and ileum of meat ducks (40×) |
由此可知,饲粮中添加枯草芽孢杆菌、复合芽孢杆菌可以提高肉鸭十二指肠绒毛高度,降低十二指肠、空肠隐窝深度,提高十二指肠、空肠黏膜厚度,改善肠道结构,促进小肠发育。
3 讨论 3.1 枯草芽孢杆菌对肉鸭生长性能的影响许多研究表明,在肉鸭饲粮中添加适量的枯草芽孢杆菌可以提高饲料的利用率,改善肉鸭的生长性能[16, 18-19]。本试验研究表明,在肉鸭饲粮中添加枯草芽孢杆菌能够降低42日龄肉鸭后期(第5周)和全期(第3~6周)的平均日采食量和料重比。这与齐博等[20]研究结果相似。BS组和CB组前期(第3周)料重比较高,可能是芽孢杆菌在肠道内定植以及对肠道微生态体系的调节作用需要一定的时间。此外,益生菌提高动物的生长性能主要是通过提供营养和消化酶[21]。芽孢杆菌能够提供某些营养素、维生素K、维生素B12以及一些胞外酶和生长因子[22]。这些成分能够改善肠道的消化功能,提高动物对饲粮中营养物质的消化和吸收。
3.2 枯草芽孢杆菌对肉鸭免疫器官指数的影响胸腺、法氏囊、脾脏对于禽类的免疫功能至关重要。其中胸腺是中枢免疫器官之一,在诱导T淋巴细胞分化和成熟中起重要作用,法氏囊是禽类特异性的体液免疫器官。脾脏作为最大的外周免疫器官,主要参与机体的体液免疫和细胞免疫。Heckert等[23]指出,测量免疫器官重量是评价鸡免疫状况的常用方法。枯草芽孢杆菌可以在肠道内产生多种有益物质,如维生素、氨基酸类等,这些有益物质可以促进免疫器官的发育。本研究结果表明,饲粮中添加枯草芽孢杆菌对42日龄肉鸭胸腺的发育有显著的促进作用;对脾脏和法氏囊的发育也有一定的促进作用,但是效果不显著。这与赵娜等[24]的研究结果相似。然而另一些研究表明,肉鸭饲粮中添加益生菌可显著增加法氏囊指数或者胸腺指数和脾脏指数[16, 25]。免疫器官发育的差异可能与动物机体的健康状况、益生菌在肠道产生的免疫活性成分、菌种的生物学特性以及添加的浓度有关。
3.3 枯草芽孢杆菌对肉鸭肠道菌群的影响动物肠道微生物区系的平衡对于动物的生长发育有着直接的影响。在饲养管理中不可避免的会导致大肠杆菌、沙门氏菌、肠球菌等病原菌进入畜禽肠道内繁殖。进入肠道的病原菌会通过产生毒素和有害物质减少肠道微生物的种类与数量,降低肠道微生物的多样性[26-27]。肠道微生物多样性的减少会降低肠内稳态和抵御病原菌的能力。研究表明,益生菌不仅能够通过刺激先天或后天免疫系统,还可以通过调节肠上皮细胞的通透性、黏液分泌以及分泌抗菌化合物增强机体抵抗病原菌[4];此外,Li等[28]报道,芽孢杆菌能抑制肠道有害菌的繁殖,促进肠道有益菌的生长。本试验研究发现,饲粮中添加枯草芽孢杆菌能够使肉鸭盲肠菌落总数及芽孢杆菌、乳酸菌的数量显著增加,大肠杆菌的数量显著下降。这说明枯草芽孢杆菌能够在肉鸭肠道内定植,通过促进肉鸭肠道微生物区系的平衡,发挥益生功效。
另外,枯草芽孢杆菌发挥益生功效主要是由于其可以以芽孢的形态被动物摄入体内,在肠道内迅速增殖形成厌氧的环境,促进乳酸菌、双歧杆菌等厌氧有益菌的繁殖,通过降低肠道pH抑制病原菌的生长,通过分泌抗菌肽和细菌素类的抗菌活性物质抑制病原菌的繁殖[29-30],以及通过竞争排斥作用减少病原菌在肠道内的定植等多方面共同作用来调节肉鸭肠道内的稳态,从而促进肉鸭的生长发育。
3.4 枯草芽孢杆菌对肉鸭肠道组织形态的影响小肠在营养物质吸收方面占据重要的位置。绒毛高度、黏膜厚度、隐窝深度是反映小肠功能的主要指标。当绒毛高度增加时,与小肠内营养物质的接触面积也相应增加,从而增强对营养物质的消化吸收能力[31]。研究表明,益生菌在肠道内的代谢产物(乳酸、琥珀酸、短链挥发性脂肪酸等),除了用于宿主的能量需求,还会刺激黏膜层下的血管,促进肠绒毛的发育。隐窝是肠细胞增殖、分化的地方,并且肠道隐窝从基部向绒毛方向不断分化,促进绒毛生长。隐窝深度会随着基部细胞的生成率的变化而变化,生成率降低则隐窝深度变浅,进而肠上皮细胞成熟率上升,增强对肠道营养物质消化吸收的能力。此外,浅的隐窝深度会促进肠上皮细胞的快速更新以应对致病菌的炎症[32]。因此,V/C可以评价动物肠道生理的变化,V/C升高,表明肠黏膜结构改善,消化吸收能力增强。益生菌促进动物肠道黏膜结构发育和改善主要是益生菌进入动物肠道内,能够不断的刺激肠道黏膜发育以及肠上皮细胞的更新,从而提高绒毛高度/隐窝深度;益生菌在肠道内能够通过竞争抑制以及产生一些抗菌肽、细菌素等代谢产物抑制有害菌的定植,减少对肠道黏膜的损伤,进而促进肠道健康。研究表明,在樱桃谷鸭(28日龄)饲粮中添加益生芽孢杆菌能够显著提高十二指肠、空肠的绒毛高度、V/C以及降低十二指肠隐窝深度[16]。在临武鸭饲粮中添加5.0×1010 CFU/kg枯草芽孢杆菌,对空肠和回肠V/C有显著影响[33]。本试验研究表明,饲粮中添加枯草芽孢杆菌能提高十二指肠绒毛高度和V/C,降低十二指肠、空肠隐窝深度。这表明枯草芽孢杆菌可以改善肉鸭肠道结构,促进小肠的发育,特别是十二指肠和空肠。
4 结论① 饲粮中添加枯草芽孢杆菌可以提高肉鸭的生长性能。
② 饲粮中添加枯草芽孢杆菌可以抑制肉鸭盲肠中有害菌的生长,促进有益菌的增殖,维持肠道微生物区系的平衡,刺激免疫器官的发育。
③ 饲粮中添加枯草芽孢杆菌可以改善肉鸭肠道黏膜结构,促进小肠的发育。
| [1] |
BUROW E, SIMONEIT C, TENHAGEN B A, et al. Oral antimicrobials increase antimicrobial resistance in porcine E. coli-a systematic review[J]. Preventive Veterinary Medicine, 2014, 113(4): 364-375. DOI:10.1016/j.prevetmed.2013.12.007 |
| [2] |
SONNENBURG J L, CHEN C T, GORDON J I, et al. Genomic and metabolic studies of the impact of probiotics on a model gut symbiont and host[J]. PLoS Biology, 2006, 4(12): e413. DOI:10.1371/journal.pbio.0040413 |
| [3] |
MARTIN F P J, WANG Y L, SPRENGER N, et al. Probiotic modulation of symbiotic gut microbial-host metabolic interactions in a humanized microbiome mouse model[J]. Molecular Systems Biology, 2008, 4(1): 157. |
| [4] |
LA FATA G, WEBER P, MOHAJERI M H. Probiotics and the gut immune system:indirect regulation[J]. Probiotics and Antimicrobial Proteins, 2017(14S): 1-11. |
| [5] |
PAGNINI C, SAEED R, BAMIAS G, et al. Probiotics promote gut health through stimulation of epithelial innate immunity[J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(1): 454-459. DOI:10.1073/pnas.0910307107 |
| [6] |
CHOI J Y, SHINDE P L, INGALE S L, et al. Evaluation of multi-microbe probiotics prepared by submerged liquid or solid substrate fermentation and antibiotics in weaning pigs[J]. Livestock Science, 2011, 138(1/2/3): 144-151. |
| [7] |
SEN S, INGALE S L, KIM Y W, et al. Effect of supplementation of Bacillus subtilis LS 1-2 to broiler diets on growth performance, nutrient retention, caecal microbiology and small intestinal morphology[J]. Research in Veterinary Science, 2012, 93(1): 264-268. DOI:10.1016/j.rvsc.2011.05.021 |
| [8] |
LEVKUT M, REVAJOVÁ V, LAUKOVÁ A, et al. Leukocytic responses and intestinal mucin dynamics of broilers protected with Enterococcus faecium EF55 and challenged with Salmonella enteritidis[J]. Research in Veterinary Science, 2012, 93(1): 195-201. DOI:10.1016/j.rvsc.2011.06.021 |
| [9] |
LATORRE J D, HERNANDEZ-VELASCO X, WOLFENDEN R E, et al. Evaluation and selection of bacillus species based on enzyme production, antimicrobial activity, and biofilm synthesis as direct-fed microbial candidates for poultry[J]. Frontiers in Veterinary Science, 2016, 3: 95. |
| [10] |
BADER J, ALBIN A, STAHL U. Spore-forming bacteria and their utilisation as probiotics[J]. Beneficial Microbes, 2012, 3(1): 67-75. DOI:10.3920/BM2011.0039 |
| [11] |
LEFEVRE M, RACEDO S M, RIPERT G, et al. Probiotic strain Bacillus subtilis CU1 stimulates immune system of elderly during common infectious disease period:a randomized, double-blind placebo-controlled study[J]. Immunity & Ageing, 2015, 12(1): 24. |
| [12] |
SHOBHARANI P, PADMAJA R J, HALAMI P M. Diversity in the antibacterial potential of probiotic cultures Bacillus licheniformis MCC2514 and Bacillus licheniformis MCC2512[J]. Research in Microbiology, 2015, 166(6): 546-554. DOI:10.1016/j.resmic.2015.06.003 |
| [13] |
RIPERT G, RACEDO S M, ELIE A M, et al. Secreted compounds of the probiotic Bacillus clausii strain O/C inhibit the cytotoxic effects induced by Clostridium difficile and Bacillus cereus toxins[J]. Antimicrobial Agents and Chemotherapy, 2016, 60(6): 3445-3354. DOI:10.1128/AAC.02815-15 |
| [14] |
TERLABIE N N, SAKYI-DAWSON E, AMOA-AWUA W K. The comparative ability of four isolates of Bacillus subtilis to ferment soybeans into dawadawa[J]. International Journal of Food Microbiology, 2006, 106(2): 145-152. DOI:10.1016/j.ijfoodmicro.2005.05.021 |
| [15] |
LEE K W, KIM D K, LILLEHOJ H S, et al. Immune modulation by Bacillus subtilis-based direct-fed microbials in commercial broiler chickens[J]. Animal Feed Science and Technology, 2015, 200: 76-85. DOI:10.1016/j.anifeedsci.2014.12.006 |
| [16] |
GUO M J, HAO G G, WANG B H, et al. Dietary Administration of Bacillus subtilis enhances growth performance, immune response and disease resistance in cherry valley ducks[J]. Frontiers in Microbiology, 2016, 7: 1975. |
| [17] |
谢强, 李孟孟, 王文策, 等. 益生菌对家禽肠道微生态的调控及其应用[J]. 饲料研究, 2017(2): 30-36. |
| [18] |
XING Y T, WANG S P, FAN J X, et al. High lysine-yielding Bacillus subtilis as a promising alternative to antibiotic for its effects on performance and immune responses of Linwu ducks[J]. Journal of Animal & Veterinary Advances, 2014, 13(6): 355-364. |
| [19] |
邢月腾, 李丽立, 王升平, 等. 枯草芽孢杆菌PL83对育雏期临武鸭生长性能和血清生化指标的影响[J]. 湖南农业大学学报(自然科学版), 2014, 40(3): 294-298, 320. |
| [20] |
齐博, 武书庚, 王晶, 等. 枯草芽孢杆菌对肉仔鸡生长性能、肠道形态和菌群数量的影响[J]. 动物营养学报, 2016, 28(6): 1748-1756. |
| [21] |
SAHU M K, SWARNAKUMAR N S, SIVAKUMAR K, et al. Probiotics in aquaculture:importance and future perspectives[J]. Indian Journal of Microbiology, 2008, 48(3): 299-308. DOI:10.1007/s12088-008-0024-3 |
| [22] |
SANDERS M E, MORELLI L, TOMPKINS T A. Sporeformers as human probiotics:Bacillus, Sporolactobacillus, and Brevibacillus[J]. Comprehensive Reviews in Food Science & Food Safety, 2003, 2(3): 101-110. |
| [23] |
HECKERT R A, ESTEVEZ I, RUSSEK-COHEN E, et al. Effects of density and perch availability on the immune status of broilers[J]. Poultry Science, 2002, 81(4): 451-457. DOI:10.1093/ps/81.4.451 |
| [24] |
赵娜, 申杰, 魏金涛, 等. 凝结芽孢杆菌对肉鸡生长性能、免疫器官指数、血清生化指标及肠道菌群的影响[J]. 动物营养学报, 2017, 29(1): 249-256. |
| [25] |
谢丽曲, 曾丽莉, 陈婉如, 等. 凝结芽孢杆菌在肉鸭配合饲料中的作用机理[J]. 福建农林大学学报(自然科学版), 2015, 44(5): 501-506. |
| [26] |
MOUNTZOURIS K C, DALAKA E, PALAMIDI I, et al. Evaluation of yeast dietary supplementation in broilers challenged or not with Salmonella on growth performance, cecal microbiota composition and Salmonella in ceca, cloacae and carcass skin[J]. Poultry Science, 2015, 94(10): 2445-2455. DOI:10.3382/ps/pev243 |
| [27] |
BARMAN M, UNOLD D, SHIFLEY K, et al. Enteric salmonellosis disrupts the microbial ecology of the murine gastrointestinal tract[J]. Infection and Immunity, 2008, 76(3): 907-915. DOI:10.1128/IAI.01432-07 |
| [28] |
LI S P, ZHAO X J, WANG J Y. Synergy of Astragalus polysaccharides and probiotics (Lactobacillus and Bacillus cereus) on immunity and intestinal microbiota in chicks[J]. Poultry Science, 2009, 88(3): 519-525. DOI:10.3382/ps.2008-00365 |
| [29] |
LECLÈRE V, BÉCHET M, ADAM A, et al. Mycosubtilin overproduction by Bacillus subtilis BBG100 enhances the organism's antagonistic and biocontrol activities[J]. Applied & Environmental Microbiology, 2005, 71(8): 4577-4584. |
| [30] |
Stein T. Bacillus subtilis antibiotics:structures, syntheses and specific functions[J]. Molecular Microbiology, 2005, 56(4): 845-857. DOI:10.1111/j.1365-2958.2005.04587.x |
| [31] |
DA LOS SANTOS F S, FARNELL M B, TELLEZ G, et al. Effect of prebiotic on gut development and ascites incidence of broilers reared in a hypoxic environment[J]. Poultry Science, 2005, 84(7): 1092-100. DOI:10.1093/ps/84.7.1092 |
| [32] |
AL-FATAFTAH A R, ABDELQADER A. Effects of dietary Bacillus subtilis on heat-stressed broilers performance, intestinal morphology and microflora composition[J]. Animal Feed Science and Technology, 2014, 198: 279-285. DOI:10.1016/j.anifeedsci.2014.10.012 |
| [33] |
XING Y, WANG S, FAN J, et al. Effects of dietary supplementation with lysine-yielding on Bacillus subtilis gut morphology, cecal microflora, and intestinal immune response of Linwu ducks[J]. Journal of Animal Science, 2015, 93(7): 3449-3457. DOI:10.2527/jas.2014-8090 |




