2. 成都农业科技职业学院, 成都 611130;
3. 成都中牧生物药业有限公司, 成都 610000
2. Chengdu Agricultural College, Chengdu 611130, China;
3. Chengdu Zhongmu Biological Pharmaceutical Co., Ltd., Chengdu 610000, China
枯草芽孢杆菌为国际公认的可在饲料中直接使用的微生物菌种,能够维持和调整肠道菌群平衡,增强机体免疫力,分泌多种消化酶,提高饲料消化利用率,促进动物的生长[1-2]。枯草芽孢杆菌不分泌毒素、安全性好、易于基因调控、无密码子偏爱性、生长快、易于培养,基因重组后所表达的外源蛋白可直接分泌到环境中,为优良的外源蛋白表达系统;但其同时也能分泌蛋白酶,导致其作为分泌表达系统存在着一定的局限性;而枯草芽孢杆菌的芽孢具有耐酸、盐、挤压、高温,生产中芽孢易纯化、成本低等优点,因而,使其芽孢表面用于展示外源功能蛋白已成为研究热点[3-4]。Lian等[5]将人类生长因子(hGH)表面展示于枯草芽孢杆菌芽孢衣壳并饲喂家蚕,结果显示展示于芽孢衣壳表面的hGH蛋白可以被家蚕消化吸收至血淋巴。Zhou等[6]将幽门螺杆菌脲酶B蛋白展示于枯草芽孢杆菌芽孢衣壳表面并饲喂小鼠后发现其产生粪便脲酶B特异性分泌型免疫球蛋白A(SIgA)和血清免疫球蛋白G(IgG)。刘明刚等[7-8]构建了表面展示鸡白痢沙门氏菌外膜蛋白OmpC的重组枯草芽孢杆菌SE1制剂,并经口给予小鼠,发现可以诱导小鼠抗鸡白痢沙门氏菌特异性抗体并对鼠伤寒沙门氏菌病具有一定的交叉保护作用。但将表面展示技术用于构建的重组枯草芽孢杆菌对动物生长性能、肠道消化酶活性和菌群的影响鲜有报道。本试验以白羽肉鸡为试验对象,将表面展示鸡白痢沙门氏菌外膜蛋白OmpC的重组枯草芽孢杆菌SE1饲喂肉鸡,研究其对肉鸡生长性能、肠道消化酶活性和菌群的影响,比较其与枯草芽孢杆菌168效果的差异,为该重组菌的应用提供试验基础。
1 材料与方法 1.1 试验材料枯草芽孢杆菌168制剂(活芽孢数为1.0×109 CFU/g)、表面展示鸡白痢沙门菌外膜蛋白OmpC的重组枯草芽孢杆菌SE1制剂(活芽孢数为1.0×109 CFU/g)均由本研究中心提供。
1.2 试验设计与试验饲粮选择7日龄科宝500(Cobb-500)肉鸡120只,随机分为3组,每组4个重复,每个重复10只鸡。A组(对照组)饲喂基础饲粮,B组在基础饲粮中添加0.1%(1.0×106 CFU/g)枯草芽孢杆菌168制剂,C组在基础饲粮中添加0.1%(1.0×106 CFU/g)重组枯草芽孢杆菌SE1制剂,添加量由前期相关预试验确定。基础饲粮(无抗菌药物)由成都市彭州某饲料厂提供,其组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of basal diets (air-dry basis) |
试验鸡采用单层笼养,各组分别隔离饲养,红外灯保温,平均室温为26 ℃左右。自由采食、饮水,定期清洁鸡笼。每天观察鸡群的采食、饮水和健康情况,记录耗料量和发病、死亡情况,试验期35 d。于7和21日龄时用新城疫弱毒疫苗进行点眼、滴鼻免疫。
1.4 指标测定与方法 1.4.1 生长性能于42日龄时对试验鸡进行空腹称重,称重前断料8 h,断水2 h,计算平均增重、料重比。
1.4.2 肠道消化酶活性于28和42日龄时,各重复取3只试验鸡剖杀,取空肠和回肠肠段,用生理盐水冲洗掉内容物(至无明显内容物即可,生理盐水量无特定要求),置于冰袋上小心刮取肠黏膜,放于液氮中速冻,然后转至-70 ℃保存,用于消化酶活性的测定。采用南京建成生物工程研究所的消化酶活性试剂盒,按照操作说明测定淀粉酶、脂肪酶和蛋白酶活性。
1.4.3 肠道菌群数量无菌称取1 g回肠和盲肠内容物,按文献[9]采用平板活菌计数法测定肠道大肠杆菌和乳杆菌的数量。
1.4.4 聚合酶链式反应-变性梯度凝胶电泳(PCR-DGGE)技术检测盲肠菌群多样性无菌称取200 mg盲肠内容物,按文献[9]采用PCR-DGGE技术分析肉鸡盲肠菌群多样性。
1.5 数据处理与分析试验数据采用SPSS 19.0进行处理,初步计算其平均值和标准差后,采用单因素方差分析(one-way ANOVA)程序进行方差分析,差异显著者采用Duncan氏法进行多重比较,差异显著水平为P < 0.05,试验数据均以“平均值±标准差”表示。
2 结果与分析 2.1 重组枯草芽孢杆菌SE1对肉鸡生长性能的影响试验期间未出现鸡只死亡情况。由表 2可知,与A组相比,C组肉鸡的终末体重和平均增重分别增加6.14%和6.76%,但差异不显著(P>0.05);C组肉鸡的料重比与A组相比降低8.21%,与B组相比降低6.28%,但差异均不显著(P>0.05)。
|
|
表 2 重组枯草芽孢杆菌SE1对肉鸡生长性能的影响 Table 2 Effects of recombinant Bacillus subtilis SE1 on growth performance of broilers |
由表 3可知,28日龄时,B组和C组肉鸡的空肠脂肪酶和回肠蛋白酶活性显著高于A组(P < 0.05);42日龄时,B组和C组肉鸡的空肠脂肪酶、蛋白酶和回肠蛋白酶活性显著高于A组(P < 0.05)。B组肉鸡的肠道消化酶活性与C组相比无显著差异(P>0.05)。
|
|
表 3 重组枯草芽孢杆菌SE1对肉鸡肠道消化酶活性的影响 Table 3 Effects of recombinant Bacillus subtilis SE1 on intestinal digestive enzyme activities of broilers |
由表 4可知,28日龄时,B组和C组肉鸡的回肠、盲肠大肠杆菌数量显著低于A组(P < 0.05),盲肠乳杆菌数量显著高于A组(P < 0.05);42日龄时,B组和C组肉鸡的回肠、盲肠大肠杆菌数量显著低于A组(P < 0.05),乳杆菌数量显著高于A组(P < 0.05)。
|
|
表 4 重组枯草芽孢杆菌SE1对肉鸡肠道菌群数量的影响 Table 4 Effects of recombinant Bacillus subtilis SE1 on intestinal microflora number of broilers |
由图 1可知,B组和C组肉鸡的盲肠菌群条带数多于A组,亮度高于A组,B组和C组出现了较多的特异性条带。由表 5可知,B组和C组肉鸡的盲肠菌群丰富度、均匀度和香农维纳指数均显著高于A组(P < 0.05)。由图 2可知,28日龄时,A组、B组、C组肉鸡盲肠菌群组内的相似性分别为64.1%、96.2%、90.9%,A组与C组间的菌群相似性为64.1%,B组和C组间的菌群相似性为90.9%;42日龄时,A组、B组、C组组内的菌群相似性分别为79.1%、94.7%、94.7%,A组与C组间的菌群相似性为79.1%,B组和C组间的菌群相似性达94.7%。
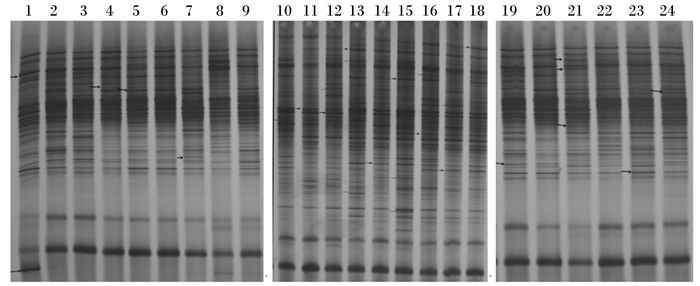
|
1~3、4~6、7~9分别为28日龄时A、B、C组样品;10~12、13~15、16~18分别为42日龄时A、B、C组样品;19、20、21分别为28日龄时A组、B组、C组混合样品;22、23、24分别为42日龄时A组、B组、C组混合样品。下图同。 1 to 3, 4 to 6 and 7 to 9 were the samples in groups A, B and C at 28 days of age, respectively; 10 to 12, 13 to 15 and 16 to 18 were the samples in groups A, B and C at 42 days of age, respectively; 19, 20 and 21 were the mixed samples in groups A, B and C at 28 days of age, respectively; 22, 23 and 24 were the mixed samples in groups A, B and C at 42 days of age, respectively. The same as below. 图 1 肉鸡盲肠菌群PCR-DGGE指纹图谱 Figure 1 PCR-DGGE fingerprint of caecal microflora of broilers |
|
|
表 5 肉鸡盲肠菌群多样性分析 Table 5 Diversity analysis of caecal microflora of broilers |
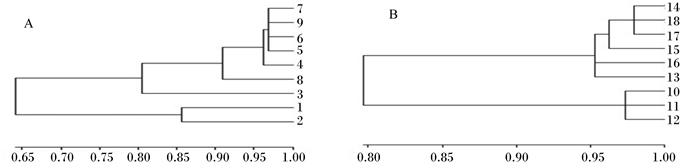
|
A:28日龄;B:42日龄。 A: 28 days of age; B: 42 days of age. 图 2 肉鸡盲肠菌群PCR-DGGE指纹图谱聚类结果 Figure 2 Clustering result of PCR-DGGE fingerprint of caecal microflora of broilers |
肉鸡盲肠菌群16S rDNA V3区PCR-DGGE指纹图谱中共选择了27个条带进行割胶回收(图 1箭头所指),除去6条重复条带,其中有12条共性条带,9条特性条带,测序后在GenBank数据库BLAST比对,结果见表 6。这些测序条带主要为乳杆菌属、梭菌属、粪球菌属、真杆菌属、瘤胃球菌属、厌氧醋菌属、解纤维素菌属、硫杆菌属、假单胞菌属、沙雷氏菌属的细菌。A组特有条带为规则粪球菌;B组和C组特有条带为甲基戊糖梭菌、嗜酸乳杆菌、液化沙雷氏菌、白色瘤胃球菌、糖丁基梭菌、嗜酸性硫酸盐还原菌、嗜硫杆菌、罗氏乳杆菌。
|
|
表 6 DGGE指纹图谱单个条带DNA序列分析 Table 6 Sequences analysis of DNA recovered from single band in DGGE fingerprints |
张晓云等[10]研究表明,枯草芽孢杆菌可提高肉鸡的日增重和采食量,降低料重比。本研究表明,与对照组相比,饲粮中添加重组枯草芽孢杆菌SE1可增加肉鸡的终末体重和平均增重,降低料重比。研究也表明,枯草芽孢杆菌能够改善动物的消化机能,提高饲料利用率,促进动物生长[11-12]。Bai等[13]研究发现,饲喂枯草芽孢杆菌可增加肉鸡的日增重,这可能是由于枯草芽孢杆菌能够通过分泌蛋白酶、淀粉酶和脂肪酶等消化酶及多种维生素、生长因子和氨基酸来提高肉鸡的肠道消化功能,促进机体对营养物质的消化吸收[14]。刘瑞瑞[15]研究表明,鸡口服禽流感重组枯草芽孢杆菌能显著增强鸡的全身性免疫水平,极显著增加鸡的小肠绒毛高度;其对鸡体重的提高作用优于正常枯草芽孢杆菌。本试验研究表明,与枯草芽孢杆菌168相比,重组枯草芽孢杆菌SE1组肉鸡的终末体重和平均增重增加,料重比降低,但差异均不显著。可能是由于重组枯草芽孢杆菌SE1增加了机体的免疫功能,改善了小肠黏膜形态结构,尤其是影响了肠绒毛的生长和发育,进而间接影响了机体的生长性能[16];而差异不显著可能是由于本试验饲养条件以及肉鸡品种较好,所以重组枯草芽孢杆菌SE1对肉鸡生长性能的作用效果与枯草芽孢杆菌168相比无显著差异。郭晓敏[17]研究表明,在攻毒前,饲喂鸡白痢沙门菌OmpC-DC重组乳酸菌对鸡体重的影响与乳酸菌组和对照组相比无显著差异,与本试验结果相一致。
3.2 重组枯草芽孢杆菌SE1对肉鸡肠道消化酶活性的影响动物肠道消化酶主要包括淀粉酶、脂肪酶和蛋白酶等,机体的生长代谢与消化酶活性的高低密切相关。Zokaeifar等[18]给南美白对虾饲喂枯草芽孢杆菌8周后,发现试验组的肠道蛋白酶和淀粉酶活性显著高于对照组。卞国顺等[19]研究报道,饲粮中添加105 CFU/g枯草芽孢杆菌可显著提高岭南黄羽肉鸡的空肠胰蛋白酶和淀粉酶活性,但脂肪酶活性显著降低。刘清华等[20]研究发现,饲喂枯草芽孢杆菌可显著提高鳗鲡消化道中蛋白酶和淀粉酶活性。本试验中,饲喂重组枯草芽孢杆菌SE1可显著提高肉鸡的空肠脂肪酶和回肠蛋白酶活性,与以上研究结果相一致,这与枯草芽孢杆菌具有产生蛋白酶、脂肪酶、淀粉酶等消化酶的特性密切相关[21-22];但肠道淀粉酶活性并未显著提高,与上述研究略有不同,这可能是由于枯草芽孢杆菌分泌的酶抑制了内源淀粉酶的活性,还可能是由于试验条件和试验动物种类不尽相同所致。而重组枯草芽孢杆菌SE1组肉鸡的肠道消化酶活性与枯草芽孢杆菌168组相比无显著差异,说明二者均能提高肉鸡的肠道消化酶活性,枯草芽孢杆菌芽孢衣壳表面在展示鸡白痢沙门氏菌外膜蛋白OmpC后,并不会影响其提高肠道消化酶活性的功能。
3.3 重组枯草芽孢杆菌SE1对肉鸡肠道菌群的影响研究证实,枯草芽孢杆菌能够维持动物肠道微生态平衡,增加肠道菌群多样性[23-25]。裴跃明等[26]发现,饲粮中添加枯草芽孢杆菌能显著降低蛋鸡的盲肠大肠杆菌数量,增加乳酸菌和双歧杆菌数量。Park等[27]研究发现,饲喂枯草芽孢杆菌能显著增加肉鸡盲肠的乳杆菌数量,降低沙门氏菌数量。Gao等[28]试验发现,饲粮中添加枯草芽孢杆菌可显著降低肉鸡的盲肠大肠杆菌和沙门氏菌数量,增加乳酸菌数量。这主要是因为:1)枯草芽孢杆菌孢子进入动物肠道后,迅速萌发成繁殖体,通过生物夺氧造成肠道厌氧环境,有利于厌氧菌的生长[29];2)产生挥发性脂肪酸和乳酸等有机酸,降低肠道pH,从而抑制致病菌生长[30];3)枯草芽孢杆菌能分泌多种具有拮抗作用的多肽[31]。本试验中,饲粮中添加重组枯草芽孢杆菌SE1可使肉鸡的回肠和盲肠大肠杆菌数量显著减少,盲肠乳杆菌数量显著增加,与以上研究结果相一致。
肠道菌群的丰富度提示肠道菌群种类多样,均匀度和香农维纳指数提示肠道菌群的均匀分配,种类越多,分配越均匀,环境越稳定,三者在一定程度上能够提示肠道微生态环境的稳定性[32-33]。本试验结果显示,饲粮中添加重组枯草芽孢杆菌SE1,肉鸡盲肠菌群的丰富度、均匀度和香农维纳指数均显著高于对照组。重组枯草芽孢杆菌SE1组肉鸡的盲肠菌群组内的相似性显著高于对照组,其中28日龄时高26.8%,42日龄时高15.6%;而与枯草芽孢杆菌168组相比,相似性达到90%以上。PCR-DGGE指纹图谱结果显示,重组枯草芽孢杆菌SE1组的特异性条带数与枯草芽孢杆菌168组完全相同,多于对照组。测序条带以梭菌属和乳杆菌属等有益菌为主,说明重组枯草芽孢杆菌SE1能够提高肉鸡的盲肠菌群多样性,维持肠道菌群的稳定性,与赵秀英等[34]、Wang等[35]、朱沛霁[36]的报道结果相一致。但重组枯草芽孢杆菌SE1组和枯草芽孢杆菌168组中均出现了条件致病菌液化沙雷氏菌,该菌是否对肉鸡存在致病作用以及存在的原因,有待进一步研究。
本试验中,饲粮中添加重组枯草芽孢杆菌SE1和枯草芽孢杆菌168对肉鸡盲肠菌群数量及菌群多样性的影响基本一致,无显著性差异。但刘明刚等[8]研究表明,重组枯草杆菌芽孢经口服免疫可诱导机体产生特异性血清IgG和肠黏膜SIgA抗体,并可赋予小鼠抗鼠伤寒沙门氏菌感染的交叉保护作用。刘瑞瑞[15]研究发现,鸡口服禽流感重组枯草芽抱杆菌能够显著提高局部黏膜体液特异性SIgA和血清特异性IgG含量。郭晓敏[17]研究表明,饲粮中添加鸡白痢沙门菌OmpC-DC重组乳酸菌,鸡血清IgG和肠内容物SIgA含量显著增加。结合本试验结果,说明重组枯草芽孢杆菌SE1可以在不改变枯草芽孢杆菌168益生效果的基础上,诱导机体产生特异性免疫保护作用,并对异源沙门氏菌感染提供交叉保护作用,这也为枯草芽孢杆菌进一步开发利用和新型沙门氏菌疫苗的研发提供了新的思路。
4 结论① 饲粮中添加重组枯草芽孢杆菌SE1能提高肉鸡的终末体重和平均增重,降低料重比,促进肉鸡的生长性能;且与枯草芽孢杆菌168制剂效果相似。
② 饲粮中添加重组枯草芽孢杆菌SE1能显著提高肉鸡的空肠脂肪酶和回肠蛋白酶活性,但对淀粉酶活性无显著影响;且与枯草芽孢杆菌168制剂效果相似。
③ 饲粮中添加重组枯草芽孢杆菌SE1能显著降低肉鸡回肠、盲肠大肠杆菌数量,增加乳杆菌数量,显著提高盲肠菌群多样性和稳定性;且与枯草芽孢杆菌168制剂效果相似。
| [1] |
LEE K W, KIM D K, LILLEHOJ H S, et al. Immune modulation by Bacillus subtilis-based direct-fed microbials in commercial broiler chickens[J]. Animal Feed Science and Technology, 2015, 200: 76-85. DOI:10.1016/j.anifeedsci.2014.12.006 |
| [2] |
GUIDO R, GABRIELE A, GIOVANNA A, et al. Safety and efficacy of Calsporin® (Bacillus subtilis DSM 15544) for sows and suckling piglets[J]. EFSA Journal, 2007, 15(4): e04761. |
| [3] |
IMAMURA D, KUWANA R, TAKAMATSU H, et al. Localization of proteins to different layers and regions of Bacillus subtilis spore coats[J]. Journal of Bacteriology, 2010, 192(2): 518-524. DOI:10.1128/JB.01103-09 |
| [4] |
AMUGUNI H, TZIPORI S. Bacillus subtilis:a temperature resistant and needle free delivery system of immunogens[J]. Human Vaccines & Immunotherapeutics, 2012, 8(7): 979-986. |
| [5] |
LIAN C Q, ZHOU Y, FENG F, et al. Surface display of human growth hormone on Bacillus subtilis, spores for oral administration[J]. Current Microbiology, 2014, 68(4): 463-471. DOI:10.1007/s00284-013-0500-9 |
| [6] |
ZHOU Z, GONG S, LI X M, et al. Expression of Helicobacter pylori urease B on the surface of Bacillus subtilis spores[J]. Journal of Medical Microbiology, 2014, 64(1): 104-110. |
| [7] |
刘明刚, 刘红露, 戴茜茜, 等. 以CotB作为融合基序在枯草芽胞杆菌芽胞表面展示雏沙门菌OmpC的研究[J]. 中国兽医科学, 2015, 45(11): 1159-1165. |
| [8] |
刘明刚, 戴茜茜, 徐毓琴, 等. 以CotB为分子载体表面展示鸡白痢沙门氏菌OmpC的重组枯草杆菌芽孢对小鼠免疫效果的研究[J]. 中国预防兽医学报, 2015, 37(12): 966-969, 977. DOI:10.3969/j.issn.1008-0589.2015.12.16 |
| [9] |
徐毓琴, 王振华, 潘康成, 等. 产γ-氨基丁酸植物乳杆菌对小鼠生长、血清抗氧化能力及盲肠菌群的影响[J]. 中国农业大学学报, 2016, 21(10): 93-101. |
| [10] |
张晓云, 周同茂, 段宝轩, 等. 枯草芽孢杆菌高耐菌株泡腾制剂对肉鸡生长性能、盲肠肠道菌群的影响[J]. 资源开发, 2016(8): 40-44. |
| [11] |
NGUYEN A T V, NGUYEN D V, TRAN M T, et al. Isolation and characterization of Bacillus subtilis CH16 strain from chicken gastrointestinal tracts for use as a feed supplement to promote weight gain in broilers[J]. Letters in Applied Microbiology, 2015, 60(6): 580-588. DOI:10.1111/lam.2015.60.issue-6 |
| [12] |
ZAGHARI M, ZAHROOJIAN N, RIAHI M, et al. Effect of Bacillus subtilis spore (GalliPro®) nutrients equivalency value on broiler chicken performance[J]. Animal Science Journal, 2015, 14(1): 94-98. |
| [13] |
BAI K, HUANG Q, ZHANG J, et al. Supplemental effects of probiotic Bacillus subtilis fmbJ on growth performance, antioxidant capacity, and meat quality of broiler chickens[J]. Poultry Science, 2016, 96(1): 74-82. |
| [14] |
GADDE U, OH S T, LEE Y S, et al. The effects of direct-fed microbial supplementation, as an alternative to antibiotics, on growth performance, intestinal immune status and epithelial barrier protein expression in broiler chickens[J]. Probiotics and Antimicrobial Proteins, 2017, 9(4): 397-405. DOI:10.1007/s12602-017-9275-9 |
| [15] |
刘瑞瑞. 口服禽流感重组枯草芽孢杆菌对鸡免疫和生长的影响[D]. 硕士学位论文. 南京: 南京农业大学, 2015.
|
| [16] |
景翠, 李福彬, 赵驻军, 等. 日粮添加地衣芽孢杆菌对蛋鸡肠道菌群与形态结构的影响[J]. 中国家禽, 2012, 34(4): 18-20. |
| [17] |
郭晓敏. 鸡白痢沙门菌OmpC-DC重组乳酸菌的制备与免疫效果研究[D]. 硕士学位论文. 长春: 吉林农业大学, 2013.
|
| [18] |
ZOKAEIFAR H, BALCÁZAR J L, SAAD C R, et al. Effects of Bacillus subtilis on the growth performance, digestive enzymes, immune gene expression and disease resistance of white shrimp Litopenaeus vannamei[J]. Fish & Shellfish Immunology, 2012, 33(4): 683-689. |
| [19] |
卞国顺, 崔志文, 姚庞, 等. 枯草芽孢杆菌替代抗生素对肉鸡生产性能和肠道黏膜酶活的影响[J]. 饲料工业, 2012, 33(9): 34-36. |
| [20] |
刘清华, 王宝珍, 郭清雄, 等. 枯草芽孢杆菌对黑仔期菲律宾鳗鲡生长、体成分和消化酶活性的影响[J]. 中国食品学报, 2016, 16(12): 177-184. |
| [21] |
MURUGESAN G R, ROMERO L F, PERSIA M E. Effects of protease, phytase and a Bacillus sp. direct-fed microbial on nutrient and energy digestibility, ileal brush border digestive enzyme activity and cecal short-chain fatty acid concentration in broiler chickens[J]. PLoS One, 2014, 9(7): e101888. DOI:10.1371/journal.pone.0101888 |
| [22] |
HMANI H, DAOUD L, JLIDI M, et al. A Bacillus subtilis strain as probiotic in poultry:selection based on in vitro functional properties and enzymatic potentialities[J]. Journal of Industrial Microbiology & Biotechnology, 2017, 44(8): 1157-1166. |
| [23] |
LEE S H, INGALE S L, KIM J S, et al. Effects of dietary supplementation with Bacillus subtilis LS 1-2 fermentation biomass on growth performance, nutrient digestibility, cecal microbiota and intestinal morphology of weanling pig[J]. Animal Feed Science and Technology, 2014, 188: 102-110. DOI:10.1016/j.anifeedsci.2013.12.001 |
| [24] |
HOSSAIN M M, BEGUM M, KIM I H. Effect of Bacillus subtilis, Clostridium butyricum and Lactobacillus acidophilus endospores on growth performance, nutrient digestibility, meat quality, relative organ weight, microbial shedding and excreta noxious gas emission in broilers[J]. Veterinární Medicina, 2015, 60(2): 77-86. |
| [25] |
LIU H, ZHANG J, ZHANG S H, et al. Oral administration of Lactobacillus fermentum I5007 favors intestinal development and alters the intestinal microbiota in formula-fed piglets[J]. Journal of Agricultural & Food Chemistry, 2014, 62(4): 860-866. |
| [26] |
裴跃明, 邵强, 吴桂龙, 等. 枯草芽孢杆菌制剂对产蛋后期蛋鸡生产性能、蛋品质、免疫及肠道菌群的影响[J]. 动物保健, 2016, 52(7): 61-65, 70. |
| [27] |
PARK J H, YUN H M, KIM I H. The effect of dietary Bacillus subtilis supplementation on the growth performance, blood profile, nutrient retention, and caecal microflora in broiler chickens[J]. Journal of Applied Animal Research, 2018, 46(1): 868-872. DOI:10.1080/09712119.2017.1411267 |
| [28] |
GAO Z H, WU H H, SHI L, et al. Study of Bacillus subtilis on growth performance, nutrition metabolism and intestinal microflora of 1 to 42 d broiler chickens[J]. Animal Nutrition, 2017, 3(2): 109-113. DOI:10.1016/j.aninu.2017.02.002 |
| [29] |
HOLZAPFEL W H, BOTHA S J. Physiology of Sporolactobacillus strains isolated from different habitats and the indication of in vitro antagonism against Bacillus species[J]. International Journal of Food Microbiology, 1988, 7(2): 161-168. DOI:10.1016/0168-1605(88)90008-6 |
| [30] |
SUVA M A, SUREJA V P, KHENI D, et al. Novel insight on probiotic Bacillus subtilis:mechanism of action and clinical applications[J]. Journal of Current Research in Scientific Medicine, 2016, 2(2): 65-72. DOI:10.4103/2455-3069.198381 |
| [31] |
ABDELQADER A, AL-FATAFTAH A R, DAŞ G. Effects of dietary Bacillus subtilis and inulin supplementation on performance, eggshell quality, intestinal morphology and microflora composition of laying hens in the late phase of production[J]. Animal Feed Science and Technology, 2013, 179(1/2/3/4): 103-111. |
| [32] |
POSSEMIERS S, VERTHÉ K, UYTTENDAELE S, et al. PCR-DGGE-based quantification of stability of the microbial community in a simulator of the human intestinal microbial ecosystem[J]. Microbiology Ecology, 2014, 49(3): 495-507. |
| [33] |
SPELLERBERG I F, FEDOR P J. A tribute to Claude Shannon (1916-2001) and a plea for more rigorous use of species richness, species diversity and the 'Shannon-Wiener' index[J]. Global Ecology and Biogeography, 2003, 12(3): 177-179. DOI:10.1046/j.1466-822X.2003.00015.x |
| [34] |
赵秀英, 县怡涵, 李晨博, 等. 灌喂植物乳杆菌和干酪乳杆菌增加仔猪肠道菌群多样性及短链脂肪酸生成[J]. 微生物学报, 2016, 56(8): 1291-1300. |
| [35] |
WANG Y, SUN J, ZHONG H, et al. Effect of probiotics on the meat flavour and gut microbiota of chicken[J]. Scientific Reports, 2017, 7: 6400. DOI:10.1038/s41598-017-06677-z |
| [36] |
朱沛霁. 枯草芽孢杆菌对雪山鸡生产性能、肠道健康和免疫机能的影响及机制[D]. 博士学位论文. 扬州: 扬州大学, 2017.
|




