2. 赤峰市农牧科学研究院, 赤峰 024031
2. Chifeng Academy of Agricultural and Animal Husbandry Sciences, Chifeng 024031, China
壳聚糖是一种由β-(1-4)-2-乙酰氨基-D-葡萄糖和β-(1-4)-2-氨基-D-葡萄糖基团组成的多聚葡萄糖胺,是自然界中仅次于纤维素的最丰富的聚合物。壳聚糖分子插入不同功能基团形成乙氨基壳聚糖、羧化壳聚糖、硫酸化壳聚糖等多种衍生物。壳聚糖及其衍生物因带有正电荷的氨基,使其具有了独特的、多用途的功能。壳聚糖及其衍生物因减肥和降血脂作用而备受关注,大量研究报道了其对动物脂质代谢的影响,但研究结果存在很大差异,而且关于其影响机制的研究较少。本文主要综述了壳聚糖及其衍生物在动物体内的代谢动力学及其对动物脂质代谢的影响与调节机制,旨在为利用壳聚糖及其衍生物更好地调节动物的脂质代谢、改善动物的健康提供参考。
1 壳聚糖及其衍生物的代谢动力学 1.1 吸收天然状态的壳聚糖具有很高的分子质量,导致其低溶解性和高黏度特性。因此,早期研究显示动物消化道不能吸收壳聚糖,体内无壳聚糖分布。但之后的研究表明,哺乳动物细胞可以吸收壳聚糖及其衍生物,参与细胞内的代谢过程,但其吸收率和细胞内活性高度依赖其分子质量、溶解度和去乙酰化率;高水溶性和低分子质量壳聚糖及其衍生物更容易被吸收[1]。
为了提高生物活性,壳聚糖经常被降解成壳寡糖,具有较低的分子质量、黏度以及高溶解度。体内与体外模型的研究结果表明,壳寡糖通过小肠上皮细胞被吸收,且其吸收率高于壳聚糖。低分子质量(13和22 ku)壳聚糖能够运输通过肠上皮细胞,而高分子质量(230 ku)无法壳聚糖被吸收[1]。
1.2 分布Xia等[2]利用荧光素标记的壳聚糖验证了其在小鼠体内的分布和代谢。结果显示,壳聚糖主要分布在肝脏、肾脏和肌肉中,其中口服壳聚糖1 h后肝脏中含量最高,而随时间推移肾脏中壳聚糖含量最高[2]。Wu等[3]进行的壳聚糖微球的代谢动力学研究也表明,壳聚糖微球几乎存在于大鼠所有组织中,尤其是肝脏和肾脏。壳聚糖及其衍生物的理化性质影响其在体内的分布。壳聚糖的分子质量越低,其在大鼠肝脏和肾脏的分布越多[1]。此外,脱乙酰度下降时,壳聚糖在小鼠肾脏中的积聚多于肝脏和脾脏[1]。
1.3 代谢与消除动物血浆、肝脏、肾脏和尿液中的溶菌酶能够降解壳聚糖。大鼠肝脏和肾脏在壳聚糖生物降解过程中发挥核心作用,肝脏中高分子质量(>200 ku)壳聚糖降解产物的分子质量从<1 ku到50 ku不等[4]。而肾脏在壳聚糖排泄中起到关键作用,大鼠体内80%以上的壳聚糖经尿液排出[4]。Xia等[2]研究显示,小鼠口服壳聚糖2.5~5.0 h后,粪便中壳聚糖以其原始形态被排泄,6~12 h后尿中壳聚糖被排泄,并且部分被降解。腹腔注射壳聚糖(300 ku)后,尿中壳聚糖的分子质量从<10 ku到40 ku不等[4],说明壳聚糖经肝脏、肾脏降解后,主要经尿液排出。
2 壳聚糖及其衍生物对动物脂质代谢的调节作用 2.1 壳聚糖及其衍生物对血脂含量的影响高脂血症和高胆固醇(CHOL)血症是动脉粥样硬化和其他心血管功能障碍的风险因子。多数研究结果发现,壳聚糖及其衍生物具有降低动物血脂含量的作用,并因其治疗肥胖和血脂异常而备受关注。动物(鼠、猪和禽)和人类的研究表明,高脂饲粮中添加壳聚糖及其衍生物,可显著降低血浆甘油三酯(TG)、CHOL、低密度脂蛋白胆固醇(LDL-C)、极低密度脂蛋白胆固醇(VLDL-C)和游离脂肪酸(FFA)含量,显著提高血浆高密度脂蛋白胆固醇(HDL-C)含量,移除组织中过多的CHOL,并将其运送至肝脏排泄[5-8]。
壳聚糖及其衍生物调节血脂的有效性仍存在争议。虽然大多数试验结果显示,壳聚糖及其衍生物能够改善血脂含量,但一些研究者对其临床疗效持怀疑态度。Keser等[9]发现,壳聚糖仅显著降低肉鸡血清中LDL-C含量,未对其他脂类物质含量产生显著影响。Wang等[10]在猪上的研究显示,壳聚糖仅升高了血清HDL-C含量,未显著影响CHOL和TG等其他血脂含量。在人类上的研究也表明,口服壳聚糖对血浆TG、HDL-C、LDL-C、VLDL-C含量未产生显著影响[11]。而Liu等[12]发现,大鼠高糖饲粮中添加7%的壳聚糖,虽然降低了血浆CHOL含量,但血浆TG含量升高。壳聚糖及其衍生物对血脂的调节作用受多种因素的影响,如理化性质和饲喂时间等,这可能是造成以上结果不一致的原因。Trivedi等[11]建议,需在摄食前约15 min至1 h摄入壳聚糖,以便使壳聚糖有足够的时间在胃酸中溶解及有效地结合饲粮中的脂肪。而Jin等[13]的研究指出,壳聚糖降脂效果与其分子质量和表面电荷相关。
2.2 壳聚糖及其衍生物对脂质堆积的影响关于壳聚糖及其衍生物对动物脂质堆积的影响报道很少。高脂饲粮容易诱发脂质代谢紊乱,增加组织中脂蛋白酯酶活性,降低内脏和皮下脂肪细胞的脂解率,促进脂肪细胞中TG的积累;壳聚糖及其衍生物能够有效抑制细胞中脂质的堆积。Wu等[3]制备的壳聚糖微球显著改善了大鼠脂肪细胞中TG含量。高糖饲粮中添加7%的壳聚糖显著提高了大鼠附睾脂肪垫的脂肪分解率,抑制了TG的积累[12]。Keser等[9]也发现,饲粮添加壳聚糖降低了肉鸡腹脂率。此外,脂质堆积过程伴随着脂肪细胞的分化与肥大。体内与体外研究数据表明,壳聚糖及其衍生物可有效抑制脂肪细胞的分化和肥大及脂肪组织重量,降低脂质堆积[14-15]。壳聚糖及其衍生物还可刺激大鼠的脂肪酸氧化,降低FFA含量,防止非脂肪组织的脂质堆积[15]。
2.3 壳聚糖及其衍生物理化性质对脂质代谢的影响壳聚糖及其衍生物是一个由拥有不同物理和化学性质的化合物组成的大家族,其结合脂肪及调控脂质代谢的能力与其理化性质密切相关。壳聚糖及其衍生物的分子质量是影响其理化性质的首要因素。低分子质量的壳聚糖及其衍生物由于其具有更好的溶解性和可吸收性,研究者更倾向于认为低分子质量壳聚糖及其衍生物具有降脂特性[1],其对CHOL的清除作用及对脂质堆积和脂肪细胞分化的抑制效果要优于高分子质量的壳聚糖。最新研究表明,壳聚糖及其衍生物的脂质结合能力与其分子质量的区间范围相关。Jin等[13]的研究显示,在体外消化道模型中分子质量3 ku壳聚糖的脂肪和CHOL结合能力最强,其分子质量大于或小于3 ku时壳聚糖的结合能力均下降。但也有研究者得出相反结论,Yao等[16]的研究显示,大鼠高脂饲粮中添加壳聚糖,只有高分子质量壳聚糖组血浆CHOL含量下降,粪便CHOL含量上升,而低分子质量壳聚糖组无显著影响。
壳聚糖的脱乙酰过程形成带正电荷的氨基。脱乙酰度越高,壳聚糖获得的自由氨基和正电荷越多,其通过静电作用结合脂质和胆汁酸的能力则越强。此外,壳聚糖颗粒大小也影响其降脂效果。分子质量固定后,颗粒粒径越小总表面积越大,因此,细颗粒壳聚糖能有效降低大鼠血浆和肝脏脂质含量[5]。而体外试验表明,粉末状壳聚糖比薄片状壳聚糖拥有更大的吸油率[2]。
3 壳聚糖及其衍生物调节动物脂质代谢的机制 3.1 结合脂类物质脂质结合机制是最早被提出的壳聚糖及其衍生物调节脂质代谢的机制。壳聚糖在消化道内形成壳聚糖-脂肪复合物,干扰饲粮脂肪的消化和吸收,促进饲粮脂肪排泄进入粪便。Trautwein等[17]证实,大鼠高脂饲粮中添加壳聚糖,粪便中脂肪排泄量显著增加,脂肪表观消化率降低了50%。Guha等[18]认为,壳聚糖在体外可以结合大约4倍自身重量的脂质。而Jin等[13]利用体外消化道模型得出结论,1 g的壳聚糖样品可以吸收2~8 g的花生油或50~65 mg的CHOL。
壳聚糖及其衍生物的脂质结合机制可能包含4个方面。一是静电引力作用。壳聚糖及其衍生物氨基所带正电荷促使其与脂肪酸和胆汁酸等阴离子物质结合,导致肠道脂质吸收中断及胆汁酸的排泄,同时为了弥补粪便损失,肝脏中的CHOL加速转化为胆汁酸,壳聚糖及其衍生物表现出降脂、降CHOL的作用。因此,在相同分子质量条件下,壳聚糖及其衍生物脱乙酰度越高,所带正电荷越多,其结合脂质的能力越强。但壳聚糖及其衍生物的静电引力作用无法解释粪便中CHOL等中性脂质的增加。二是包封作用。壳聚糖及其衍生物在胃内溶解形成黏性乳液,随着多糖链开始聚合,黏性的壳聚糖在胃内包封脂肪滴,形成保护膜。复合物到达小肠时,壳聚糖与其包裹的脂肪一起沉淀下来,使得脂肪酶难以对脂质进行消化降解,未消化脂质经由粪便排泄[2]。三是嵌入作用。脂肪分子可嵌入在壳聚糖的长链中,壳聚糖的分子质量愈大、链愈长,则会有更多的脂肪分子被嵌入[17]。因此,壳聚糖的脂质结合能力随着分子质量的增加而增强。四是吸附作用。在分子质量相同的情况下,与片状壳聚糖相比,粉末状壳聚糖颗粒粒径小,表面积大,开放的孔结构更多,有利于吸附[2]。然而,壳聚糖可以在胃内酸性条件下溶解,造成体内这种吸附功能减弱。
然而,Gang等[19]的研究发现,饲粮添加壳聚糖不影响小鼠粪便脂肪的排泄,因此,不会降低脂肪的吸收。Pokhis等[20]认为,壳聚糖-脂肪复合物一部分被排泄出体外,一部分被人类结肠细菌用于能量消耗,因此粪便中脂肪的检出量不会明显升高,因此认为壳聚糖不具有显著的结合脂肪的能力。Stoll等[21]的研究显示,壳聚糖不仅可以限制摄食高脂饮食的人类体重,也可降低摄食高碳水化合物饮食的人类体重,这说明壳聚糖及其衍生物的降脂特性除脂质结合机制外,还存在其他机制。
3.2 抑制胰脂肪酶的活性胰脂肪酶是降解饲粮TG的关键酶,将TG转化为1个甘油单酯和2个脂肪酸。壳聚糖及其衍生物被认为是胰脂肪酶的竞争性抑制剂,可降低肠道脂质和CHOL的吸收[22]。Jin等[13]的研究显示,在体外消化道模型中不同分子质量(1~9 ku)壳聚糖均能够在一定程度上抑制胰脂肪酶的活性。但是,壳聚糖及其衍生物抑制胰脂肪酶活性的具体机制尚不清楚,相关报道较少,有待进一步研究。
3.3 调节脂肪细胞因子的分泌脂肪细胞是能量储存的主要场所,同时也在能量平衡中发挥重要的内分泌作用。脂肪细胞因子通过其局部和全身性的作用调节能量代谢、炎症和胰岛素敏感性。壳聚糖及其衍生物可通过抑制脂肪细胞的分化和肥大以及降低脂肪组织重量调节脂肪细胞因子的分泌,进而抑制脂肪生成[12, 23]。
白细胞介素-6(IL-6)拥有促炎症和抗炎症的双重作用,同时也可作为脂质积累的抑制剂及脂肪分解和氧化的诱导剂。在体外培养的3T3-L1脂肪细胞中,壳寡糖通过增加IL-6启动子的转录活性以及上调IL-6的基因表达进而下调过氧化物酶体增殖物激活受体γ(peroxisome proliferators-activated receptors, PPARγ)、CCAAT增强子结合蛋白等脂肪生成相关基因的表达,从而减少脂肪细胞的分化和脂质积累[23]。
能量平衡由一个复杂的神经内分泌系统控制,包括脂肪细胞衍生的外围信号。瘦素(LEP)是一种脂肪细胞分泌的激素,与白色脂肪量呈正比。LEP是调节能量平衡的关键点,在脂肪细胞分化过程起到表观遗传调控作用。LEP使大脑了解全身的能量储存状态,而脂肪组织驱动大脑控制能量平衡。LEP调节啮齿类动物的食欲和能量消耗,导致体脂含量下降。研究者还发现壳聚糖及其衍生物能够通过升高血浆LEP含量削弱动物的食欲和采食量,同时伴随LEP含量及其基因表达的增加[7]。鉴于LEP在抑制食欲中的关键作用,研究者认为壳聚糖与食欲控制之间存在潜在联系[7]。Bahar等[23]发现,脂肪细胞分化过程中,壳寡糖抑制LEP基因启动子的去甲基化,抑制脂肪细胞成熟及脂肪生成。此外,LEP能够激活腺苷酸活化蛋白激酶(adenosine monophosphate-activated protein kinase, AMPK)刺激脂肪酸氧化,防止非脂肪组织的脂肪堆积。Chiu等[15]的研究也发现,壳聚糖通过诱导LEP分泌逆转高脂饲粮对大鼠肝脏AMPK活性的抑制,进而刺激脂肪酸氧化。
此外,降低肿瘤坏死因子-α(TNF-α)能够调节脂质代谢,增强大鼠肝脏脂质合成。同时脂肪细胞肥大也可增加血浆TNF-α含量。而脂联素抑制脂肪生成。壳聚糖及其衍生物促进大鼠脂肪细胞分泌脂联素,降低TNF-α含量[14]。
3.4 分子调控机制 3.4.1 调节脂质代谢相关酶活性及其基因的表达壳聚糖及其衍生物通过调节与脂质代谢相关的酶活性及其基因的表达参与动物体内的脂质代谢过程。研究发现,壳聚糖及其衍生物通过抑制脂质合成和转运相关酶活性及其基因的表达,同时上调脂质氧化和分解相关基因的表达调节动物体内脂质代谢过程。Choi等[22]利用数字基因表达谱技术和基因本体分析技术分析后得出,大鼠高脂饲粮中添加壳寡糖引起965个基因的表达存在差异,其中有640个基因上调,而325个基因下调;富集基因主要参与脂质代谢、细胞酮代谢、有机酸代谢、类固醇代谢、脂肪酸的β氧化等生物过程。壳寡糖对信号通路的影响主要富集在过氧化物酶体增殖物激活受体(PPARs)信号通路、脂肪酸代谢、不饱和脂肪酸生物合成、溶酶体和胆汁分泌、胆汁酸合成、类固醇激素合成等代谢途径[22]。Rahman等[14]研究了壳寡糖对3T3-L1脂肪细胞分化的影响,结果发现壳寡糖处理导致大量蛋白质斑点发生差异变化,其中有50个蛋白质发生显著变化,6个蛋白质被上调,44个蛋白质被下调,这些蛋白质中大多数与脂质代谢、细胞骨架和氧化还原调控相关[14]。
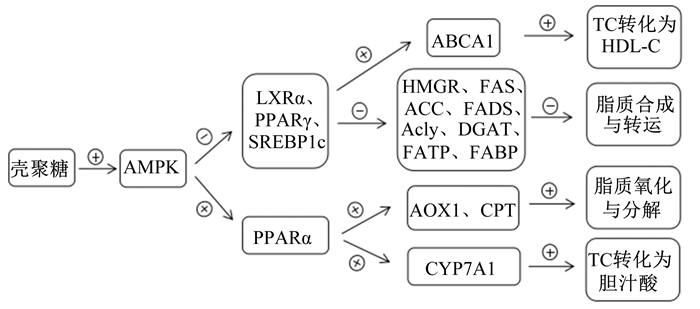
3.4.2 调节AMPK和脂质合成转录因子的表达AMPK作为细胞能量稳态的重要传感器在调节肝脏和脂肪组织的脂质代谢中起关键作用。AMPK抑制肝脏X受体(liver X receptors, LXRs)活性,从而抑制肝脏TG积累和脂肪酸合成酶的激活。补充壳聚糖可显著激活AMPK的磷酸化,减弱老鼠肝脏、附睾和肾脏周围脂肪组织中高脂饲粮诱导的LXRα、PPARγ、固醇调节元件结合蛋白1c(sterol-regulatory element binding proteins, SREBP1c)等脂质合成转录因子的表达[15]。最新研究显示,壳寡糖通过钙敏感受体磷脂酶C-三磷酸肌醇(IP3)受体通道激活AMPK的活性[24]。此外,壳聚糖及其衍生物能够诱导LEP和IL-6的分泌,逆转高脂饲粮对老鼠肝脏、附睾和肾脏周围脂肪组织中AMPK的抑制[14-15]。
LXRs和PPARs是一类配体激活的转录因子,被称为核受体,在脂肪酸和CHOL代谢中发挥重要作用,已成为细胞代谢的关键调节因子。LXRα通过诱导SREBP1c触发下游脂肪酸合成酶类的基因表达,增加脂肪酸的合成。PPARs家族包含PPARα、PPARβ、PPARγ。PPARγ控制脂肪细胞分化和脂质储存,而PPARα降低高血脂。为了能量平衡,在肝脏脂肪酸水平升高的情况下,PPARα诱导脂肪酸的β-氧化。壳聚糖及其衍生物可抑制大鼠白色脂肪组织LXRα和PPARγ的基因表达,促进PPARα的基因表达[22]。
肝脏中CHOL转化为胆汁酸是消除体内CHOL的重要途径。胆固醇7α-羟化酶(cholesterol 7α-hydroxylase, CYP7A1)是催化胆汁酸合成过程的限速酶。大鼠高脂饲粮中添加壳聚糖,活化的PPARα与维甲酸受体X形成复合物并结合CYP7A1调控元件,激活肝脏CYP7A1的转录,加速CHOL转化为胆汁酸[22]。羟甲基戊二酰辅酶A还原酶(3-hydroxy-3-methylglutaryl coenzyme A reductase, HMGR)和固醇调节元件结合蛋白-2(sterol-regulatory element binding proteins-2, SREBP-2)是CHOL合成的关键酶,高脂/高CHOL饲粮诱导的LXRα激活可上调二者的基因表达。饲粮添加壳聚糖抑制高脂饲粮大鼠肝脏LXRα蛋白的表达,导致HMGR和SREBP-2蛋白的表达下调[25]。此外,ATP结合盒转运体A1(ATP binding cassette transporter A1,ABCA1)作为肝脏转运蛋白,促进肝脏CHOL转移至载脂蛋白A(apolipoprotein A,apoA)形成HDL-C。饲粮补充壳聚糖促进ABCA1的基因表达,缓解高脂饲粮大鼠肝脏CHOL含量[25]。
壳聚糖通过抑制LXRa和SREBP1c的表达以及激活PPARa,降低脂肪酸合成酶、乙酰辅酶A羧化酶、脂肪酸去饱和酶、ATP-柠檬酸裂解酶、二酰基甘油酰基转移酶等下游脂肪酸和TG合成与调节相关基因的表达,上调酰基辅酶A氧化酶、肉毒碱棕榈酰基转移酶等下游脂质氧化和分解相关基因的表达[15, 25]。在肥胖患者中,脂肪肝的特征不仅与脂质的合成与分解相关,同时也与脂质通量有关。脂肪酸经脂肪酸转运蛋白(fatty acid transport protein,FATP)转运进入肝细胞,而脂肪酸结合蛋白(fatty acid-binding proteins, FABP)结合疏水的脂肪酸扩散至细胞溶质,随后酯化成TG并在肝脏中积累。高脂饲粮添加壳聚糖可以有效抑制大鼠肝脏FATP和FABP的表达,同时核受体因子在其中发挥关键作用[15]。
综合现有研究成果,壳聚糖及其衍生物通过激活AMPK调节核受体和SREBPs等关键转录因子及其下游脂质代谢(合成、转运、分解、氧化)相关酶的基因表达调控动物体内脂质代谢过程,其调控机制如图 1所示。
|
AMPK:腺苷酸活化蛋白激酶adenosine monophosphate-activated protein kinase; LXR肝脏X受体α liver X receptors α; PPARγ:过氧化物酶体增殖物激活受体peroxisome proliferators-activated receptors γ; SREBP1c:固醇调节元件结合蛋白1c sterol-regulatory element binding proteins; PPARα:过氧化物酶体增殖物激活受体α peroxisome proliferators-activated receptors α; ABCA1:ATP结合盒转运体A1 ATP binding cassette transporter A1;HMGR:羟甲基戊二酰辅酶A还原酶3-hydroxy-3-methylglutaryl coenzyme A reductase; FAS:脂肪酸合成酶fatty acid synthase; ACC:乙酰辅酶A羧化酶acetyl CoA carboxyl-ase; FADS:脂肪酸去饱和酶fatty acid desaturase; Acly:ATP-柠檬酸裂解酶ATP-citrate lyase; DGAT:二酯酰甘油酰基转移酶acyl CoA diacylgycerol acyltransferase; FATP:脂肪酸转运蛋白fatty acid transport protein; FABP:脂肪酸结合蛋白fatty acid-binding proteins; AOX1:醇氧化酶1 alcohol oxidase 1;CPT:肉毒碱棕榈酰转移酶carnitine palmitoyltransterase; CYP7A1:胆固醇7α-羟化酶cholesterol 7α-hydroxylase; TC:总胆固醇total cholesterol; HDL-C:高密度脂蛋白胆固醇high density lipo-protein cholesterol。 图 1 壳聚糖及其衍生物的分子调控机制 Figure 1 Molecular regulation mechanism of chitosan and its derivatives |
然而,Egan等[7]发现,常规饲粮中添加壳聚糖上调猪下丘脑PPARγ的表达,同时下调小肠和下丘脑促食欲基因的表达,因此认为,饲粮壳聚糖通过改变食欲和进食行为影响体内饱感信号发挥其抗肥胖作用和降低体脂含量。Chia等[26]在饲喂常规饲粮的小鼠皮下注射壳聚糖,显著激活脑和胃中的PPARγ活性,下调载脂蛋白B(apolipoprotein B,apoB)和饥饿激素的基因表达。apoB与微粒体转运蛋白结合将脂质并入apoB,形成极低密度脂蛋白(VLDL)颗粒,apoB基因表达的下调有助于降低TG和CHOL含量。此外,Xu等[27]还发现,壳聚糖可增加大鼠肝脏LDL-C受体mRNA水平,消除富含CHOL的脂蛋白颗粒。大鼠高脂饲粮中添加壳聚糖抑制肝脏酰基辅酶A:胆固醇酰基转移酶(acyl coenzyme A: cholesterol acyltransferase,ACAT)的基因表达[5]。ACAT负责肠道CHOL的吸收以及VLDL的装配,高ACAT活性加速肝脏释放VLDL,导致血液中的CHOL含量升高。
4 小结综上所述,壳聚糖及其衍生物能够有效降低动物的血脂含量和脂质沉积,其机制主要体现在壳聚糖及其衍生物的脂质结合作用和对胰脂肪酶的抑制作用,以及对脂肪细胞因子、脂质代谢相关酶活性与基因表达、AMPK和脂质合成转录因子的调节作用。然而,目前的研究主要集中在人和大鼠等研究领域,在其他动物领域的研究报道较少,尤其是关于其对脂质代谢的影响及其调节机制仍存在争议,因此需要深入探讨,为通过壳聚糖及其衍生物科学调控动物的脂质代谢提供理论依据。
| [1] |
ZENG L T, QIN C Q, WANG W, et al. Absorption and distribution of chitosan in mice after oral administration[J]. Carbohydrate Polymers, 2008, 71(3): 435-440. DOI:10.1016/j.carbpol.2007.06.016 |
| [2] |
XIA W S, LIU P, ZHANG J L, et al. Biological activities of chitosan and chitooligosaccharides[J]. Food Hydrocolloids, 2011, 25(2): 170-179. DOI:10.1016/j.foodhyd.2010.03.003 |
| [3] |
WU S H, PAN H T, TAN S R, et al. In vitro inhibition of lipid accumulation induced by oleic acid and in vivo pharmacokinetics of chitosan microspheres (CTMS) and chitosan-capsaicin microspheres(CCMS)[J]. Food & Nutrition Research, 2017, 61(1): 1331658. |
| [4] |
SHAO K, HAN B Q, DONG W, et al. Pharmacokinetics and biodegradation performance of a hydroxypropyl chitosan derivative[J]. Journal of Ocean University of China, 2015, 14(5): 888-896. DOI:10.1007/s11802-015-2600-6 |
| [5] |
WU C C, LIN S Y, CHEN C T, et al. Differential blood lipid-lowering effects of alkylsulfonated chitosan of different molecular weights in Syrian hamsters in vivo[J]. Molecular Medicine Reports, 2012, 5(3): 688-694. |
| [6] |
TAO Y, ZHANG H L, HU Y M, et al. Preparation of chitosan and water-soluble chitosan microspheres via spray-drying method to lower blood lipids in rats fed with high-fat diets[J]. International Journal of Molecular Sciences, 2013, 14(2): 4174-4184. DOI:10.3390/ijms14024174 |
| [7] |
EGAN Á M, O'DOHERTY J V, VIGORS V, et al. Prawn shell chitosan exhibits anti-obesogenic potential through alterations to appetite, affecting feeding behaviour and satiety signals in vivo[J]. PLoS One, 2016, 11(2): e0149820. DOI:10.1371/journal.pone.0149820 |
| [8] |
LI X J, PIAO X S, KIM S W, et al. Effects of chito-oligosaccharide supplementation on performance, nutrient digestibility, and serum composition in broiler chickens[J]. Poultry Science, 2007, 86(6): 1107-1114. DOI:10.1093/ps/86.6.1107 |
| [9] |
KESER O, BILAL T, KUTAY H C, et al. Effects of chitosan oligosaccharide and/or beta-glucan supplementation to diets contained organic zinc on performance and some blood indices in broilers[J]. Pakistan Veterinary Journal, 2012, 32(1): 15-19. |
| [10] |
WANG J P, YOO J S, KIM H J, et al. Nutrient digestibility, blood profiles and fecal microbiota are influenced by chitooligosaccharide supplementation of growing pigs[J]. Livestock Science, 2009, 125(2/3): 298-303. |
| [11] |
TRIVEDI V R, SATIA M C, DESCHAMPS A, et al. Single-blind, placebo controlled randomised clinical study of chitosan for body weight reduction[J]. Nutrition Journal, 2015, 15: 3. DOI:10.1186/s12937-016-0122-8 |
| [12] |
LIU S H, HE S P, CHIANG M T. Effects of long-term feeding of chitosan on postprandial lipid responses and lipid metabolism in a high-sucrose-diet-impaired glucose-tolerant rat model[J]. Journal of Agricultural and Food Chemistry, 2012, 60(17): 4306-4310. DOI:10.1021/jf300792b |
| [13] |
JIN Q, YU H H, WANG X Q, et al. Effect of the molecular weight of water-soluble chitosan on its fat-/cholesterol-binding capacities and inhibitory activities to pancreatic lipase[J]. PeerJ, 2017, 5(3): e3279. |
| [14] |
RAHMAN A, KUMAR S G, KIM S W, et al. Proteomic analysis for inhibitory effect of chitosan oligosaccharides on 3T3-L1 adipocyte differentiation[J]. Proteomics, 2008, 8(3): 569-581. DOI:10.1002/(ISSN)1615-9861 |
| [15] |
CHIU C Y, CHAN I L, YANG T H, et al. Supplementation of chitosan alleviates high-fat diet-enhanced lipogenesis in rats via adenosine monophosphate (AMP)-activated protein kinase activation and inhibition of lipogenesis-associated genes[J]. Journal of Agricultural and Food Chemistry, 2015, 63(11): 2979-2988. DOI:10.1021/acs.jafc.5b00198 |
| [16] |
YAO H T, HUANG S Y, CHIANG M T. A comparative study on hypoglycemic and hypocholesterolemic effects of high and low molecular weight chitosan in streptozotocin-induced diabetic rats[J]. Food and Chemical Toxicology, 2008, 46(5): 1525-1534. DOI:10.1016/j.fct.2007.12.012 |
| [17] |
TRAUTWEIN E A, JVRGENSEN U, ERBERSDOBLER H F. Cholesterol-lowering and gallstone-preventing action of chitosans with different degrees of deacetylation in hamsters fed cholesterol-rich diets[J]. Nutrition Research, 1997, 17(6): 1053-1065. DOI:10.1016/S0271-5317(97)00069-9 |
| [18] |
GUHA S, PAL S K, CHATTERJEE N, et al. Effect of chitosan on lipid levels when administered concurrently with atorvastatin-a placebo controlled study[J]. Journal of the Indian Medical Association, 2005, 103(8): 418, 420. |
| [19] |
GANG Y P, MUN S, PARK Y, et al. Influence of encapsulation of emulsified lipids with chitosan on their in vivo digestibility[J]. Food Chemistry, 2007, 104(2): 761-767. DOI:10.1016/j.foodchem.2006.12.020 |
| [20] |
POKHIS K, BITTERLICH N, CORNELLI U, et al. Efficacy of polyglucosamine for weight loss-confirmed in a randomized double-blind, placebo-controlled clinical investigation[J]. BMC Obesity, 2015, 2(1): 25. DOI:10.1186/s40608-015-0053-5 |
| [21] |
STOLL M, BITTERLICH N, CORNELLI U. Randomised, double-blind, clinical investigation to compare orlistat 60 milligram and a customized polyglucosamine, two treatment methods for the management of overweight and obesity[J]. BMC Obesity, 2017, 4: 4. DOI:10.1186/s40608-016-0130-4 |
| [22] |
CHOI C R, KIM E K, KIM Y S, et al. Chitooligosac-charides decreases plasma lipid levels in healthy men[J]. International Journal of Food Sciences and Nutrition, 2012, 63(1): 103-106. DOI:10.3109/09637486.2011.602051 |
| [23] |
BAHAR B, O'DOHERTY J V, SWEENEY T. A potential role of IL-6 in the chito-oligosaccharide-mediated inhibition of adipogenesis[J]. British Journal of Nutrition, 2011, 106(8): 1142-1150. DOI:10.1017/S0007114511001486 |
| [24] |
MUANPRASAT C, WONGKRASANT P, SATITSRI S, et al. Activation of AMPK by chitosan oligosaccharide in intestinal epithelial cells:mechanism of action and potential applications in intestinal disorders[J]. Biochemical Pharmacology, 2015, 96(3): 225-230. DOI:10.1016/j.bcp.2015.05.016 |
| [25] |
CHIU C Y, CHANG T C, LIU S H, et al. The regulatory effects of fish oil and chitosan on hepatic lipogenic signals in high-fat diet-induced obese rats[J]. Journal of Food and Drug Analysis, 2017, 25(4): 919-930. DOI:10.1016/j.jfda.2016.11.015 |
| [26] |
CHIA H K, CHIEN Y H, TIN Y H. Assessment of chitosan-affected metabolic response by peroxisome proliferator-activated receptor bioluminescent imaging-guided transcriptomic analysis[J]. PLoS One, 2012, 7(4): e34969. DOI:10.1371/journal.pone.0034969 |
| [27] |
XU G, HUANG X, QIU L, et al. Mechanism study of chitosan on lipid metabolism in hyperlipidemic rats[J]. Asia Pacific Journal of Clinical Nutrition, 2007, 16(S1): 313-317. |




