全封闭畜禽舍和规模化养殖模式在生猪和家禽养殖中越来越普及。畜禽舍内空气质量已成为影响畜禽健康、生产效率、畜产品品质的重要环境因子。氨气无色且具有强烈刺激性气味,是畜禽舍内的主要污染气体之一。氨气暴露刺激呼吸道黏膜产生炎症反应,降低黏膜的屏障功能。氨气通过肺泡进入血液,与血红蛋白结合,造成组织缺氧和贫血。舍内高浓度氨气降低畜禽的采食量,影响动物行为,严重危害畜禽的生长性能和健康[1-2]。氨气对畜禽健康的相关研究主要集中在消化道、呼吸道、血液血红蛋白、免疫和行为损伤等方面。近年来,一些研究也表明氨气对畜禽的肉品质也会产生不利影响。本文就集约化养殖中氨气的来源、氨气对畜禽生长性能和肉品质的影响及其影响肉品质形成的可能分子机制进行综述,旨在阐明氨气影响畜禽生产的作用途径和机制,为健康养殖和生产优质畜产品提供理论依据。
1 畜禽舍内氨气的产生畜禽的粪便、尿液和饲料残渣是舍内环境氨气的主要来源[3-4]。粪便、尿液和饲料残渣等分解形成氨气的速度不同,粪便和饲料残渣中含有约80%的有机氮,在微生物作用下分解成氨气需要几周时间;而尿液中的尿素/尿酸在常温条件下被微生物分解成氨气仅需要几个小时[5]。畜禽舍内氨气产生受到饲粮组成、舍内温度以及粪便、尿液滞留时间等多个因素的综合影响[6-8]。饲粮粗蛋白质水平影响动物粪尿液中氮的百分含量,畜禽粪便、尿液中有机氮含量越高,粪便滞留舍内时间越长,舍内温度越接近微生物分解酶的最适温度,氨气则产生越多,累积浓度越高。因此,增加舍内有效通风量和保持舍内环境清洁能够降低舍内氨气浓度[7]。
2 机体内氨的代谢途径环境氨气通过动物的呼吸道,在肺泡内通过气体交换进入血液后,以铵根正离子(NH4+)(主要)和氨气的形式存在。血液中NH4+/氨气的比例取决于血液的pH[9]。动物机体自身的物质代谢,如氨基酸的脱氨基作用以及胺类、嘌呤和嘧啶的分解[10],可以产生氨。部分氨基酸在消化道微生物作用下也会生成氨。正常生理条件下,机体有2个途径来代谢氨,防止其对组织和细胞造成损伤,氨可以与丙酮酸反应生成无毒的丙氨酸,氨还可以和α-酮戊二酸在谷氨酸脱氢酶的作用下转化成无毒的谷氨酰胺[9]。谷氨酰胺不仅是生物合成途径中重要的氨基酸成分和氨基供体,也是非常重要的供能物质[11]。骨骼肌体量大,是氨转化成谷氨酰胺、解除氨中毒途径发生的重要组织。氨代谢生成的丙氨酸和谷氨酰胺被运输到肝脏或肾脏通过尿素循环合成尿素/尿酸,在肝脏和肾脏中分别以尿素/尿酸和铵盐形式随尿液排出体外[10]。
3 氨气对生长的影响氨气严重危害畜禽的生长性能,氨气对畜禽生长性能的危害主要集中体现在氨气暴露降低畜禽采食量、饲料转化率和体增重,以及增加动物死淘率。Reece等[12]研究发现,在25~200 mg/kg氨气浓度下,肉鸡的饲料转化率和出栏体重均出现下降,当氨气浓度超过100 mg/kg时,肉鸡致死率增加;李聪等[13]将21日龄肉鸡分别暴露在25、50和75 mg/kg氨气浓度下21 d,肉鸡的平均日采食量和平均日增重分别显著降低了4.01%、6.68%、9.56%和8.25%、11.83%、15.42%。Cheng等[14]将生长猪连续15周暴露在20 mg/kg环境氨气中,发现猪的生长率和健康未受到显著影响;曹进等[15]研究发现,随着舍内氨气浓度的升高,仔猪的平均日增重下降,当氨气浓度达到80 mg/kg时显著降低了22.07%;Drummond等[16]把4周龄猪分别暴露在50、100和150 mg/kg氨气浓度下4周,发现猪体重分别显著降低了12%、30%和29%。以上研究结果表明,氨气暴露对畜禽的采食量和体增重的影响呈现浓度依赖性,高浓度氨气暴露对畜禽生长性能影响尤为显著。一方面,高浓度氨气暴露刺激动物的眼睛、鼻和口,影响采食行为和采食量,从而降低体增重和生长性能[17];另一方面,高浓度氨气作为应激原,使得营养物质向免疫和机体防御组织器官重分配[18],减少能量物质在肌肉中的沉积,降低饲料转化率。
4 氨气对肌肉品质的影响氨气暴露能显著降低动物采食量,减少对蛋白质和能量的营养物质摄入量。研究表明,蛋白质和能量水平的摄入会影响动物肌肉内氧化型肌纤维的比例和脂肪含量[19-20],进而影响畜禽的肌肉品质。同时,高浓度氨气暴露导致动物产生应激反应,一方面应激会减少能量物质在肌肉中的沉积,降低饲料转化率[18];另一方面应激会造成肌肉中糖原含量的变化,当糖原含量达到一定的阈值会引起肌肉中pH的变化[21],肉的颜色变淡,货架寿命变短[22];宰前短暂的应激(包括热应激、电致晕等)会引起肌肉发酸、系水力下降,易造成白肌肉(PSE肉)[23-24]。过往的氨气暴露对畜禽肉品质影响的研究大都是以肉鸡作为模型,在猪等其他畜种上的研究报道相对较少。20世纪70年代,Quarles等[25]发现肉鸡暴露在25、50 mg/kg氨气浓度下,胸肌产生水疱,胴体等级评分降低。Sackett等[26]将肉鸡暴露在25、50、75和100 mg/kg氨气浓度下,发现25 mg/kg氨气浓度有降低胸肌pH、增加滴水损失的趋势;而高浓度(75和100 mg/kg)氨气显著降低胸肌的嫩度。周风珍等[27]发现,肉鸡暴露在20 mg/kg氨气浓度下2周,宰后45 min的胸肌pH显著降低;50 mg/kg氨气暴露显著提高了胸肌肉色亮度(L*)值。Wei等[28]研究发现,高浓度(70 mg/kg)氨气极显著提高了肉鸡胸肌的滴水损失,显著降低了肉鸡胸肌的嫩度和宰后45 min的胸肌肉色红度(a*)值,显著提高了宰后45 min的胸肌肉色L*和黄度(b*)值以及宰后24 h肉鸡胸肌肉色b*值。本实验室前期研究结果表明,氨气暴露显著增加了肉鸡胸肌的滴水损失,但对肉色无显著影响[13],氨气暴露还改变了肉鸡体脂分布,显著降低了肉鸡胸肌内的脂肪含量[29]。以上研究表明,舍内氨气暴露能够影响肉鸡的肉品质,降低质量等级评分、肌肉pH、肉嫩度和肉颜色,增加肌肉的滴水损失。
5 氨气暴露影响肉品质的可能分子机制环境中高浓度的氨气通过呼吸系统(主要)和消化系统进入机体后,会引起动物血液内氨浓度升高,最终导致动物机体内相关的信号通路和关键基因表达发生改变。这些改变不仅会影响骨骼肌细胞的能量代谢和生长以及肌肉内脂肪的沉积,还会导致骨骼肌肌纤维类型之间相互转化,从而影响畜禽肌肉产量和肉品质。
5.1 氨诱导肌肉生长抑素影响肌细胞生长舍内高浓度氨气通过呼吸道和肺泡进入血液中后,引起血液中氨浓度短暂的升高,然而,当血液中氨浓度超过动物机体所能代谢的阈值后,血液中氨浓度会稳定在一个较高水平。高浓度的血氨可以显著上调骨骼肌中肌肉生长抑素(myostatin,MSTN)的表达[9, 30]。MSTN是强有力的蛋白质合成抑制剂,经丝氨酸苏氨酸蛋白激酶(serine threonine kinase,Akt)依赖或非依赖机制抑制哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)的激活,从而造成骨骼肌细胞蛋白质合成功能障碍[31],最终导致动物产肉量下降;除此之外,MSTN还是骨骼肌肌纤维转化调控的关键因子,可以通过激活转化生长因子-β(transforming growth factor-β,TGF-β)/Smad3通路的下游分子Smad2和Smad3,调节叉头框蛋白O(forkhead box O,FoxO)和肌萎缩因子(Atroin-1),减少骨骼肌纤维粗肌丝肌球蛋白的表达[32],诱导肌肉萎缩[33]以及调控肌纤维由Ⅰ型向Ⅱ型转化[34]。肌纤维的类型与肉色、系水力、pH、嫩度以及肌内脂肪沉积等肉品质指标均存在密切的联系,氧化型(Ⅰ型和Ⅱa型)肌纤维中肌红蛋白和脂质含量较高,故氧化型肌纤维比例越高,肉的颜色越深[35],越有利于水分的保持;酵解型(Ⅱb型)肌纤维糖原含量高,故酵解型肌纤维比例高时,糖原无氧酵解产生乳酸越多,宰后pH下降越快[36],不利于保存。
Qiu等[30]的研究同样发现,高浓度氨通过激活核因子κ增强子结合蛋白(nuclear factor kappa enhancer binding protein,NF-κB)介导的信号通路(图 1)调节MSTN的表达。高浓度氨可以激活NF-κB抑制因子激酶α/β(inhibitor of NF-κB kinase α/β,IKKα/β)以及下游信号分子,将p50-p65异二聚体释放,p50-p65进入细胞核与MSTN启动子上的顺式作用元件相结合,从转录水平调节其表达[37]。目前氨通过激活NF-κB信号通路诱导MSTN表达,从而抑制肌肉蛋白质合成的研究主要在体外的细胞水平,但细胞内氨气的感受器尚未被发现,氨激活IKKα/β等分子机制仍不清楚且相关的动物试验也鲜见报道。
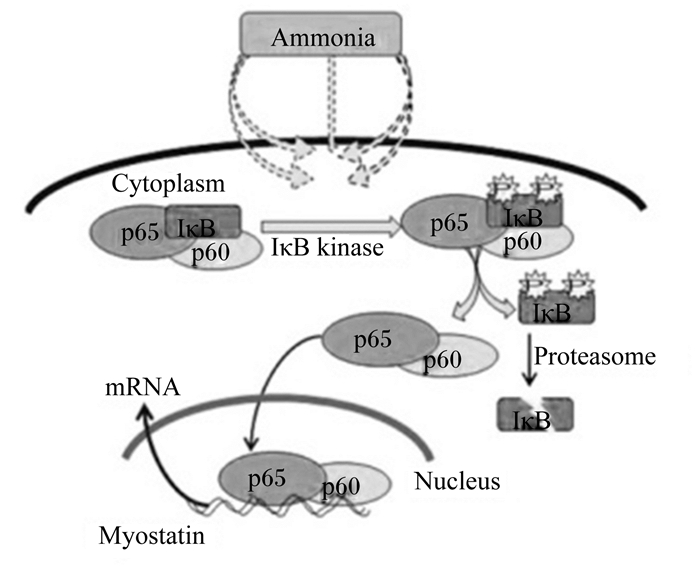
|
Ammonia:氨; p65:转录调控因子p65 protein 65;p50:转录调控因子p50 protein 50;IκB:NF-κB抑制因子inhibi-tor of NF-κB; IκB kinase:NF-κB抑制因子激酶inhibitor of NF-κB kinase; Proteasome:蛋白酶体; Myostatin:肌肉生长抑素; Cytoplasm:细胞质; Nucleus:细胞核; mRNA:信使RNA messenger ribonucleic acid。 图 1 氨诱导骨骼肌肌生成抑制蛋白转录上调机制 Figure 1 Mechanism of ammonia-induced transcriptional up-regulation of skeletal muscle myostatin[31] |
血液中氨浓度稳定在一个较高水平时,动物机体的肝脏不能及时将氨转化成尿素或者尿酸。由于氨可以自由通过细胞膜,是联系肝脏和肌肉间重要的气体信号分子,大量的氨能够进入到肌肉中,与α-酮戊二酸结合,回补转化成谷氨酸和谷氨酰胺,降低血氨浓度[38]。α-酮戊二酸是联系碳-氮循环非常重要的代谢物,作为三羧酸循环中重要中间产物,其含量的降低将减少腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)的生成,从而影响高耗能的蛋白质合成过程[9],最终导致骨骼肌纤维减少,影响肌肉产量。这与医学研究上肝硬化病人由于肝功能缺失,尿素循环受阻,血氨浓度升高,最终造成少肌症和肌无力等骨骼肌机能障碍相一致。有研究发现,亮氨酸是生成α-酮戊二酸的回补反应底物[39],故添加亮氨酸有可能缓解氨对骨骼肌的损伤,减少氨暴露对肉品质的不利影响。
除此之外,由于ATP含量降低导致一磷腺苷酸(AMP)/ATP上升,会促使腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)激活[40]。AMPK是细胞内的能量感受器,在调节糖、脂代谢过程中具中重要作用[34]。一方面,AMPK激活会增加自噬,清除翻译后修饰的肌肉蛋白,这可能会损伤肌动球蛋白的交互作用,最终导致肌肉功能障碍[9];另一方面,AMPK活性升高能够诱导过氧化物酶体增殖物受体辅激活因子-1α(peroxisome proliferator activated receptor co-activator 1α,PGC-1α)基因表达,PGC-1α是转录共激活因子,其在骨骼肌中表达水平的高低与肌纤维类型关系十分密切[34],因此,AMPK可以通过调节PGC-1α的表达水平影响肌纤维的类型进而影响动物肌肉品质。有研究表明,在小鼠骨骼肌中过表达AMPK可以使Ⅱb型肌纤维向Ⅱa型或者Ⅱx型肌纤维转化[41]。
5.3 氨影响肌内脂肪沉积本实验室前期开展的试验发现,氨气暴露改变了肉鸡的体脂分布,降低了胸肌内脂肪沉积,增加了腹部脂肪的沉积[29]。通过转录组学方法,本实验室发现氨气可以调控与脂肪代谢相关基因的表达[42-43](图 2)。其中分化抗原簇36(cluster of differentiation 36,CD36)是位于细胞质膜和线粒体上的脂肪酸受体,参与脂肪酸的摄取、转运和脂肪酸氧化[44]。CD36在需要脂肪酸氧化供能的骨骼肌组织中表达量很高[45],敲除CD36基因阻碍脂肪酸的转运和氧化,降低肌肉的脂肪含量[46]。溶质载体家族27成员1(solute carrier family 27 member 1,SLC27A1)是参与脂肪酸转运和脂肪代谢的另一个关键基因,它主要在肌肉组织和脂肪组织中表达。Wu等[47]发现SLC27A1失活可以使小鼠避免由饲粮诱导而引起的肥胖症。长链脂酰辅酶A合成酶1(long-chain-fatty-acid CoA ligase 1,ACSL1)基因与脂肪沉积能力和肉品质有很大关联,Joseph等[48]研究表明,ACSL1基因参与不饱和脂肪酸的生物合成和脂肪酸的代谢。锚蛋白重复序列和细胞因子信号抑制物盒蛋白质2(the ankyrin repeats and suppressor of cytokine signaling box 2,ASB2)作为参与加速排酸过程的重要基因,其产物能够造成肌纤维蛋白的降解,该基因表达量高时肌肉具有较高嫩度[28]。脂滴包被蛋白2(perilipin 2,PLIN2)基因参与肌内脂肪的储存和脂肪动员。Conte等[49]研究发现,PLIN2基因高表达能降低肌肉力量,在猪上研究表明,PLIN2基因表达量增加的同时肌肉内脂肪含量也随之增加[50]。这些研究结果已表明,舍内氨气暴露可以通过调节脂肪的沉积位置,从转录水平调节组织脂肪代谢,减少肌肉脂肪沉积从而降低肌肉品质。
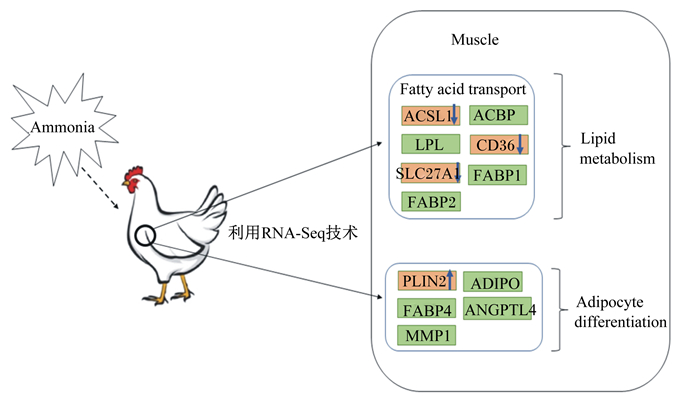
|
Ammonia:氨气; Muscle:肌肉; Fatty acid transport:脂肪酸转运; Lipid metabolism:脂质代谢; Adipocyte differentiation:脂肪细胞分化; ACSL1:长链脂酰辅酶A合成酶1 long-chain-fatty-acid CoA ligase 1;ACBP:酰基辅酶A结合蛋白acyl-CoA-binding protein; LPL:脂蛋白脂肪酶lipoprotein lipase; CD36:分化抗原簇36 cluster of differentiation 36;SLC27A1:溶质载体家族27成员1 solute carrier family 27 member 1;FABP1:脂肪酸结合蛋白1 fatty acid binding protein 1;FABP2:脂肪酸结合蛋白2 fatty acid binding protein 2;PLIN2:脂滴包被蛋白2 Perilipin 2;FABP4:脂肪酸结合蛋白4 fatty acid binding protein 4; ADIPO:脂联素adiponectin; MMP1:基质金属肽酶1 matrix metallopeptidase 1;ANGPTL4:类血管生成素4 angiopoietin like 4。 图 2 氨气对脂肪代谢相关基因影响 Figure 2 Effects of ammonia on fat metabolism related genes[44] |
畜禽养殖环境中氨气浓度的高低直接关系到饲养员和动物的健康。过高浓度的氨气暴露不仅影响畜禽采食、降低饲料转化率、严重危害生产性能,还显著降低畜禽肌肉品质。目前舍内氨气对畜禽肉品质影响的研究多是以肉鸡为模型,动物种类偏少,不同动物品种、日龄、生理阶段以及氨气暴露时间的累积效应等缺乏系统研究;已有文献报道的研究多侧重肉品质表观指标,而对于影响的分子机理方面的探究不够深入。进一步深入研究解析氨气暴露影响肌肉生长的机制,不仅可以为揭示骨骼肌生长规律提供新的视野,还可以为品种、营养、环境多维度考察肉品质的形成及探讨其调控手段提供路径。
| [1] |
邓小闻, 张宏娟, 张学兰, 等. 猪舍氨气的危害及降低氨气浓度的意义[J]. 现代畜牧兽医, 2012(3): 67-69. |
| [2] |
张国强, 谭德富, 孟杰, 等. 内外源氨气的危害及控制方法[J]. 国外畜牧学(猪与禽), 2012, 32(5): 73-75. |
| [3] |
PHILIPPE F X, CABARAUX J F, NICKS B. Ammonia emissions from pig houses:Influencing factors and mitigation techniques[J]. Agriculture, Ecosystems & Environment, 2011, 141(3/4): 245-260. |
| [4] |
BEHERA S N, SHARMA M, ANEJA V P, et al. Ammonia in the atmosphere:a review on emission sources, atmospheric chemistry and deposition on terrestrial bodies[J]. Environmental Science & Pollution Research International, 2013, 20(11): 8092-8131. |
| [5] |
AARNINK A J A, VERSTEGEN M W A. Nutrition, key factor to reduce environmental load from pig production[J]. Livestock Science, 2007, 109(1/2/3): 194-203. |
| [6] |
MILES D M, ROWE D E, CATHCART T C. High litter moisture content suppresses litter ammonia volatilization[J]. Poultry Science, 2011, 90(7): 1397-1405. DOI:10.3382/ps.2010-01114 |
| [7] |
DAVID B, MEJDELL C, MICHEL V, et al. Air quality in alternative housing systems may have an impact on laying hen welfare.Part Ⅰ-Dust[J]. Animals:An Open Access Journal from MDPI, 2015, 5(3): 886-896. |
| [8] |
ZHAO Y, SHEPHERD T A, LI H, et al. Environmental assessment of three egg production systems-Part Ⅰ:monitoring system and indoor air quality[J]. Poultry Science, 2015, 94(3): 518-533. DOI:10.3382/ps/peu076 |
| [9] |
DASARATHY S, MOOKERJEE R P, RACKAYOVA V, et al. Ammonia toxicity:from head to toe?[J]. Metabolic Brain Disease, 2017, 32(2): 529-538. DOI:10.1007/s11011-016-9938-3 |
| [10] |
邹思湘. 动物生物化学[M]. 4版. 北京: 中国农业出版社, 2005: 218-223.
|
| [11] |
SCHNEIDER M, MARISON I W, VON STOCKAR U. The importance of ammonia in mammalian cell culture[J]. Journal of Biotechnology, 1996, 46(3): 161-185. DOI:10.1016/0168-1656(95)00196-4 |
| [12] |
REECE F N, LOTT B D. The effect of ammonia and carbon dioxide during brooding on the performance of broiler chickens[J]. Poultry Science, 1980, 59(7): 1654. |
| [13] |
李聪, 卢庆萍, 唐湘方, 等. 不同氨气浓度对肉鸡生长性能及肉质性状的影响[J]. 中国农业科学, 2014, 47(22): 4516-4523. DOI:10.3864/j.issn.0578-1752.2014.22.017 |
| [14] |
CHENG Z, O'CONNOR E A, JIA Q, et al. Chronic ammonia exposure does not influence hepatic gene expression in growing pigs[J]. Animal, 2014, 8(2): 331-337. DOI:10.1017/S1751731113002127 |
| [15] |
曹进, 张峥. 封闭猪场内氨气对猪群生产性能的影响及控制试验[J]. 养猪, 2003(4): 42-44. |
| [16] |
DRUMMOND J G, CURTIS S E, SIMON J, et al. Effects of aerial ammonia on growth and health of young pigs[J]. Journal of Animal Science, 1980, 50(6): 1085-1091. DOI:10.2527/jas1980.5061085x |
| [17] |
COLINA J J, LEWIS A, MILLER P S. A review of the ammonia issue and pork production[J]. Nebraska Swine Report, 2000, 108: 23-25. |
| [18] |
刘凤华, 谢仲权, 孙朝龙, 等. 高温对蛋鸡血液理化指标及生产性能的影响[J]. 中国畜牧杂志, 1997(5): 23-25. |
| [19] |
孙相俞. 不同品种和营养水平对猪肌纤维类型和胴体肉质性状的影响[D]. 硕士学位论文. 雅安: 四川农业大学, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10626-2009258685.htm
|
| [20] |
周招洪, 陈代文, 郑萍, 等. 饲粮能量和精氨酸水平对育肥猪生长性能、胴体性状和肉品质的影响[J]. 中国畜牧杂志, 2013, 49(15): 40-45. DOI:10.3969/j.issn.0258-7033.2013.15.011 |
| [21] |
HENCKEL P, KARLSSON A, JENSEN M T, et al. Metabolic conditions in porcine longissimus muscle immediately pre-slaughter and its influence on peri-and post mortem energy metabolism[J]. Meat Science, 2002, 62(2): 145-155. DOI:10.1016/S0309-1740(01)00239-X |
| [22] |
GREGORY N G. 动物福利与肉类生产[M]. 2版. 顾宪红, 时建忠, 译. 北京: 中国农业出版社, 2008: 257-267.
|
| [23] |
MALLIA J G, BARBUT S, VAILLANCOURT J P, et al. A dark, firm dry-like condition in turkeys condemned for cyanosis[J]. Poultry Science, 2000, 79(2): 281-285. DOI:10.1093/ps/79.2.281 |
| [24] |
PETRACCI M, FLETCHER D L, NORTHCUTT J K. The effect of holding temperature on live shrink, processing yield, and breast meat quality of broiler chickens[J]. Poultry Science, 2001, 80(5): 670-675. DOI:10.1093/ps/80.5.670 |
| [25] |
QUARLES C L, KLING H F. Evaluation of ammonia and infectious bronchitis vaccination stress on broiler performance and carcass quality[J]. Poultry Science, 1974, 53(4): 1592-1596. DOI:10.3382/ps.0531592 |
| [26] |
SACKETT B A M, FRONTING G W, DESHAZER J A, et al. Effect of gaseous preslaughter environment on chicken broiler meat quality[J]. Poultry Science, 1986, 65(3): 511-519. DOI:10.3382/ps.0650511 |
| [27] |
周风珍. 鸡舍氨浓度对肉仔鸡免疫机能和肉品质影响的研究[D]. 硕士学位论文. 广州: 华南农业大学, 2003. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y548333
|
| [28] |
WEI F X, HU X F, SA R N, et al. Antioxidant capacity and meat quality of broilers exposed to different ambient humidity and ammonia concentrations[J]. Genetics and Molecular Research Gmr, 2014, 13(2): 3117-3127. DOI:10.4238/2014.April.17.8 |
| [29] |
邢焕. 舍内氨气对肉鸡脂肪代谢的影响[D]. 硕士学位论文. 北京: 中国农业科学院, 2015. http://cdmd.cnki.com.cn/Article/CDMD-82101-1015378806.htm
|
| [30] |
QIU J, THAPALIYA S, RUNKANA A, et al. Hyperammonemia in cirrhosis induces transcriptional regulation of myostatin by an NF-κB-mediated mechanism[J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(45): 18162-18167. DOI:10.1073/pnas.1317049110 |
| [31] |
DASARATHY S, MCCULLOUGH A J, MUC S, et al. Sarcopenia associated with portosystemic shunting is reversed by follistatin[J]. Journal of Hepatology, 2011, 54(5): 915-921. DOI:10.1016/j.jhep.2010.08.032 |
| [32] |
EARNEST C P, MORSS G M, WYATT F, et al. Effects of a commercial herbal-based formula on exercise performance in cyclists[J]. Medicine & Science in Sports & Exercise, 2004, 36(3): 504-509. |
| [33] |
LOKIREDDY S, MCFARLANE C, GE X J, et al. Myostatin induces degradation of sarcomeric proteins through a Smad3 signaling mechanism during skeletal muscle wasting[J]. Molecular Endocrinology, 2011, 25(11): 1936-1949. DOI:10.1210/me.2011-1124 |
| [34] |
于亮, 陈晓萍, 王瑞元. 骨骼肌纤维类型转化的分子调控机制研究进展[J]. 中国运动医学杂志, 2014, 33(5): 470-475. |
| [35] |
张耿, 肖淑华, 何军. 劣质肉的形成机理以及微营养素对肉质的调控方法综述[J]. 今日养猪业, 2007(1): 39-44. |
| [36] |
GOSKER H R, ENGELEN M P, VAN MAMEREN H, et al. Muscle fiber type ⅡX atrophy is involved in the loss of fat-free mass in chronic obstructive pulmonary disease[J]. American Journal of Clinical Nutrition, 2002, 76(1): 113-119. DOI:10.1093/ajcn/76.1.113 |
| [37] |
MA K, MALLIDIS C, ARTAZA J, et al. Characterization of 5'-regulatory region of human myostatin gene:regulation by dexamethasone in vitro[J]. American Journal of Physiology:Endocrinology and Metabolism, 2001, 281(6): E1128-E1136. DOI:10.1152/ajpendo.2001.281.6.E1128 |
| [38] |
WOOTTON J C. Re-assessment of ammonium-ion affinities of NADP-specific glutamate dehydrogenases.Activation of the Neurospora crassa enzyme by ammonium and rubidium ions[J]. Biochemical Journal, 1983, 209(2): 527-531. DOI:10.1042/bj2090527 |
| [39] |
SCHACHTER D, SANG J C. Regional differentiation in the rat aorta for a novel signaling pathway:leucine to glutamate[J]. American Journal of Physiology, 1997, 273(2): 1484-1492. |
| [40] |
SAKAMOTO K, MCCARTHY A, SMITH D, et al. Deficiency of LKB1 in skeletal muscle prevents AMPK activation and glucose uptake during contraction[J]. Embo Journal, 2005, 24(10): 1810-1820. DOI:10.1038/sj.emboj.7600667 |
| [41] |
MURPHY R M. Enhanced technique to measure proteins in single segments of human skeletal muscle fibers:fiber-type dependence of AMPK-α1 and-β1[J]. Journal of Applied Physiology, 2011, 110(3): 820-825. DOI:10.1152/japplphysiol.01082.2010 |
| [42] |
YI B, CHEN L, SA R, et al. Transcriptome profile analysis of breast muscle tissues from high or low levels of atmospheric ammonia exposed broilers (Gallus gallus)[J]. PLoS One, 2016, 11(9): e0162631. DOI:10.1371/journal.pone.0162631 |
| [43] |
YI B, CHEN L, SA R N, et al. High concentrations of atmospheric ammonia induce alterations of gene expression in the breast muscle of broilers (Gallus gallus) based on RNA-Seq[J]. BMC Genomics, 2016, 17: 598. DOI:10.1186/s12864-016-2961-2 |
| [44] |
DAVIS R V N, LAMONT S J, ROTHSCHILD M F, et al. Transcriptome analysis of post-hatch breast muscle in legacy and modern broiler chickens reveals enrichment of several regulators of myogenic growth[J]. PLoS One, 2015, 10(3): e0122525. DOI:10.1371/journal.pone.0122525 |
| [45] |
TARHDA Z, SEMLALI O, KETTANI A, et al. Three dimensional structure prediction of fatty acid binding site on human transmembrane receptor CD36[J]. Bioinformatics and Biology Insights, 2013, 7(7): 369-373. |
| [46] |
MCFARLAN J T, YOSHIDA Y, JAIN S S, et al. In vivo, fatty acid translocase (CD36) critically regulates skeletal muscle fuel selection, exercise performance, and training-induced adaptation of fatty acid oxidation[J]. Journal of Biological Chemistry, 2012, 287(28): 23502-23516. DOI:10.1074/jbc.M111.315358 |
| [47] |
WU Q W, ORTEGON A M, TSANG B, et al. FATP1 is an insulin-sensitive fatty acid transporter involved in diet-induced obesity[J]. Molecular and Cellular Biology, 2006, 26(9): 3455-3467. DOI:10.1128/MCB.26.9.3455-3467.2006 |
| [48] |
JOSEPH R, POSCHMANN J, SUKARIEH R, et al. ACSL1 is associated with fetal programming of insulin sensitivity and cellular lipid content[J]. Molecular Endocrinology, 2015, 29(6): 909-920. DOI:10.1210/me.2015-1020 |
| [49] |
CONTE M, VASURI F, TRISOLINO G, et al. Increased Plin2 expression in human skeletal muscle is associated with sarcopenia and muscle weakness[J]. PLoS One, 2013, 8(8): e73709. DOI:10.1371/journal.pone.0073709 |
| [50] |
XING K, ZHU F, ZHAI L W, et al. The liver transcriptome of two full-sibling Songliao black pigs with extreme differences in backfat thickness[J]. Journal of Animal Science and Biotechnology, 2014, 5: 32. DOI:10.1186/2049-1891-5-32 |




