2. 内蒙古农牧业科学院动物营养与饲料研究所, 呼和浩特 010031
2. Institute of Animal Nutrition and Feed, Inner Mongolia Academy of Agriculture and Animal Husbandry Sciences, Hohhot 010031, China
瘤胃对挥发性脂肪酸(volatile fatty acid,VFA)的吸收是动物机体获得能量的重要来源之一,为动物机体提供约占总代谢能75%的能量[1]。瘤胃发酵产生的VFA一部分由瘤胃上皮吸收,一部分被唾液中和,还有一部分随食糜进入小肠被吸收。其中瘤胃上皮对VFA摄入、代谢以及转运入血液起到关键性作用。VFA通过不同吸收机制进入到瘤胃上皮细胞及相关组织进行代谢,这一过程会刺激瘤胃发生适应性变化,对反刍动物任何生理阶段的生命活动都具有重要作用。VFA是一种弱酸,解离出的氢离子(H+)会影响瘤胃液pH。在给反刍动物饲喂高精料饲粮的条件下,VFA浓度升高会导致瘤胃液pH下降,若持续较低的pH,会造成瘤胃微生物区系以及瘤胃发酵类型的改变,严重时会导致瘤胃上皮屏障功能受损,进而影响瘤胃上皮对VFA的吸收。因此,研究VFA在瘤胃上皮吸收的相关机制以及与VFA吸收相关基因,对建立和发展反刍动物瘤胃营养调控系统有重要作用,对生产实践也具有重要的指导意义。笔者阅读大量文献后,针对瘤胃液VFA的吸收相关机制及与吸收相关基因表达进行综述和探讨。
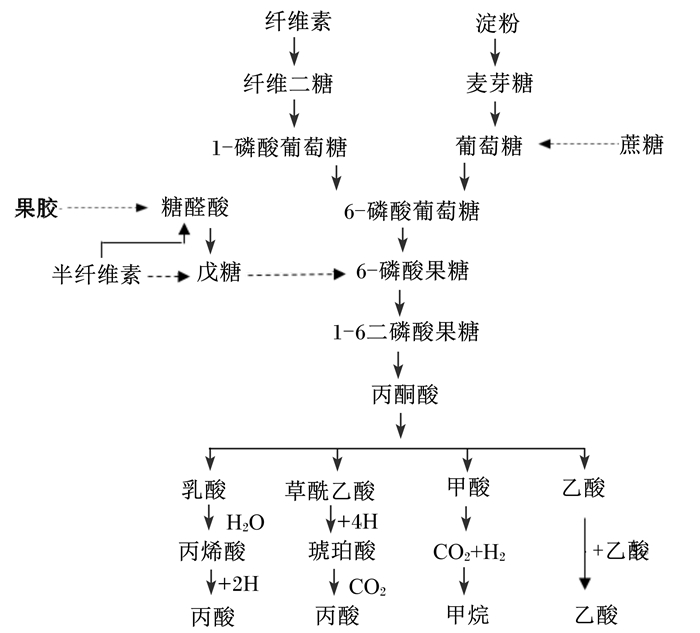
1 瘤胃中VFA的产生反刍动物采食饲粮中碳水化合物在瘤胃微生物发酵下产生的可利用终产物是VFA,如图 1[2]所示。主要的VFA是乙酸、丙酸和丁酸,它们占总挥发性脂肪酸(TVFA)的比例分别为40%~70%、15%~40%、10%~20%,作为反刍动物主要的能量来源,可提供高达75%以上的代谢能[1]。
|
图 1 瘤胃中碳水化合物被微生物发酵转化为VFA的主要途径 Figure 1 Main metabolic ways of VFA produced by microbial fermentation of dietary carbohydrate in rumen[2] |
有研究发现,瘤胃中VFA浓度与组成差异的根本原因是饲粮组成上的差异性(主要是中性洗涤纤维),这导致瘤胃中微生物数量、种类和各种微生物的活性和比例的不同,最终影响瘤胃内VFA的浓度[3]。Kolver等[4]报道,提高饲粮精料比例会增加VFA浓度,从而提高反刍动物的生产性能(如产奶量)。然而,VFA作为弱酸,大部分在瘤胃中电解离释放出H+,导致瘤胃液pH降低。当VFA浓度过高,且已超过瘤胃中和释放出H+的能力时,可能会引发瘤胃酸中毒。
2 瘤胃上皮对VFA的吸收瘤胃如同一个厌氧发酵罐,不仅发酵产生VFA同时产生二氧化碳和氨。VFA是瘤胃中碳水化合物发酵的最重要的终产物,其主要通过瘤胃上皮吸收入血液,并为反刍动物提供充足的能量物质。
研究表明,瘤胃内产生的VFA中50%~85%被瘤胃上皮所吸收,其余则在瓣胃和真胃被吸收。由于VFA种类不同且分子大小也不同,其被吸收的速度也不同,当瘤胃液pH≥7时,吸收速度依次为乙酸>丙酸>丁酸; 当pH<7时吸收速度快慢则相反[5]。封贵[6]向瘤胃中直接灌注低[0.5 g/(kg·d)]、中[1.0 g/(kg·d)]和高[2.0 g/(kg·d)]3个剂量的乙酸溶液,灌注4 h后抽取瘤胃液测定VFA浓度,结果显示,灌注3个剂量的乙酸溶液都会造成瘤胃液乙酸浓度的显著升高;灌注低和中剂量的乙酸溶液后,瘤胃液丙酸和丁酸浓度没有显著变化,而在灌注高剂量乙酸溶液后,瘤胃液丙酸和丁酸浓度则出现极显著下降。这是由于灌注的3个剂量乙酸溶液都超出瘤胃上皮对乙酸的吸收能力,导致乙酸在瘤胃中大量积蓄其浓度升高。在灌注高剂量乙酸溶液后,过量乙酸导致瘤胃液pH下降,瘤胃上皮对各VFA的吸收速率发生变化,瘤胃上皮以吸收丙酸和丁酸为主,从而瘤胃液中的丙酸和丁酸浓度下降。
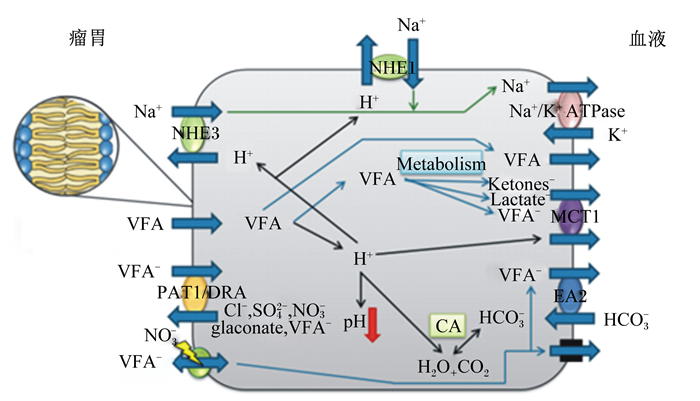
2.1 瘤胃上皮VFA吸收的可能机制国内外学者关于瘤胃上皮VFA吸收机制已有大量研究报道,但其确切机制仍不明确。图 2展示了当前国内外学者们对VFA吸收和稳定瘤胃液pH相关机制的研究和理解[7]。VFA在瘤胃上皮的吸收可能包括5种机制:一是被动扩散。脂溶性的VFA可通过瘤胃壁之间的间隙直接扩散进入血液,其吸收程度和速度受VFA的浓度渗透压的影响,也就是直接依赖于瘤胃液与血液中的浓度差值,差值越大,扩散进入血液的速度就越快。有研究发现,若VFA完全依赖被动扩散,其在瘤胃上皮被吸收存在很多局限性。首先,VFA只在非解离状态才可以扩散进入瘤胃上皮细胞磷脂双分子层,当瘤胃液pH降低,非解离态VFA比例增加,从而提高VFA在瘤胃上皮被动扩散的速度。但在正常瘤胃液pH条件下,瘤胃中非离解状态VFA比例较低。VFA的酸度系数(pKa)约为4.8[8]。即使瘤胃液pH降低到5.8,超过90%以上VFA仍处于解离状态[9],因此只有一小部分VFA能以非解离态在瘤胃上皮经被动扩散吸收。其次,各VFA亲脂性丁酸>丙酸>乙酸,它们在瘤胃上皮吸收速率的研究发现,在各VFA浓度一致时,体外培养试验显示各VFA在瘤胃上皮的吸收速率相似,并没有出现显著差异。将TVFA浓度从10 mmol/L提高到50 mmol/L,乙酸和丁酸在瘤胃上皮吸收速率分别只提高了2.1倍和2.4倍[10]。这些结果说明瘤胃上皮通过被动扩散吸收VFA只起到一定作用。二是挥发性脂肪酸酸根离子(VFA-)和碳酸氢根(HCO3-)的阴离子交换。在瘤胃中,绝大多数的VFA将处于电解离状态,即VFA-。VFA-的吸收发生在由多个潜在的阴离子交换剂介导的电中性过程中[11]。这种机制为瘤胃环境提供了HCO3-来源,通过产生二氧化碳和水的碳酸酐酶反应中和H+。事实上,HCO3-依赖VFA的吸收,随瘤胃内VFA浓度的增加而增加,也随瘤胃液pH的降低而增加[11]。三是硝酸盐敏感性VFA吸收。硝酸根离子(NO3-)与瘤胃上皮中阴离子交换机制相互作用[12-13],包括通过VFA-/HCO3-和氯离子(Cl-)/HCO3-交换剂在瘤胃上皮顶膜运输VFA-(或Cl-)[11-12, 14]。Dengler等[15]为验证NO3-通过阴离子交换机制介导VFA的吸收,在尤斯灌流系统(Ussing chamber)的浆膜侧加入NO3-来增加VFA-从黏膜到浆膜侧的流通量,结果发现HCO3-依赖性运输机制也在基底外侧接收VFA-(而不是HCO3-),这一假设得到试验的支持。随后Aschenbach等[11]报道,这个过程是在碳酸氢盐存在和缺乏的情况下发生的。Laarman等[16]研究发现,HCO3-增加对乙酸吸收有抑制作用,对丁酸吸收没有影响,与Kramer等[14]试验结果一致,并且该试验还发现随着瘤胃液内HCO3-浓度增加,瘤胃上皮对丙酸和Cl-的吸收也产生了抑制作用。但目前所涉及的转运蛋白还尚不明确,未来需要进一步研究。四是质子耦合VFA-运输。当通过被动扩散吸收VFA时,将从瘤胃内容物中除去1个H+,然而,一旦出现在细胞溶质中,VFA将快速解离。然后释放出的H+需要从细胞中驱逐出,以维持细胞内pH和组织完整性。参与细胞内pH调节的单羧酸转运蛋白(monocarboxylate transporter,MCT)和钠/氢交换剂(Na+/H+ exchanger,NHE)将H+输送回瘤胃或进入细胞外空间,并且可以促进去除VFA代谢的终产物如酮体和乳酸[17-18]。因此,H+输出的方向对于被动扩散是否有助于瘤胃液pH的稳定有重要意义。最后是电生成的VFA运输,这种运输过程被认为是由巨阴离子通道介导的,但是目前对VFA转运的贡献尚不清楚。
|
Rumen:瘤胃;Blood:血液;Na+:钠离子;VFA:挥发性脂肪酸;VFA-:挥发性脂肪酸酸根离子;PAT1:假定阴离子转运蛋白 1 putative anion transporter 1;DAR:下调式腺瘤载体down regulated in adenoma;NO3-:硝酸根离子;NHE3:钠/氢交换剂 3 Na+/H+ exchanger 3;Cl-:氯离子;SO42-:硫酸根离子;glaconate:葡萄糖酸盐;H2O:水water;CO2:二氧化碳;HCO3-:碳酸氢根 离子;CA:碳酸酐酶 carbonic anhydrase;NHE1:钠/氢交换剂 1 Na+/H+ exchanger 1;Metabolism:代谢;Ketones-:酮体;Lac- tate-:乳酸;MCT1:单羧酸转运蛋白 1 monocarboxylate transporter 1;K+:钾离子;H+:氢离子;Na+/K+ATPase:钠/钾ATP酶; EA2:阴离子交换蛋白 2 anion exchanger 2。 图 2 VFA吸收转运机制模型 Figure 2 VFA absorption transport mechanism model[7] |
目前关于各种VFA运输过程的相对比例的研究很少。现有的一些零星数据显示,对于乙酸来说,HCO3-依赖性转运、硝酸盐敏感性转运和被动扩散所占比例分别为0~14%、42%~57%和29%~59%。对于丁酸,HCO3-转运、硝酸盐敏感转运和被动扩散所占比例分别为24%~46%、0~4%和25%~76%[19-20]。
2.2 瘤胃上皮VFA吸收相关基因目前,瘤胃上皮中被确定参与VFA吸收的主要载体蛋白共分为3类,一是VFA-/H+交换载体,主要包括:下调式腺瘤载体(down regulated in adenoma,DRA)、假定阴离子转运蛋白1(putative anion transporter 1,PAT1)、阴离子交换蛋白(anion exchanger,AE);二是VFA-/H+共转运载体,主要包括单羧酸转运蛋白1(monocarboxylate transporter 1,MCT1)和单羧酸转运蛋白4(monocarboxylate transporter 4,MCT4);三是细胞稳态调节蛋白,主要包括NHE、vH+ATP酶泵(vH+ATPase)、钠/钾ATP酶(Na+/K+ATPase)等。下文将对DRA、AE、MCT、NHE及Na+/K+-ATPase进行重点阐述。
2.2.1 DRADRA最初是由于参与杂交克隆寻找结肠腺瘤病理基因被命名为“下调式腺瘤载体”[21]。后来被确定为胃肠道特异性阴离子交换蛋白。同时对DRA转运特性进行详细研究,揭示了它是一种Cl-/HCO3-交换器。DRA的表达主要见于肠绒毛细胞和结肠表面吸收细胞[22]。有研究报道,DRA与上皮顶膜NHE2和NHE3功能性偶联介导电中性氯化钠(NaCl)的吸收[23],并且DRA和顶膜NHE的偶联受碳酸酐酶调控;DRA与囊性纤维化转运蛋白调节剂(cystic fibrosis transmem-brane regulator,CFTR)功能性偶联以介导Cl-和HCO3-分泌[24]。
DRA和PAT1以及AE2是主要的VFA-/HCO3-交换载体,瘤胃上皮细胞顶膜对VFA的吸收能力主要取决于VFA-/HCO3-交换载体,特别是乙酸主要通过HCO3-吸收,其中DRA对上皮细胞膜VFA的吸收起着至关重要的作用[7, 25]。艳城[26]和Connor等[27]研究发现DRA和MCT1存在协同作用。这说明瘤胃上皮吸收VFA能力随饲粮精料水平的提高而提高,通过VFA转运者(MCT1、MCT4、DRA、PTA1和AE2)来调控。
2.2.2 AEAE在瘤胃上皮存在4种亚型(AE1~AE4),其中AE2位于瘤胃上皮细胞基顶膜,起到交换VFA-与HCO3-的作用,同时在调节内环境稳定方面也发挥重要作用[28]。Würmli等[13]首次证实瘤胃上皮细胞中存在可以直接调节HCO3-分泌的蛋白。Bilk等[28]报道瘤胃上皮通过AE实现HCO3-和Cl-的交换,并且在此过程中与VFA的吸收转运相关。瘤胃上皮细胞中HCO3-的分泌量受到瘤胃内VFA浓度的影响[29]。闫磊等[30]研究表明,奶牛饲粮精粗比从4 : 6提高到7 : 3,影响瘤胃上皮VFA吸收的基因AE2基因表达量下调了30%,而DRA和NHE3基因表达量则分别上调了140%和60%;同时体外细胞培养结果显示,当培养液pH为6.8时,可降低瘤胃上皮细胞AE2基因的表达量,而VFA浓度对AE2基因的表达量无影响,这提示影响瘤胃上皮VFA吸收的基因AE2基因表达与瘤胃液pH可能密切相关。
2.2.3 MCTMCT是单羧酸转运家族16(SLC16)的成员[31],是一种质子偶合转运蛋白,位于上皮细胞基底外侧膜,用于转运细胞内VFA-和其代谢产物,即酮体和乳酸[17]。只有MCT1、MCT2和MCT4被确认在VFA转运中发挥作用,并且MCT1和MCT4只有在辅助蛋白CD147的协助下才能正常发挥作用[32]。Koho等[33]发现,MCT1和MCT4基因在梅花鹿的瘤胃上皮中表达。Doaa等[18]、Graham等[34]等发现MCT1、MCT2、MCT3基因在牛、山羊的瘤胃上皮中表达,分布在基底层和棘层细胞边缘的MCT1可转运乙酸和丙酸进入血液,对山羊瘤胃上皮棘层和基底层VFA的排出起着直接作用。翁秀秀[35]在研究不同饲粮对VFA吸收相关基因影响时发现,与高精料饲粮相比,饲喂低精料饲粮显著上调奶牛瘤胃乳头的MCT1基因表达量,而MCT2和MCT3基因表达量没有显著变化。这表明MCT2和MCT3可能对瘤胃上皮VFA的转运不起直接作用。但艳城[26]研究发现,饲粮瘤胃降解蛋白(rumen degraded protein,RDP)含量相同,中性洗涤纤维(NDF)/非纤维性碳水化合物(NFC)不同时,对瘤胃上皮MCT1基因表达量没有显著影响, 而MCT4基因表达量则随饲粮NDF/NFC降低而降低,且在饲粮NDF/NFC和RDP含量都相对较高时,MCT1和MCT4基因的表达量最高。
2.2.4 NHENHE位于瘤胃上皮顶膜和基底外侧膜,负责将细胞内的H+与细胞外的钠离子(Na+)按照1 : 1的比例进行跨膜交换,从而调节Na+的转运和细胞质pH水平[36]。已有研究证实,在NHE家族中有多个成员在瘤胃上皮表达,包括NHE1、NHE2和NHE3[34],其活性可影响瘤胃上皮对VFA吸收。而VFA吸收是稳定瘤胃液pH的重要机制之一,当VFA以酸性形式进入瘤胃上皮细胞时,酸性形式的VFA迅速解离成H+和VFA-,使细胞内的H+浓度升高,这时候NHE被激活,从而调节细胞内pH[35]。因此,提高瘤胃上皮细胞中NHE水平和活性,有助于维持瘤胃上皮细胞的稳定。Graham等[34]研究显示NHE1、NHE2、NHE3和NHE8存在于瘤胃上皮细胞中,其中NHE1和NHE3位于上皮细胞的顶端,其功能是将Na+导入细胞并将H+输送到瘤胃;而NHE2的功能是将Na+导入细胞,但将H+输出到细胞外空间。可见NHE活性是中和pH的关键驱动力。
Laarman等[16]研究发现,通过限饲处理后,瘤胃上皮NHE3基因表达量上调,这提供了可以证实NHE3调节pH作用的证据。随着瘤胃发酵过程中VFA浓度增加,NHE3基因表达量的增加可能导致瘤胃上皮细胞H+输出的增加,有助于调节pH。近期大量研究支持了以往研究结论,给山羊饲喂高精料饲粮时,瘤胃上皮NHE的表达量和活性均增强[37-38]。NHE1、NHE2和NHE3基因表达量随饲粮中精料水平的增加而增强[35, 39]。
2.2.5 Na+/K+ATPaseNa+/K+ATPase位于基底外侧膜,调节Na+从细胞中排出[40]。Na+/K+ ATPase是维持电化学梯度的一个重要转运载体[41],由Na+/K+ ATPase形成的Na+驱动力是Na+的跨膜吸收的必要因素。Na+/K+ ATPase在真核细胞膜上广泛存在,1分子ATP水解释放出的能量可以将3个Na+泵出细胞膜外,再将2个K+泵入细胞膜内,以维持膜内外的离子平衡,从而调节跨膜电位,维持细胞容量。由Na+/K+ ATPase产生的Na+驱动力对于钠(Na)的吸收是必不可少的,因此与通过Na+和H+交换的传递间接相关[42]。闫磊等[30]试验结果显示,Na+/K+ ATPase基因的表达量在饲粮NFC/NDF为0.66时最高,而NFC/NDF过低或过高都会降低其表达量。Metzler-Zebeli等[43]研究显示,给山羊饲喂60%谷物饲粮,其瘤胃中Na+/K+ ATPase基因的表达量显著高于饲喂30%谷物饲粮,同时回归分析显示瘤胃中Na+/K+ ATPase基因表达量与瘤胃角质层增厚以及瘤胃液pH呈负相关。Mcleod等[44]试验中也发现提高饲粮精料水平能够提高Na+/K+ ATPase的活性。
3 影响瘤胃VFA吸收的因素 3.1 瘤胃液pH根据VFA吸收机制可知,瘤胃液pH升高并不利于VFA吸收。李文[45]探究了瘤胃液pH对VFA吸收的影响,结果显示瘤胃内低pH有利于VFA的吸收,这仅适用在瘤胃可承受的pH范围内,过高或者过低的pH都会影响瘤胃上皮吸收VFA的能力,而且过低的酸性环境会损坏瘤胃上皮的完整性。Melo等[46]研究数据表明,高pH(pH>7.0)会抑制瘤胃上皮VFA吸收,低pH(4.9<pH<7.0)则有利于瘤胃上皮VFA吸收,并且使质子化形式的VFA浓度增加,这就更有利于瘤胃上皮对VFA的被动扩散吸收。瘤胃液pH可以通过调节基因转录的方式来影响瘤胃上皮细胞对VFA的吸收能力,在体外培养条件下,与pH 7.4相比,pH 6.8能促进山羊影响瘤胃上皮细胞VFA吸收的基因MCT1基因表达量,而降低AE2基因表达量[47]。
3.2 瘤胃上皮形态瘤胃上皮将瘤胃内环境维持在一个动态的平衡中,并会根据瘤胃消化代谢的情况进行动态调整。贾玉东[48]在研究饲粮精粗比对奶牛瘤胃产生VFA影响的研究中发现,当饲喂高精料饲粮时,瘤胃上皮乳头状突起明显增多,而瘤胃上皮乳头状突起可增大VFA的有效吸收面积,进而增强瘤胃壁对VFA的吸收能力。Yan等[39]用瘤网胃上皮表面积控制VFA的吸收时发现VFA的吸收受瘤胃上皮通透性和血流量的影响。VFA的吸收也与瘤胃上皮屏障功能有关,奶牛发生酸中毒后其瘤胃上皮屏障功能被破坏,导致瘤胃上皮通透性增加,VFA吸收增强[49]。
3.3 饲粮组成在瘤胃中影响VFA浓度和组成进而影响其吸收的最根本因素之一就是饲粮类型。提高饲粮中的精料水平可以促进山羊瘤胃上皮中VFA吸收相关基因的表达,从而提高瘤胃上皮对VFA的吸收能力[47],这种变化可能与瘤胃液VFA浓度的升高及pH降低有关。据报道,在饲粮中适当增加易发酵碳水化合物,瘤胃上皮对VFA吸收能力增强,并且VFA吸收量增加高达1.7倍以上[50]。Schurmann等[51]研究结果显示,不断提高饲粮中碳水化合物含量会造成反刍动物瘤胃上皮屏障功能降低,增强瘤胃上皮对Na+和VFA的吸收,这其中被动扩散是VFA吸收的主要途径。而翁秀秀[35]研究发现,饲喂低精料饲粮(MF组)瘤胃主要以乙酸发酵模式为主,饲喂高精料饲粮(CS组)瘤胃主要以丙酸发酵模式为主;同时饲粮不同精料水平并不影响瘤胃中VFA的吸收速率,MF组奶牛的瘤胃中VFA吸收速率为15.9%,CS组为13.7%,这与Júnior等[52]研究结果一致。
4 小结饲粮中碳水化合物经瘤胃微生物发酵产生的VFA通过不同的吸收机制进入瘤胃上皮细胞或其他代谢组织,进而为动物机体提供能量。瘤胃上皮VFA吸收相关机制已有大量研究,但不同VFA吸收机制、各种VFA(乙酸、丙酸和丁酸)之间的相互作用、各种因素如饲粮类型和瘤胃上皮不同生理时期形态变化对瘤胃上皮VFA吸收机制影响的研究还很少。随着分子生物学技术在反刍动物营养学的不断应用和发展,VFA吸收相关基因的发现对探究瘤胃上皮VFA吸收机制起到了重要作用,期望在未来研究中将VFA吸收代谢基因与各种基因传导信号间的调控机制联系起来进行更深层次的探究,实现对VFA高效、充分的利用,提高反刍动物养殖的生产效率。
| [1] |
BERGMAN E N. Energy contributions of volatile fatty acids from the gastrointestinal tract in various species[J]. Physiological Reviews, 1990, 70(2): 567-590. DOI:10.1152/physrev.1990.70.2.567 |
| [2] |
杨红建. 不同碳水化合物和蛋白质水平日粮瘤胃VFA产生及微生物蛋白合成规律研究[D]. 博士学位论文. 北京: 中国农业大学, 2000. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y351192
|
| [3] |
袁庆启, 姜发彬, 王亚琼, 等. 不同精粗比日粮对奶牛瘤胃发酵与肝脏VFA代谢及产奶性能的影响[J]. 家畜生态学报, 2016, 37(7): 36-43. |
| [4] |
KOLVER E S, DE VETH M J. Prediction of ruminal pH from pasture-based diets[J]. Journal of Dairy Science, 2002, 85(5): 1255-1266. DOI:10.3168/jds.S0022-0302(02)74190-8 |
| [5] |
李伟忠, 单安山. 挥发性脂肪酸在动物体内的作用[J]. 饲料博览, 2003(10): 5-7. DOI:10.3969/j.issn.1001-0084.2003.10.002 |
| [6] |
封贵. 瘤胃内灌注乙酸对山羊瘤胃内环境及真胃壁M2、M3和eNOS的基因表达影响[D]. 硕士学位论文. 扬州: 扬州大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-11117-1016284538.htm
|
| [7] |
ASCHENBACH J R, PENNER G B, STUMPFF F, et al. Ruminant Nutrition Symposium:role of fermentation acid absorption in the regulation of ruminal pH[J]. Journal of Animal Science, 2011, 89(4): 1092-107. DOI:10.2527/jas.2010-3301 |
| [8] |
LIDE D R. CRC Handbook of chemistry and physics[M]. 88th ed. Boca Raton, FL: CRC Press, 2007: 8-40.
|
| [9] |
ZAHER U, BOUVIER J C, STEYER J P, et al. Titrimetric montoring of anaerobic digestion: VFA, alkalinities and more[C]//Proceedings of 10th World Congress on Anaerobic Digestion (AD10). [S. l. ]: [s. n. ], 2004: 330-336.
|
| [10] |
SCHWAIGER T, BEAUCHEMIN K A, PENNER G B. The duration of time that beef cattle are fed a high-grain diet affects the recovery from a bout of ruminal acidosis:dry matter intake and ruminal fermentation[J]. Journal of Animal Science, 2013, 91(12): 5729-5742. DOI:10.2527/jas.2013-6471 |
| [11] |
ASCHENBACH J R, BILK S, TADESSE G, et al. Bicarbonate-dependent and bicarbonate-independent mechanisms contribute to nondiffusive uptake of acetate in the ruminal epithelium of sheep[J]. American Journal of Physiology Gastrointestinal and Liver Physiology, 2009, 296(5): G1098-G1107. DOI:10.1152/ajpgi.90442.2008 |
| [12] |
SEIFTER J L, ARONSON P S. Cl-transport via anion exchange in Necturus renal microvillus membranes[J]. American Journal of Physiology, 1984, 247(2): F888-F895. |
| [13] |
WVRMLI R, WOLFFRAM S, SCHARRER E. Inhibition of chloride absorption from the sheep rumen by nitrate[J]. Transboundary and Emerging Diseases, 2010, 34(1/2/3/4/5/6/7/8/9/10): 476-479. |
| [14] |
KRAMER T, MICHELBERGER T, GVRTLER H, et al. Absorption of short-chain fatty acids across ruminal epithelium of sheep[J]. Journal of Comparative Physiology B, 1996, 166(4): 262-269. DOI:10.1007/BF00262870 |
| [15] |
DENGLER F, RACKWITZ R, BENESCH F, et al. Bicarbonate-dependent transport of acetate and butyrate across the basolateral membrane of sheep rumen epithelium[J]. Acta Physiologica, 2013, 210(2): 403-414. |
| [16] |
LAARMAN A H, PEDERZOLLI R A, WOOD K M, et al. Effects of subacute ruminal acidosis and low feed intake on short-chain fatty acid transporters and flux pathways in Holstein steers[J]. Journal of Animal Science, 2016, 94(9): 3729-3737. DOI:10.2527/jas.2016-0638 |
| [17] |
MVLLER F, HUBER K, PFANNKUCHE H, et al. Transport of ketone bodies and lactate in the sheep ruminal epithelium by monocarboxylate transporter 1[J]. American Journal of Physiology:Gastrointestinal and Liver Physiology, 2002, 283(5): 1139-1146. DOI:10.1152/ajpgi.00268.2001 |
| [18] |
KIRAT D, MASUOKA J, HAYASHI H, et al. Monocarboxylate transporter 1(MCT1) plays a direct role in short-chain fatty acids absorption in caprine rumen[J]. The Journal of Physiology, 2006, 576(2): 635-647. DOI:10.1113/jphysiol.2006.115931 |
| [19] |
PENNER G B, ASCHENBACH J R, GÄBEL G, et al. Epithelial capacity for apical uptake of short chain fatty acids is a key determinant for intraruminal pH and the susceptibility to subacute ruminal acidosis in sheep[J]. The Journal of Nutrition, 2009, 139(9): 1714-1720. DOI:10.3945/jn.109.108506 |
| [20] |
WALPOLE M E, SCHURMANN B L, GÓRKA P, et al. Functional roles of aquaporins and urea transporters in urea flux across the ruminal epithelium[C]//OLTJEN J W, KEBREAB E, LAPIERRE H. Energy and protein metabolism and nutrition in sustainable animal production. Energy and protein metabolism and nutrition in sustainable animal production. Wageningen: Wageningen Academic Publishers, 2013.
|
| [21] |
MOSELEY R H, HÖGLUND P, WU G D, et al. Downregulated in adenoma gene encodes a chloride transporter defective in congenital chloride diarrhea[J]. American Journal of Physiology, 1999, 276(1): 185-192. |
| [22] |
ALREFAI W A, WEN X M, JIANG W, et al. Molecular cloning and promoter analysis of downregulated in adenoma (DRA)[J]. American Journal of Physiology:Gastrointestinal and Liver Physiology, 2007, 293(5): G923-G934. DOI:10.1152/ajpgi.00029.2007 |
| [23] |
MUSCH M W, ARVANS D L, WU G D, et al. Functional coupling of the downregulated in adenoma Cl-/base exchanger DRA and the apical Na+/H+ exchangers NHE2 and NHE3[J]. American Journal of Physiology:Gastrointestinal and Liver Physiology, 2009, 296(2): G202-G210. DOI:10.1152/ajpgi.90350.2008 |
| [24] |
JACOB P, ROSSMANN H, LAMPRECHT G, et al. Down-regulated in adenoma mediates apical Cl-/HCO3- exchange in rabbit, rat, and human duodenum[J]. Gastroenterology, 2002, 122(3): 709-724. DOI:10.1053/gast.2002.31875 |
| [25] |
PENNER G B, OBA M, GÄBEL G, et al. A single mild episode of subacute ruminal acidosis does not affect ruminal barrier function in the short term[J]. Journal of Dairy Science, 2010, 93(10): 4838-4845. DOI:10.3168/jds.2010-3406 |
| [26] |
艳城. 日粮对细毛羊瘤胃上皮的SCFA吸收相关基因及氮素转运的调控[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10129-1015427828.htm
|
| [27] |
CONNOR E E, LI R W, BALDWIN R L, et al. Gene expression in the digestive tissues of ruminants and their relationships with feeding and digestive processes[J]. Animal, 2010, 4(7): 993-1007. DOI:10.1017/S1751731109991285 |
| [28] |
BILK S, HUHN K, HONSCHA K U, et al. Bicarbonate exporting transporters in the ovine ruminal epithelium[J]. Journal of Comparative Physiology B, 2005, 175(5): 365-374. DOI:10.1007/s00360-005-0493-1 |
| [29] |
GÄBEL G, ASCHENBACH J R, MVLLER F. Transfer of energy substrates across the ruminal epithelium:implications and limitations[J]. Animal Health Research Reviews, 2002, 3(1): 15-30. DOI:10.1079/AHRR200237 |
| [30] |
闫磊, 沈赞明. 日粮精粗比对奶牛瘤胃上皮VFA吸收相关基因表达的影响[J]. 畜牧与兽医, 2012, 44(增刊1): 125. |
| [31] |
HALESTRAP A P, MEREDITH D. The SLC16 gene family from monocarboxylate transporters (MCTs) to aromatic amino acid transporters and beyond[J]. Pflügers Archiv, 2004, 447(5): 619-628. DOI:10.1007/s00424-003-1067-2 |
| [32] |
曾军英, 韩雪峰, 谭支良. 单羧酸转运蛋白家族及其生物学功能[J]. 生命的化学, 2008, 28(4): 404-407. |
| [33] |
KOHO N, MAIJALA V, NORBERG H, et al. Expression of MCT1, MCT2 and MCT4 in the rumen, small intestine and liver of reindeer (Rangifer tarandus tarandus L.)[J]. Comparative Biochemistry and Physiology Part A, Molecular & Integrative Physiology, 2005, 141(1): 29-34. |
| [34] |
GRAHAM C, GATHERAR I, HASLAM I, et al. Expression and localization of monocarboxylate transporters and sodium/proton exchangers in bovine rumen epithelium[J]. American Journal of Physiology:Regulatory, Integrative and Comparative Physiology, 2007, 292(2): R997-R1007. DOI:10.1152/ajpregu.00343.2006 |
| [35] |
翁秀秀. 饲喂不同日粮奶牛瘤胃发酵和VFA吸收特性及其相关基因表达的研究[D]. 博士学位论文. 兰州: 甘肃农业大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10733-1014012284.htm
|
| [36] |
RØJEN B A, POULSEN S B, THEIL P K, et al. Short communication:Effects of dietary nitrogen concentration on messenger RNA expression and protein abundance of urea transporter-B and aquaporins in ruminal papillae from lactating Holstein cows[J]. Journal of Dairy Science, 2011, 94(5): 2587-2591. DOI:10.3168/jds.2010-4073 |
| [37] |
YANG W, MARTENS H, SHEN Z M. Effects of energy intake and ruminal SCFA on mRNA expression of Na+/H+ exchangers in rumen epithelium of goats[C]//Proceedings of the 11th International Symposium on Ruminant Physiology. Clermont-Ferrand: [s. n. ], 2009.
|
| [38] |
SCHVRMANN N, TRABUCO L G, BENDER C, et al. Molecular dissection of human argonaute proteins by DNA shuffling[J]. Nature Structural & Molecular Biology, 2013, 20(7): 818-826. |
| [39] |
YAN L, ZHANG B, SHEN Z M. Dietary modulation of the expression of genes involved in short-chain fatty acid absorption in the rumen epithelium is related to short-chain fatty acid concentration and pH in the rumen of goats[J]. Journal of Dairy Science, 2014, 97(9): 5668-5675. DOI:10.3168/jds.2013-7807 |
| [40] |
LEONHARD-MAREK S, STUMPFF F, MARTENS H. Transport of cations and anions across forestomach epithelia:conclusions from in vitro studies[J]. Animal, 2010, 4(7): 1037-1056. DOI:10.1017/S1751731110000261 |
| [41] |
ZOUZOULAS A, DUNHAM P B, BLOSTEIN R. The effect of the gamma modulator on Na/K pumps activity of intact Mammalian cells[J]. The Journal of Membrane Biology, 2005, 204(1): 49-56. DOI:10.1007/s00232-005-0746-7 |
| [42] |
ALBRECHT E, KOLISEK M, VIERGUTZ T, et al. Molecular identification, immunolocalization, and functional activity of a vacuolar-type H+-ATPase in bovine rumen epithelium[J]. Journal of Comparative Physiology B, 2008, 178(3): 285-295. DOI:10.1007/s00360-007-0221-0 |
| [43] |
METZLER-ZEBELI B U, HOLLMANN M, SABITZER S, et al. Epithelial response to high-grain diets involves alteration in nutrient transporters and Na+/K+-ATPase mRNA expression in rumen and colon of goats[J]. Journal of Animal Science, 2013, 91(9): 4256-4266. DOI:10.2527/jas.2012-5570 |
| [44] |
MCLEOD K R, BALDWIN R L. Effects of diet forage:concentrate ratio and metabolizable energy intake on visceral organ growth and in vitro oxidative capacity of gut tissues in sheep[J]. Journal of Animal Science, 2000, 78(3): 760-770. DOI:10.2527/2000.783760x |
| [45] |
李文. 瘤胃液pH值、渗透压、挥发性脂肪酸(VFAs)浓度对绵羊瘤胃上皮VFAs吸收影响的研究[D]. 硕士学位论文. 泰安: 山东农业大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10434-1014341716.htm
|
| [46] |
MELO L Q, COSTA S F, LOPES F, et al. Rumen morphometrics and the effect of digesta pH and volume on volatile fatty acid absorption[J]. Journal of Animal Science, 2013, 91(4): 1775-1783. DOI:10.2527/jas.2011-4999 |
| [47] |
闫磊. 日粮精料水平对瘤胃上皮SCFA吸收相关载体表达的影响及其机理研究[D]. 博士学位论文. 南京: 南京农业大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10307-1016041460.htm
|
| [48] |
贾玉东. 日粮精粗比对奶牛瘤胃厌氧细菌和挥发性脂肪酸及血液指标的影响[D]. 硕士学位论文. 泰安: 山东农业大学, 2008. http://cdmd.cnki.com.cn/article/cdmd-10434-2008206433.htm
|
| [49] |
杨淑青. 亚急性瘤胃酸中毒对奶山羊瘤胃上皮屏障功能影响机制的研究[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10129-1014375617.htm
|
| [50] |
ETSCHMANN B, SUPLIE A, MARTENS H. Change of ruminal sodium transport in sheep during dietary adaptation[J]. Archives of Animal Nutrition, 2009, 63(1): 26-38. DOI:10.1080/17450390802506885 |
| [51] |
SCHURMANN B L, WALPOLE M E, GÓRKA P, et al. Short-term adaptation of the ruminal epithelium involves abrupt changes in sodium and short-chain fatty acid transport[J]. American Journal of Physiology:Regulatory, Integrative and Comparative Physiology, 2014, 307(7): R802-R816. DOI:10.1152/ajpregu.00035.2014 |
| [52] |
JÚNIOR J C R, PEREIRA M N, BÔER H, et al. Comparison of techniques to determine the clearance of ruminal volatile fatty acids[J]. Journal of Dairy Science, 2006, 89(8): 3096-3106. DOI:10.3168/jds.S0022-0302(06)72584-X |




