褪黑素(melatonin, MT)广泛存在于单细胞藻类、植物、无脊椎动物及高等动物中。松果体是动物合成褪黑素的重要组织,但是肠道中褪黑素的含量是松果体的400倍[1]。动物机体内的褪黑素具有广泛的生物学作用,褪黑素是一种非酶类抗氧化剂,能清除羟基和不同的活性氧,增加抗氧化酶的表达和活力[2];褪黑素可调控动物的繁殖机能、调节卵泡的发育、卵母细胞成熟、促进胚胎发育[3];褪黑素对先天性免疫和获得性免疫均具有促进作用[4]。基于褪黑素广泛的生物学作用,适当提高特定生理阶段时动物机体中褪黑素含量可能会有积极意义。调节动物机体内褪黑素含量的方法,一是从静脉直接注射或通过饲粮补喂褪黑素[5-7];二是补喂或注射褪黑素的前体物质[包括色氨酸(tryptophan, Trp)、5-羟色氨酸(5-hydroxytryptophan, 5-HTP)等][1, 8]。在对反刍动物的研究发现,饲粮中添加色氨酸、过瘤胃色氨酸后并未显著影响泌乳期奶牛白天和夜间时血浆中褪黑素的含量[9];腹腔注射500 mg/kg BW的色氨酸,绵羊血浆中褪黑素含量并未显著增加,腹腔注射5-羟色氨酸则显著提高了绵羊血浆中褪黑素的含量[8]。由此看来,色氨酸作为褪黑素合成的前体物质并进而发挥影响褪黑素合成的作用可能存在种属差异性。腹腔注射5-羟色氨酸可影响绵羊血浆中褪黑素含量,但通过胃肠给予方式是否具有同样的作用?由于瘤胃微生物对氨基酸普遍具有降解作用,而目前尚未有5-羟色氨酸是否会在绵羊瘤胃中降解的研究报道。因此,本试验的目的是比较绵羊在补喂5-羟色氨酸、瘤胃保护性5-羟色氨酸后不同时间点时血浆中5-羟色氨酸、5-羟色胺(5-hydroxytryptamine, 5-HT)、褪黑素含量的变化,探究通过补喂5-羟色氨酸调节绵羊机体中褪黑素分泌模式及含量的可能性,为通过在饲粮中添加5-羟色氨酸来调控反刍动物机体褪黑素合成的技术方法提供科学理论基础。
1 材料与方法 1.1 试验时间与地点本试验于2017年5月13至2017年5月29日在新疆惠康畜牧生物科技有限公司羊场进行,采集血样当天日出时间为06:32,日落时间为21:44。
1.2 试验材料5-羟色氨酸购自武汉远成共创科技有限公司,纯度为98%;瘤胃保护性5-羟色氨酸是以5-羟色氨酸为原料,由北京亚禾营养高新技术有限责任公司加工制成,其中5-羟色氨酸有效含量为45.00%,过瘤胃率为88.60%。
1.3 试验设计试验选取健康、1岁、平均体重为(55.78±3.24) kg(体重在50.5~65.8 kg)的陶赛特母羊18只,按体重分为3组,每组6只,分别为对照组、试验Ⅰ组和试验Ⅱ组,所有羊只饲喂同一营养水平的粉状精料(购自新疆天康畜牧生物技术股份有限公司),每天每只羊的粉状精料饲喂量为体重的1%,玉米青贮饲喂量为0.6 kg,混合干草(苜蓿:麦秸=3: 7)自由采食,在此基础上,试验Ⅰ组和试验Ⅱ组羊只分别补喂50 mg/kg BW 5-羟色氨酸、111 mg/kg BW瘤胃保护性5-羟色氨酸(补喂量参考Huether等[10]的研究结果,试验Ⅰ组和试验Ⅱ组补喂的5-羟色氨酸的有效剂量相同,均为50 mg/kg BW),进行15 d的饲养试验。试验过程中使用的粉状精料组成及营养水平见表 1,玉米青贮、苜蓿、麦秸的营养水平见表 2。
|
|
表 1 粉状精料组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of powder concentrate (DM basis) |
|
|
表 2 玉米青贮、苜蓿、麦秸的营养水平(干物质基础) Table 2 Nutrient levels of corn silage, alfalfa and wheat straw (DM basis) |
试验期间,将每天每只羊的粉状精料和玉米青贮、5-羟色氨酸、瘤胃保护性5-羟色氨酸平均分为2份,分别于早上(07:30)、下午(19:30)饲喂,饲喂时将5-羟色氨酸或瘤胃保护性5-羟色氨酸与50 g粉状精料混合后饲喂,待绵羊摄入完毕后再饲喂其他粉状精料和玉米青贮。饲喂粉状精料、玉米青贮时为单栏饲养,采食完毕后试验羊只在运动场中自由活动。夜晚时羊舍使用灯泡(250 lx)照明。
1.5 样品的采集与处理于试验的第16天采集血液,血液采集时间点分别为早上(07:30)和下午饲喂前0 h(19:30)以及饲喂后1.5、3.0、6.0、9.0 h,通过颈静脉采集血液至肝素钠抗凝的采血管中,3 500 r/min离心15 min制备血浆,用移液枪小心吸取血浆至1.5 mL Eppendorf管中,立即放入-20 ℃冰箱中冷冻保存。血液采集过程中所有羊只每个时间点的血液采集过程不超过10 min。
1.6 样品的测定绵羊血浆送至北京华英生物技术研究所进行5-羟色氨酸、色氨酸、5-羟色胺、褪黑素含量的测定。5-羟色氨酸、褪黑素含量测定使用放射免疫法(XH-6020全自动放免计数仪,西安核仪器厂),5-羟色胺含量测定使用酶联免疫法(华卫德朗DR-200BS酶标分析仪,无锡华卫德朗仪器有限公司),色氨酸含量测定使用比色法(A6半自动生化仪,北京松上技术有限公司)。
1.7 数据分析数据采用Excel 2003进行初步整理,试验结果以平均值(mean)±标准差(SD)表示。试验数据采用SPSS 18.0软件的one-way ANOVA程序进行方差分析,各组间平均值的多重比较采用Duncan氏法。
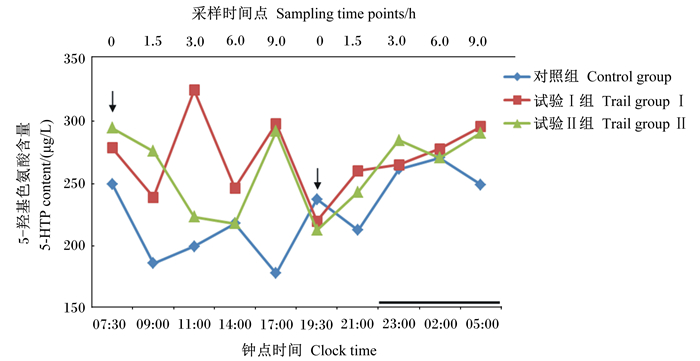
2 结果与分析 2.1 补喂5-羟色氨酸、瘤胃保护性5-羟色氨酸对绵羊血浆中5-羟色氨酸含量的影响由表 3、图 1可知,在早上饲喂后1.5、3.0、6.0、9.0 h,即09:00—17:00,试验Ⅰ组和试验Ⅱ组血浆中5-羟色氨酸含量均高于对照组,且试验Ⅰ组在早上饲喂后1.5、3.0、9.0 h与对照组的差异达到了极显著水平(P < 0.01),试验Ⅱ组在早上饲喂后1.5、9.0 h与对照组的差异达到了极显著水平(P < 0.01);但在下午饲喂前0 h(19:30时),对照组和各试验组血浆中5-羟色氨酸含量接近(P>0.05);在下午饲喂后的不同时间点试验Ⅰ组和试验Ⅱ组血浆中5-羟色氨酸含量均高于对照组,且在下午饲喂后1.5 h(21:00时)与对照组的差异达到了极显著水平(P < 0.01);在下午饲喂后1.5、3.0、6.0 h,各试验组血浆中5-羟色氨酸含量均增加,但对照组血浆中5-羟色氨酸含量在下午饲喂后1.5 h下降。
|
|
表 3 补喂5-羟色氨酸、瘤胃保护性5-羟色氨酸对绵羊血浆中5-羟色氨酸含量的影响 Table 3 Effects of diet supplemented with 5-HTP, rumen protected 5-HTP on plasma 5-HTP content of sheep (n=6) |
|
“→”表示饲喂时间,“—”表示夜晚。下图同。 "→" mean the time of feeding, and "—" mean night. The same as below. 图 1 补喂5-羟色氨酸、瘤胃保护性5-羟色氨酸对绵羊血浆中5-羟色氨酸含量的影响 Figure 1 Effects of supplement with 5-HTP, rumen protected 5-HTP on plasma 5-HTP content of sheep |
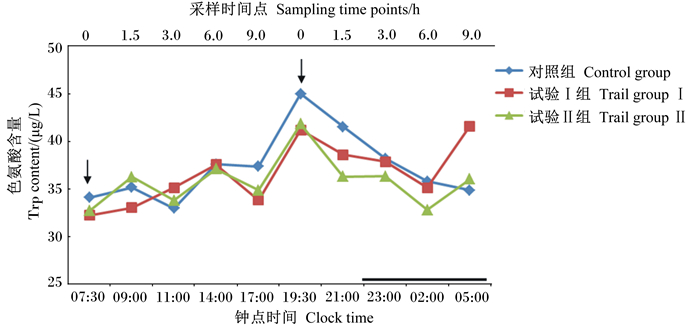
由表 4、图 2可知,早上饲喂后1.5 h(09:00时),各组血浆中色氨酸含量呈增加趋势;在早上饲喂后3.0~6.0 h,对照组、试验Ⅱ组血浆中色氨酸含量呈现出先下降后又上升的趋势,而试验Ⅰ组血浆中色氨酸含量则持续增加,但在各采样时间点各组间差异均不显著(P>0.05);在下午饲喂前0 h(19:30时),各组血浆中色氨酸含量达到了最大值,且对照组高于试验Ⅰ组和试验Ⅱ组,但差异不显著(P>0.05);在下午饲喂后的1.5、3.0、6.0 h,即21:00、23:00、02:00时,各组血浆中色氨酸含量均呈下降趋势,且同一采样时间点各组间差异不显著(P>0.05);在下午饲喂后9 h(05:00时)试验Ⅰ组和试验Ⅱ组血浆中色氨酸含量呈增加趋势,而对照组仍为下降趋势。
|
|
表 4 补喂5-羟色氨酸、瘤胃保护性5-羟色氨酸对绵羊血浆中色氨酸含量的影响 Table 4 Effects of diet supplemented with 5-HTP, rumen protected 5-HTP on plasma tryptophan content of sheep (n=6) |
|
图 2 补喂5-羟色氨酸、瘤胃保护性5-羟色氨酸对绵羊血浆中色氨酸含量的影响 Figure 2 Effects of diet supplemented with 5-HTP, rumen protected 5-HTP on plasma tryptophan content of sheep |
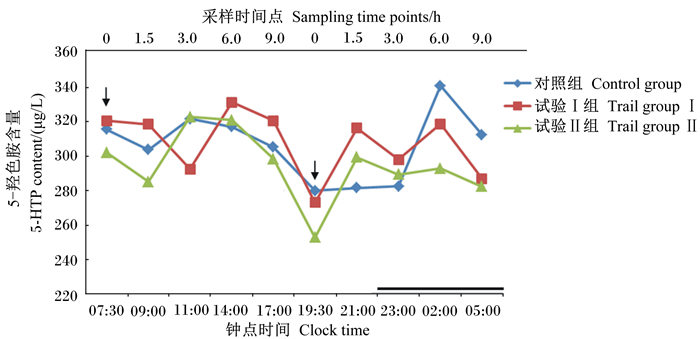
由表 5、图 3可知,在早上饲喂前0 h和饲喂后1.5、3.0、6.0、9.0 h,即07:30、09:00、11:00、14:00、17:00时,各组血浆中5-羟色胺含量均在320~285 ng/mL,各组间差异不显著(P>0.05);而在下午饲喂前0 h(19:30时),各组血浆中5-羟色胺含量均有所下降,且试验Ⅰ组和试验Ⅱ组均低于对照组,但差异不显著(P>0.05);随后,在下午饲喂后1.5、3.0、6.0 h,即21:00、23:00、02:00时,各组血浆中5-羟色胺含量呈波动性上升;但在下午饲喂后9 h(05:00时)各组血浆中5-羟色胺含量均有所下降。
|
|
表 5 补喂5-羟色氨酸、瘤胃保护性5-羟色氨酸对绵羊血浆中5-羟色胺含量的影响 Table 5 Effects of diet supplemented with 5-HTP, rumen protected 5-HTP on plasma 5-HT content of sheep (n=6) |
|
图 3 补喂5-羟色氨酸、瘤胃保护性5-羟色氨酸对绵羊血浆中5-羟色胺含量的影响 Figure 3 Effect of diet supplemented with 5-HTP, rumen protected 5-HTP on plasma 5-HT content of sheep |
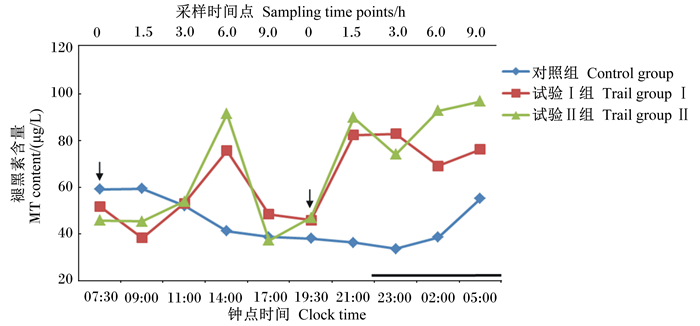
由表 6、图 4可知,在早上饲喂后1.5 h(09:00时),试验Ⅰ组和试验Ⅱ组血浆中褪黑素含量均极显著低于对照组(P<0.01);在早上饲喂后3.0~9.0 h(11:00—17:00时),试验Ⅰ组和试验Ⅱ组血浆中褪黑素含量均高于对照组,其中在早上饲喂后6.0 h(14:00时)试验Ⅰ组和试验Ⅱ组与对照组的差异均达到了极显著水平(P<0.01);在下午饲喂后1.5、3.0、6.0、9.0 h,对照组以及试验Ⅰ组和试验Ⅱ组血浆中褪黑素含量均呈波动性上升,且在下午饲喂后1.5、3.0、6.0 h试验Ⅰ组和试验Ⅱ组极显著高于对照组(P<0.01),在下午饲喂后9.0 h试验Ⅱ组显著高于对照组(P<0.05)。
|
|
表 6 补喂5-羟色氨酸、瘤胃保护性5-羟色氨酸对绵羊血浆中褪黑素含量的影响 Table 6 Effects of diet supplemented with 5-HTP, rumen protected 5-HTP on plasma melatonin content of sheep (n=6) |
|
图 4 补喂5-羟色氨酸、瘤胃保护性5-羟色氨酸对绵羊血浆中褪黑素含量的影响 Figure 4 Effects of diet supplemented with 5-HTP, rumen protected 5-HTP on plasma melatonin content of sheep |
绵羊在饲喂前后血液中5-羟色氨酸含量的动态变化少见报道。本试验显示,在白天,对照组绵羊在饲喂前后的12 h内,血浆中5-羟色氨酸含量的变化呈现出“W”模式(血浆中5-羟色氨酸含量最高点分别在饲喂前0 h及饲喂后6.0 h)。在试验Ⅰ组(即补喂5-羟色氨酸组),白天时摄入5-羟色氨酸后血浆中5-羟色氨酸含量分别在早上饲喂后3.0、9.0 h(11:00、17:00时)出现了2个含量高峰,即出现了“双峰”模式,这与5-羟色氨酸在健康人体中的代谢模式相似,可能是与胃部的2次排空作用和广泛存在的肝肠循环有关[11]。在试验Ⅱ组(即补喂瘤胃保护性5-羟色氨酸组),血浆中5-羟色氨酸含量的变化则表现为“单峰”模式(在饲喂后6.0 h血浆5-羟色氨酸含量达到最高)。
在下午饲喂后直到夜间(即19:30—05:00),对照组、试验Ⅰ组、试验Ⅱ组的血浆中5-羟色氨酸含量均在比白天平均含量较高的水平上变化。对于对照组,这可能是肠道、松果体等内源性5-羟色氨酸合成增加的结果;对于2个试验组,除内源性5-羟色氨酸增加之外,补喂的5-羟色氨酸也是重要的来源。研究表明,给人口服2 mg/kg BW的5-羟色氨酸后,70%的5-羟色氨酸会进入机体血液循环,血浆中5-羟色氨酸含量在口服5-羟色氨酸后2 h开始增加[12]。另外,恐慌病人通过静脉分别注射10、20、40 mg的5-羟色氨酸,在注射后血液中5-羟色氨酸含量开始显著增加,在注射后30 min时血液中5-羟色氨酸含量达到最大值,随后下降,且血液中5-羟色氨酸含量与5-羟色氨酸注射量存在明显的剂量效应[13]。
在本试验中,早上饲喂后3.0、6.0 h(11:00、14:00时)及下午饲喂后1.5 h(21:00时),摄入5-羟色氨酸绵羊血浆中5-羟色氨酸含量高于摄入瘤胃保护性5-羟色氨酸绵羊血浆中5-羟色氨酸含量,这是由于5-羟色氨酸进入绵羊消化道后可快速地被吸收,而瘤胃保护性5-羟色氨酸表面存在包衣,在瘤胃内可能无法全部降解,到达肠道后才会使包衣内的5-羟色氨酸释放出来,致使瘤胃保护性5-羟色氨酸在绵羊体内的吸收存在延迟现象。然而,5-羟色氨酸在瘤胃内能否降解目前尚不明确,值得进一步研究。
3.2 补喂5-羟色氨酸、瘤胃保护性5-羟色氨酸对绵羊血浆中色氨酸含量的影响在本试验中,在所采样的各个时间点上,2个试验组血浆中色氨酸含量与对照组血浆中色氨酸含量相近,且变化趋势基本一致,表明补喂5-羟色氨酸或瘤胃保护性5-羟色氨酸对绵羊色氨酸吸收、代谢没有产生显著影响。研究表明,5-羟色氨酸在肠道中的吸收方式为主动运输[14],而氨基酸的吸收主要是通过氨基酸转运载体来实现[15],因此,可以认为,5-羟色氨酸、色氨酸在动物肠道转运(即吸收)上不存在竞争关系。肠道对5-羟色氨酸吸收的详细机制仍不明确。
动物体内血浆中氨基酸含量的变化受采食时间、饲粮组成等的影响[16]。Purser等[17]以羔羊为试验对象,研究饲喂蛋白质水平为8.1%的饲粮后,24 h内血浆中氨基酸含量的变化,结果表明,饲喂后3 h血浆中氨基酸含量增加。在本试验中,早上饲喂后1.5~9.0 h(09:00—19:30时),各组血浆中色氨酸含量呈波动性增加,这与Purser等[17]的研究结果一致。在下午饲喂后的1.5、3.0、6.0 h(21:00—02:00时)各组血浆中色氨酸含量均呈下降趋势,而此时血浆中5-羟色氨酸含量呈增加趋势,因此下午饲喂后机体中的色氨酸可能在色氨酸羟化酶的作用下转化为了5-羟色氨酸,使血浆中5-羟色氨酸含量增加。下午饲喂后9.0 h(05:00时)试验Ⅰ组和试验Ⅱ组血浆中色氨酸含量呈增加趋势,而对照组仍为下降趋势,在这段时间内是绵羊体内褪黑素合成量最高的阶段,摄入的5-羟色氨酸或瘤胃保护性5-羟色氨酸可作为褪黑素合成的间接前体物质,用于褪黑素的合成,使机体中色氨酸的消耗量降低,导致血浆中色氨酸含量增加;而对照组绵羊为使血浆中褪黑素含量保持较高含量,需要褪黑素的前体物质,就对照组绵羊而言,机体中褪黑素的间接前体物质只有色氨酸,因此对照组绵羊体内的色氨酸被用于褪黑素的合成,导致对照组绵羊血浆中色氨酸含量持续降低。
3.3 补喂5-羟色氨酸、瘤胃保护性5-羟色氨酸对绵羊血浆中5-羟色胺含量的影响本试验结果显示,在所采样的各个时间点上,2个试验组血浆中5-羟色胺含量与对照组血浆中5-羟色胺含量相近,且变化趋势基本一致。5-羟色胺既是色氨酸、5-羟色氨酸的转化产物,也是生成褪黑素的直接底物;同时,机体中的5-羟色胺主要通过尿液排出,哺乳动物肝脏和肾脏中含有大量的可降解5-羟色胺的酶[18],约2/3的5-羟色胺在肝脏与硫酸或葡萄糖醛酸结合后排出,或将吲哚断裂而分解;约1/3经单氨氧化酶作用氧化脱氨形成5-羟基吲哚乙酸后从尿排出[19]。因此,动物机体血液中的5-羟色胺含量受到生成、转化及直接代谢排泄等3种主要过程的调节。Wa等[20]于白天时给健康青年男性连续静脉注射5-羟色氨酸60 min,注射量为10 μg/(kg·min),注射前尿液中5-羟色胺的排出量小于0.7 nmol/min,而在注射5-羟色氨酸后,尿液中5-羟色胺排出量达到了为(412±92) nmol/min,但血液中5-羟色胺含量并未发生显著的变化,为788~813 nmol/L,这表明在使用5-羟色氨酸处理后,生成的5-羟色胺主要通过尿液排出,而血液中的5-羟色胺含量并未发生显著变化。由此可以推测,动物机体血浆或血清中的5-羟色胺含量并不一定与褪黑素含量的变化具有一致性。在本试验中,早上饲喂前0 h和饲喂后1.5、3.0、6.0、9.0 h(07:30—17:00时),各组血浆中5-羟色胺含量在320~285 ng/mL,这与Wa等[20]的研究结果证实外源性5-羟色氨酸对血浆中5-羟色胺含量无显著影响的结果相一致,但本试验未收集母羊尿液,尿液中5-羟色胺含量的变化情况尚不明确,在今后的研究中可收集母羊尿液,测定尿液中5-羟色胺含量,验证母羊通过饲粮摄入5-羟色氨酸后尿液中5-羟色胺的含量是否增加。
3.4 补喂5-羟色氨酸、瘤胃保护性5-羟色氨酸对绵羊血浆中褪黑素含量的影响在哺乳动物体内,褪黑素主要在松果体、肠道中合成,其他组织器官也可合成少量褪黑素,但只有松果体和视网膜具有周期性分泌的特点[21-22]。哺乳动物体内的褪黑素含量存在明显的昼夜节律,白天时含量低,夜晚时含量高[23]。济宁青山羊春季12:00、18:00时血液中褪黑素含量分别为(11.44±1.77) pg/mL、(17.61±2.53) pg/mL,00:00、03:00时血液中褪黑素含量分别为(72.25±5.08) pg/mL、(66.20±4.49) pg/mL[24]。小尾寒羊、同羊和滩羊血液中褪黑素含量在春分、夏至、秋分时存在着明显的季节性变化,在春分和秋分时平均含量相对较低,在夏至时明显升高,且在夏至日没时褪黑素含量开始增加[25]。本试验中,白天时对照组绵羊血液中褪黑素含量为38.80~59.15 pg/mL,而在23:00—05:00时对照组绵羊血液中褪黑素含量呈增加趋势(33.67~55.18 pg/mL),但并未表现出明显的昼夜节律,这可能与夜间时羊舍的光照有关,影响了褪黑素的合成与分泌[26]。此外,在本试验中,选用的是繁殖季节性不是很强的陶赛特母羊,本试验是在夏季(5月份)进行的,因此,绵羊褪黑素分泌的昼夜节律可能表现不明显。
研究表明,外源性褪黑素前体物质可增加绵羊血液中褪黑素含量。Namboodiri等[8]于07:00时给绵羊分别腹腔注射5-羟色氨酸20、200 mg/kg BW,12:00时血浆中褪黑素含量分别为64.32、349.89 pg/mL,而对照组绵羊血浆中褪黑素含量为23.00 pg/mL。Sugden等[27]给绵羊分别腹腔注射20、200 mg/kg BW 5-羟色氨酸,5 h后绵羊松果体中5-羟色胺-N-乙酰转移酶(AA-NAT)和羟基吲哚氧位甲基转移酶(HIOMT)的活性均增加。在本试验中,试验Ⅰ组、试验Ⅱ组在下午饲喂后血浆中褪黑素含量最高分别达到(82.95±16.20)、(92.72±7.46) pg/mL,高于Namboodiri等[8]使用20 mg/kg BW 5-羟色氨酸的试验结果,而低于使用200 mg/kg BW 5-羟色氨酸的试验结果,表明5-羟色氨酸调节绵羊血液中褪黑素含量可能存在剂量效应,这可能与5-羟色氨酸转化为褪黑素过程中的酶有关[27-28]。
Shindo等[11]使用[14C]标记的5-羟色氨酸在动物机体中得到证实,组织和器官可快速、大量地摄取5-羟色氨酸。本试验中,在早上饲喂后1.5 h(09:00时)2个试验组血浆中褪黑素含量均显著低于对照组,这可能是由于进入绵羊机体内的5-羟色氨酸被组织器官快速摄取,使血浆中5-羟色氨酸含量下降,使褪黑素的前体物质含量降低,从而导致血浆中褪黑素含量降低。
在早上饲喂后3.0~6.0 h(11:00—17:00时),2个试验组血浆中褪黑素含量均高于对照组,且早上饲喂后3.0~6.0 h(11:00—17:00时)血浆中褪黑素含量接近夜晚时血浆中褪黑素的含量,表明绵羊口服摄入5-羟色氨酸、瘤胃保护性5-羟色氨酸后,通过肠道吸收转化可有效地改变白天时绵羊血浆中褪黑素的分泌模式和含量,这与Namboodiri等[8]在白天时给绵羊腹腔注射5-羟色氨酸(20、200 mg/kg BW)后2~5 h内绵羊血浆中褪黑素含量显著增加的结果一致。在夜晚时,本试验中绵羊下午饲喂前0 h及饲喂后1.5、3.0、6.0、9.0 h(19:30—05:00时),2个试验组血浆中褪黑素含量仍显著高于对照组,但Namboodiri等[8]夜晚时给绵羊腹腔注射5-羟色氨酸(20、200 mg/kg BW)后,血液中褪黑素含量并未出现显著增加,这可能与5-羟色氨酸的处理方式有关。综合本试验3个组绵羊血浆中5-羟色氨酸含量的变化模式及5-羟色氨酸的代谢路径,在白天,5-羟色氨酸含量的“消长”变化与褪黑素含量的“长消”变化之间具有较好的一致性;在夜间,5-羟色氨酸含量的“消长”变化与褪黑素含量的“长消”变化之间的一致性较差。因此,通过饲粮饲喂的方式摄入5-羟色氨酸或瘤胃保护性5-羟色氨酸均可有效调控白天绵羊机体内褪黑素的分泌模式和分泌量。由于绵羊机体中褪黑素的分泌存在明显的季节性差异,本试验只研究了夏季时5-羟色氨酸对绵羊血液中褪黑素含量的影响,后期可比较不同季节时饲喂5-羟色氨酸对绵羊血液中褪黑素含量的影响。
就摄入5-羟色氨酸或瘤胃保护性5-羟色氨酸对绵羊血浆中褪黑素含量的影响而言,在早上饲喂后3.0、6.0 h(即11:00、14:00时)及下午饲喂后1.5、6.0、9.0 h(即21:00、02:00、05:00时)补喂瘤胃保护性5-羟色氨酸组血浆中褪黑素含量均高于补喂5-羟色氨酸组,表明瘤胃保护性5-羟色氨酸对增加绵羊血浆中褪黑素含量更加有效。
4 结论补喂5-羟色氨酸(50 mg/kg BW)、瘤胃保护性5-羟色氨酸(111 mg/kg BW)均可显著提高绵羊血浆中5-羟色氨酸含量,改变白天机体中褪黑素分泌模式及含量,且瘤胃保护性5-羟色氨酸的作用更有效,但对血浆中色氨酸、5-羟色胺含量均无显著影响。
| [1] |
CHEN C Q, FICHNA J, BASHASHATI M, et al. Distribution, function and physiological role of melatonin in the lower gut[J]. Word Journal of Castroeterology, 2011, 17(34): 3888-3898. |
| [2] |
PAZAR A, KOLGAZI M, MEMISOGLU A, et al. The neuroprotective and anti-apoptotic effects of melatonin on hemolytic hyperbilirubinemia-induced oxidative brain damage[J]. Journal of Pineal Research, 2016, 60(1): 74-83. DOI:10.1111/jpi.12292 |
| [3] |
CHEMINEAU P, PELLETIER J, GUÉRIN Y, et al. Photoperiodic and melatonin treatments for the control of seasonal reproduction in sheep and goats[J]. Reproduction, Nutriton, Developpement, 1988, 28(2B): 409-422. DOI:10.1051/rnd:19880307 |
| [4] |
CARRILLO-VICO A, GUERRERO J M, LARDONR P J, et al. A review of the multiple actions of melatonin on the immune system[J]. Endocrine, 2005, 27(2): 189-200. DOI:10.1385/ENDO:27:2 |
| [5] |
杨明辉, 史建民, 陶景丽, 吴昊, 等. 外源褪黑素处理方式对荷斯坦奶牛体内褪黑素富集与代谢的影响[J]. 中国畜牧兽医, 2017, 44(9): 2613-2620. |
| [6] |
BERTRAND P P, BERTRAND R L, CAMELL P J, et al. Simultaneous measurement of serotonin and melatonin from the intestine of old mice:the effects of daily melatonin supplementation[J]. Journal of Pineal Research, 2010, 49(1): 23-24. DOI:10.1111/jpi.2010.49.issue-1 |
| [7] |
HUETHER G, MESSNER M, RODENBECK A, et al. Effect of continuous melatonin infusions on steadystate plasma melatonin levels in rats under near physiological conditions[J]. Journal of Pineal Research, 1998, 24(3): 146-151. DOI:10.1111/jpi.1998.24.issue-3 |
| [8] |
NAMBOODIRI M A, SUGDEN D, KLEIN D C, et al. 5-hydroxytryptophan elevates serum melatonin[J]. Science, 1983, 221(4611): 659-661. DOI:10.1126/science.6867734 |
| [9] |
陈俊宏, 赵芳, 魏凯敏, 等. 添喂色氨酸、过瘤胃色氨酸对奶牛泌乳性能、血浆指标和乳中褪黑素含量的影响[J]. 动物营养学报, 2017, 29(11): 3921-3931. |
| [10] |
HUETHER G, POEGGELER B, REIMER A, et al. Effect of tryptophan administration on circulating melatonin levels in chicks and rats:evidence for stimulation of melatonin synthesis and release in the gastrointestinal tract[J]. Life Science, 1992, 51(12): 945-953. DOI:10.1016/0024-3205(92)90402-B |
| [11] |
SHINDO H, MIYAKOSHI N. Whole-body autoradiographic studies on the distribution of 14C-labeled D-and L-5-hydroxytryptophan, 5-hydroxytryptamine and 5-hydroxyindole-3-acetic acid in rats[J]. Chemical and Pharmaceutical Bulletin, 1976, 24(12): 3158-3168. DOI:10.1248/cpb.24.3158 |
| [12] |
MAGNUSSEN I, JENSEN T S, RAND J H, et al. Plasma accumulation of metabolism of orally administered single dose L-5-hydroxytryptophan in man[J]. Acta Pharmacolgica et Toxicologica, 1981, 49(3): 184-189. |
| [13] |
DEN BOER J A, WESTENBERG H G M. Behavioral, neuroendocrine, and biochemical effects of 5-hydroxytryptophan administration in panic disorder[J]. Psychiatry Research, 1990, 31(3): 267-278. DOI:10.1016/0165-1781(90)90096-N |
| [14] |
SHINDO H, KOMAI T, KAWAI K. Mechanism of intestinal absorption and brain uptake of L-5-hydroxytryptophan in rats, as compared to those of L-3, 4-dihydroxyphenylalanine[J]. Chemical and Pharmaceutical Bulletin, 1977, 25(6): 1417-1425. DOI:10.1248/cpb.25.1417 |
| [15] |
BRÖER S. Amino acid transport across mammalian intestinal and renal epithelia[J]. Physiological Reviews, 2008, 88(1): 249-286. DOI:10.1152/physrev.00018.2006 |
| [16] |
BLACK A L, KLEIBER M, SMITH A H, et al. Acetate as a precursor of amino acids of casein in the intact dairy cow[J]. Biochimica et Biophysica Acta, 1957, 23: 54-59. DOI:10.1016/0006-3002(57)90284-6 |
| [17] |
PURSER D B, KLOPFENSTEIN T J, CLINE J H. Dietary and defaunation effects upon plasma amino acid concentrations in sheep[J]. The Journal of Nutrition, 1966, 89(2): 226-234. DOI:10.1093/jn/89.2.226 |
| [18] |
SOLE M J, MADAPALLIMATTAM A, BAINES A D. An active pathway for serotonin synthesis by renal proximal tubules[J]. Kidney International, 1986, 29(3): 689-694. DOI:10.1038/ki.1986.53 |
| [19] |
BARNES N M, SHARP T. A review of central 5-HT receptors and their function[J]. Neuropharmacology, 1999, 38(8): 1083-1152. DOI:10.1016/S0028-3908(99)00010-6 |
| [20] |
WA T C, BURNS N J T, WILLIAMS B C, et al. Blood and urine 5-hydroxytryptophan and 5-hydroxytryptamine levels after administration of two 5-hydroxytryptamine precursors in normal man[J]. British Journal of Clinical Pharmacology, 1995, 39(3): 327-329. DOI:10.1111/j.1365-2125.1995.tb04456.x |
| [21] |
BITTMAN E L, KARSCH F J. Nightly duration of pineal melatonin secretion determines the reproductive response to inhibitory day length in the ewe[J]. Biology of Reproduction, 1984, 30(3): 585-593. DOI:10.1095/biolreprod30.3.585 |
| [22] |
SHARMA M, PALACIOS-BOIS J, SCHWARTZ G, et al. Circadian rhythms of melatonin and cortisol in aging[J]. Biological Psychiatry, 1989, 25(3): 305-319. DOI:10.1016/0006-3223(89)90178-9 |
| [23] |
ZEMDEGS I Z, MCMILLEN I C, WALKER D W, et al. Diurnal rhythms in plasma melatonin concentrations in the fetal sheep and pregnant ewe during late gestation[J]. Endocrinology, 1988, 123(1): 284-289. DOI:10.1210/endo-123-1-284 |
| [24] |
葛仕豪, 高立坤, 王树迎, 等. 济宁青山羊不同季节血浆内褪黑素分泌规律的研究[J]. 畜牧兽医学报, 2008, 39(2): 158-163. |
| [25] |
陈玉林, 张小辉. 不同绵羊品种褪黑激素的季节性及昼夜变化规律研究[J]. 家畜生态学报, 2005, 26(1): 35-38. |
| [26] |
TRINDER J, ARMSTRONG S, O'BRIEN C, et al. Inhibition of melatonin secretion onset by low levels of illumination[J]. Journal of Sleep Research, 1996, 5(2): 77-82. DOI:10.1046/j.1365-2869.1996.00011.x |
| [27] |
SUGDEN D, NAMBOODIRI M A A, KLEIN D C, et al. Ovine pineal indoles:effects of L-tryptophan or L-5-hydroxytryptophan administration[J]. Journal of Neurochemistry, 1985, 44(3): 769-772. DOI:10.1111/jnc.1985.44.issue-3 |
| [28] |
RIBELAYGA C, PÉVET P, SIMONNEAUX V. Hiomt drives the photoperiodic changes in the amplitude of the melatonin peak of the Siberian hamster[J]. American Journal of Physiology, 2000, 278(5): R1339-R1345. |




