2. 苏州市阳澄湖国家现代农业示范区发展有限公司, 苏州 215123
2. Suzhou Yangchenghu National Modern Agricultural Industrial Park Co., Ltd., Suzhou 215123, China
日本沼虾(Macrobrachium nipponense),俗称青虾,具有营养价值高、食性杂、生长快、繁殖力强等特点,是我国淡水养殖虾类的重要品种,仅2016年的产量就达27.26万t,同比上年增长2.8%[1]。
关于日本沼虾营养需求的研究已有不少报道,已知日本沼虾对蛋白质的需要量在38.0%~41.5%[2-3],对脂肪的需要量在6%~12%[4-5],对维生素E的需要量在66.07~212.68 mg/kg[6],对维生素B6的需要量为80 mg/kg[7]。然而,关于饲料磷脂水平对日本沼虾影响的研究相对较少,相关研究也是多关注在不同脂肪源的比较上[2, 8]。
甲壳类动物消化系统形态和结构与脊椎动物存在较大差异,例如,甲壳类动物没有胆囊。胆囊的缺失提示甲壳类动物对脂质的乳化作用可能不及脊椎动物。而磷脂是一种具有双亲性的生物活性物质,能增强食物中脂质的乳化,促进甘油三酯、胆固醇和一些脂溶性营养物质的吸收与转运[9]。已有大量研究证实磷脂是虾类生长和存活所必需的[10-13]。磷脂是否能促进日本沼虾的生长和存活以及对脂类的吸收利用目前还不清楚。因此,本试验拟在不同脂肪水平下研究饲料磷脂水平对日本沼虾生长和生理的影响,旨在揭示饲料磷脂水平对日本沼虾脂肪需要量的影响,为甲壳类脂质营养生理理论的发展提供科学依据。
1 材料与方法 1.1 饲料制作试验以大豆磷脂、鱼油和大豆油为磷脂来源。试验用大豆磷脂由苏州鑫裕饲料有限公司提供,其中磷脂酰胆碱含量为15%,磷脂酰乙醇胺的含量为13%,磷脂酰肌醇含量为9%;试验用鱼油为深海鳀鱼油,大豆油为金龙鱼大豆油。将鱼油和豆油等比例混合均匀,再与大豆磷脂分别按2 : 1和1 : 2混合,即大豆磷脂分别占脂类混合物的33.3%(低磷脂组)和66.7%(高磷脂组)。将2种脂类混合物分别按3%(低脂肪组)、6%(中脂肪组)、9%(高脂肪组)的比例添加到饲料中,配制出6种等氮等能的试验饲料。根据试验饲料中脂类混合物添加量和大豆磷脂添加量,将6种试验饲料分别命名为L3P1、L3P2、L6P2、L6P4、L9P3、L9P6,实测试验饲料中脂肪水平分别为7%、7%、10%、10%、13%、13%。试验饲料组成及营养水平见表 1。制备饲料颗粒时,首先将各种固态原料经粉碎机(1500型,永康市兆申电器有限公司)粉碎,过80目筛并经搅拌机(B-20型,广州市番禺力丰食品机械厂)搅拌,充分混合均匀,其中维生素和矿物质等微量原料采用逐级扩大法混合,再加入脂类混合物手工搓匀,继而加入40%的蒸馏水混合均匀,用双螺杆挤条机(自行研制的设备)压制成粒径为1.0 mm的饲料,风干后放入-20 ℃冰箱中保存备用。
|
|
表 1 试验饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of experimental diets (DM basis) |
试验在苏州市相城区阳澄湖现代农业产业园有限公司的配载中心(江苏省企业研究生工作站进行)。试验用虾苗购自本地虾苗繁育场,幼虾初始体重为(0.075±0.001) g,健康无病,规格整齐。试验虾在养殖水池暂养15 d,禁食24 h后分于24个100 cm×100 cm×100 cm的塑料缸内饲养,养殖缸盛水约300 L,并放置有生物性和非生物性的虾体附着物。每缸放养150尾。每种试验饲料投喂4缸试验虾,试验饲料随机分配。每天07:30和18:30各投喂1次,饱食投喂,发现死亡虾捞出并称重。试验用水为纱网过滤、沉淀24 h后的湖水。试验期间水体pH为7.5~8.1,氨氮浓度低于0.05 mg/L,连续增氧保持溶氧浓度在6.2~7.1 mg/L。每天排污1次,隔天换水1/3,水温24~28 ℃。饲养4周时称重1次,饲养8周后,禁食24 h后开始采样。
1.3 测定指标与方法 1.3.1 生长性能测定将每缸所有日本沼虾捞出后分别称总重,记录尾数,用于计算增重率(WGR)、成活率(SR)、特定生长率(SGR)及饲料系数(FCR)。各生长性能指标计算公式如下:
增重率(%)=100×(终末体重-初始体重)/初始体重;
成活率(%)=100×终末虾尾数/初始虾尾数;
特定生长率(%)=100×(ln终末体重-ln初始体重)/饲养天数;
饲料系数=干物质摄入量/虾体增重。
1.3.2 肝胰腺消化酶活力和抗氧化指标的测定从每缸中随机选取8尾日本沼虾,冰浴短暂麻醉,用磷酸盐缓冲液(PBS)缓慢冲洗,吸水纸吸去表面水分,在无菌操作箱(xw-80,泰州市高港鑫伟试验设备厂)中取其肝胰腺,剪碎混匀后,取0.5 g左右组织样品,加入9倍体积质量分数为0.8%的生理盐水制成10%的组织匀浆液,3 000 r/min离心10 min,取上清液,用于测定肝胰腺中消化酶活性和抗氧化指标。淀粉酶(amylase)、类胰蛋白酶(typtase)、脂肪酶(lipase)和超氧化物歧化酶(SOD)活性及总抗氧化能力(T-AOC)与总蛋白含量均采用南京建成生物工程研究所生产的试剂盒测定。
1.3.3 肝胰腺组织学观察制作冷冻切片观察肝胰腺组织学,样品制备参考周永梅等[14]的方法,稍作修改。每缸取3尾日本沼虾,冰浴麻醉状态下取其肝胰腺,用OCT包埋剂包埋后,用Leical 1900(德国Leical公司)冷冻切片机切片,切片10 μm厚,黏附在载破片上,然后采用苏丹Ⅲ染液染色,70%乙醇洗去多余染液,甘油明胶封片液封片,采用OLYMPUS BX 51(日本Olympus公司)显微成像系统观察和拍摄肝胰腺组织形态。
1.3.4 营养成分分析采集饲料样品用于饲料概略养分分析,收集剩余的虾用于体成分分析。其中,水分含量测定采用低温冷冻干燥法(LJB 18型冷冻干燥机,北京四环科学仪器厂有限公司);粗蛋白质含量测定采用凯氏定氮法(GB 5009.5—2010;所用消化仪:LNK 87型,江苏省宜兴市科教仪器研究所;蒸馏仪:KN 520型,济南阿尔瓦仪器有限公司);粗脂肪含量测定采用索氏抽提法(GB/T 14772—2008)。饲料的总能采用全自动氧弹量热仪(PARR 6300型,上海昌吉地质仪器有限公司)测定;粗灰分含量采用GB 5009.4—2010中方法测定,样品先于200 ℃碳化至不冒烟,再于550 ℃陶瓷纤维马弗炉中(8-10TP型,上海慧泰仪器制造有限公司)灼烧至恒重。
1.4 数据分析所有数据以平均值±标准差表示。数据分析使用SPSS 11.0软件进行,采用单因素方差分析(one-way ANOVA)和双因素方差分析(two-way ANOVA)程序对数据进行分析,并采用Duncan氏法进行多重比较,显著性水平设为P < 0.05。
2 结果与分析 2.1 生长性能由表 2可知,脂类混合物添加量和大豆磷脂比例对日本沼虾的终末体重、增重率、特定生长率、饲料系数和成活率均存在显著影响(P < 0.05),且二者的交互作用对日本沼虾的终末体重、增重率、特定生长率也存在显著影响(P < 0.05)。各组日本沼虾的成活率介于47.8%~66.9%,以L6P4组成活率最高。方差分析结果显示,低和中脂肪组的成活率高于高脂肪组(P < 0.05),高磷脂组成活率显著高于低磷脂组(P < 0.05)。增重率和特定生长率均以L6P4组最高,其次是L3P2组,二者显著高于其他各组(P < 0.05)。方差分析结果显示,随着脂肪水平升高,增重率和特定生长率均逐渐下降,而高磷脂组显著高于低磷脂组(P < 0.05)。各组间饲料系数的差异与增重率和特定生长率相反。
|
|
表 2 日本沼虾的生长性能 Table 2 Growth performance of oriental river prawn (Macrobrachium nipponensis) (n=4) |
由表 3可知,脂类混合物添加量和大豆磷脂比例对日本沼虾的虾体粗脂肪含量存在显著影响(P < 0.05),而对虾体粗蛋白质和水分含量无显著影响(P>0.05),且二者的交互作用对虾体粗脂肪、粗蛋白质和水分含量均无显著影响(P>0.05)。方差分析结果显示,虾体粗脂肪含量以L9P3组最高,显著高于其他各组(P < 0.05);随着饲料中脂肪水平的升高,虾体粗脂肪含量显著上升(P < 0.05);高磷脂组虾体粗脂肪含量显著低于低磷脂组(P < 0.05)。
|
|
表 3 日本沼虾的体成分以及肝胰腺消化酶活性和抗氧化指标 Table 3 Body composition, the activities of digestive enzymes and the antioxidant indices in hepatopancreas of oriental river prawn (Macrobrachium nipponensis) (n=4) |
由表 3可知,脂类混合物添加量和大豆磷脂比例及二者的交互作用对日本沼虾的肝胰腺淀粉酶活性影响不显著(P>0.05)。日本沼虾的肝胰腺类蛋白酶和脂肪酶活性均受脂类混合物添加量的显著影响(P < 0.05),并均表现为高脂肪组显著低于中和低脂肪组(P < 0.05)。日本沼虾的肝胰腺脂肪酶活性也受大豆磷脂比例的显著影响(P < 0.05),高磷脂组显著高于低磷脂组(P < 0.05)。此外,脂类混合物添加量和大豆磷脂比例对脂肪酶活性还具有显著的交互作用(P < 0.05)。
由表 3可知,日本沼虾的肝胰腺SOD活性和T-AOC均受脂类混合物添加量的显著影响(P < 0.05),而大豆磷脂比例对二者的影响不显著(P < 0.05)。随着饲料脂肪水平的升高,肝胰腺SOD活性先升高后下降,而T-AOC则逐渐上升。此外,脂类混合物添加量和大豆磷脂比例对日本沼虾肝胰腺T-AOC还具有显著的交互作用(P < 0.05)。
2.4 肝胰腺组织学观察光学显微镜下观察发现,L3P1、L3P2组日本沼虾肝胰腺中脂肪滴细小且较少,L6P2、L6P4组出现较大的脂肪颗粒,而L9P3、L9P6组这2个高脂肪水平组日本沼虾肝胰腺中脂肪滴密集但细小,且L9P3组脂肪颗粒数量要多于L9P6组(图 1)。
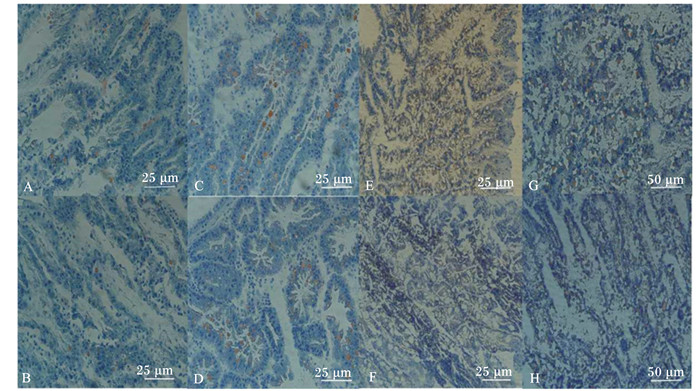
|
A:L3P1组; B:L3P2组; C:L6P2组; D:L6P4组; E和G:L9P3组; F和H:L9P6组。肝胰腺组织中染成黄色的为脂肪滴。 A:group L3P1; B:group L3P2; C:group L6P2; D:group L6P4; E and G:group L9P3; f and h:group L9P6. Lipid granules are stained yellow in hepatopancreas tissue. 图 1 日本沼虾肝胰腺冷冻切片 Figure 1 Frozen sections of hepatopancreas for oriental river prawn (Macrobrachium nipponensis) |
虾类的生长和存活易受水环境中的一些胁迫因子的影响,如水体中氨氮浓度[15]、亚硝酸盐浓度[16]、pH[17]、溶氧浓度[18]等;此外,日本沼虾喜营附着生活,附着基的数量和质量也影响其生长和存活。本试验中,养殖用水为过滤沉淀后的阳澄湖水,同时养殖缸内投放盆栽伊乐藻供日本沼虾依附攀爬,并采用纳米管充氧,溶氧量高,气泡细小均匀,养殖过程中所监测的水质因子均在日本沼虾生长的安全阈值内,为日本沼虾的生长、脱壳、攀附营造了一个合适的条件。8周的生长试验结果显示,各组日本沼虾的成活率在47.8%~66.8%,增重率在173.67%~272.02%,饲料系数在1.31~1.70,表明日本沼虾生长良好,试验结果能够充分反映饲料的差异。
本研究中,双因素方差分析结果显示脂类混合物添加量为6%(饲料脂肪水平为10%)时日本沼虾的成活率最高,但增重率却显著低于脂类混合物添加量为3%(饲料脂肪水平为7%)时。尽管如此,这2组的特定生长率和饲料系数差异不显著,且单因素方差分析结果显示,L6P4组(饲料脂肪水平为10%)日本沼虾的特定生长率最高。日本沼虾具有相互残杀的习性,因此拥挤胁迫效应比较明显。本课题组在前期研究中发现放养密度高时日本沼虾成活率往往偏低,而相同放养密度下成活率低时个体增重率往往较高。考虑到高成活率导致的拥挤胁迫效应,有理由相信饲料中10%的脂肪水平比较接近日本沼虾对脂肪的需要量。
Hari等[19]发现罗氏沼虾(Macrobrachium rosenbergii)在饲料脂肪水平为6%~8%时生长最好,若如果脂肪水平过高(>12%),则对其生长有负面效应。黄凯等[20]研究发现,凡纳滨对虾(Litopenaeus vannamei)在饲料脂肪水平为8.47%时增重率和成活率最高,饲料脂肪水平过高或过低时对生长有一定抑制作用。本试验结果显示,饲料脂肪水平由10%提高到13%时,日本沼虾的特定生长率大幅度下降,与上述报道相支持。此外,有研究表明脂肪酶的活性会受到饲料脂肪水平的诱导,且二者具有一定的相关性[21]。本试验中消化酶活性测定结果表明,饲料脂肪水平为13%时,日本沼虾肝胰腺中类胰蛋白酶、脂肪酶的活性显著低于饲料脂肪水平为10%和7%时。肝胰腺是甲壳动物重要的消化及吸收器官,消化酶活性下降提示消化吸收能力下降,这可能是其前期体内脂肪积累较多后的自我调节作用。本研究结果还显示,投喂高脂饲料(饲料脂肪水平为13%)的日本沼虾体脂含量最高(表 3),肝组织中脂肪积累也最高(图 1)。
甲壳类动物幼体自身合成磷脂能力有限[22],因此饲料中添加不同形态的磷脂是仔虾及幼虾生长和存活所必需的[10-13]。在凡纳滨对虾[10, 12]和斑节对虾[23]的研究中均发现,随着饲料磷脂水平的升高,幼虾的生长性能显著提高。Sui等[24]研究发现,饲料中添加适量卵磷脂可以加快中华绒螯蟹(Eriocheir sinensis)蚤状幼体和大眼幼体的蜕壳和生长,提高其成活率。侯迎梅等[25]研究发现,饲料中适宜水平(41.96 g/kg)的大豆磷脂可以提高三疣梭子蟹幼蟹的生长性能和饲料利用率。此外,由于大豆磷脂富含不饱和脂肪酸,对幼龄动物器官发育、机体成长也具有非常重要的促进作用[26-28]。本试验结果表明,高磷脂饲料更有利于日本沼虾的生长,饲料效率更高,与上述报道相支持。
已有研究表明,饲料中补充磷脂可以提高脂质的利用效率[29]。本试验结果显示,饲料脂肪(以脂类混合物添加量显示)与磷脂水平(以大豆磷脂比例显示)对日本沼虾生长性能(表 2)、肝胰腺脂肪酶活性(表 3)及肝胰脏T-AOC(表 3)具有显著的交互作用,对成活率的交互作用也趋于显著(表 2),表现为随着磷脂水平的升高,高脂肪组日本沼虾的生长性能更好,成活率更高,脂肪酶活性增强,体脂(表 3)和肝脂(图 1)含量降低。这可能是由于大豆磷脂分子中存在疏水性的脂肪酸链和亲水基团,可起到表面活性剂和乳化剂的作用,能将进入小肠内的脂肪进一步分散,增大脂肪及脂溶性物质与肠黏膜的接触面积,从而提高脂肪的消化吸收率。同时,磷脂是脂蛋白装配和分泌所必需的成分,对乳糜微粒或脂蛋白的合成和分泌有特殊作用[30],可以通过对脂蛋白合成的影响来调节机体内脂类的代谢。这一现象提示日本沼虾饲料中脂肪和磷脂应保持一定的比例关系,但其适宜的比例关系还有待于进一步研究。
正常情况下,体内自由基的产生和清除处于平衡状态中,SOD与T-AOC是生物体清除活性氧自由基能力的重要表征。磷脂具有抗氧化性[31]。徐丽珊等[32]发现大豆磷脂可提高小鼠肝脏抗氧化能力,且高磷脂组显著高于低磷脂组。本研究结果发现,饲料磷脂比例对日本沼虾肝胰腺SOD活性和T-AOC均无显著影响(表 3),这可能与磷脂的乳化特性有关,当添加量超过其临界胶束浓度后,磷脂的乳化能力趋于稳定,乳化效果不再增强[33]。
4 结论综上所述,日本沼虾饲料中脂肪与磷脂间应保持一定的比例。根据本试验结果,饲料中脂肪水平为10%、大豆磷脂添加量为4%时对日本沼虾比较适宜。
| [1] |
农业部渔业局. 中国渔业年鉴2017[M]. 北京: 中国农业出版社, 2017.
|
| [2] |
张南南. 基于适宜饲料蛋白和能量水平下的日本沼虾(Macrobrachium nipponense)适宜蛋白源和脂肪源研究[D]. 硕士学位论文. 上海: 华东师范大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10269-1016137987.htm
|
| [3] |
秦钦, 蔡永祥, 陈校辉, 等. 不同规格日本沼虾饲料蛋白最适含量研究[J]. 饲料研究, 2010(4): 53-55. |
| [4] |
丁志丽, 陈立侨, 李二超, 等. 不同脂肪源对日本沼虾非越冬期生长、存活及性腺发育的影响[C]//2011年中国水产学会学术年会论文集. 厦门: 中国水产协会, 2011. http://cpfd.cnki.com.cn/Article/CPFDTOTAL-OGSB201111001352.htm
|
| [5] |
斯烈钢, 邹李昶, 申屠基康, 等. 饲料添加不同脂肪及蛋白质水平对日本沼虾(Macrobrachium nipponensis)生长性能、体成分及消化酶活力的影响[J]. 海洋与湖沼, 2014, 45(2): 400-408. DOI:10.11693/hyhz20140300087 |
| [6] |
孔有琴, 丁志丽, 张易祥, 等. 维生素E对日本沼虾生长性能、抗氧化性能及抗氨氮胁迫能力的影响[J]. 动物营养学报, 2017, 29(8): 2893-2905. |
| [7] |
王亚斌, 张亚娟, 王军静. 饵料中的维生素B6对日本沼虾部分免疫功能的影响[J]. 安徽农业科学, 2009, 37(17): 8025-8026. DOI:10.3969/j.issn.0517-6611.2009.17.088 |
| [8] |
赵卫红, 於叶兵, 王资生, 等. 不同脂肪源饵料对日本沼虾抗氧化机能及肝胰腺和卵巢中脂肪酸含量的影响[J]. 江苏农业科学, 2014, 42(12): 266-271. |
| [9] |
GEURDEN I, BERGOT P, SCHWAR L, et al. Relationship between dietary phospholipid classes and neutral lipid absorption in newly-weaned turbot, shape Scophthalmus maximus[J]. Fish Physiology and Biochemistry, 1998, 19(3): 217-228. DOI:10.1023/A:1007723515204 |
| [10] |
GONG H, LAWRENCE A L, JIANG D H, et al. Lipid nutrition of juvenile Litopenaeus vannamei:Ⅰ.Dietary cholesterol and de-oiled soy lecithin requirements and their interaction[J]. Aquaculture, 2000, 190(3/4): 305-324. |
| [11] |
ROY L A, DAVIS D A, SAOUD I P. Effects of lecithin and cholesterol supplementation to practical diets for Litopenaeus vannamei reared in low salinity waters[J]. Aquaculture, 2006, 257(1/2/3/4): 446-452. |
| [12] |
GONZÉLEZ-FELIX M L, GATLIN D M G, LAWRENCE A L, et al. Effect of dietary phospholipid on essential fatty acid requirements and tissue lipid composition of Litopenaeus vannamei juveniles[J]. Aquaculture, 2002, 207(1/2): 151-167. |
| [13] |
王兰梅, 李嘉尧, 王丹丽, 等. 饲料中大豆磷脂对红螯光壳螯虾性腺发育期营养物质积累的影响[J]. 中国水产科学, 2013, 20(2): 381-391. |
| [14] |
周永梅, 陈敬文, 赖续文, 等. 冷冻切片锇酸染色法在脂肪染色中的应用[J]. 临床与实验病理学杂志, 2016, 32(4): 467-468. |
| [15] |
邹李昶, 任夙艺, 王志铮, 等. 氨氮急性胁迫对日本沼虾(Macrobrachium nipponensis)死亡率、耗氧率及窒息点的影响[J]. 海洋与湖沼, 2015, 46(1): 206-211. |
| [16] |
彭自然, 臧维玲, 高杨, 等. 氨和亚硝酸盐对凡纳滨对虾幼虾的毒性影响[J]. 上海海洋大学学报, 2004, 13(3): 274-278. |
| [17] |
张薇. 日本沼虾对盐度和pH适应性的研究[D]. 硕士学位论文. 保定: 河北大学, 2001. http://cdmd.cnki.com.cn/Article/CDMD-10075-2001003667.htm
|
| [18] |
李玉全, 李健, 王清印, 等. 溶解氧含量和养殖密度对中国对虾生长的影响[J]. 中国水产科学, 2005, 12(6): 751-756. |
| [19] |
HARI B, KURUP B M. The effect of dietary lipid levels on the nutrition and growth of juveniles of Macrobrachium rosenbergii (de Man)[J]. Fishery Technology, 2006, 43(1): 65-72. |
| [20] |
黄凯, 吴宏玉, 朱定贵, 等. 饲料脂肪水平对凡纳滨对虾生长、肌肉和肝胰腺脂肪酸组成的影响[J]. 水产科学, 2011, 30(5): 249-255. |
| [21] |
SHIELDS R J. Larviculture of marine finfish in Europe[J]. Aquaculture, 2001, 200(1/2): 55-88. |
| [22] |
KANAZAWA A, TESHIMA S I, SAKAMOTO M. Effects of dietary lipids, fatty acids, and phospholipids on growth and survival of prawn (Penaeus japonicus) larvae[J]. Aquaculture, 1985, 50(1/2): 39-49. |
| [23] |
VASAGAM K P K, RAMESH S, RAMESH S, et al. Dietary value of different vegetable oil in black tiger shrimp Penaeus monodon in the presence and absence of soy lecithin supplementation:effect on growth, nutrient digestibility and body composition[J]. Aquaculture, 2005, 250(1/2): 317-327. |
| [24] |
SUI L Y, WILLE M, CHENG Y X, et al. The effect of dietary n-3 HUFA levels and DHA/EPA ratios on growth, survival and osmotic stress tolerance of Chinese mitten crab Eriocheir sinensis larvae[J]. Aquaculture, 2007, 273(1): 139-150. DOI:10.1016/j.aquaculture.2007.09.016 |
| [25] |
侯迎梅, 袁野, 陆游, 等. 三疣梭子蟹幼蟹对大豆卵磷脂的需要量[J]. 水产学报, 2016, 40(11): 1753-1764. |
| [26] |
JONES D B, HANCOCK J D, HARMON D L, et al. Effects of exogenous emulsifiers and fat sources on nutrient digestibility, serum lipids, and growth performance in weanling pigs[J]. Journal of Animal Science, 1992, 70(11): 3473-3482. DOI:10.2527/1992.70113473x |
| [27] |
ØVERLANDM, MROZZ, SUNDSTØLF. Effect of lecithin on the apparent ileal and overall digestibility of crude fat and fatty acids in pigs[J]. Journal of Animal Science, 1994, 72(8): 2022-2028. |
| [28] |
ASH G C, SUTTON T S. The effects of soya lecithin on the absorption, utilization and storage of vitamin A and carotene in the white rat[J]. Journal of Nutrition, 1948, 36(3): 391-404. DOI:10.1093/jn/36.3.391 |
| [29] |
SÁNCHEZ D R, FOX J M, GATLIN D, et al. Dietary effect of fish oil and soybean lecithin on growth and survival of juvenile Litopenaeus vannamei in the presence or absence of phytoplankton in an indoor system[J]. Aquaculture Research, 2014, 45(8): 1367-1379. DOI:10.1111/are.2014.45.issue-8 |
| [30] |
FONTANÉ S, GURDEN I, ESCAFFRE A M, et al. Histological changes induced by dietary phospholipids in intestine and liver of common carp (Cyprinus carpio L.) larvae[J]. Aquaculture, 1998, 161(1/2/3/4): 213-223. |
| [31] |
KING M F, BOYDL C, SHELDON B W. Effects of phospholipids on lipid oxidation of a salmon oil model system[J]. Journal of the American Oil Chemists Society, 1992, 69(9): 953-953. DOI:10.1007/BF02636352 |
| [32] |
徐丽珊, 楼芬苹, 樊晓丽, 等. 大豆磷脂对小鼠学习记忆和抗氧化功能的影响[J]. 营养学报, 2000, 22(3): 287-288. |
| [33] |
SEYDLOVÁ G, SVOBODOVÁ J. Development of membrane lipids in the surfactin producer Bacillus subtitles[J]. Folia Hydrobiologica, 2008, 53(4): 303-307. |




