仔猪断奶后的腹泻可严重影响仔猪生长性能和成活率,而仔猪饲养水平直接影响着养猪生产者的经济效益。因此,研究预防和缓解仔猪腹泻对养猪生产者至关重要。乳酸菌作为一种新型的饲料添加剂,是目前研究较多且在动物生产中发挥作用较好的一类益生菌。乳酸菌具有调节肠道菌群结构、增强机体免疫力、减少致病菌对肠道的感染等益生功能,可在一定程度上缓解致病菌等引起的仔猪腹泻[1-2]。研究表明,乳酸菌的益生功能主要通过调节动物肠道屏障功能来实现[3-6]。猪肠道上皮细胞(IPEC-J2细胞)是维持其肠道屏障功能的主要执行者,其完整性和免疫调节功能是发挥其屏障作用的重要条件[7]。已有研究表明,不同菌株的乳酸菌对仔猪肠道细胞完整性有保护作用,能够缓解脂多糖等引起的肠道细胞损伤,同时还能抑制有害菌引起的细胞炎症反应[8-9]。但目前猪源植物乳杆菌对IPEC-J2细胞影响的报道还较少。因此,本研究以IPEC-J2细胞为体外培养模型,研究植物乳杆菌对大肠杆菌感染IPEC-J2细胞形态、存活和免疫应答的影响,为其作用机理研究和进一步开发应用提供理论基础。
1 材料与方法 1.1 试验材料 1.1.1 菌株和细胞本试验所用的猪源植物乳杆菌由北京市农林科学院畜牧兽医研究所动物营养研究室分离自健康仔猪肠道,该菌株已保藏于微生物菌种保藏中心,分类命名为植物乳杆菌ZLP001,保藏号为CGMCCNo.7370;大肠杆菌为产肠毒素大肠杆菌(enteroinvasive Escherichia coli, ETEC),血清型为O149 : K91 : K88ac;IPEC-J2细胞为仔猪肠道上皮细胞,购自广州吉妮欧生物科技有限公司。
1.1.2 主要试剂和仪器主要试剂:DMEM/F12基础培养基、热灭活胎牛血清(FBS)、青/链霉素和0.25%胰酶-乙二胺四乙酸(EDTA),均购自美国Gibco公司;吉姆萨染色液和4%台盼蓝染液,均购自北京酷来搏(Coolaber)科技有限公司;Trizol试剂,购自美国Invitrogen公司;氯仿和异丙醇,均购自北京化工厂;Quant cDNA第1链合成试剂盒、普通PCR试剂盒和SuperReal荧光定量预混试剂,均购自天根生化科技有限公司。
主要仪器:HF151 UV CO2细胞培养箱,上海力申科学仪器有限公司;HZQ-F160全温振荡培养箱,哈尔滨东联电子技术开发有限公司;IX71倒置显微镜,日本OLYMPUS公司;TC20细胞计数仪,美国Bio-Rad公司;荧光定量PCR Quant Studio 3,美国Thermo Fisher Scientic公司。
1.2 试验方法 1.2.1 IPEC-J2细胞的培养IPEC-J2细胞采用75T培养瓶、DMEM/F12基础培养基培养,并添加10% FBS、1%青/链霉素。将IPEC-J2细胞培养于5% CO2、95%相对湿度、37 ℃的细胞培养箱中,24 h换液1次。待细胞贴壁生长至80%~90%后用0.25%胰酶-EDTA消化,309×g离心5 min进行传代。细胞传代3次后以5×105个/孔的量接种于6孔细胞培养板中,此时所用培养液中除不含上述青/链霉素外,其他成分同传代细胞培养液。待6孔细胞培养板中细胞培养至单层细胞时进行试验[10]。
1.2.2 菌株的培养及菌体悬液的制备 1.2.2.1 菌株的培养将植物乳杆菌冻存液以1%接种量接种于新鲜的液体乳酸细菌培养基(MRS培养基)中,37 ℃恒温培养20 h,传代2代备用。将大肠杆菌冻存液以1%接种量接于新鲜的液体溶菌肉汤培养基(LB培养基)中,37 ℃摇床培养8 h,传代2代备用。
1.2.2.2 菌体悬液的制备将生长至对数期的植物乳杆菌和大肠杆菌经3 300×g离心15 min,收集菌体。用无菌磷酸盐缓冲液(PBS,pH 7.2~7.4)洗涤2次后重悬于DMEM/F12基础培养基中。通过显微镜计数和固体平板计数,将其制备成108 CFU/mL的植物乳杆菌和107 CFU/mL的大肠杆菌菌体悬液待用。
1.2.3 植物乳杆菌对大肠杆菌感染IPEC-J2细胞形态的影响将IPEC-J2单层细胞用无菌PBS润洗2遍后,进行以下处理:1)无处理的对照组;2)大肠杆菌处理组;3)植物乳杆菌处理组;3)植物乳杆菌+大肠杆菌处理组。分别处理1、2、3 h后,PBS清洗3遍,彻底洗去未黏附的菌体。之后用甲醇固定15 min,吉姆萨染液染色30 min。用蒸馏水清洗细胞2次后用倒置显微镜在200倍镜下观察细胞形态。每个试验重复3次[11]。
1.2.4 植物乳杆菌对大肠杆菌感染IPEC-J2细胞存活的影响将IPEC-J2单层细胞用无菌PBS润洗2遍后,对IPEC-J2细胞的处理同1.2.3。分别处理1、2、3 h后,吸取上清于10 mL灭菌离心管内。并用无菌PBS清洗细胞3遍,然后用300 μL 0.05%胰酶-EDTA对细胞进行消化。终止消化后309×g离心5 min,弃上清,用500 μL DMEM/F12基础培养液重悬细胞。台盼蓝染色后在TC20细胞计数仪上对活细胞进行计数。每个试验重复3次[11]。
1.2.5 植物乳杆菌对大肠杆菌感染IPEC-J2细胞免疫应答的影响将IPEC-J2单层细胞用无菌PBS润洗2遍后,对IPEC-J2细胞的处理同1.2.3。处理结束后,放入细胞培养箱中,37 ℃分别培养1、2、3 h。培养结束后,弃上清,用无菌PBS清洗细胞3遍,6孔板每孔加入1 mL Trizol试剂,常温下裂解5 min,吹打完全后转移至1.5 mL无RNA酶离心管内,-80 ℃保存。每个试验重复3次。
按Trizol法提取细胞总RNA,接着按照Quant cDNA第1链合成试剂盒说明书将其逆转录成cDNA。以cDNA为模板,按照普通PCR试剂盒说明书进行扩增,摸索试验目的基因反应体系及程序,产物用琼脂糖凝胶电泳鉴定。用于PCR的引物序列见表 1。将普通PCR摸好反应体系及程序的目的基因按照SuperReal荧光定量预混试剂说明书进行实时定量荧光(real-time)PCR,用于检测Toll样模式识别受体(Toll-like receptors,TLRs)中Toll样模式识别受体2(TLR2)、Toll样模式识别受体6(TLR6)和NOD样模式识别受体(NOD-like receptors,NLRs)中NOD样模式识别受体1(NOD1)、NOD样模式识别受体2(NOD2)以及细胞因子[白细胞介素-8(IL-8)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、转化生长因子-β1(TGF-β1)]的mRNA相对表达量。
|
|
表 1 用于PCR的引物序列 Table 1 Primer sequences used for PCR |
PCR反应程序:95 ℃,5 min;95 ℃,30 s,退火(NOD1、NOD2为61 ℃,TNF-α为62.5 ℃,其余基因均为60 ℃),30 s,72 ℃,20 s,32个循环;72 ℃,5 min。
1.3 数据统计与分析试验数据用Excel 2016初步整理后,采用SPSS 19.0软件对数据进行单因素方差分析(one-way ANOVA),方差齐时用Tukey’s法进行多重比较。P < 0.05表示差异显著,P < 0.01表示差异极显著。数据用平均值±标准误表示。使用GraphPad Prism 5软件对数据进行作图。
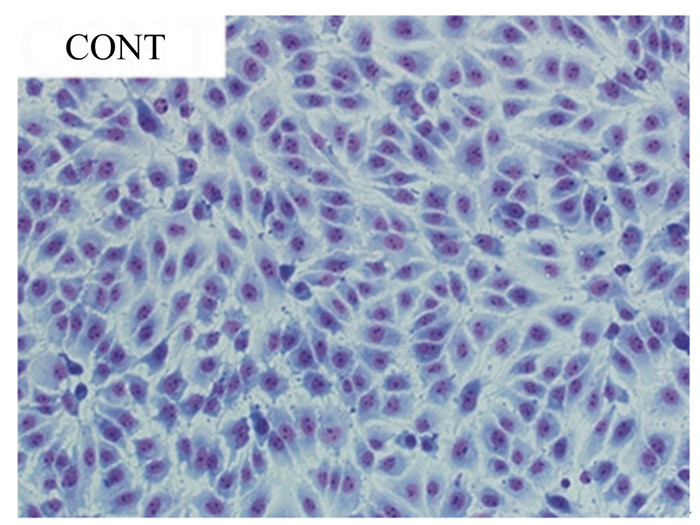
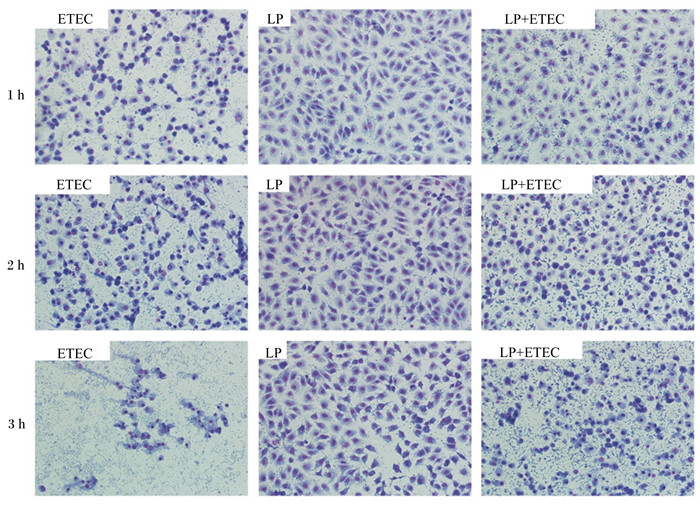
2 结果与分析 2.1 植物乳杆菌对大肠杆菌感染IPEC-J2细胞形态的影响从图 1可以看出,正常的IPEC-J2细胞(对照组)由均匀的上皮样细胞组成,细胞为不规则多边形,互不重叠,呈铺路石镶嵌排列,细胞之间相互连接,细胞核呈卵圆状,为典型的上皮样单层细胞。从图 2可以看出,植物乳杆菌处理IPEC-J2细胞1、2、3 h后,与对照组的正常IPEC-J2细胞形态相比,均未发生明显变化。大肠杆菌处理IPEC-J2细胞1 h后,与对照组的正常IPEC-J2细胞形态相比,细胞出现了变小、边缘化等微小变化;大肠杆菌处理IPEC-J2细胞2 h后,细胞形态出现了明显的变化,即细胞皱缩变圆、染色质浓缩、细胞质中出现很大的空泡、边缘化、细胞形态不完整等;大肠杆菌处理IPEC-J2细胞3 h后,细胞形态受到严重损伤,甚至死亡脱落。植物乳杆菌与大肠杆菌共同处理IPEC-J2细胞1、2 h后,可以有效缓解大肠杆菌造成的细胞形态损伤;植物乳杆菌与大肠杆菌共同处理IPEC-J2细胞3 h后,植物乳杆菌虽可以缓解大肠杆菌引起的细胞形态损伤,但缓解作用没有1、2 h明显。
|
CONT:对照组control group。下图同。The same as below. 图 1 正常的IPEC-J2细胞形态(1、2、3 h) Figure 1 The normal morphology of IPEC-J2 cells (1, 2 and 3 h, 200×) |
|
ETEC:大肠杆菌处理组Escherichia coli treated group; LP:植物乳杆菌处理组Lactobacillus plantarum treated group; LP+ ETEC:植物乳杆菌+大肠杆菌处理组Escherichia coli+Lactobacillus plantarum treated group。下图同。The same as below. 图 2 植物乳杆菌对大肠杆菌感染IPEC-J2细胞形态的影响 Figure 2 Effects of Lactobacillus plantarum on morphology of Escherichia coli infected IPEC-J2 cells (200×) |
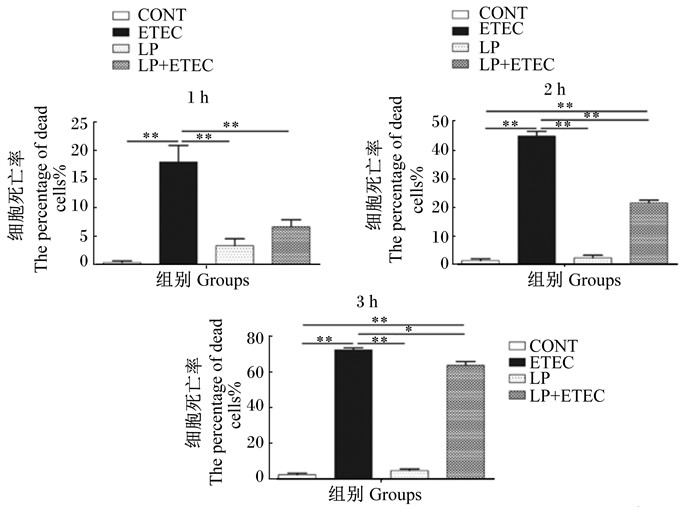
从图 3可以看出,植物乳杆菌处理IPEC-J2细胞1、2、3 h后,细胞死亡率与对照组相比差异均不显著(P>0.05)。大肠杆菌处理IPEC-J2细胞1、2、3 h后,细胞的死亡率均极显著高于对照组(P < 0.01),说明大肠杆菌处理IPEC-J2细胞1、2、3 h会严重影响细胞的存活。与大肠杆菌处理组相比,植物乳杆菌与大肠杆菌共同处理IPEC-J2细胞1、2 h后,可极显著降低细胞死亡率(P < 0.01);植物乳杆菌与大肠杆菌共同处理IPEC-J2细胞3 h后,可显著降低细胞死亡率(P < 0.05)。
|
*表示差异显著(P < 0.05), **表示差异极显著(P < 0.01)。下图同。 * indicated significant difference (P < 0.05), * * indicated significant difference (P < 0.01). The same as below. 图 3 植物乳杆菌对大肠杆菌感染IPEC-J2细胞存活的影响 Figure 3 Effects of Lactobacillus plantarum on survival of Escherichia coli infected IPEC-J2 cells |
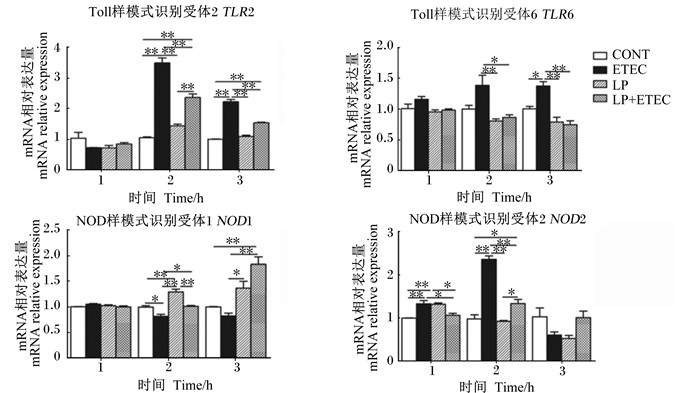
由图 4可以看出,大肠杆菌处理IPEC-J2细胞后可以刺激细胞胞外模式识别受体TLR2、TLR6以及细胞胞内模式识别受体NOD2 mRNA的表达。植物乳杆菌与大肠杆菌共同处理IPEC-J2细胞后,可以显著或极显著抑制大肠杆菌引起的TLR2(2、3 h)、TLR6(2、3 h)和NOD2(2 h) mRNA的过表达(P < 0.05或P < 0.01),而对NOD1 mRNA的表达有显著或极显著的刺激作用(P < 0.05或P < 0.01)。植物乳杆菌处理IPEC-J2细胞后,对NOD1(2 h)和NOD2(1 h)mRNA的表达有极显著的刺激作用(P < 0.01)。
|
图 4 植物乳杆菌对大肠杆菌感染IPEC-J2细胞TLRs和NLRs mRNA相对表达量的影响 Figure 4 Effects of Lactobacillus plantarum on TLRs and NLRs mRNA relative expression of Escherichia coli infected IPEC-J2 cells |
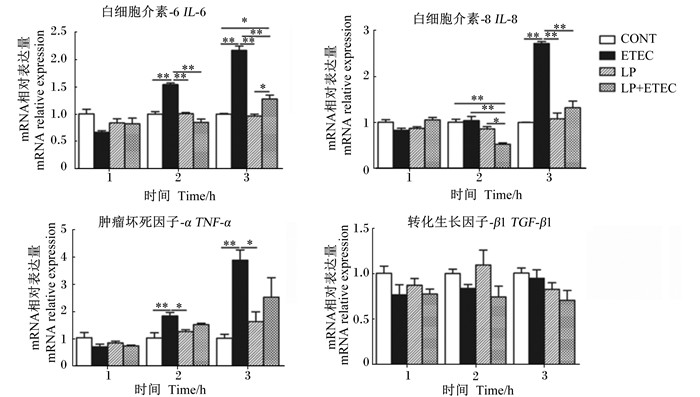
由图 5可以看出,与对照组相比,大肠杆菌处理IPEC-J2细胞2 h后,细胞炎性因子IL-6和TNF-α mRNA相对表达量极显著提高(P < 0.01);大肠杆菌处理IPEC-J2细胞3 h后,细胞炎性因子IL-6、IL-8和TNF-α mRNA相对表达量极显著提高(P < 0.01)。植物乳杆菌与大肠杆菌共处理IPEC-J2细胞2、3 h后,植物乳杆菌可以极显著抑制大肠杆菌引起的细胞炎性因子的IL-6、IL-8 mRNA的过表达(P < 0.01)。与对照组相比,各组TGF-β1 mRNA的表达量均无显著差异(P>0.05)。
|
图 5 植物乳杆菌对大肠杆菌感染IPEC-J2细胞细胞因子mRNA相对表达量的影响 Figure 5 Effects of Lactobacillus plantarum on cytokines mRNA relative expressions of Escherichia coli infected IPEC-J2 cells |
肠道上皮细胞是猪肠道上皮屏障功能的主要执行者,大约占据肠道上皮100 m2的区域,上皮细胞的完整性是维持其选择通透性和抵御外源致病菌入侵等功能的首要条件[17]。Wine等[18]研究也表明,致病菌黏附或侵入肠道上皮细胞后大量繁殖,破坏肠道上皮结构,同时引起细胞死亡,损伤肠上皮屏障功能。因此,本试验结合吉姆萨染色和台盼蓝染色,从形态学和存活率2个方面研究了植物乳杆菌对大肠杆菌感染IPEC-J2细胞的损伤。结果表明,大肠杆菌单独处理细胞一定时间后可严重影响细胞的形态结构,甚至引起细胞大量脱落死亡。而植物乳杆菌与IPEC-J2细胞共培养后,对细胞的形态和存活没有明显影响。植物乳杆菌与大肠杆菌共同处理IPEC-J2细胞后,可明显缓解大肠杆菌引起的细胞形态损伤,还可显著或极显著抑制大肠杆菌引起的细胞死亡。杨俊等[19]试验结果表明,大肠杆菌处理肠道细胞后,可黏附于细胞损害细胞骨架,引起细胞间隙增大而损伤细胞,而将乳酸菌与大肠杆菌共培养发现,乳酸菌可明显减缓大肠杆菌引起的细胞损伤,与本研究结果一致。这说明益生菌对肠道大肠杆菌的感染具有抑制作用。此外,赵毅博[20]试验发现,食淀粉乳杆菌代谢产物也可抑制大肠杆菌等引起细胞形态的不完整。这也提示本研究中,植物乳杆菌在保护肠道细胞形态免受大肠杆菌损伤时,其代谢产物也可能发挥了作用,这需要进一步的研究来验证。
3.2 植物乳杆菌对大肠杆菌感染IPEC-J2细胞免疫应答的影响猪肠道先天性免疫反应系统对维护肠道屏障功能、避免致病菌引起的机体损伤等具有非常重要的作用。肠道免疫系统通过一个复杂的受体系统来识别病原微生物和宿主共生菌,其受体主要包括胞外的TLRs和胞内的NLRs。一般情况下,适度免疫信号通过TLRs和NLRs产生促炎细胞因子、趋化因子和抗炎因子等,调节宿主免疫应答,对维持机体健康、抵抗疾病是有益的[21-22]。而机体受到病原菌等有害物质刺激时,免疫刺激反应会处于高度激活状态,导致炎性细胞因子,如TNF-α,以及促炎性细胞因子,如IL-6、IL-8等的过量分泌,进而引起免疫应激。研究表明,益生菌可通过抑制肠道上皮细胞炎性细胞因子的过表达而缓解大肠杆菌引起的细胞炎性损伤[23]。本试验研究表明,大肠杆菌单独作用IPEC-J2细胞2、3 h后,可刺激炎性细胞因子IL-6、IL-8、TNF-α mRNA的表达,而植物乳杆菌与大肠杆菌共同处理IPEC-J2细胞2、3 h后,可以抑制大肠杆菌引起的细胞炎症因子IL-6、IL-8和TNF-α mRNA的过表达。此结果与Wang等[24]试验研究结果相一致。原因可能是大肠杆菌通过某个受体激活了细胞因子的表达通路,而植物乳杆菌缓解了这种过度免疫。此外,本试验还研究了植物乳杆菌对大肠杆菌感染的IPEC-J2细胞模式识别受体的影响。结果表明,大肠杆菌处理IPEC-J2细胞后可刺激细胞TLR2、TLR6和NOD2 mRNA的表达,而植物乳杆菌与大肠杆菌共同处理IPEC-J2细胞后可抑制大肠杆菌引起的TLR2、TLR6和NOD2 mRNA的过表达。这说明植物乳杆菌可通过及时调节上述模式识别受体信号来维持机体免疫平衡,进而可避免肠道上皮组织的炎性损伤。此外,本研究结果还发现,大肠杆菌处理IPEC-J2细胞后不刺激NOD1 mRNA的表达,而植物乳杆菌却促进了NOD1 mRNA的表达。原因可能与Trinchieri等[25]研究中提到的模式识别受体具有特异性有关。这说明NOD2很可能是植物乳杆菌发挥作用的主要胞内模式识别受体,而TLR2、TLR6可能是植物乳杆菌发挥作用的主要胞外模式识别受体。另外,TGF-β1是IPEC-J2细胞表皮生长因子相关基因,对细胞的分化、生长及免疫具有很重要的调节作用。本试验中TGF-β1 mRNA相对表达量在对照组、植物乳杆菌处理组、大肠杆菌处理组及植物乳杆菌+大肠杆菌处理组均差异不显著。而侯成立[26]试验表明,罗伊氏乳杆菌处理细胞6 h后,可以显著刺激转化生长因子-β3 mRNA的表达,原因可能与试验菌株不同有关。
4 结论植物乳杆菌能够缓解大肠杆菌引起的猪肠道上皮细胞形态损伤及死亡;可通过调节模式识别受体TLR2、TLR6和NOD2 mRNA的表达而缓解大肠杆菌引起的细胞炎症因子IL-6、IL-8 mRNA的过表达。
| [1] |
MURALIDHARA K S, SHEGGEBY G G, ELLIKER P R, et al. Effect of feeding Lactobacillus on the coliform and Lactobacillus flora of intestinal tissue and feces from piglets[J]. Journal of Food Protection, 1977, 40(5): 288-295. DOI:10.4315/0362-028X-40.5.288 |
| [2] |
GIANG H H, VIET T Q, OGLE B, et al. Growth performance, digestibility, gut environment and health status in weaned piglets fed a diet supplemented with potentially probiotic complexes of lactic acid bacteria[J]. Livestock Science, 2010, 129(1/2/3): 95-103. |
| [3] |
MENNIGEN R, BRUEWER M. Effect of probiotics on intestinal barrier function[J]. Annals of the New York Academy of Sciences, 2009, 1165(1): 183-189. DOI:10.1111/j.1749-6632.2009.04059.x |
| [4] |
KUMAR N S N, BALAMURUGAN R, JAYAKANTHAN K, et al. Probiotic administration alters the gut flora and attenuates colitis in mice administered dextran sodium sulfate[J]. Journal of Gastroenterology and Hepatology, 2008, 23(12): 1834-1839. DOI:10.1111/jgh.2008.23.issue-12 |
| [5] |
OHLAND C L, MACNAUGHTON W K. Probiotic bacteria and intestinal epithelial barrier function[J]. American Journal of Physiology:Gastrointestinal and Liver Physiology, 2010, 298(6): G807-G819. DOI:10.1152/ajpgi.00243.2009 |
| [6] |
MENNIGEN R, BRUEWER M. Effect of probiotics on intestinal barrier function[J]. Annals of the New York Academy of Sciences, 2009, 1165(1): 183-189. DOI:10.1111/j.1749-6632.2009.04059.x |
| [7] |
COSTA L F, PAIXÃO T A, TSOLIS R M, et al. Salmonellosis in cattle:advantages of being an experimental model[J]. Research in Veterinary Science, 2012, 93(1): 1-6. DOI:10.1016/j.rvsc.2012.03.002 |
| [8] |
YANG F J, WANG A N, ZENG X f, et al. Lactobacillus reuteri I5007 modulates tight junction protein expression in IPEC-J2 cells with LPS stimulation and in newborn piglets under normal conditions[J]. BMC Microbiology, 2015, 15: 32. DOI:10.1186/s12866-015-0372-1 |
| [9] |
PALÓCZ O, PÁSZTI-GERE E, GÁLFI P, et al. Chlorogenic acid combined with Lactobacillus plantarum 2142 reduced LPS-induced intestinal inflammation and oxidative stress in IPEC-J2 cells[J]. PLoS One, 11(11): e0166642. https://www.medscape.com/medline/abstract/27861533
|
| [10] |
LIU Y Y, FATHEREE N Y, MANGALAT N, et al. Human-derived probiotic Lactobacillus reuteri strains differentially reduce intestinal inflammation[J]. American Journal of Physiology:Gastrointestinal and Liver Physiology, 2010, 299(5): G1087-G1096. DOI:10.1152/ajpgi.00124.2010 |
| [11] |
朱晶. 产肠毒素大肠杆菌、肠上皮细胞和乳酸菌相互关系的研究[D]. 博士学位论文. 上海: 上海交通大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10248-1011298278.htm
|
| [12] |
ARCE C, RAMÍREZ-BOO M, LUCENA C, et al. Innate immune activation of swine intestinal epithelial cell lines (IPEC-J2 and IPI-2I) in response to LPS from Salmonella typhimurium[J]. Comparative Immunology, Microbiology and Infectious Diseases, 2010, 33(2): 161-174. DOI:10.1016/j.cimid.2008.08.003 |
| [13] |
MARIANI V S, PALERMO S, FIORENTINI S, et al. Gene expression study of two widely used pig intestinal epithelial cell lines:IPEC-J2 and IPI-2I[J]. Veterinary Immunology and Immunopathology, 2009, 131(3/4): 278-284. |
| [14] |
ZHANG W, ZHU Y H, YANG J C, et al. A selected Lactobacillus rhamnosus strain promotes EGFR-independent Akt activation in an enterotoxigenic Escherichia coli K88-infected IPEC-J2 cell model[J]. PLoS One, 2015, 10(4): e0125717. DOI:10.1371/journal.pone.0125717 |
| [15] |
夏璐. 枯草芽孢杆菌菌体对RV感染IPEC-J2细胞TLRs和细胞因子mRNA表达的影响[D]. 硕士学位论文. 哈尔滨: 东北农业大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10224-1014341108.htm
|
| [16] |
周传丽, 刘铮铸, 俞英, 等. F4ac型产肠毒素大肠杆菌菌液上清对仔猪小肠上皮细胞的免疫刺激作用[J]. 中国农业科学, 2014, 47(4): 779-785. |
| [17] |
张永刚, DAVINR. 猪小肠上皮细胞作用的新发现[J]. 中国畜牧杂志, 2015, 51(8): 57-60. |
| [18] |
WINE E, GAREAU M G, JOHNSON-HENRY K, et al. Strain-specific probiotic (Lactobacillus helveticus) inhibition of Campylobacter jejuni invasion of human intestinal epithelial cells[J]. FEMS Microbiology Letters, 2009, 300(1): 146-152. DOI:10.1111/fml.2009.300.issue-1 |
| [19] |
杨俊, 张中伟, 秦环龙. 乳酸菌对肠上皮细胞侵袭性大肠杆菌损伤的保护作用[J]. 世界华人消化杂志, 2008, 16(30): 3394-3399. DOI:10.3969/j.issn.1009-3079.2008.30.006 |
| [20] |
赵毅博. 食淀粉乳杆菌代谢产物调节细胞完整性及屏障功能的抗病毒作用[D]. 硕士学位论文. 哈尔滨: 东北农业大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10224-1014341113.htm
|
| [21] |
MEDZHITOV R. Recognition of microorganisms and activation of the immune response[J]. Nature, 2007, 449(7164): 819-826. DOI:10.1038/nature06246 |
| [22] |
SANSONETTI P J. War and peace at mucosal surfaces[J]. Nature Reviews Immunology, 2007, 4(1): 953-964. |
| [23] |
SKJOLAAS K A, BURKEY T E, DRITZ S S, et al. Effects of Salmonella enterica serovar Typhimurium, or serovar Choleraesuis, Lactobacillus reuteri and Lactobacillus licheniformis on chemokine and cytokine expression in the swine jejunal epithelial cell line, IPEC-J2[J]. Veterinary Immunology and Immunopathology, 2007, 115(3/4): 299-308. |
| [24] |
WANG Z L, WANG L, ZHUANG C, et al. In vitro evaluation of swine-derived Lactobacillus reuteri:probiotic properties and effects on intestinal porcine epithelial cells challenged with enterotoxigenic Escherichia coli K88[J]. Journal of Microbiology and Biotechnology, 2016, 26(6): 1018-1025. DOI:10.4014/jmb.1510.10089 |
| [25] |
TRINCHIERI G, SHER A. Cooperation of Toll-like receptor signals in innate immune defence[J]. Nature, 2007, 7(3): 179-190. |
| [26] |
侯成立. 罗伊氏乳杆菌全基因组序列分析及其调节仔猪肠黏膜免疫功能的研究[D]. 博士学位论文. 北京: 中国农业大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10019-1015584368.htm
|




