2. 中国农业 科学院北京畜牧兽医研究所, 农业部奶产品质量安全风险评估实验室(北京), 北京 100193;
3. 中国农业科学院北京畜牧兽医研究所, 动物营养学国家重点实验室, 北京 100193;
4. 华中农业大学动物科学技术学院, 武汉 430070
2. Laboratory of Quality and Safety Risk Assessment for Dairy Products of Ministry of Agriculture(Beijing), Institute of Animal Sciences, Chinese Academy of Agricultural Sciences, Beijing 100193, China;
3. State Key Laboratory of Animal Nutrition, Institute of Animal Sciences, Chinese Academy of Agricultural Sciences, Beijing 100193, China;
4. College of Animal Science and Technology, Huazhong Agricultural University, Wuhan 430070, China
胃肠道是机体内一种独特的器官,栖息着大量的致病性和非致病性的微生物。作为机体中最稳定、最密集和最多样化的菌群[1],肠道中的微生物参与宿主的各种生理代谢活动,对于宿主的营养、代谢、免疫稳态和健康均起着关键作用。人类肠道微生物数量约有4×1014个,几乎和成年人体细胞数一样多[2]。菌群的失调与许多疾病有关,如炎症性疾病[3]、肥胖症[4]、糖尿病[5]、帕金森病[6]及风湿性关节炎[7]等。宿主在促进其与微生物的互作关系中至关重要,如黏液层、微生物营养来源和免疫细胞的细菌识别等[8]。肠道上皮细胞是机体抵抗外界复杂环境的第一道防线,其杯状细胞分泌产生的黏液层,维持了肠上皮的完整性,对肠道有润滑、保护和免疫调节作用。其中,黏液层黏蛋白侧链上的岩藻糖,是一种重要的蛋白糖基化形式,参与了肠道微生物的黏附和定植等,在调控肠道微生物稳态中发挥重要作用。因此,揭示岩藻糖在肠道微生物与肠道上皮细胞互作中的调控作用,对于促进肠道微生物和宿主间的动态平衡,维持肠道健康有重要意义。
1 肠道黏蛋白的岩藻糖糖基化形式与过程肠道上皮杯状细胞通过Toll样受体(Toll-like receptors,TLR)和NOD样受体蛋白6途径分泌黏蛋白至肠腔[9],形成具有2层结构的黏液层,即内层和外层。黏液内层与肠道上皮细胞紧密连接;黏液外层含有肠道上皮细胞表达和分泌的多糖,为肠道微生物提供丰富的营养来源,对于肠道微生物有一定的选择和调控作用[10]。黏蛋白是一种高度糖基化的糖蛋白,其富含丝氨酸、苏氨酸的蛋白骨架与多种O-型寡聚糖侧链结合,如岩藻糖。在结肠黏液外层中,O-型寡聚糖侧链可以为共生菌提供特异性结合位点,促进其定植,抑制致病菌的生长[11]。Fu等[12]研究表明,O-型寡聚糖侧链的缺失或缩短,会增加细菌的入侵,诱发肠道内炎症。黏蛋白上的多糖是共生菌重要的营养来源和黏附位点,也是致病菌的首要靶点,其独特的生理和免疫功能具有组织差异性。黏蛋白糖基化的水平在一定程度上决定了肠黏膜的屏障功能水平,微生物刺激以及肠道免疫系统可以调节肠道上皮细胞的糖基化,进而提高微生物在肠腔中的适应与生存能力。
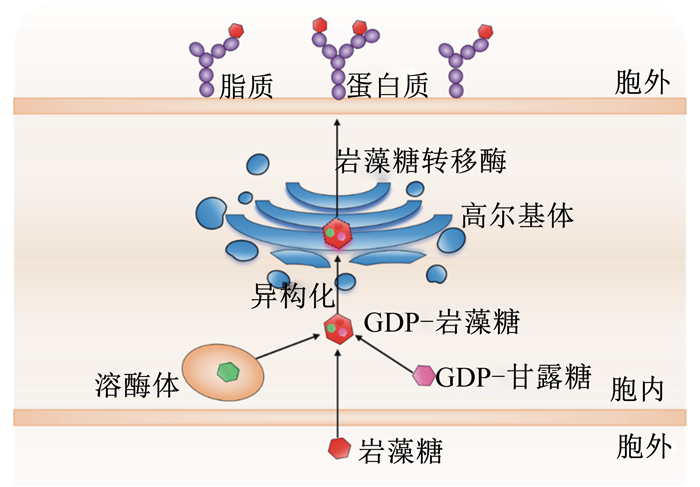
黏蛋白的岩藻糖基化是糖基化的重要形式。岩藻糖是黏蛋白侧链上重要的糖基,占糖基总数的4%~14%,它是一种广泛存在于动物肠道中的L-岩藻糖,是肠道微生物重要的能源物质。相比于一般的六碳糖,岩藻糖在第6个碳原子上少1个羟基,亲水性弱,疏水性强,可以作为血型标记。在岩藻糖转移酶(fucosyltransferase,Fut)的催化下,岩藻糖可与黏蛋白丝氨酸、苏氨酸残基羟基相连,以末端修饰的方式使黏蛋白糖基化。目前,在人类基因组中已经发现了13种Fut基因[13],其中Fut1和Fut2主要存在于人类和鼠类的小肠,特别是肠道上皮细胞。Fut2基因是一种分泌型基因,能够以GDP-岩藻糖的形式转运岩藻糖,而GDP-岩藻糖是岩藻糖基化的唯一供体。
在哺乳动物中,一般可以通过从头合成途径和补救合成途径2种方式合成GDP-岩藻糖,但主要以从头合成途径为主[14]。目前发现的参与合成GDP-岩藻糖的物质有3种:胞外的岩藻糖,溶酶体内的岩藻糖残基以及GDP-甘露糖[15]。GDP-甘露糖主要参与从头合成途径,在GDP-甘露糖-4, 6-脱水酶和GDP-4-酮-6-脱氧甘露糖-3, 5异构酶-4-还原酶的催化作用下转化为GDP-岩藻糖。被合成后的GDP-岩藻糖发生异构化,然后转运至高尔基体或内质网中,在Fut的介导下进行末端修饰。被修饰后的岩藻糖经Fut转运至肠道上皮细胞膜的蛋白或脂质上,完成岩藻糖基化过程。其中,α1, 2-岩藻糖能够被Fut2特异性调控,其糖基化修饰主要发生在杯状细胞的细胞表面,然后分泌至肠腔发挥糖基化抗原的功能,这种特殊的表达方式在肠道微生物,特别是共生菌与肠道上皮细胞的互作中非常重要。如共生菌多形拟杆菌通过产生岩藻糖苷酶分解α1, 2-岩藻糖,然后合成这些岩藻糖残基,并在相关酶的作用下,循环利用岩藻糖残基作为细菌细胞壁的组成成分来促进自身的定植[16]。
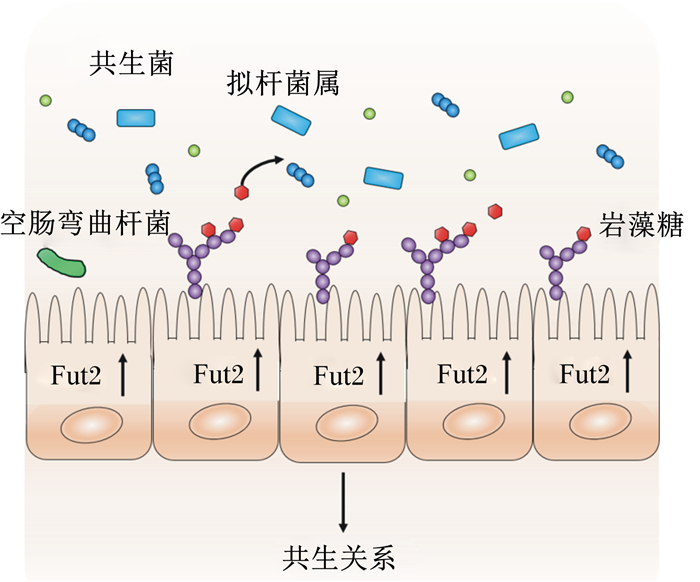
2 微生物调控肠道上皮细胞岩藻糖基化过程肠道微生物诱导岩藻糖基化一般有2种方式,共生菌非依赖模式和共生菌依赖模式。在共生菌非依赖模式中,3型天然淋巴细胞(type 3 innate lymphoid cell,ILC3)分泌的淋巴毒素(lymphotoxin,LT)α1β2可不通过共生菌的诱导,直接参与Fut2对岩藻糖的调节。在共生菌依赖模式中,多形拟杆菌已经被证明可以诱导人和小鼠的肠道上皮细胞的岩藻糖基化[16]。Goto等[18]研究表明,分节丝状菌(segmented filamentous bacteria,SFB)也可以诱导岩藻糖的表达,它主要通过共生菌依赖模式激活ILC3,诱导肠道上皮细胞Fut2和岩藻糖的表达,进而抵抗沙门氏菌的感染。岩藻糖,特别是α1, 2-岩藻糖的表达主要在回肠,仅仅少数α1, 2-岩藻糖的表达在十二指肠和空肠。致病菌,如鼠类柠檬酸杆菌,可以在盲肠而非小肠诱导α1, 2-岩藻糖基化[19]。微生物诱导岩藻糖基化的位置不同,可能与其自身在肠道内的生态位分布有关。对于无菌小鼠,岩藻糖基化一般发生在盲肠、结肠和小肠回肠,但当其被植入菌群后,岩藻糖基化发生在整个小肠[20]。
一些微生物的代谢产物,也参与诱导肠上皮Fut2和岩藻糖的表达[21]。断奶后的幼年大鼠,肠道中多胺和岩藻糖的浓度会增加,当给大鼠饲喂多胺后,发现肠道岩藻糖基化水平升高[22]。Wlodarska等[23]研究表明,消化链球菌属细菌能够利用黏蛋白作为能量来源,裂解并转运岩藻糖,促进自身的定植,其色氨酸代谢产物吲哚丙烯酸能够增强肠道上皮细胞的屏障功能,减轻炎症反应,消化链球菌属和肠道上皮细胞之间的互作关系营造了良好的肠道环境。
3 岩藻糖对肠道微生物的调控作用 3.1 对肠道微生物的营养调控作用岩藻糖的本质是碳水化合物,可以作为微生物的碳源,调控肠道微生物与肠道上皮的共生关系,这个过程需要岩藻糖苷酶的催化。含有岩藻糖苷酶的微生物可以直接降解宿主或者外源的岩藻糖,也可以将降解的岩藻糖残基提供给其他不含岩藻糖苷酶的菌群利用。多形拟杆菌通过岩藻糖操纵子,可以上调与岩藻糖相关的分解或代谢基因来降解利用岩藻糖,在肠道环境改变时将其作为碳源,同时,还可以促进肠道上皮细胞的岩藻糖基化[21, 24]。脆弱拟杆菌参与肠道内的糖代谢过程,利用岩藻糖促进自身定植,进而更好地适应肠道环境[25]。岩藻糖是空肠弯曲杆菌唯一可以利用的碳水化合物,它通常情况下只能利用氨基酸或柠檬酸代谢途径来获取碳源,但是却可以利用岩藻糖[26]。
|
Fut2:岩藻糖转移酶2 fucosyltransferase 2。 |
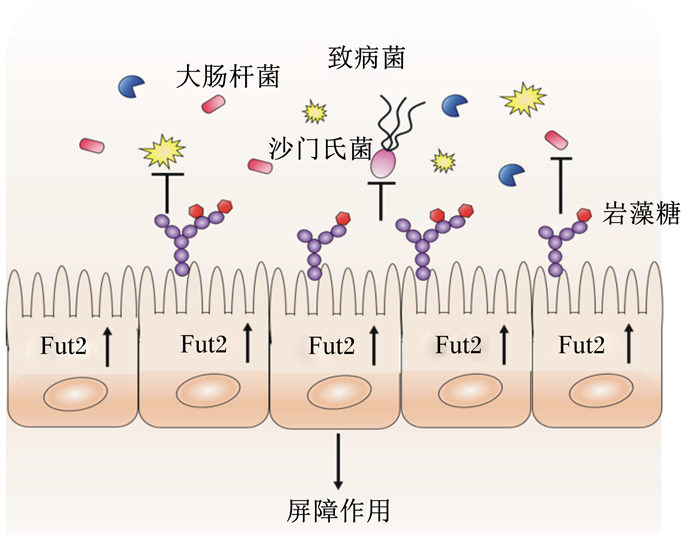
作为固有免疫系统的组成部分,黏液层表面的多糖可以抵抗致病性微生物的入侵,特别是岩藻糖,可以作为信号分子,有效的抑制一些致病菌的感染,这是它维持肠道菌群平衡的一个重要功能。肠道上皮细胞Fut2缺失,导致岩藻糖的调控受阻,当小鼠Fut2缺陷时,会引起肠道菌群失调,加剧柠檬酸杆菌诱导的肠道炎症[19]和鼠伤寒沙门氏菌的易感性[27]。岩藻糖作为黏蛋白糖基化的侧链,可以与沙门氏菌的菌毛结合,使沙门氏菌黏附在黏蛋白上,阻止其异位感染。Pacheco等[28]研究表明,岩藻糖可以通过刺激出血性大肠杆菌的膜受体磷酸化来抑制其毒力相关操纵子,进而降低其对宿主的致病性。另外,岩藻糖能够降低炎症因子,增加紧密连接蛋白的表达,并上调小肠中短链脂肪酸受体,进而缓解肠道黏膜损伤[29]。
岩藻糖还可以显著降低致病菌消化链球菌属的丰度,减少肠道抗原载体[30],更重要的是,它可以提高肠道益生菌的丰度[31],如在Fut2缺陷的小鼠中,梭菌目中的一些共生菌的数量会减少[32]。Rodríguez-Díaz等[26]研究发现,大部分致病菌不含有岩藻糖苷酶,不能利用岩藻糖,而一些益生菌含有高活性的岩藻糖苷酶,如双歧杆菌,可以降解岩藻糖合成自身多糖,益生菌的高丰度表达可能与岩藻糖苷酶有关。但也有研究发现,在Fut2缺陷的小鼠中,即岩藻糖表达受阻的情况下,如拟杆菌属、毛螺菌科等共生菌的数量会增加[32]。
|
图 3 岩藻糖对肠道致病微生物的屏障作用 Figure 3 Fucose creates a barrier environment against pathogenic microbiota[17] |
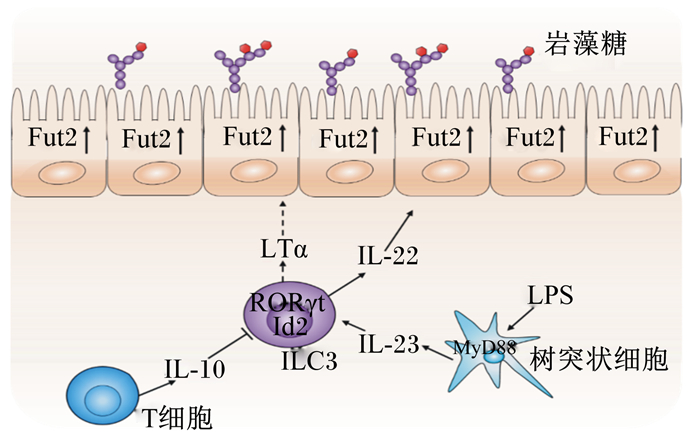
免疫细胞包含固有免疫细胞和获得性免疫细胞,其中,ILC3是调控岩藻糖表达的重要的固有淋巴细胞,无菌小鼠感染后,小肠快速岩藻糖基化与ILC3的激活密切相关。脂多糖等感染小鼠后,首先诱导肠道树突细胞分泌白介素(interleukin,IL)-23,这个过程与髓样分化因子88(myeloid differentiation primary response 88,MyD88)信号的激活有关,随后IL-23诱导ILC3释放IL-22,IL-22可以上调Fut2的表达[20]。IL-22是IL-10家族成员,可以被共生菌和致病菌激活,其相关受体可以激活信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)信号,在肠道上皮发挥防御和组织修复功能[33-34],而IL-22缺陷小鼠很容易发生肠道炎症[35]。鉴于IL-22能够提高岩藻糖基化水平,口服岩藻糖基化多糖可以提高易感小鼠的存活率。ILC3还可以分泌肿瘤坏死因子(TNF)家族成员LTα,但LTα是以共生菌非依赖模式调控Fut2,进而调控岩藻糖基化的,它的表达不受抗生素的影响。IL-22和LTα的表达均依赖ILC3转录因子维甲酸受体相关孤儿受体γt(retinoic acid-related orphan receptor γt,RORγt)和分化抑制因子2(inhibitor of differentiation 2,Id2),但两者具体发挥的机制还不是很清楚。有报道,LTα的表达促进树突细胞IL-23的分泌,随后调控了ILC3对IL-22的表达[36],ILC3分泌的IL-22对LTα的表达是否有影响还不清楚。
获得性免疫细胞也可以调控岩藻糖基化,但其对岩藻糖和Fut的表达呈负向调控[37]。重组激活基因(recombination activating gene,Rag)缺陷小鼠不能表达T细胞和B细胞,研究表明,和野生型小鼠相比,Rag缺陷小鼠可以高表达肠道上皮细胞的岩藻糖,并且,只有产生IL-10的T细胞亚群能够抑制肠道上皮的岩藻糖表达[18]。在Rag缺陷小鼠的肠上皮中还发现,ILC3细胞的数量和其分泌的IL-22的表达均升高,这提示T细胞可以负向调控ILC3细胞的数量和IL-22的表达[38],可能与竞争ILC3生态位或产生某些抑制因子有关。获得性免疫细胞的缺失促进肠上皮岩藻糖基化,这可能是一种补偿保护反应来促进肠腔的自我平衡。肠道免疫系统是肠道上皮岩藻糖基化重要的协调者,维持并改善了宿主和肠道微生物的共生环境。
5 小结岩藻糖作为一种能源和调控物质,可以被肠道微生物利用,并能促进共生菌的定植,抵抗致病菌的感染,进而更好地维持肠道菌群平衡,其发挥作用的途径大致有以下几种。岩藻糖可能参与某些菌群的代谢途径,诱导菌群产生一些对宿主有益的代谢产物,如多种氨基酸、维生素和短链脂肪酸等。岩藻糖可能还会影响某些细菌相关基因的表达,如抑制粪肠球菌毒性基因的表达。另外,岩藻糖促进了肠道益生菌的定植,如疣微菌科、拟杆菌属等,进而维持肠道菌群的动态平衡。但并不是利用岩藻糖的菌群都是对宿主有益的,岩藻糖也是一些致病菌的黏附位点,如胃肠腔的幽门螺杆菌,其分泌的黏附素与胃肠道上皮细胞的岩藻糖结合,以此为媒介感染宿主[40]。
|
IL-10:白介素-10 interleukin 10;IL-22:白介素-22 in-terleukin 22;IL-23:白介素-23 interleukin 23;ILC3:3型天然淋巴细胞type 3 innate lymphoid cell; RORγt:维甲酸受体相关孤儿受体γt retinoic acid-related orphan receptor γt; Id2:分化抑制因子2 inhibitor of differentiation 2;LTα:淋巴毒素α lymphotoxin α; MyD88:髓样分化因子88 myeloid differ-entiation primary response 88;LPS:脂多糖lipopolysaccha-ride。 图 4 免疫细胞调控肠道上皮细胞岩藻糖的表达 Figure 4 Immune cells regulate the expression of the fucose in intestinal epithelial cells[18, 20, 39] |
肠道微生物的代谢产物反过来又可以影响肠道上皮细胞,促进宿主的防御能力,进而营造良好的肠道环境,微生物与宿主间的这种互惠互利的共生关系,提高了机体抵抗外界感染的能力,对一些疾病的预防有积极作用。但是,对于岩藻糖如何识别共生菌和致病菌,如何参与不同肠道微生物的代谢途径,以及肠道不同区域岩藻糖基化程度为何不同等,还不是很清楚。如果能够进一步深入研究,更加明确岩藻糖调控肠道稳态的机制,对于维持肠道健康有重要的指导意义。
本文主要对黏蛋白侧链上的岩藻糖及其调控机制进行综述,外源的岩藻多糖,如墨角藻多糖、褐藻糖胶、褐藻多糖硫酸酯等均含有岩藻糖,在抗凝血、抗血栓、抗病毒以及抗肿瘤[41]方面均有重要作用。外源的岩藻糖能够被含有岩藻糖苷酶的微生物直接降解,当肠道上皮细胞岩藻糖表达不足时,外源添加岩藻糖是否可以促进其岩藻糖基化,进而更好的维持肠道稳态,这也为人类膳食、动物饲养以及饲料添加剂的选择提供重要参考。
| [1] |
COSTELLO E K, LAUBER C L, HAMADY M, et al. Bacterial community variation in human body habitats across space and time[J]. Science, 2009, 326(5960): 1694-1697. DOI:10.1126/science.1177486 |
| [2] |
SENDER R, FUCHS S, MILO R. Are we really vastly outnumbered? Revisiting the ratio of bacterial to host cells in humans[J]. Cell, 2016, 164(3): 337-340. DOI:10.1016/j.cell.2016.01.013 |
| [3] |
GEVERS D, KUGATHASAN S, DENSON L A, et al. The treatment-naive microbiome in new-onset Crohn's disease[J]. Cell Host & Microbe, 2014, 15(3): 382-392. |
| [4] |
TURNBAUGH P J, HAMADY M, YATSUNENKO T, et al. A core gut microbiome in obese and lean twins[J]. Nature, 2009, 457(7228): 480-484. DOI:10.1038/nature07540 |
| [5] |
KOSTIC A D, GEVERS D, SILJANDER H, et al. The dynamics of the human infant gut microbiome in development and in progression toward type 1 diabetes[J]. Cell Host & Microbe, 2015, 17(2): 260-273. |
| [6] |
SAMPSON T R, DEBELIUS J W, THRON T, et al. Gut microbiota regulate motor deficits and neuroinflammation in a model of Parkinson's disease[J]. Cell, 2016, 167(6): 1469-1480. DOI:10.1016/j.cell.2016.11.018 |
| [7] |
ZHANG X, ZHANG D Y, JIA H J, et al. The oral and gut microbiomes are perturbed in rheumatoid arthritis and partly normalized after treatment[J]. Nature Medicine, 2015, 21(8): 895-905. DOI:10.1038/nm.3914 |
| [8] |
HOOPER L V, LITTMAN D R, MACPHERSON A J. Interactions between the microbiota and the immune system[J]. Science, 2012, 336(6086): 1268-1273. DOI:10.1126/science.1223490 |
| [9] |
BIRCHENOUGH G M H, NYSTRÖM E E L, JOHANSSON M E V, et al. A sentinel goblet cell guards the colonic crypt by triggering Nlrp6-dependent Muc2 secretion[J]. Science, 2016, 352(6293): 1535-1542. DOI:10.1126/science.aaf7419 |
| [10] |
HANSSON G C, JOHANSSON M E. The inner of the two Muc2 mucin-dependent mucus layers in colon is devoid of bacteria[J]. Gut Microbes, 2010, 1(1): 51-54. DOI:10.4161/gmic.1.1.10470 |
| [11] |
JUGE N. Microbial adhesins to gastrointestinal mucus[J]. Trends in Microbiology, 2012, 20(1): 30-39. DOI:10.1016/j.tim.2011.10.001 |
| [12] |
FU J X, WEI B, WEN T, et al. Loss of intestinal core 1-derived O-glycans causes spontaneous colitis in mice[J]. The Journal of Clinical Investigation, 2011, 121(4): 1657-1666. DOI:10.1172/JCI45538 |
| [13] |
BECKER D J, LOWE J B. Fucose:biosynthesis and biological function in mammals[J]. Glycobiology, 2003, 13(7): 41R-53R. DOI:10.1093/glycob/cwg054 |
| [14] |
MARONI L, VAN DE GRAAF S F, HOHENESTER S D, et al. Fucosyltransferase 2:a genetic risk factor for primary sclerosing cholangitis and Crohn's disease-a comprehensive review[J]. Clinical Reviews in Allergy & Immunology, 2015, 48(2/3): 182-191. |
| [15] |
MICHALSKI J C, KLEIN A. Glycoprotein lysosomal storage disorders:α-and β-mannosidosis, fucosidosis and α-N-acetylgalactosaminidase deficiency[J]. Biochimica et Biophysica Acta (BBA):Molecular Basis of Disease, 1999, 1455(2/3): 69-84. |
| [16] |
COYNE M J, REINAP B, LEE M M, et al. Human symbionts use a host-like pathway for surface fucosylation[J]. Science, 2005, 307(5716): 1778-1781. DOI:10.1126/science.1106469 |
| [17] |
GOTO Y, UEMATSU S, KIYONO H. Epithelial glycosylation in gut homeostasis and inflammation[J]. Nature Immunology, 2016, 17(11): 1244-1251. DOI:10.1038/ni.3587 |
| [18] |
GOTO Y, OBATA T, KUNISAWA J, et al. Innate lymphoid cells regulate intestinal epithelial cell glycosylation[J]. Science, 2014, 345(6202): 1254009. DOI:10.1126/science.1254009 |
| [19] |
PHAM T A N, CLARE S, GOULDING D, et al. Epithelial IL-22RA1-mediated fucosylation promotes intestinal colonization resistance to an opportunistic pathogen[J]. Cell Host & Microbe, 2014, 16(4): 504-516. |
| [20] |
PICKARD J M, MAURICE C F, KINNEBREW M A, et al. Rapid fucosylation of intestinal epithelium sustains host-commensal symbiosis in sickness[J]. Nature, 2014, 514(7524): 638-641. DOI:10.1038/nature13823 |
| [21] |
TERAHARA K, NOCHI T, YOSHIDA M, et al. Distinct fucosylation of M cells and epithelial cells by Fut1 and Fut2, respectively, in response to intestinal environmental stress[J]. Biochemical and Biophysical Research Communications, 2011, 404(3): 822-828. DOI:10.1016/j.bbrc.2010.12.067 |
| [22] |
BIOL-N'GARAGBA M C, GRECO S, GEORGE P, et al. Polyamine participation in the maturation of glycoprotein fucosylation, but not sialylation, in rat small intestine[J]. Pediatric Research, 2002, 51(5): 625-634. DOI:10.1203/00006450-200205000-00014 |
| [23] |
WLODARSKA M, LUO C W, KOLDE R, et al. Indoleacrylic acid produced by commensal Peptostreptococcus species suppresses inflammation[J]. Cell Host & Microbe, 2017, 22(1): 25-37. |
| [24] |
SONNENBURG J L, XU J, LEIP D D, et al. Glycan foraging in vivo by an intestine-adapted bacterial symbiont[J]. Science, 2005, 307(5717): 1955-1959. DOI:10.1126/science.1109051 |
| [25] |
FLETCHER C M, COYNE M J, VILLA O F, et al. A general O-glycosylation system important to the physiology of a major human intestinal symbiont[J]. Cell, 2009, 137(2): 321-331. DOI:10.1016/j.cell.2009.02.041 |
| [26] |
RODRÍGUEZ-DÍAZ J, MONEDERO V, YEBRA M J. Utilization of natural fucosylated oligosaccharides by three novel α-L-fucosidases from a probiotic Lactobacillus casei strain[J]. Applied and Environmental Microbiology, 2011, 77(2): 703-705. DOI:10.1128/AEM.01906-10 |
| [27] |
CHESSA D, WINTER M G, NUCCIO S P, et al. RosE represses Std fimbrial expression in Salmonella enterica serotype Typhimurium[J]. Molecular Microbiology, 2008, 68(3): 573-587. DOI:10.1111/j.1365-2958.2008.06185.x |
| [28] |
PACHECO A R, CURTIS M M, RITCHIE J M, et al. Fucose sensing regulates bacterial intestinal colonization[J]. Nature, 2012, 492(7427): 113-117. DOI:10.1038/nature11623 |
| [29] |
WIERICHS R J, ZELCK H, DOERFER C E, et al. Effects of dentifrices differing in fluoride compounds on artificial enamel caries lesions in vitro[J]. Odontology, 2017, 105(1): 36-45. DOI:10.1007/s10266-016-0233-x |
| [30] |
LYNCH M B, SWEENEY T, CALLAN J J, et al. The effect of dietary Laminaria-derived laminarin and fucoidan on nutrient digestibility, nitrogen utilisation, intestinal microflora and volatile fatty acid concentration in pigs[J]. Journal of the Science of Food and Agriculture, 2010, 90(3): 430-437. |
| [31] |
SHANG Q S, JIANG H, CAI C, et al. Gut microbiota fermentation of marine polysaccharides and its effects on intestinal ecology:an overview[J]. Carbohydrate Polymers, 2017, 179: 173-185. |
| [32] |
KASHYAP P C, MARCOBAL A, URSELL L K, et al. Genetically dictated change in host mucus carbohydrate landscape exerts a diet-dependent effect on the gut microbiota[J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(42): 17059-17064. DOI:10.1073/pnas.1306070110 |
| [33] |
SATOH-TAKAYAMA N, VOSSHENRICH C A, LESJEAN-POTTIER S, et al. Microbial flora drives interleukin 22 production in intestinal NKp46+ cells that provide innate mucosal immune defense[J]. Immunity, 2008, 29(6): 958-970. DOI:10.1016/j.immuni.2008.11.001 |
| [34] |
SONNENBERG G F, FOUSER L A, ARTIS D. Border patrol:regulation of immunity, inflammation and tissue homeostasis at barrier surfaces by IL-22[J]. Nature Immunology, 2011, 12(5): 383-390. DOI:10.1038/ni.2025 |
| [35] |
ZHENG Y, VALDEZ P A, DANILENKO D M, et al. Interleukin-22 mediates early host defense against attaching and effacing bacterial pathogens[J]. Nature Medicine, 2008, 14(3): 282-289. DOI:10.1038/nm1720 |
| [36] |
OTA N, WONG K, VALDEZ P A, et al. IL-22 bridges the lymphotoxin pathway with the maintenance of colonic lymphoid structures during infection with Citrobacter rodentium[J]. Nature Immunology, 2011, 12(10): 941-948. DOI:10.1038/ni.2089 |
| [37] |
GOTO Y, LAMICHHANE A, KAMIOKA M, et al. IL-10-producing CD4+ T cells negatively regulate fucosylation of epithelial cells in the gut[J]. Scientific Reports, 2015, 5: 15918. DOI:10.1038/srep15918 |
| [38] |
SAWA S, LOCHNER M, SATOH-TAKAYAMA N, et al. RORγt+ innate lymphoid cells regulate intestinal homeostasis by integrating negative signals from the symbiotic microbiota[J]. Nature Immunology, 2011, 12(4): 320-326. DOI:10.1038/ni.2002 |
| [39] |
PICKARD J M, CHERVONSKY A V. Intestinal fucose as a mediator of host-microbe symbiosis[J]. Journal of Immunology, 2015, 194(12): 5588-5593. DOI:10.4049/jimmunol.1500395 |
| [40] |
MAGALHÃES A, REIS C A. Helicobacter pylori adhesion to gastric epithelial cells is mediated by glycan receptors[J]. Brazilian Journal of Medical and Biological Research, 2010, 43(7): 611-618. DOI:10.1590/S0100-879X2010007500049 |
| [41] |
PARK H S, KIM G Y, NAM T J, et al. Antiproliferative activity of fucoidan was associated with the induction of apoptosis and autophagy in AGS human gastric cancer cells[J]. Journal of Food Science, 2011, 76(3): T77-T83. DOI:10.1111/j.1750-3841.2011.02099.x |