蜜蜂是与人类以及自然界关系密切的社会性昆虫,它不仅可以为人类提供营养丰富的蜂产品,而且通过授粉来增加农作物的产量,并维护生态平衡,对保护和维持生物多样性起到重要作用[1]。蜂王是蜂群中唯一具有繁殖特性的雌性个体,蜂王的质量对于蜂群起着决定性作用,高质量的蜂王具有更强的产卵能力以及抵抗疾病的能力,因此培育高质量的蜂王对于生产尤为重要[2]。蜂王在幼虫期和产卵期的食物都是蜂王浆,其营养成分主要包括蛋白质、游离氨基酸、脂肪酸、糖、维生素等[3]。维生素是昆虫生长和代谢所必需的微量有机物质,是辅酶的主要组成成分,维生素缺乏不仅会影响细胞代谢,使昆虫的生长发育受阻,而且会引起组织和细胞发生病变。维生素参与蜜蜂机体内三大营养物质的氧化还原反应和新陈代谢,与蜜蜂的健康、生长发育和繁殖密切相关。昆虫一般自身不能合成维生素,必须从食物中获取[4]。叶酸作为维持生物体正常生命活动所必需的一类有机物质,通常被机体吸收后最终以至少5种有活性的辅酶形式来参与到机体内一碳单位的转移,对嘌呤、嘧啶、核酸和蛋白质的生物合成以及细胞的分裂生长具有特别重要的作用[5]。蜂王浆中叶酸的含量在0.16~0.50 μg/g,昆虫在发育过程中虽然对叶酸需要量很少,但如果缺少叶酸会对高龄幼虫和蛹的发育造成影响[6],而叶酸对于蜂王质量的影响还鲜有报道。蜂王质量包括蜂王初生重、胸长、胸宽、产卵能力以及相关基因表达等,其中,卵黄蛋白原(vitellogenin,Vg)基因是一种多效性基因,与蜜蜂卵巢活性、寿命、免疫力等均具有一定相关性[7]。储存蛋白110(hexamerin 110,hex110)和储存蛋白70b(hexamerin 70b,hex70b)是蜜蜂体内重要的储存蛋白,担负着变态发育、级型分化、性别决定、产卵、寿命、免疫等生物学功能[8-14]。鉴于此,为了揭示叶酸对蜂王质量的影响,本试验以西方蜜蜂(Apis mellifera)为研究对象,探索额外添加叶酸对所培育蜂王初生重、胸宽以及卵巢中Vg、hex110和hex70b基因表达的影响,为培育更高质量的蜂王提供参考。
1 材料与方法 1.1 试验动物试验动物为江西农业大学蜜蜂研究所饲养的西方蜜蜂,试验开展时间为2017年5月至2017年7月。
1.2 主要试剂及器材叶酸(纯度≥98%)和焦炭酸二乙酯(DEPC)水(北京索莱宝科技有限公司),氯化钠(分析纯,北京西陇化工有限公司),Trizol总RNA提取试剂盒和RNA酶抑制剂(北京全式金生物技术有限公司),反转录酶M-MLV(200 U/μL)、dNTP Mixture(2.5 mmol/L)和荧光染料(TaKaRa公司),Oligo(dT)(由美国英杰生命技术公司合成),定量PCR仪(iQTM2,美国Bio-Rad公司),核酸蛋白测定仪(德国Implen公司),生化培养箱(GZ-250-GSI,韶关市广智科技设备发展公司)。
1.3 试验设计 1.3.1 育王及药物处理选取一群蜜蜂为虫源群,控制蜂王产卵8 h。3 d后,按照标准人工育王方法分别在群势基本一致的4群西方蜜蜂蜂群中培育西方蜜蜂蜂王,每群1框,每框2排,每排20个王台。从移入幼虫的第2天起,按照每框的不同区域,随机用微量进样器分别给王台内的小幼虫饲喂2 μL含有0、0.05、0.25、1.00 mg/kg叶酸的糖水,并分别标记为Ⅰ组、Ⅱ组、Ⅲ组、Ⅳ组,连续饲喂3 d。
1.3.2 蜂王外部指标测定蜂王羽化出房后,利用电子天平称其初生重;剪下蜂王胸部,去掉翅足后,利用形态观察系统测量蜜蜂的胸宽。
1.3.3 荧光定量PCR测定卵巢中Vg、hex110及hex70b基因的相对表达量 1.3.3.1 样品采集刚出房的蜂王测完初生重、胸宽后立即解剖,采集卵巢,装入1.5 mL RNase-free的EP管并迅速放入液氮中,用于后续指标检测。
1.3.3.2 总RNA的提取以及cDNA的合成参考秦秋红[15]的试验方法对样本总RNA进行提取,用核酸蛋白测定仪检测提取的总RNA的纯度(OD260/280在1.9~2.1,符合标准),琼脂糖凝胶电泳评估RNA的28S、18S和5S这3个条带的完整性。使用反转录试剂盒对总RNA进行反转录,反转录产物保存于-80 ℃冰箱保存。
1.3.3.3 荧光定量PCR引物的设计及荧光定量PCR根据GenBank中的相关序列,用Primer 5.0软件设计引物序列,由上海生物有限公司合成(表 1),以β-肌动蛋白(β-actin)作为内参基因。荧光定量PCR的反应体系为10 μL,包括cDNA 1 μL,SYBR® Premix ExTaqTM Ⅱ 5 μL,Rox 0.2 μL,上游、下游引物各0.4 μL,超纯灭菌水3 μL,混匀后放入荧光定量PCR仪中进行扩增。反应条件:95 ℃ 30 s;95 ℃ 10 s,60 ℃ 1 min,40个循环;之后50 ℃加热到90 ℃(每6 s升高1 ℃)。建立熔解曲线,收集目的基因与内参基因的Ct值[16],并参考Qiang等[17]的方法计算各个目的基因的相对表达量。
|
|
表 1 基因引物序列 Table 1 Primer sequences of genes |
试验数据用SPSS 17.0软件中的ANOVA程序进行差异显著性比较分析。
2 结果与分析 2.1 叶酸对西方蜜蜂蜂王初生重及胸宽的影响由表 2可知,Ⅱ组蜂王的初生重显著高于Ⅰ组、Ⅲ组及Ⅳ组(P < 0.05),而Ⅱ组、Ⅲ组及Ⅳ组之间差异不显著(P>0.05);蜂王的胸宽4个组的结果比较接近,差异均不显著(P>0.05)。
|
|
表 2 叶酸对西方蜜蜂蜂王初生重和胸宽的影响 Table 2 Effects of folic acid on birth weight and chest width of queens for Western honeybee (Apis mellifera) |
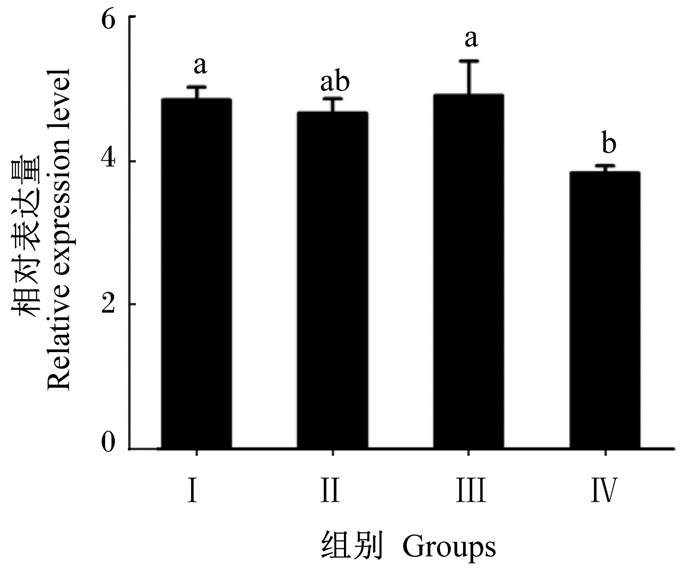
由图 1可知,Ⅰ组、Ⅲ组蜂王卵巢中Vg基因的相对表达量显著高于Ⅳ组(P < 0.05),但Ⅰ组、Ⅱ组及Ⅲ组之间差异不显著(P>0.05),Ⅱ组与Ⅳ组之间差异也不显著(P>0.05)。
|
数据柱标注相同字母表示差异不显著(P>0.05),不同字母表示差异显著(P < 0.05)。下图同。 Date columns with the same letters mean no significant difference (P>0.05), while with different letters mean significant difference (P < 0.05). The same as below. 图 1 叶酸对蜂王卵巢中Vg基因相对表达量的影响 Figure 1 Effects of folic acid on the relative expression level of Vg gene in ovary of queens for Western honeybee (Apis mellifera) |
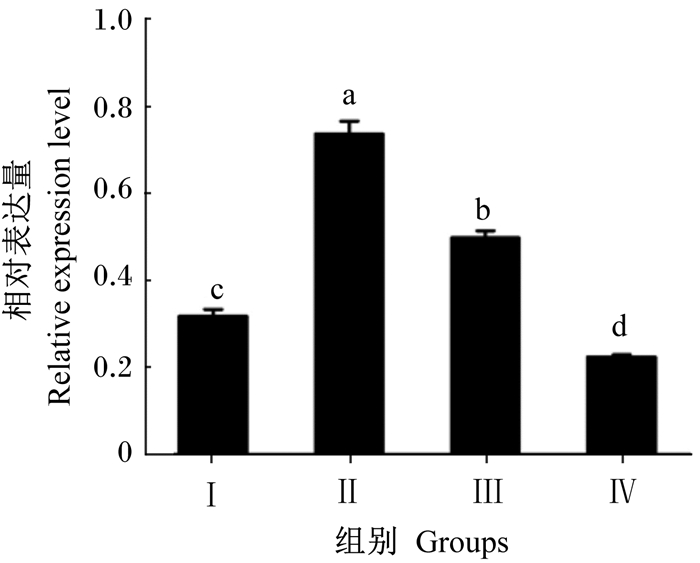
由图 2可知,随着叶酸浓度的增加,卵巢中hex110基因的相对表达量先增加后降低,其中Ⅱ组显著高于Ⅰ组、Ⅲ组和Ⅳ组(P < 0.05),Ⅲ组显著高于Ⅰ组和Ⅳ组(P < 0.05),Ⅰ组显著高于Ⅳ组(P < 0.05)。
|
图 2 叶酸对蜂王卵巢中hex110基因相对表达量的影响 Figure 2 Effects of folic acid on the relative expression level of hex110 gene in ovary of queens for Western honeybee (Apis mellifera) |
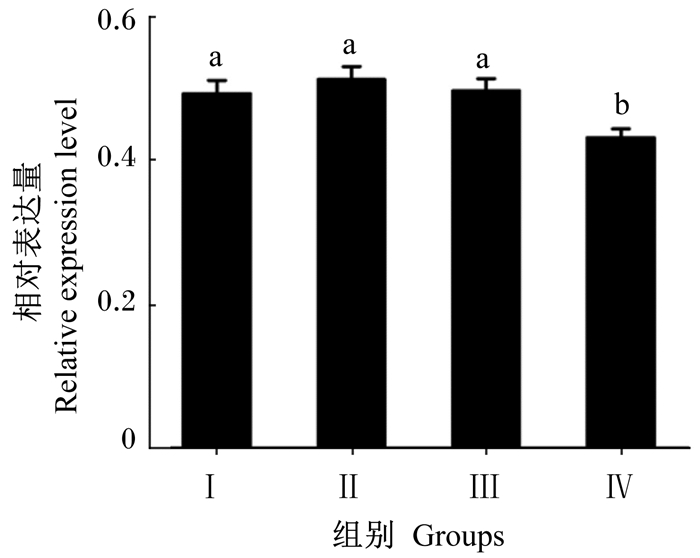
由图 3可知,Ⅰ组、Ⅱ组及Ⅲ组蜂王卵巢中hex70b基因的相对表达量显著高于Ⅳ组(P < 0.05),但Ⅰ组、Ⅱ组及Ⅲ组之间差异不显著(P>0.05)。
|
图 3 叶酸对西方蜜蜂蜂王卵巢中hex70b相对表达量的影响 Figure 3 Effects of folic acid on the relative expression level of hex70b gene in ovary of queens for Western honeybee (Apis mellifera) |
营养是影响蜜蜂健康的重要因素,合理、均衡的营养物质供应以及适宜的环境条件是蜜蜂健康生长的重要条件。蜜蜂的营养需要主要包括碳水化合物、蛋白质、矿物质、脂类及维生素需要等[18]。虽然维生素的需要量相对较少,但维生素对蜜蜂的生长发育至关重要。蜂王的质量决定蜂群群势的强弱,蜂王的初生重与蜂王的质量成正比关系,初生重大的蜂王,具有发育良好的卵巢和数量较多的卵巢管,这种蜂王具有较强的产卵力[19]。本研究发现:额外添加低浓度的叶酸可增加蜂王的初生重,额外添加高浓度的叶酸对蜂王的初生重没有显著影响,可能由于叶酸作为维持生物体正常生命活动所必需的一类有机化合物,被机体吸收后转变成辅酶,参与机体内一碳单位的转移,对嘧啶、嘌呤、核酸和蛋白质的生物合成以及细胞的分裂生长具有特别重要的作用,促进了基因表达及细胞的分裂增长[5],从而提高了蜂王的初生重;过量的叶酸可能未被蜂王幼虫所吸收,同时还可能影响了蜜蜂其他代谢过程,从而影响其他机能,如蜂王卵巢相关基因的表达等。
Vg是一类大分子量的糖脂复合蛋白质,广泛存在于卵生脊椎动物和非脊椎动物的血淋巴脂肪体和卵等器官中,是蜜蜂卵黄发生的关键物质,具有激活卵巢、生殖竞争、行为构建、延长寿命、转化食物等多种功能,Vg是卵黄蛋白的前体,卵黄蛋白为胚胎发育提供蛋白质、必需氨基酸等多种营养物质,卵巢发育好的蜂王,具有较高的Vg基因表达量,因此Vg基因的表达量也是衡量蜂王质量的重要指标[20-28]。本研究发现,高浓度叶酸组(Ⅳ组)蜂王卵巢中Vg基因的相对表达量显著低于对照组(Ⅰ组),而低浓度叶酸组(Ⅱ组)和中浓度叶酸组(Ⅲ组)与对照组差异不显著,这也说明过量的叶酸会抑制蜂王卵巢中Vg基因表达,从而影响蜂王的发育。
储存蛋白是昆虫储存起来供以后作为营养物质使用的蛋白质。储存蛋白一般是由6个亚基构成的六聚体蛋白,是由幼虫脂肪体细胞合成并分泌释放到血淋巴内,蜜蜂体内有4种储存蛋白基因,按照其分子质量大小分别命名为hex110、储存蛋白70a(hexamerin 70a,hex70a)、hex70b和储存蛋白70c(hexamerin 70c,hex70c)[13]。研究发现储存蛋白在许多昆虫中与雌性昆虫产卵有关,而且储存蛋白的表达与其产卵能力密切相关[29-32]。本研究发现,随着叶酸浓度的增加,蜂王卵巢中hex110基因的相对表达量先增加后降低,以Ⅱ组最高。这说明,在育王时额外添加低浓度的叶酸可促进卵巢中hex110基因的表达,过高浓度的叶酸会抑制hex110基因的表达。hex110是蜂王卵巢中重要的基因[33],在产卵蜂王卵巢中高表达,hex110的高表达有利于蜂王卵巢的发育,提高蜂王的繁殖性能[13],hex110基因表达量相对较低,则不利于蜂王卵巢的发育。本研究发现,高浓度叶酸组蜂王卵巢中hex70b基因的相对表达量显著低于对照组、低浓度叶酸组和中浓度叶酸组,但低浓度叶酸组和中浓度叶酸组与对照组之间差异不显著,这说明过量的叶酸也抑制了蜂王卵巢中hex70b基因的表达。hex70b是富含蛋氨酸和亮氨酸的储存蛋白,不仅与蜜蜂级型分化有关,还与蜂王以及雄蜂的性腺发育有关[13],hex70b基因的表达下降影响着蜂王卵巢发育质量。本研究发现,额外添加高浓度(1.00 mg/kg)的叶酸后蜂王卵巢中Vg、hex110和hex70b基因的相对表达量均显著低于对照组。Pickell等[34]研究发现,过量的叶酸会引起DNA的过甲基化,改变其表观遗传学特征,高浓度叶酸摄取会引起胚胎发育紊乱从而影响基因表达。
4 结论在育王时额外添加叶酸对西方蜜蜂蜂王质量存在影响,额外添加1.00 mg/kg的叶酸导致蜂王卵巢中Vg、hex110和hex70b基因的相对表达量显著下降;额外添加0.25 mg/kg的叶酸显著提高了蜂王卵巢中hex110基因的相对表达量;额外添加0.05 mg/kg的叶酸显著提高了蜂王的初生重、卵巢中hex110基因的相对表达量。由此可知,育王时可添加0.05 mg/kg的叶酸来提高蜂王质量。
| [1] |
吴小波, 王子龙, 石元元, 等. 婚飞对中华蜜蜂性成熟处女蜂王sRNAs表达的影响[J]. 中国农业科学, 2013, 46(17): 3721-3728. DOI:10.3864/j.issn.0578-1752.2013.17.022 |
| [2] |
廖春华, 邹垂彬, 谢国秀, 等. 饲粮粗蛋白质水平对中华蜜蜂育王质量的影响[J]. 动物营养学报, 2016, 28(9): 2998-3004. |
| [3] |
方国桢, 方建生, 田树革. 蜂王浆成分及其分析方法研究进展[J]. 中国乳品工业, 1994, 22(6): 278-286. |
| [4] |
冯倩倩, 胥保华, 刘锋, 等. 维生素对蜜蜂生长发育的影响[J]. 中国蜂业, 2011, 62(1): 14-15. |
| [5] |
杨玉柱, 王储炎, 焦必宁. 叶酸的研究进展[J]. 农产品加工(学刊), 2006(5): 31-35, 39. |
| [6] |
郭芳彬. 神奇的蜂王浆[M]. 北京: 中国农业出版社, 1997: 32-33.
|
| [7] |
张卫星, 胥保华. 蜜蜂卵黄原蛋白的研究进展[J]. 蜜蜂杂志, 2014, 34(5): 5-7. |
| [8] |
CRISTINO A S, NUNES F M F, BARCHUK A R, et al. Organization, evolution and transcriptional profile of hexamerin genes of the parasitic wasp Nasonia vitripennis (Hymenoptera:Pteromalidae)[J]. Insect Molecular Biology, 2010, 19(Suppl.1): 137-146. |
| [9] |
CUNHA A D, NASCIMENTO A M, GUIDUGLI K R, et al. Molecular cloning and expression of a hexamerin cDNA from the honey bee, Apis mellifera[J]. Journal of Insect Physiology, 2005, 51(10): 1135-1147. DOI:10.1016/j.jinsphys.2005.06.004 |
| [10] |
MARTINS J R, NUNES F M F, SIMÕES Z L, et al. A honeybee storage protein gene, hex 70a, expressed in developing gonads and nutritionally regulated in adult fat body[J]. Journal of Insect Physiology, 2008, 54(5): 867-877. DOI:10.1016/j.jinsphys.2008.03.009 |
| [11] |
BITONDI M M G, NASCIMENTO A M, CUNHA A D, et al. Characterization and expression of the Hex110 gene encoding a glutamine-rich hexamerin in the honey bee Apis mellifera[J]. Archives of Insect Biochemistry and Physiology, 2006, 63(2): 57-72. DOI:10.1002/(ISSN)1520-6327 |
| [12] |
DANTY E, ARNOLD G, BURMESTER T, et al. Identification and developmental profiles of hexamerins in antenna and hemolymph of the honeybee Apis mellifera[J]. Insect Biochemistry and Molecular Biology, 1998, 28(5/6): 387-397. |
| [13] |
MARTINS J R, NUNES F M F, CRISTINO A S, et al. The four hexamerin genes in the honey bee:structure, molecular evolution and function deduced from expression patterns in queens, workers and drones[J]. BMC Molecular Biology, 2010, 11: 23. DOI:10.1186/1471-2199-11-23 |
| [14] |
CAMERON R C, DUNCAN E J, DEARDEN P K. Biased gene expression in early honeybee larval development[J]. BMC Genomics, 2013, 14: 903. DOI:10.1186/1471-2164-14-903 |
| [15] |
秦秋红. 东方蜜蜂与西方蜜蜂学习记忆比较及蜜蜂学习记忆相关分子机理分析[D]. 硕士学位论文. 南昌: 江西农业大学, 2013. http://cdmd.cnki.com.cn/article/cdmd-10410-1013343049.htm
|
| [16] |
WANG W X, TIAN L Q, HUANG Q, et al. Effects of 10-hydroxy-2-decenoic acid on the development of honey bee (Apis mellifera) larvae[J]. Journal of Apicultural Research, 2014, 53(1): 171-176. DOI:10.3896/IBRA.1.53.1.19 |
| [17] |
QIANG H, KRYGER P, LE CONTE Y, et al. Survival and immune response of drones of a Nosemosis tolerant honey bee strain towards N. ceranae infections[J]. Journal of Invertebrate Pathology, 2012, 109(3): 297-302. DOI:10.1016/j.jip.2012.01.004 |
| [18] |
王颖, 马兰婷, 胥保华. 蜜蜂营养需要研究的必要性及策略[J]. 动物营养学报, 2011, 23(8): 1269-1272. |
| [19] |
谢代癸. 对蜂王初生体重与质量的研究[J]. 中国蜂业, 1983, 33(2): 13-14, 11. |
| [20] |
王秀秀, 杨明华, 李昌, 等. 东方蜜蜂卵黄原蛋白基因cDNA克隆及其基本生物信息学特征[J]. 中国蜂业, 2015, 66(3): 12-15. |
| [21] |
BLANK S, SEISMANN H, MCINTYRE M, et al. Vitellogenins are new high molecular weight components and allergens (Api m 12 and Ves v 6) of Apis mellifera and Vespula vulgaris venom[J]. PLoS One, 2013, 8(4): e62009. DOI:10.1371/journal.pone.0062009 |
| [22] |
WANG Y, BRENT C S, FENNERN E, et al. Gustatory perception and fat body energy metabolism are jointly affected by vitellogenin and juvenile hormone in honeybees[J]. PLoS Genetics, 2012, 8(6): e1002779. DOI:10.1371/journal.pgen.1002779 |
| [23] |
KAPHEIM K M, SMITH A R, IHLE K E, et al. Physiological variation as a mechanism for developmental caste-biasing in a facultatively eusocial sweat bee[J]. Proceedings of the Royal Society B:Biological Sciences, 2012, 279(1732): 1437-1446. DOI:10.1098/rspb.2011.1652 |
| [24] |
CARDOEN R, ERNST U R, VAN VAERENBERGH M, et al. Differential proteomics in dequeened honeybee colonies reveals lower viral load in hemolymph of fertile worker bees[J]. PLoS One, 2011, 6(6): e20043. DOI:10.1371/journal.pone.0020043 |
| [25] |
GAUTHIER L, RAVALLEC M, TOURNAIRE M, et al. Viruses associated with ovarian degeneration in Apis mellifera L.queens[J]. PLoS One, 2011, 6(1): e16217. DOI:10.1371/journal.pone.0016217 |
| [26] |
AMDAM G V, PAGE R E, Jr. The developmental genetics and physiology of honeybee societies[J]. Animal Behaviour, 2010, 79(5): 973-980. DOI:10.1016/j.anbehav.2010.02.007 |
| [27] |
NUNES F M F, SIMÕES Z L P. A non-invasive method for silencing gene transcription in honeybees maintained under natural conditions[J]. Insect Biochemistry and Molecular Biology, 2009, 39(2): 157-160. DOI:10.1016/j.ibmb.2008.10.011 |
| [28] |
WHEELERD E, KAWOOYA J K. Purification and characterization of honey bee vitellogenin[J]. Archives of Insect Biochemistry and Physiology, 1990, 14(4): 253-267. DOI:10.1002/(ISSN)1520-6327 |
| [29] |
HAHN D A, WHEELER D E. Presence of a single abundant storage hexamerin in both larvae and adults of the grasshopper, Schistocerca americana[J]. Journal of Insect Physiology, 2003, 49(12): 1189-1197. DOI:10.1016/j.jinsphys.2003.09.002 |
| [30] |
PAN M L, TELFER W H. Methionine-rich hexamerin and arylphorin as precursor reservoirs for reproduction and metamorphosis in female luna moths[J]. Archives of Insect Biochemistry & Physiology, 1996, 33(2): 149-162. |
| [31] |
杨文静. 西方蜜蜂(Apis mellifera)储存蛋白hex70b和hex110的表达与功能研究[D]. 硕士学位论文. 福州: 福建农林大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10389-1016134227.htm
|
| [32] |
CHINZEI Y, HARUNA T, MIURA K, et al. Purification and characterization of biliverdin-associated cyanoprotein from eggs and hemolymph of the bean bug, Riptortus clavatus (Heteroptera:Alydidae)[J]. Insect Biochemistry, 1990, 20(6): 545-555. DOI:10.1016/0020-1790(90)90066-4 |
| [33] |
庞倩, 王莹, 王康, 等. 不同移虫日龄蜂王卵巢中hexamerin110、hexamerin70b的差异表达分析[J]. 环境昆虫学报, 2017, 39(1): 62-67. |
| [34] |
PICKELL L, BROWN K, LI D Q, et al. High intake of folic acid disrupts embryonic development in mice[J]. Birth Defects Research Part A:Clinical and Molecular Teratology, 2011, 91(1): 8-19. DOI:10.1002/bdra.v91.1 |




