养猪生产中,许多因素会导致猪体内产生大量自由基,如饲料霉菌毒素污染、高温、病毒感染、断奶等;当过量自由基在体内得不到及时清除而大量蓄积时,体内氧化-抗氧化防御系统平衡被打破,引发机体氧化应激。氧化应激会导致动物免疫力降低,生产性能下降,产品品质变差,甚至出现死亡,带来严重的经济损失[1-2]。因此,寻求能有效保护仔猪免遭氧化应激危害的功能性产品是仔猪营养领域研究的热点之一。壳寡糖(chitooligosaccharides,COS)是由甲壳素的脱乙酰产物壳聚糖降解获得的低聚糖,由2~10个氨基葡萄糖通过β-1, 4-糖苷键连接而成[3]。研究表明,COS具有多种生物活性,且相对于壳聚糖,具有分子质量小、黏度小、易溶于水、无毒副作用等优点[4]。体外试验已证实COS能降低细胞氧化应激[5]。体内试验也发现,饲粮添加COS能提高动物的免疫力和生产性能[6-7],减少仔猪肠道有害菌数量,降低腹泻率[8-9]。在肉鸡饲粮中添加COS能显著提高其抗氧化能力[10]。但是,当仔猪遭受刺激产生氧化应激时,COS的抗氧化保护效应尚不清楚。因此,本研究拟验证正常饲养条件下,仔猪饲粮添加COS的基础上,通过一次性腹腔注射10 mg/kg BW敌草快(diquat)建立仔猪氧化应激模型,进而研究COS对氧化应激状态下仔猪生长性能、抗氧化功能及空肠养分消化和转运能力的影响,为COS在仔猪饲粮中的合理应用提供试验依据。
1 材料与方法 1.1 试验材料COS由北京中泰和生物科技有限公司提供,有效含量为10%,载体为麦芽糊精。
Diquat购自Sigma-Aldrich公司(上海),使用时用灭菌生理盐水配成10 mg/mL的diquat溶液。
1.2 试验设计与试验动物采用2×2双因子试验设计,腹腔是否滴注diquat(0、10 mg/kg BW)和饲粮中是否添加COS(0、50 mg/kg)为2个主效应,共形成4个组(对照组、COS组、diquat组和COS+diquat组)。选取24日龄、平均体重(7.34±0.09) kg的健康“杜×长×大”断奶仔猪24头,根据体重相近原则随机分为4个组,每组6个重复,每个重复1头猪。试验期28 d。其中COS从试验第1天开始添加,直至试验结束;腹腔注射diquat于试验第22天进行,不注射diquat试验猪腹腔注射等量生理盐水。仔猪全程单笼饲养。
1.3 试验饲粮基础饲粮参照NRC(2012)7~11 kg和11~25 kg仔猪营养需要进行配制,其组成及营养水平见表 1。在基础饲粮中添加试验设计剂量的COS构成试验饲粮。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
试验在四川农业大学动物营养研究所科研基地进行。室温保持在26 ℃左右,每天喂料4次(08:00、12:00、16:00、20:00),每次以仔猪吃饱后料槽内略有余料为度,自由饮水。圈舍每天打扫,注意通风换气,定期消毒。
1.5 样品采集与处理 1.5.1 粪样于试验第18~21天进行部分收粪,每天每个重复收150 g左右,加入10%粪便重量的10%稀硫酸,并加2滴甲苯,转入样品袋混匀,放入4 ℃冷冻保存,最后将每个重复4 d收集的粪样经充分混合后,65 ℃烘干达恒重后粉碎,过40目筛,于-20 ℃保存待测。
1.5.2 血浆所有仔猪禁食12 h后,于试验第22和29天早上前腔静脉采血10 mL,置于加肝素钠试管中,静置30 min后3 500 r/min离心15 min,分离血浆,分装后于-20 ℃保存待测。
1.5.3 空肠黏膜于试验第29天早上称重采血后,所有仔猪麻醉后迅速打开腹腔分离空肠,剪截完好无损的空肠中段10 cm左右,用预冷生理盐水冲洗,滤纸吸干多余水分,置于冰面上沿纵向剪开,用干净载玻片轻轻刮取黏膜并分装于冻存管中,液氮速冻后于-80 ℃保存待测。
1.6 检测指标与方法 1.6.1 生长性能试验期间准确记录每个重复试验猪每天的采食量,在试验第1、22和29天早上试验猪空腹称重,计算1~21天和22~28天的平均日增重(average daily gain, ADG)、平均日采食量(average daily feed intake, ADFI)和料重比(feed/gain, F/G)。
1.6.2 养分表观消化率饲粮及粪便中的干物质(DM)、有机物(OM)、粗灰分(Ash)、粗蛋白质(CP)、钙(Ca)、磷(P)、粗脂肪(EE)含量和总能(TE)的检测参照张丽英[11]的方法,盐酸不溶灰分(AIA)含量参照GB/T 23743—2009的灼烧处理法进行测定。饲粮养分消化率的计算公式如下:
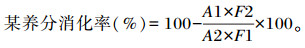
|
式中:F1为饲粮中该养分含量(%);F2为粪便中该养分含量(%);A1为饲粮中AIA含量(%);A2为粪便中AIA含量(%)。
1.6.3 血浆氧化还原指标血浆总抗氧化能力(T-AOC),超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)和过氧化氢酶(CAT)活性以及丙二醛(MDA)含量采用比色法测定。所有试剂盒均购自南京建成生物工程研究所,详细操作方法参见试剂盒说明书。
1.6.4 空肠黏膜二糖酶活性空肠黏膜中乳糖酶、蔗糖酶和麦芽糖酶活性的测定参照Cao等[12]的方法,试剂盒购于南京建成生物工程研究所,详细操作方法参见试剂盒说明书。
1.6.5 空肠黏膜养分转运载体mRNA表达量采用实时荧光定量PCR技术检测空肠黏膜养分转运载体葡萄糖转运载体2(GLUT2)、钠/葡萄糖转运载体1(SGLT1)、碱性氨基酸转运载体1(SLC7A1)、中性氨基酸转运载体(NAAT)和碱性氨基酸转运载体7(SLC7A7)的mRNA相对表达量。组织中总RNA的提取和质量检测参照Chen等[13]的方法进行。cDNA的合成采用试剂盒(Prime ScriptTM Reagent Kit, TaKaRa, 日本)进行,具体操作步骤参照说明书。登陆NCBI获得目的基因CDS序列,引物用Primer Premier 5.0软件进行设计,并在NCBI中进行BLAST比对引物特异性,筛选出特异性好的引物序列送华大基因生物科技有限公司进行合成,引物序列见表 2。用实时定量PCR仪(ABI-7900)进行测定,RT-PCR反应体系为10 μL:SYBR Premix Ex TaqTM Ⅱ (TaKaRa,日本) 5 μL,上、下游引物各0.4 μL,cDNA 1 μL,ddH2O 3.2 μL。PCR扩增条件为:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,共40个循环;95 ℃ 15 s。内参基因为β-肌动蛋白(β-actin),相对荧光定量的计算采用2-ΔΔCt法[14]。
|
|
表 2 基因引物序列 Table 2 Primer sequences of genes |
所有数据均采用SPSS 17.0统计软件进行统计分析。其中,应激前仔猪的生长性能、营养物质消化率和血浆相关指标采用t检验;应激后仔猪的生长性能、血浆和空肠相关指标均采用双因素有互作方差分析,以diquat(有、无)、饲粮COS(有、无)及二者的互作为主效应,结合Duncan氏法进行多重比较。所有结果以平均值和总体标准误表示,P < 0.01为差异极显著,P < 0.05为差异显著,0.05≤P < 0.10为有差异趋势。
2 结果 2.1 COS和氧化应激对仔猪生长性能的影响由表 3可知,注射diquat前(试验第1~21天),饲粮添加COS对仔猪的ADG和ADFI无显著影响(P>0.05),有降低F/G的趋势(P=0.09)。
|
|
表 3 饲粮添加COS和注射diquat对仔猪生长性能的影响 Table 3 Effects of dietary COS and diquat injection on growth performance of piglets |
注射diquat极显著降低试验第22~28天仔猪的ADG和ADFI(P < 0.01),极显著升高F/G(P < 0.01);饲粮添加COS能显著抑制氧化应激仔猪ADG的下降(P < 0.05),并使ADFI升高7.69%,F/G降低13.69%,但差异均不显著(P>0.05)。
2.2 COS对氧化应激前仔猪养分消化率的影响由表 4可知,饲粮添加COS极显著升高氧化应激前仔猪对饲粮CP、总能、Ash和P的表观消化率(P < 0.01),显著升高对饲粮OM、DM、EE和Ca的表观消化率(P < 0.05)。
|
|
表 4 饲粮添加COS对注射diquat前仔猪养分表观消化率的影响 Table 4 Effects of dietary COS on apparent digestibility of nutrients of piglets before diquat injection |
由表 5可知,注射diquat前,饲粮添加COS极显著升高仔猪血浆SOD活性(P < 0.01),显著升高血浆T-AOC(P < 0.05),对血浆CAT和GSH-Px活性及MDA含量无显著影响(P>0.05)。
|
|
表 5 饲粮添加COS和注射diquat对仔猪血浆抗氧化指标的影响 Table 5 Effects of dietary COS and diquat injection on plasma antioxidant indexes of piglets |
注射diquat极显著降低了血浆CAT活性(P < 0.01);饲粮添加COS显著升高氧化应激仔猪的血浆SOD活性和T-AOC(P < 0.05),有提高血浆GSH-Px活性的趋势(P=0.07)。
2.4 COS和氧化应激对仔猪空肠黏膜二糖酶活性及养分转运载体mRNA表达的影响由表 6可知,注射diquat显著降低了仔猪空肠黏膜中蔗糖酶、乳糖酶和麦芽糖酶的活性(P < 0.05);饲粮添加COS显著改善了空肠黏膜蔗糖酶、乳糖酶和麦芽糖酶的活性(P < 0.05),且与diquat组相比,diquat+COS组仔猪的乳糖酶、蔗糖酶和麦芽糖酶活性分别升高24.09%(P>0.05)、30.66%(P < 0.05)和20.16%(P>0.05)。饲粮添加COS和注射diquat对仔猪空肠黏膜二糖酶活性无显著交互作用(P>0.05)。
|
|
表 6 饲粮添加COS和注射diquat对仔猪空肠黏膜二糖酶活性的影响 Table 6 Effects of dietary COS and diquat injection on the activities of disaccharidases of jejunum mucosa of piglets |
由表 7可知,注射diquat显著下调空肠黏膜GLUT2和SGLT1的mRNA表达量(P < 0.05),而对SLC7A7、NAAT和SLC7A1的mRNA表达量无显著影响(P>0.05);添加COS显著抑制注射diquat诱导的GLUT2和SGLT1 mRNA表达量的下调(P < 0.05)。饲粮添加COS和注射diquat对仔猪空肠黏膜养分转运载体的mRNA表达量无显著交互作用(P>0.05)。
|
|
表 7 饲粮添加COS和注射diquat对仔猪空肠黏膜养分转运载体mRNA表达的影响 Table 7 Effects of dietary COS and diquat injection on mRNA expression of nutrient transport carrier of jejunum mucosa of piglets |
正常饲养条件下,饲粮添加COS对仔猪生长性能的影响已有许多报道。Chen等[7]发现,COS能够显著提高仔猪的ADG和ADFI,且0.5%的添加量优于0.25%。Yang等[9]也发现,饲粮添加0.04%和0.06%的COS可提高断奶仔猪的ADG和饲料转化率。但Han等[15]研究表明,饲粮添加0.3%和0.4%的COS对断奶仔猪的ADG无显著影响,但可改善饲料转化率。本研究也发现,正常饲养条件下,饲粮添加50 mg/kg COS有降低仔猪F/G的趋势。饲粮添加COS对仔猪生长性能影响不一致的原因,可能与试验仔猪所处的生理阶段及试验所用COS产品不同有关。COS是由2~10个氨基葡萄糖通过β-1, 4-糖苷键连接而成的低聚糖,因其组分比例及乙酰化程度的不同,生物学效应存在差异[16-17]。大量研究表明,饲粮添加COS可改善仔猪的饲料转化效率,可能与其能显著提高饲粮养分消化率有关。Liu等[8]研究表明,200 mg/kg COS能够显著提高16日龄断奶仔猪对饲粮总能、DM、CP、EE、Ca和P的吸收。Walsh等[17]在仔猪饲粮中添加250 mg/kg不同分子质量的COS,发现与分子质量 < 1、3~5、10~50和51~100 ku的COS相比,5~10 ku的COS能极显著提高仔猪对饲粮DM、OM和CP等的表观消化率。本试验也发现,正常饲养条件下,50 mg/kg COS能显著或极显著提高仔猪对饲粮CP、总能和OM等的表观消化率,其原因可能与COS能提高仔猪的抗氧化能力和改善肠黏膜屏障功能有关。正常饲养条件下,50 mg/kg COS可显著提高仔猪血浆SOD活性和T-AOC,与龙次民等[10]在妊娠后期母猪和新生仔猪上的报道结果相一致,即饲粮添加30 mg/kg COS能显著提高母猪和新生仔猪血液抗氧化酶活性,降低MDA含量。此外,研究也表明,COS能够改善肠道形态结构,增加肠道绒毛密度和高度,降低隐窝深度,增加肠道内吸收面积,促进营养物质的消化吸收[18]。
在仔猪的生命过程中常常会遭受各种应激,导致体内活性氧自由基(ROS)的大量产生,如高温、炎症、断奶、高代谢负担等[19]。过量的ROS若不能被机体的氧化还原系统有效清除,则会导致氧化应激,后者会影响仔猪的健康和生长性能。因此,寻求能有效保护仔猪免遭氧化应激危害的功能性产品是仔猪营养研究领域的热点之一。研究已证明,在腹腔注射diquat诱导的氧化应激模型条件下,仔猪的ADFI和ADG可分别降低29.74%和40.57%,F/G升高45.35%[20]。本试验研究发现,注射diquat极显著降低试验第22~28天仔猪的ADG和ADFI,极显著升高F/G;饲粮添加COS能显著抑制氧化应激仔猪ADG的下降,并使ADFI升高7.69%,F/G降低13.69%,提示COS能有效缓解氧化应激导致的仔猪生长性能降低。
COS对氧化应激仔猪的保护效应可能是通过增强机体抗氧化功能、保护肠道消化酶活性和养分转运载体而实现的。Sun等[21]体外研究表明,COS对细胞中超氧阴离子有较好的清除效果,与维生素C和SOD相当。也有研究发现,COS对自由基的清除能力会随着COS浓度的升高而增强[22]。本试验研究发现,注射diquat导致血浆CAT活性极显著下降,饲粮添加COS则显著改善氧化应激仔猪的血浆SOD活性和T-AOC,且有提高血浆GSH-Px活性的趋势。这表明,饲粮添加COS能在仔猪遭受氧化应激时提高血浆中抗氧化酶活性和抗自由基能力,进而缓解遭受的氧化损伤。与此同时,因注射diquat会导致仔猪采食量急剧下降,甚至发生呕吐、腹泻等现象,肠道作为消化吸收的主要器官首先遭受缺血而又最迟得到恢复,当组织再灌注提供氧,出现爆发性氧消耗,同时产生大量超氧自由基,导致肠道遭受应激损伤进而影响其功能。小肠二糖酶是二糖分解的关键酶,其活性的高低可直接反映肠道对糖类物质的消化能力。本试验研究发现,注射diquat后仔猪空肠黏膜二糖酶活性显著降低,可能与应激后仔猪采食量骤降有关。肠腔中营养物质的吸收,主要依赖于上皮细胞刷状缘和基底膜上不同的载体转运系统。其中,葡萄糖的吸收主要通过位于肠道黏膜上皮细胞的钠/葡萄糖转运载体(sodium/glucose cotransporter, SGLT)家族和葡萄糖转运载体(glucose transporter, GLUT)家族来完成,SGLT1和GLUT2分别是2个家族的重要成员且分布于肠道黏膜上皮细胞。同样,氨基酸的吸收转运需要氨基酸转运载体,后者可分为中性、碱性和酸性氨基酸转运载体。李丽娟[23]研究发现,氧化应激可显著降低仔猪肠道黏膜SGLT1和GLUT2的mRNA表达量。Yin等[24]研究却发现,注射diquat诱导氧化应激对仔猪空肠氨基酸转运载体SLC7A1、NAAT和SLC7A7的mRNA表达量无显著影响。本试验研究发现,注射diquat显著下调空肠黏膜GLUT2和SGLT1的mRNA表达量,而SLC7A1、NAAT和SLC7A7的mRNA表达量无显著变化。COS的添加可有效缓解肠道结构和功能的损伤。Xu等[25]研究表明,添加COS可提高断奶应激仔猪的空肠淀粉酶活性,并呈剂量依赖关系。Xiao等[26]在大肠杆菌攻毒仔猪饲粮中添加30 mg/kg COS能显著修复空肠的形态结构,增加绒毛高度,降低隐窝深度。本试验研究也发现,50 mg/kg COS能显著增加氧化应激仔猪空肠黏膜二糖酶活性及GLUT2和SGLT1的mRNA表达量,但对氨基酸转运载体SLC7A7、NAAT和SLC7A1的mRNA表达量无显著影响。综上分析,COS对应激仔猪的保护作用,可能是通过增强机体的抗氧化能力,缓解注射diquat导致的ROS的产生和(或)增强机体对ROS的清除,维护肠道结构和功能的完整性,进而缓解应激对仔猪生长性能的危害。
4 结论① 正常饲养条件下,饲粮添加COS可显著改善仔猪对饲粮的养分消化率,增强机体的抗氧化能力,有降低F/G的趋势;
② 氧化应激条件下,COS可通过改善机体的抗氧化能力,缓解diquat诱导的氧化应激,提高应激仔猪的空肠养分消化和转运能力,缓解氧化应激导致的增重下降。
| [1] |
BHATTACHARYYA A, CHATTOPADHYAY R, MITRA S, et al. Oxidative stress:an essential factor in the pathogenesis of gastrointestinal mucosal diseases[J]. Physiological Reviews, 2014, 94(2): 329-354. DOI:10.1152/physrev.00040.2012 |
| [2] |
YUAN S B, CHEN D W, ZHANG K Y, et al. Effects of oxidative stress on growth performance, nutrient digestibilities and activities of antioxidative enzymes of weanling pigs[J]. Asian Australasian Journal of Animal Sciences, 2007, 20(10): 1600-1605. DOI:10.5713/ajas.2007.1600 |
| [3] |
胡志鹏. 壳寡糖的研究进展[J]. 中国生化药物杂志, 2003, 24(4): 210-212. |
| [4] |
ZOU P, YANG X, WANG J, et al. Advances in characterisation and biological activities of chitosan and chitosan oligosaccharides[J]. Food Chemistry, 2016, 190: 74-81. |
| [5] |
LIU H T, LI W M, XU G, et al. Chitosan oligosaccharides attenuate hydrogen peroxide-induced stress injury in human umbilical vein endothelial cells[J]. Pharmacological Research, 2009, 59(3): 167-175. DOI:10.1016/j.phrs.2008.12.001 |
| [6] |
SWIATKIEWICZ S, SWIATKIEWICZ M, ARCZEWSKA-WLOSEK A, et al. Chitosan and its oligosaccharide derivatives (chito-oligosaccharides) as feed supplements in poultry and swine nutrition[J]. Journal of Animal Physiology and Animal Nutrition, 2015, 99(1): 1-12. DOI:10.1111/jpn.12222 |
| [7] |
CHEN Y J, KIM I H, CHO J H, et al. Effects of chitooligosaccharide supplementation on growth performance, nutrient digestibility, blood characteristics and immune responses after lipopolysaccharide challenge in weanling pigs[J]. Livestock Science, 2009, 124(1/2/3): 255-260. |
| [8] |
LIU P, PIAO X S, KIM S W, et al. Effects of chito-oligosaccharide supplementation on the growth performance, nutrient digestibility, intestinal morphology, and fecal shedding of Escherichia coli and Lactobacillus in weaning pigs[J]. Journal of Animal Science, 2008, 86(10): 2609-2618. DOI:10.2527/jas.2007-0668 |
| [9] |
YANG C M, FERKET P R, HONG Q H, et al. Effect of chito-oligosaccharide on growth performance, intestinal barrier function, intestinal morphology and cecal microflora in weaned pigs[J]. Journal of Animal Science, 2012, 90(8): 2671-2676. DOI:10.2527/jas.2011-4699 |
| [10] |
丁雪梅, 迟晓枫, 李小聪, 等. 饲粮中添加壳寡糖对肉鸡抗氧化性能的影响[J]. 四川农业大学学报, 2017, 35(4): 568-573. |
| [11] |
张丽英. 饲料分析及饲料质量检测技术[M]. 3版. 北京: 中国农业大学出版社, 2007.
|
| [12] |
CAO W, LIU G M, FANG T T, et al. Effects of spermine on the morphology, digestive enzyme activities, and antioxidant status of jejunum in suckling rats[J]. RSC Advances, 2015, 5(93): 76607-76614. DOI:10.1039/C5RA15793E |
| [13] |
CHEN Y, CHEN D W, TIAN G, et al. Dietary arginine supplementation alleviates immune challenge induced by Salmonella enterica serovar choleraesuis bacterin potentially through the Toll-like receptor 4-myeloid differentiation factor 88 signalling pathway in weaned piglets[J]. British Journal of Nutrition, 2012, 108(6): 1069-1076. DOI:10.1017/S0007114511006350 |
| [14] |
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△Ct method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [15] |
HAN K N, KWON I K, LOHAKARE J D, et al. Chito-oligosaccharides as an alternative to antimicrobials in improving performance, digestibility and microbial ecology of the gut in weanling pigs[J]. Asian-Australasian Journal of Animal Sciences, 2007, 20(4): 556-562. DOI:10.5713/ajas.2007.556 |
| [16] |
QUINTERO-VILLEGAS M I, AAM B B, RUPNOW J, et al. Adherence inhibition of enteropathogenic Escherichia coli by chitooligosaccharides with specific degrees of acetylation and polymerization[J]. Journal of Agricultural and Food Chemistry, 2013, 61(11): 2748-2754. DOI:10.1021/jf400103g |
| [17] |
WALSH A M, SWEENEY T, BAHAR B, et al. The effects of supplementing varying molecular weights of chitooligosaccharide on performance, selected microbial populations and nutrient digestibility in the weaned pig[J]. Animal, 2013, 7(4): 571-579. DOI:10.1017/S1751731112001759 |
| [18] |
LI X J, PIAO X S, KIM S W, et al. Effects of chito-oligosaccharide supplementation on performance, nutrient digestibility, and serum composition in broiler chickens[J]. Poultry Science, 2007, 86(6): 1107-1114. DOI:10.1093/ps/86.6.1107 |
| [19] |
CELI P, GABAI G. Oxidant/antioxidant balance in animal nutrition and health:the role of protein oxidation[J]. Frontier in Veterinary Science, 2015, 2: 48. |
| [20] |
赵娇, 周招洪, 梁小芳, 等. 葡萄籽原花青素及维生素E对氧化应激仔猪生长性能、血清氧化还原状态和肝脏氧化损伤的影响[J]. 中国农业科学, 2013, 46(19): 4157-4164. DOI:10.3864/j.issn.0578-1752.2013.19.021 |
| [21] |
SUN T, XIE W M, XU P X. Superoxide anion scavenging activity of graft chitosan derivatives[J]. Carbohydrate Polymers, 2004, 58(4): 379-382. DOI:10.1016/j.carbpol.2004.06.042 |
| [22] |
张吉, 刘洪涛, 李秀英, 等. 壳寡糖对自由基的清除及对N9小胶质细胞的保护作用[J]. 食品科学, 2010, 31(7): 81-85. |
| [23] |
李丽娟. 氧化应激对仔猪肠细胞葡萄糖转运能力及转运载体表达量的影响[D]. 硕士学位论文. 雅安: 四川农业大学, 2007. http://cdmd.cnki.com.cn/Article/CDMD-10626-2007208729.htm
|
| [24] |
YIN J, LIU M, REN W, et al. Effects of dietary supplementation with glutamate and aspartate on diquat-induced oxidative stress in piglets[J]. PLoS One, 2015, 10(4): e0122893. DOI:10.1371/journal.pone.0122893 |
| [25] |
XU Y, SHI B, YAN S, et al. Effects of chitosan supplementation on the growth performance, nutrient digestibility, and digestive enzyme activity in weaned pigs[J]. Czech Journal of Animal Science, 2014, 59(4): 156-163. DOI:10.17221/CJAS |
| [26] |
XIAO D F, TANG Z R, YIN Y L, et al. Effects of dietary administering chitosan on growth performance, jejunal morphology, jejunal mucosal sIgA, occluding, claudin-1 and TLR4 expression in weaned piglets challenged by enterotoxigenic Escherichia coli[J]. International Immunopharmacology, 2013, 17(3): 670-676. DOI:10.1016/j.intimp.2013.07.023 |




