2. 上海海洋大学水产与生命学院, 上海 201306
2. College of Fisheries and Life Sciences, Shanghai Ocean University, Shanghai 201306, China
长链多不饱和脂肪酸(LC-PUFA)在调节鱼类生长性能、免疫性能、细胞膜结构、繁育性能及脂质代谢方面都具有重要意义[1-3]。在过去的研究中,大多数有关LC-PUFA对海水动物生长与生理功能的研究主要集中于n-3 LC-PUFA,特别是C22 : 6n-3(DHA)和C20 : 5n-3(EPA)[4-5]。而花生四烯酸(arachidonic acid, ARA)作为一种重要的n-6 LC-PUFA,由于同DHA和EPA相比,其在鱼类组织中不占主导地位,从而使得ARA在鱼类营养中处于被忽视的地位[6]。但是,近年来众多研究发现,ARA代谢过程中能够形成多种高生物活性的类烯酸物质,主要包括前列腺素(prostaglandins, PGs)、血栓素(thromboxane, TX)和白三烯(leukotreines, LTs)[7],这些生物活性物质在动物体内能够调节一系列重要的生理代谢,可对机体生长发育、免疫性能等方面产生重要的影响。
研究发现,饲料中ARA能够对海水动物的生长和存活具有一定的促进作用,同时会影响鱼体脂肪沉积及脂肪酸组成[8-9]。另外,ARA还能够调节鱼体的抗氧化能力及免疫功能,保证鱼体的健康[10-11]。在对大菱鲆(Scophthalmus maximus)[12]、半滑舌鳎(Cynoglossus semilaevis)[13]等的研究中均证实,ARA在调节鱼体非特异性免疫能力方面具有重要作用,同时能够增强仔稚鱼抗应激能力[14-15];在对刺参(Apostichopus japonicus)的研究中也表明ARA能够提高刺参的生长性能和抗氧化能力,以及影响体壁的脂肪酸组成[16];左然涛等[17]研究表明,适量ARA能够促进中间球海胆(Strongylocentyotus intermedius)的生长和性腺发育,同时能够影响其肠道的菌群结构。
珍珠龙胆石斑鱼(Epinephelus fuscoguttatus♀×Epinephelus lanceolatus ♂)是由龙胆石斑鱼雄性和老虎斑雌性杂交出的新品种,其生长迅速、肉质鲜美、抗病能力强,具有较高的市场价值,是广东、福建沿海一带深受欢迎的养殖品种。目前,关于珍珠龙胆石斑鱼营养方面的研究已有一些报道,主要集中在蛋白质和氨基酸营养、鱼粉替代、矿物质营养等方面[18-21],而关于脂肪酸营养方面的研究较少,同时尚未见有关珍珠龙胆石斑鱼ARA营养方面的研究报道。因此,本试验通过研究饲料中不同ARA水平对珍珠龙胆石斑鱼生长性能、抗氧化能力、血清生化指标及组织脂肪酸组成的影响,为确定ARA在珍珠龙胆石斑鱼配合饲料中的添加量提供一定的基础数据,也为初步阐述ARA对珍珠龙胆石斑鱼幼鱼机体免疫及脂肪酸代谢的影响奠定理论基础。
1 材料与方法 1.1 试验设计及试验饲料制备以鱼粉和酪蛋白为主要蛋白质源,小麦粉和α-淀粉为主要糖源,并补充矿物质、维生素和DHA纯化油(武汉嘉必优生物技术股份有限公司提供)等,配制基础饲料。在此基础上,通过调整ARA纯化油(武汉嘉必优生物技术股份有限公司提供)的添加量制成ARA水平分别为0.04%、0.17%、0.35%、0.66%、1.29%和2.16%(干物质基础)的等氮等脂的6种试验饲料(表 1),以硬脂酸甘油三酯进行调平。6种试验饲料分别命名为S1、S2、S3、S4、S5和S6,其中S1作为对照,试验饲料脂肪酸组成见表 2。所有饲料原料均粉碎过80目筛,依据试验配方,按照配比从小到大逐级均匀混合,随后加入油脂与干粉充分混匀,之后再加入适量蒸馏水再次混合均匀,混匀后的原料均匀分为2份,分别挤压制成直径为2.5和3.5 mm的2种硬颗粒饲料,50 ℃左右烘干后,置于通风干燥处备用。
|
|
表 1 试验饲料组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of experimental diets (DM basis) |
|
|
表 2 试验饲料脂肪酸组成(占总脂肪酸的百分比) Table 2 Fatty acids composition of experimental diets (percent of total fatty acids) |
|
|
表 7 饲料ARA水平对珍珠龙胆石斑鱼幼鱼肝脏脂肪酸组成的影响(占总脂肪酸的百分比) Table 7 Effects of dietary ARA level on liver fatty acid composition of juvenile hybrid grouper (percent of total fatty acids) |
|
|
表 8 饲料ARA水平对珍珠龙胆石斑鱼幼鱼肌肉脂肪酸组成的影响(占总脂肪酸的百分比) Table 8 Effects of dietary ARA level on muscle fatty acid composition of juvenile hybrid grouper (percent of total fatty acids) |
养殖试验在山东省海洋资源与环境研究院东营实验基地进行,试验用鱼为该基地当年繁育的同一批珍珠龙胆石斑鱼幼鱼,试验期为8周。首先将试验鱼放置于养殖桶中,用对照组饲料(S1)暂养15 d,使其适应养殖环境。试验开始前,将其饥饿24 h,选取规格均匀、体色健康的珍珠龙胆石斑鱼幼鱼[平均体重为(23.77±0.98) g],随机放置于18个养殖桶(直径75 cm,深度80 cm)内。每个桶内放置30尾幼鱼,每种试验饲料投喂3个养殖桶(重复),养殖方式为循环水养殖。试验期间每天在08:30和16:30各饱食投喂1次,投喂30 min后,将残饵吸出,并记录残饵数量。试验期间水温控制在(27±1) ℃,溶氧浓度>6.2 mg/L,盐度为23.5~26.5,pH 7.5~8.0,氨氮和亚硝酸氮浓度均<0.1 mg/L。
1.3 样品收集8周养殖试验结束后,将试验鱼饥饿24 h,然后对每个养殖桶中的试验鱼进行计数和称重。之后,从每个养殖桶中随机取出8尾鱼,其中3尾用于全鱼常规营养成分分析,放置于-20 ℃冰柜进行保存。将剩余5尾鱼进行解剖,分离出肝脏、肠道和肌肉等组织,放入离心管中后迅速转移到液氮中速冻。每个养殖桶另随机取5尾鱼,先采用尾部静脉取血法进行取血,取出的血液4 ℃静置4 h,3 000 r/min离心10 min,小心将血清吸出后迅速放入液氮中。每个养殖桶另随机取3尾鱼测量每尾鱼体长、体重,用于计算肥满度(CF),之后解剖取其肝脏和内脏团并称重,计算试验鱼的肝体比(HSI)和脏体比(VSI)。样品采集完成后运回实验室,放置于-80 ℃超低温冰箱中保存,用于后期试验分析。
1.4 测定指标及方法 1.4.1 生长指标存活率(SR,%)=100×终末尾数/初始尾数;
增重率(WGR,%)=100×(终末体重-初始体重)/初始体重;
特定生长率(SGR,%/d)=100×(ln终末体重-ln初始体重)/试验天数;
饲料效率(FE,%)=100×(终末体重-初始体重)/摄食饲料干重;
HSI(%)=100×试验鱼肝脏湿重/试验鱼体重;
VSI(%)=100×试验鱼内脏湿重/试验鱼体重;
CF(%)=100×试验鱼体重/试验鱼体长3 (体重单位:g,体长单位:cm)。
1.4.2 血清生化指标和肝脏抗氧化指标血清生化指标采用日立自动生化分析仪(7020型,Hitachi,日本)测定,测定指标主要包括:谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(AKP)、乳酸脱氢酶(LDH)活性及白蛋白(ALB)、甘油三酯(TG)、胆固醇(CHOL)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)含量。肝脏抗氧化指标使用南京建成生物工程研究所生产的试剂盒测定,测定指标主要包括:总抗氧化能力(T-AOC)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)活性及丙二醛(MDA)含量。
1.4.3 饲料、全鱼及组织常规营养成分分析试验样品的水分含量测定采用105 ℃烘干恒重法(GB/T 6435—2006)测定;粗蛋白质含量采用凯氏定氮法(GB/T 6432—2006)测定;粗脂肪含量采用索氏抽提法(GB/T 6433—2006)测定;粗灰分含量采用马弗炉550 ℃失重法(GB/T 6438—2007)测定。
1.4.4 饲料及组织脂肪酸组成饲料及组织的脂肪酸组成测定方法参考Mourente等[22]的气相色谱法,并稍作修改。取100 mg左右冷冻干燥后磨碎的样品,置于15 mL的顶空进样玻璃瓶中,加入1 mol/L KOH-甲醇溶液3 mL,放在75 ℃水浴中加热20 min,冷却至室温后,加入2 mol/L HCl-甲醇溶液3 mL,放在75 ℃水浴中加热20 min,冷却之后加入1.5 mL正己烷(色谱级),振荡萃取,静置分层。小心吸取上层正己烷和脂肪酸甲酯的混合物,用微量进样器吸取1 μL注入气相色谱仪(HP5890П,美国)中,采用火焰电离检测器检测。最后,根据标准脂肪酸出峰时间确定样品中脂肪酸种类,通过峰面积归一法计算各脂肪酸的相对含量。
1.5 数据统计分析试验数据用平均值±标准误(mean±SE)表示,用SPSS 19.0分析软件对试验数据进行单因素方差分析(one-way ANOVA),并用Tukey’s检验方法对试验数据进行多重比较,当P<0.05时表示具有显著性差异。以SGR和FE为判据,采用折线模型估计珍珠龙胆石斑鱼幼鱼对ARA的需求量。
2 结果 2.1 饲料ARA水平对珍珠龙胆石斑鱼幼鱼生长性能的影响由表 3可知,试验鱼的存活率介于91.11%~100.00%,不同组间无显著差异(P>0.05)。当饲料ARA水平从0.04%提高至0.66%时,试验鱼的SGR呈上升趋势,且在S4组达到最高水平,显著高于S1组(P<0.05);而当饲料ARA水平由0.66%进一步提高至2.16%时,试验鱼的SGR略有下降,但与S4组无显著差异(P>0.05),试验鱼的WGR和FE呈现同SGR相似的变化趋势。
|
|
表 3 饲料ARA水平对珍珠龙胆石斑鱼幼鱼生长性能的影响 Table 3 Effects of dietary ARA level on growth performance of juvenile hybrid grouper |
随着饲料ARA水平的升高,试验鱼的HSI呈先下降后上升的趋势,S3和S4组试验鱼的HSI显著低于其他各组(P<0.05),而S6组试验鱼的HSI显著高于其他各组(P<0.05)。试验鱼的VSI在S3组达到最低值,显著低于其他各组(P<0.05),而S5和S6组试验鱼的VSI显著高于其他各组(P<0.05)。此外,各组试验鱼的CF无显著差异(P>0.05)。
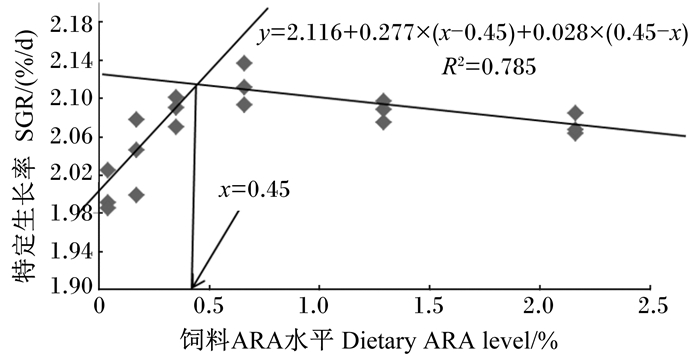
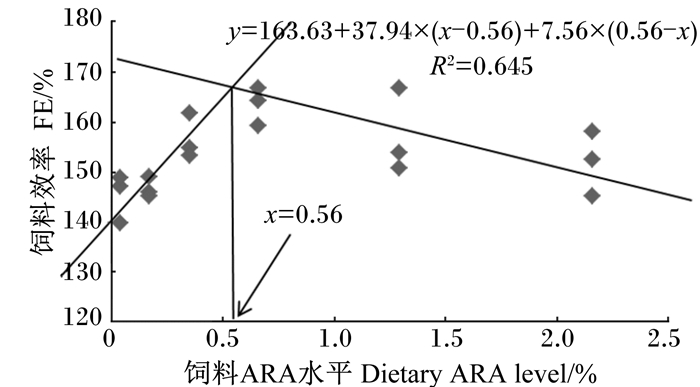
通过折线模型分析,在本试验条件下,当饲料中ARA水平为0.45%时,珍珠龙胆石斑鱼幼鱼得到最大SGR(图 1);当饲料中ARA水平为0.56%时,FE达到最大值(图 2)。
|
图 1 珍珠龙胆石斑鱼幼鱼SGR与饲料ARA水平的折线模型 Figure 1 Broken-line model of dietary ARA level and SGR of juvenile hybrid grouper |
|
图 2 珍珠龙胆石斑鱼幼鱼的FE与饲料ARA水平的折线模型 Figure 2 Broken-line model of dietary ARA level and FE of juvenile hybrid grouper |
由表 4可知,全鱼粗脂肪含量随饲料ARA水平的升高呈先降低后升高的变化,S3组全鱼粗脂肪含量最低,显著低于S5和S6组(P<0.05),而与S1、S2和S4组无显著差异(P>0.05),S6组全鱼粗脂肪含量最高,显著高于其他各组(P<0.05)。全鱼粗蛋白质含量呈现同全鱼粗脂肪含量相反的变化趋势,S3组全鱼粗蛋白质含量最高,显著高于S1、S5和S6组(P<0.05),与S2和S4组无显著差异(P>0.05)。全鱼水分和粗灰分含量各组间无显著差异(P>0.05)。
|
|
表 4 饲料ARA水平对珍珠龙胆石斑鱼幼鱼全鱼及组织常规营养成分的影响(干物质基础) Table 4 Effects of dietary ARA level on whole body and tissue common nutrition components of juvenile hybrid grouper (DM basis) |
当饲料ARA水平由0.04%升至0.35%时,肝脏粗脂肪含量从28.21%降低到20.43%,之后随着饲料ARA水平由0.35%进一步提高到2.16%,肝脏粗脂肪含量又从20.43%升高到29.01%,表现为S3组肝脏粗脂肪含量显著低于S1、S5和S6组(P<0.05),与S2和S4组无显著差异(P>0.05)。随着饲料ARA水平由0.04%升至2.16%,试验鱼肌肉粗脂肪含量从2.62%升高到3.66%,在S6组达到最大值,显著高于S1、S2和S3组(P<0.05)。
2.3 饲料ARA水平对珍珠龙胆石斑鱼幼鱼肝脏抗氧化指标的影响由表 5可知,肝脏中SOD活性随饲料ARA水平的升高呈先降低后升高趋势,其中S3和S4组显著高于其他各组(P<0.05),而S3和S4组间无显著差异(P>0.05);同时,肝脏中CAT活性和T-AOC均在S4组达到最高值,其中T-AOC显著高于S1、S2、S5和S6组(P<0.05),CAT活性显著高于S1、S2和S6组(P<0.05)。当饲料ARA水平从0.04%提升到0.66%时,肝脏中MDA含量显著降低(P<0.05),而当饲料ARA水平由0.66%进一步升高至2.16%时,肝脏中MDA含量呈显著上升(P<0.05),且在S6组达到最大值,显著高于S3、S4和S5组(P<0.05),同S1和S2组无显著差异(P>0.05)。
|
|
表 5 饲料ARA水平对珍珠龙胆石斑鱼幼鱼肝脏抗氧化指标的影响 Table 5 Effects of dietary ARA level on antioxidant indices in liver of juvenile hybrid grouper |
由表 6可知,随着饲料ARA水平的升高,血清中ALT活性表现出先降低后升高的趋势,并且S3和S4组血清中ALT活性显著低于S1和S6组(P<0.05),同时血清中AST、AKP和LDH的活性均表现出同血清中ALT活性相似的变化趋势。
|
|
表 6 饲料ARA水平对珍珠龙胆石斑鱼幼鱼血清生化指标的影响 Table 6 Effects of dietary ARA level on serum biochemical parameters of juvenile hybrid grouper |
血清中TG含量随饲料ARA水平的升高呈先降低后升高的趋势,在饲料ARA水平为0.35%~0.66%时,血清中TG含量处于相对较低水平,而饲料ARA水平进一步升高至2.16%时,血清中TG含量达到最高,显著高于其他各组(P<0.05)。血清中CHOL含量随饲料ARA水平的升高呈逐渐增加的趋势,也在饲料ARA水平为2.16%时达到最高,显著高于S1组(P<0.05),而与其他组无显著差异(P>0.05)。同时,血清中HDL-C含量在S3和S4组处于较高水平,显著高于S1和S6组(P<0.05),而与S3和S4组无显著差异(P> 0.05)。血清中LDL-C含量呈现同血清中HDL-C含量相反的变化趋势。
2.5 饲料ARA水平对珍珠龙胆石斑鱼幼鱼肝脏和肌肉脂肪酸组成的影响由表 7、表 8可知,随着饲料ARA水平的升高,试验鱼肝脏和肌肉中C20 : 3n-6、C20 : 4n-6和n-6 PUFA含量显著升高(P<0.05),而C18 : 1n-9、C18 : 1n-7、C18 : 3n-6、C20 : 5n-3、C22 : 6n-3含量则有不同程度下降,但C14 : 0、C16 : 0含量在不同组间无显著差异(P>0.05)。另外,肌肉中C18 : 0和C18 : 3n-3含量随着饲料ARA水平的升高呈下降趋势,S6组显著低于S1和S2组(P<0.05),而肝脏中C18 : 0和C18 : 3n-3含量却均无显著变化(P>0.05)。随着饲料ARA水平的升高,肝脏中C18 : 2n-6含量呈升高趋势,S5、S6组显著低于S1和S2组(P<0.05),而肌肉中C18 : 2n-6含量却无显著变化(P>0.05)。
3 讨论 3.1 饲料ARA水平对珍珠龙胆石斑鱼幼鱼生长性能的影响本研究中,饲料中适宜水平(0.35%~0.66%)的ARA对珍珠龙胆石斑鱼幼鱼的WGR、SGR与FE均能产生一定的促进作用,这表明珍珠龙胆石斑鱼幼鱼需要一定量的ARA来维持正常生长与生理功能。这同先前在其他鱼类上的研究结果相近,如Xu等[6]在鲈鱼(Lateolabrax japonicus)幼鱼中的研究表明,当饲料中ARA水平为0.36%~0.56%时,鲈鱼幼鱼的生长效果最佳;Furuita等[23]研究报道,牙鲆(Paralichthys olivaceus)亲鱼对ARA的最适需求量为0.6%;王成强等[9]研究表明,以SGR和FE为评定指标时,大规格鲈鱼[(207.16±0.72) g]对ARA的需求量均为0.37%。另外,在牙鲆仔稚鱼[24]、欧洲鲈鱼(Dicentrarchus labrax)稚鱼[25]和半滑舌鳎稚鱼[26]上的研究均表明海水仔稚鱼对ARA具有更高的需求量。同时,也有学者报道了饲料中ARA并不能对鱼类的生长产生显著的促进作用[8, 27]。这些研究结果的差异可能与养殖鱼种及规格、养殖环境、研究方法等有关。
本研究发现饲料ARA水平对珍珠龙胆石斑鱼幼鱼生长的影响呈现剂量效应,中等水平(0.66%)ARA可使珍珠龙胆石斑鱼幼鱼获得最佳的生长性能,ARA水平过高或缺乏时均影响珍珠龙胆石斑鱼幼鱼的生长。在对鲈鱼[6, 9]、大菱鲆[28]等的研究中也发现了类似的结果。这一系列研究均表明,饲料中ARA水平过高可能会对机体的发育产生抑制作用,产生这种抑制的原因可能是因为饲料中过多的ARA抑制了体内EPA的生物转化,而且DHA与EPA比例的不平衡不仅会影响鱼体的正常生长,同时也可能会掩盖ARA对鱼体的营养作用[23]。
通过分析形体指标发现,随饲料ARA水平升高,珍珠龙胆石斑鱼幼鱼HSI与VSI均在S6组达到最大值,显著高于其他各组。这一结果表明,饲料中过高的ARA水平,一方面可能会导致鱼体肝脏受到一定损伤,肝脏代谢受限;另一方面可能导致鱼体无法完全吸收ARA,使其在机体中沉积,导致机体脂肪含量过高[12, 29]。同时,在鲈鱼[6, 9]以及军曹鱼(Rachycentron canadum)[30]的试验中,也得到了类似的研究结果。
3.2 饲料ARA水平对珍珠龙胆石斑鱼幼全鱼及组织常规营养成分的影响本试验中珍珠龙胆石斑鱼幼鱼全鱼和肝脏中粗脂肪含量均在S3组最低,显著低于S5和S6组,另外,S3组幼鱼肝脏粗脂肪含量显著低于S1组。这说明适量的ARA能够有效降低鱼体和肝脏中粗脂肪含量,但具体调控机理有待于进一步研究。这与王成强等[29]在鲈鱼中的研究结果相一致,其研究表明,当饲料中ARA水平在1.38%~2.32%时,鲈鱼肝脏脂肪氧化相关基因[过氧化物酶体增殖剂激活受体-α(PPAR-α)和肉碱棕榈酸转移酶-Ⅰ(CPT-Ⅰ)]表达量显著降低,鲈鱼全鱼和肝脏中粗脂肪含量显著升高,而当饲料中ARA水平在0.37%~0.60%时,鲈鱼全鱼和肝脏中粗脂肪含量较低。另外,Tian等[8]研究报道,草鱼鱼体粗脂肪含量在饲料ARA水平为0.30%时最低,显著低于饲料ARA水平为0.03%和0.60%时。由此可以推测,饲料中适量的ARA能够降低机体及组织中粗脂肪含量,而ARA过量或不足均能影响机体及组织中脂肪的正常代谢,造成脂肪沉积过多。
3.3 饲料ARA水平对珍珠龙胆石斑鱼幼鱼抗氧化能力的影响研究证实,饲料中适量的ARA对鱼体的抗氧化能力具有一定的增强作用,肝脏作为机体最主要的代谢器官,其抗氧化能力可以间接反映鱼体本身的抗氧化水平[31]。机体的抗氧化能力主要包括与抗氧化能力密切相关的酶的活性和衡量受损伤程度的代谢产物的含量2个方面,前者主要是反映机体抗氧化系统功能的综合水平,主要包括T-AOC、SOD等;后者主要是反映机体细胞受自由基攻击的严重程度,主要包括MDA等[32-33]。本研究中,肝脏中T-AOC以及SOD和CAT活性均在S4组达到最高,显著高于S1与S6组;另外,肝脏中MDA含量却在S4组最低,显著低于S1与S6组。由此说明饲料中适宜水平(0.35%~0.66%)的ARA也能对珍珠龙胆石斑鱼幼鱼肝脏抗氧化能力起到一定的促进作用,进一步证实了ARA对鱼体抗氧化能力的调节功能;同时,这也表明机体抗氧化能力与饲料ARA水平同样遵循剂量效应,饲料中ARA水平过高或过低均能降低机体抗氧化能力并损害肝脏健康,这同在大菱鲆[28]、鲈鱼[6, 29]和刺参[16]上的研究结果相似。
3.4 饲料ARA水平对珍珠龙胆石斑鱼幼鱼血清生化指标的影响正常情况下血清中AST和ALT的活性很低,但当肝脏细胞受损或通透性改变后,血清AST和ALT的活性就会升高,因此这2个指标可以用来反映肝脏的受损情况,从而能够可以间接反映机体健康状况[34-35]。本研究结果显示,S3和S4组珍珠龙胆石斑鱼幼鱼血清中AST和ALT活性显著低于S1和S6组,这说明饲料中适宜水平的ARA可能有利于试验鱼的肝脏健康。这与之前在大菱鲆[28]和草鱼[8]等上的研究结果相一致。此外,AKP是生物体内碱性环境下水解磷酸酯的一组重要代谢调控酶,在机体非特异性免疫反应中发挥重要作用[36]。本试验结果显示,随饲料中ARA水平的变化,血清中AKP活性呈现同血清中AST和ALT活性相似的变化趋势,这也说明当饲料ARA水平在0.35%~0.66%时能够提高机体的非特异性免疫能力。大多研究认为ARA影响机体免疫机制主要是因为其能够影响类二十烷酸的产生,以ARA为前体生成的类二十烷酸,主要是2-系列前列腺素和4-系列白细胞三烯,其在调节免疫细胞功能方面起着重要的作用[37]。另外,有研究表明ARA代谢衍生物前列腺F2a能够促进肌原纤维的形成,可以限制肌肉组织的降解,而前列腺E2则具有相反的作用[38]。由此可以推测,ARA之所以能够影响机体免疫能力,可能主要是因为不同水平的ARA能导致体内代谢衍生物含量不同或前列腺E2与前列腺F2a比例不同,从而对机体的免疫机制起到不同的调控作用。同时,Li等[39]通过体外细胞培养试验表明,ARA能够显著影响大黄鱼头肾巨噬细胞的免疫及生理活性。
已有研究报道,饲料中的n-3 PUFA能够降低肝脏中极低密度脂蛋白的分泌,增加乳糜颗粒的代谢和清除,从而降低血清中TG的含量[40-41];而过高的n-6 PUFA容易引发机体炎症,造成肝脏功能受损[42],从而容易导致血清中血脂代谢紊乱,TG和LDL-C含量较高。本研究发现,血清中TG、CHOL和LDL-C含量均在S6组(ARA水平最高组)达到最高值,这可能也暗示高水平的ARA可能会对珍珠龙胆石斑鱼幼鱼的肝脏代谢产生较大负担,容易引起鱼体脂质代谢紊乱,因而影响了血脂的代谢与存储。HDL-C是血浆中胆固醇运回肝脏一种方式,血清中HDL-C含量越高机体将胆固醇运回肝脏中的能力越强,机体心血管越健康。值得注意的是,本试验中S3和S4组试验鱼血清HDL-C含量显著高于S1和S6组,从而也证明S3和S4组试验鱼机体健康处于较佳水平。结合上述试验鱼全鱼和肝脏中粗脂肪含量的研究结果,可以推测饲料中适宜水平的ARA可能对鱼体的脂质代谢起到积极的作用,而过高或过低的ARA水平可能影响鱼体及组织中脂质的正常代谢,造成脂肪沉积过多,其相关的调控机制有待于进一步深入研究。
3.5 饲料ARA水平对珍珠龙胆石斑鱼幼鱼组织脂肪酸组成的影响一系列研究表明,鱼体及组织脂肪酸组成受到饲料脂肪酸组成的影响,本研究试验结果也得到了相一致的结论。本试验中,肝脏和肌肉中n-6 PUFA(C18 : 2n-6、C18 : 3n-6、C20 : 3n-6和C20 : 4n-6)含量反映了其在饲料中的相应变化,而肌肉中C18 : 2n-6含量变化趋势不明显,这可能与C18 : 2n-6在机体中沉积率比较低有关。而肝脏和肌肉中饱和脂肪酸(SFA)和单不饱和脂肪酸(MUFA)却呈现同饲料组不同的变化趋势,这可能是因为鱼体内的PUFA具有优先保存的优势,而SFA和MUFA则被优先利用[43]。同时,肝脏和肌肉中EPA含量均与ARA含量呈相反的变化趋势,这同在半滑舌鳎[26]、鲈鱼[6]以及大菱鲆[28]中的研究结果相似。这可能是由于EPA和ARA本身存在相互竞争的关系,而高含量的ARA能在一定程度上抑制EPA竞争融入机体组织的能力[41]。
4 结论综上所述,在本试验条件下,饲料中适宜水平(0.35%~0.66%)的ARA能够促进珍珠龙胆石斑鱼幼鱼的生长,提高抗氧化能力与肝脏健康水平。以SGR与FE作为评价指标,经折线模型回归分析得出珍珠龙胆石斑鱼幼鱼饲料中ARA的适宜水平分别为饲料干重的0.45%和0.56%。
| [1] |
HIGGS D A, DONG F M.Lipids and Fatty Acids[C]//STICKNEY R R.The encyclopedia of aquaculture.New York: JohnWiley and Sons, 2000: 476-496.
|
| [2] |
KIRON V, THAWONSUWAN J, PANIGRAHI A, et al. Antioxidant and immune defences of rainbow trout (Oncorhynchus mykiss) offered plant oils differing in fatty acid profiles from early stages[J]. Aquaculture Nutrition, 2011, 17(2): 130-140. DOI:10.1111/anu.2011.17.issue-2 |
| [3] |
GILL R, T SUNG A, BILLIAR T. Linking oxidative stress to inflammation:Toll-like receptors[J]. Free Radical Biology and Medicine, 2010, 48(9): 1121-1132. DOI:10.1016/j.freeradbiomed.2010.01.006 |
| [4] |
SKALLI A, ROBIN J H. Requirement of n-3 long chain polyunsaturated fatty acids for European sea bass (Dicentrarchus labrax) juveniles:growth and fatty acid composition[J]. Aquaculture, 2004, 240(1/2/3/4): 399-415. |
| [5] |
ZUO R T, AI Q H, MAI K S, et al. Effects of dietary n-3 highly unsaturated fatty acids on growth, nonspecific immunity, expression of some immune related genes and disease resistance of large yellow croaker (Larmichthys crocea) following natural infestation of parasites (Cryptocaryon irritans)[J]. Fish & Shellfish Immunol, 2012, 32: 249-258. |
| [6] |
XU H G, AI Q H, MAI K S, et al. Effects of dietary arachidonic acid on growth performance, survival, immune response and tissue fatty acid composition of juvenile Japanese seabass, Lateolabrax japonicus[J]. Aquaculture, 2010, 307(1/2): 75-82. |
| [7] |
TANG D G, CHEN Y Q, HONN K V. Arachidonate lipoxygenases as essential regulators of cell survival and apoptosis[J]. Proceedings of the National Academy of Sciences of the United States of America, 1996, 93: 5241-5252. DOI:10.1073/pnas.93.11.5241 |
| [8] |
TIAN J J, JI H, OKU H, et al. Effects of dietary arachidonic acid (ARA) on lipid metabolism and health status of juvenile grass carp, Ctenopharyngodon idellus[J]. Aquaculture, 2014, 430: 57-65. DOI:10.1016/j.aquaculture.2014.03.020 |
| [9] |
王成强, 梁萌青, 徐后国, 等. 大规格鲈鱼(Lateolabrax japonicas)对饲料中花生四烯酸的需求量[J]. 渔业科学进展, 2016, 37(5): 46-55. |
| [10] |
KHOZIN-GOLDBERG I, COHEN Z, Pimenta-Leibowitz M, et al. Feeding with arachidonic acid-rich triacylglycerols from the microalga Parietochloris incisa improved recovery of guppies from infection with Tetrahymena sp[J]. Aquaculture, 2006, 255(1/2/3/4): 142-150. |
| [11] |
ATALAH E, HERNÁNDEZ-CRUZ C M, GANUZA E, et al. Importance of dietary arachidonic acid for the growth, survival and stress resistance of larval European seabass (Dicentrarchus labrax) fed high dietary docosahexaenoic and eicosapentaenoic acids[J]. Aquacuture Research, 2011, 42(9): 1261-1268. |
| [12] |
张圆琴, 徐后国, 曹林, 等. 饲料中花生四烯酸对发育前期大菱鲆亲鱼性类固醇激素合成的影响[J]. 水产学报, 2017, 41(4): 588-601. |
| [13] |
XU H G, CAO L, ZHANG Y Q, et al. Dietary arachidonic acid differentially regulates the gonadal steroidogenesis in the marine teleost, tongue sole (Cynoglossus semilaevis), depending on fish gender and maturation stage[J]. Aquaculture, 2017, 468: 378-385. DOI:10.1016/j.aquaculture.2016.11.002 |
| [14] |
MATINS D A, ROCHA F, CASTANHEIRA F, et al. Effects of dietary arachidonic acid on cortisol production and gene expression in stress response in Senegalese solo (Solea senegalensis) post-larvae[J]. Fish physiology and biochemistry, 2013, 39(5): 1223-1238. DOI:10.1007/s10695-013-9778-6 |
| [15] |
MARTINS D A, ENGROLA S, MORAIS S, et al. Cortisol response to air exposure in Solea senegalensis post-larvae is affected by dietary arachidonic acid-to-eicosapentaenoic acid ratio[J]. Fish physiology and biochemistry, 2011, 37(4): 733-743. DOI:10.1007/s10695-011-9473-4 |
| [16] |
王成强, 李宝山, 王际英, 等. 饲料中花生四烯酸含量对刺参生长性能、抗氧化能力及脂肪酸代谢的影响[J]. 中国水产科学, 2018, 25(3): 555-566. |
| [17] |
左然涛, 李敏, 吴反修, 等.饲料中花生四烯酸对中间球海胆生长性能、性腺指数和肠道菌群组成的影响[C]//第十一届世界华人鱼虾营养学术研讨会摘要集.湖州: 中国水产学会, 2017.
|
| [18] |
RAHIMNEJAD S, BANG I C, PARK J Y, et al. Effects of dietary protein and lipid levels on growth performance, feed utilization and body composition of juvenile hybrid grouper (Epinephelus fuscoguttatus×E. lanceolatus)[J]. Aquaculture, 2015, 446: 283-289. DOI:10.1016/j.aquaculture.2015.05.019 |
| [19] |
刘云, 王际英, 李宝山, 等. 蛋氨酸钴对珍珠龙胆石斑鱼幼鱼生长、矿物元素沉积及肝脏酶活力的影响[J]. 中国水产科学, 2016, 23(3): 574-583. |
| [20] |
魏佳丽, 王际英, 宋志东, 等. 酶解磷虾粉替代鱼粉对珍珠龙胆石斑鱼幼鱼生长性能、体组成及血清生化的影响[J]. 渔业科学进展, 2016, 37(1): 100-110. |
| [21] |
曹伏君, 陈思, 梁华芳, 等. 不同饲料对珍珠龙胆石斑幼鱼生长性能的影响[J]. 水产科技情报, 2016, 43(2): 66-71. |
| [22] |
MOURENTE G, DICK J R, BELL J G, et al. Effect of partial substitution of dietary fish oil by vegetable oils on desaturation and β-oxidation of[1-14C]18:3n-3(LNA) and[1-14C]20:5n-3(EPA) in hepatocytes and enterocytes of European seabass (Dicentrarchus labrax L.)[J]. Aquaculture, 2005, 248(1/2/3/4): 173-186. |
| [23] |
FURUITA H, YAMAMOTO T, SHIMA T, et al. Effect of arachidonic acid levels in broodstock diet on larval and egg quality of Japanese flounder Paralichthys olivaceus[J]. Aquaculture, 2003, 220(1/2/3/4): 725-735. |
| [24] |
刘镜恪, 陈晓琳, 李岿然, 等. 实验微粒饲料中花生四烯酸含量对牙鲆(Paralichthys olivaceus)仔稚鱼生长、存活的影响[J]. 海洋与湖沼, 2005, 36(5): 518-522. |
| [25] |
TORRENCILLAS S, ROMÁN L, RIVERO-RAMÍREZ F, et al. Supplementation of arachidonic acid rich oil in European sea bass juveniles (Dicentrarchus labrax) diets:effects on leucocytes and plasma fatty acid profiles, selected immune parameters and circulating prostaglandins levels[J]. Fish & Shellfish Immunology, 2017, 64: 437-445. |
| [26] |
YUAN Y H, LI S L, MAI K S, et al. The effect of dietary arachidonic acid (ARA) on growth performance, fatty acid composition and ARA metabolism-related genes expression in larval half-smooth tongue sole (Cynoglossus semilaevis)[J]. British Journal of Nutrition, 2015, 113(10): 1518-1530. DOI:10.1017/S0007114515000781 |
| [27] |
ASIL S M, KENARI A A, MIYANJI G R, et al. The influence of dietary arachidonic acid on growth, reproductive performance, and fatty acid composition of ovary, egg and larvae in an anabantid model fish, Blue gourami (Trichopodus trichopterus; Pallas, 1770)[J]. Aquaculture, 2017, 476: 8-18. DOI:10.1016/j.aquaculture.2017.03.048 |
| [28] |
谭青.n-3/n-6HUFA对大菱鲆幼鱼生长、体组成、脂肪酸成分及免疫的影响[D].硕士学位论文.上海: 上海海洋大学, 2017: 30-32.
|
| [29] |
王成强.饲料花生四烯酸、亚麻酸含量及亚麻酸/亚油酸比值对大规格鲈鱼生长性能、脂肪酸组成和脂肪沉积的影响[D].硕士学位论文.上海: 上海海洋大学, 2016: 21-28.
|
| [30] |
刘亮.军曹鱼幼鱼对花生四烯酸的需求与调控[D].硕士学位论文.汕头: 汕头大学, 2008: 10-15.
|
| [31] |
WINSTON G W, DI R T, GIULIO R T, et al. Prooxidant and antioxidant mechanisms in aquatic organisms[J]. Aquatic Toxicolology, 1991, 19(2): 137-161. DOI:10.1016/0166-445X(91)90033-6 |
| [32] |
FANG Y Z, YANG S, WU G Y. Free radicals, antioxidants and nutrition[J]. Nutrition, 2002, 18(10): 872-879. DOI:10.1016/S0899-9007(02)00916-4 |
| [33] |
VALKO M, RHODES C J, MONCOLA J M, et al. Free radicals, metals and antioxidants in oxidative stress-induced cancer[J]. Chemico-Biological Interactions, 2006, 160(1): 1-40. DOI:10.1016/j.cbi.2005.12.009 |
| [34] |
SONG Z D, LI P Y, WANG J Y, et al. Effects of fishmeal replacement with soy protein hydrolysates on growth performance, blood biochemistry, gastrointestinal digestion and muscle composition of juvenile starry flounder (Platichthys stellatus)[J]. Aquaculture, 2014, 426-427: 96-104. DOI:10.1016/j.aquaculture.2014.01.002 |
| [35] |
WANG L N, LIU W B, LU K L, et al. Effects of dietary carbohydrate/lipid ratios on non-specific immune responses, oxidative status and liver histology of juvenile yellow catfish Pelteobagrus fulvidraco[J]. Aquaculture, 2014, 426: 41-48. |
| [36] |
章龙珍, 朱卫, 王妤, 等. 饲料脂肪水平对点篮子鱼消化酶活性和血液主要生化指标的影响[J]. 海洋渔业, 2014, 36(2): 170-176. DOI:10.3969/j.issn.1004-2490.2014.02.011 |
| [37] |
ROWLEY A F, KNIGHT J, LLOYD-EVANS P, et al. Eicosanoids and their role in immune modulation in fish-a brief overview[J]. Fish & Shellfish Immunology, 1995, 5(8): 549-567. |
| [38] |
PALMER R M. Prostaglandins and the control of muscle protein synthesis and degradation[J]. Prostaglandins, Leukotrienes and Essential Fatty Acids, 1990, 39(2): 95-104. DOI:10.1016/0952-3278(90)90017-F |
| [39] |
LI Q F, AI Q H, MAI K S, et al. In vitro effects of arachidonic acid on immune functions od head kidney macrophages isolated from large yellow croaker (Larmichthys crocea)[J]. Aquaculture, 2012, 330-333: 47-53. DOI:10.1016/j.aquaculture.2011.11.045 |
| [40] |
DAVIDSON M H. Mechanisms for the hypotriglyceridemic effect of marine omega-3 fatty acids[J]. The American journal of cardiology, 2006, 98(Suppl.1): 27-33. |
| [41] |
SHEARER G C, SAVINOVA O V, HARRIS W S. Fish oil-How does it reduce plasma triglycerides[J]. Biochimica et Biophysica Acta:Molecular and Cell Biology of Lipids, 2012, 1821(5): 843-851. DOI:10.1016/j.bbalip.2011.10.011 |
| [42] |
ZUO R T, AI Q H, MAI K S, et al. Effects of conjugated linoleic acid on growth, non-specific immunity, antioxidant capacity, lipid deposition and related gene expression in juvenile large yellow croaker (Larmichthys crocea) fed soybean oil-based diets[J]. British Journal of Nutrition, 2013, 110(7): 1220-1232. DOI:10.1017/S0007114513000378 |
| [43] |
FALK-PETERSEN S, SARGENT J R, FOX C, et al. Lipids in atlantic halibut (Hippoglossus hippoglossus) eggs from planktonic samples in Northern Norway[J]. Marine biology, 1898, 101(4): 553-556. |




