炎症是人和动物常见的病理过程,并出现红、肿、热、痛、痒等典型症状。在炎症发生过程中,致炎因素导致的组织损伤和机体启动的抗损伤之间的优势对比决定着炎症的发展方向和结局[1]。炎症发生后,一般采用传统的抗炎药物进行治疗,虽然这些药物的抗炎效果较好,但是副作用也较大,因此,研发安全无副作用的替代品成为了新的热点。病原微生物引起的炎症过程中,致使单核巨噬细胞产生不同程度的增生。巨噬细胞是主要的炎性细胞,当其受到外界抗原刺激时会释放白介素(IL)-6、肿瘤坏死因子-α(TNF-α)等一系列炎性细胞因子,从而促进炎症反应和组织损伤[2]。局部炎症反应也会影响到整个机体,从而产生不同程度的全身性反应,但机体本身的状态能够制约局部炎症的发生和发展[3]。所以,巨噬细胞对维持机体内环境稳定,维持机体免疫、抗炎等方面有着重要作用[4]。沙葱,属百合科、葱属,学名蒙古韭,具有药用价值和功效[5]。沙葱提取物含有酮类、醛类、糖类等多种活性物质,其中黄酮类化合物是重要的成分之一[6]。黄酮类化合物是一类重要的含氧杂环天然有机化合物,并具有抗氧化、抗菌消炎、抗病毒、抗癌等作用[7-9]。所以,本研究以脂多糖(LPS)诱导的小鼠腹腔巨噬细胞为炎症模型,探讨沙葱总黄酮的抗炎效果,为沙葱黄酮类化合物的进一步开发和利用提供科学依据。
1 材料与方法 1.1 试验动物6~8周龄的C57BL/6J雄性小鼠,购自内蒙古医科大学实验动物中心。
1.2 药物及试剂沙葱总黄酮[由本实验室自己提取制备,提取率为(12.85±0.03) mg/g[10]]、液体硫乙醇酸盐培养基(7017946,BD)、LPS(L2880,Sigma)、胎牛血清(FBS,FND500,ExCell Bio)、RPMI-1640培养基(C11875500BT,Gibco)、CCK-8(ck04,东仁化学科技有限公司)、二甲基亚砜(DMSO,D8371,Solarbio)、一氧化氮(NO)试剂盒(G2930,Promega)、RNA提取试剂盒(Axygen)、反转录试剂盒(RR047A,TaKaRa)、PCR试剂盒(RR820A,TaKaRa)、TNF-α酶联免疫吸附试验(ELISA)试剂盒(430904,Biolegend)、IL-6 ELISA试剂盒(431304,Biolegend)、IL-10 ELISA试剂盒(88-7105,Invitrogen)、IL-1β ELISA试剂盒(432604,Biolegend)。
1.3 试验仪器SynergyHT酶标仪(美国伯腾仪器有限公司)、IX51倒置显微镜(奥林巴斯科技有限公司)、Roche480 PCR仪(罗氏诊断产品有限公司)、恒温培养箱(赛默飞世尔科技有限公司)、低温离心机(上海铺泽商贸有限公司)。
1.4 小鼠腹腔巨噬细胞的培养取6~8周龄的C57BL/6J雄性小鼠,向其腹腔内注射3%的液体硫乙醇酸盐培养基(TG) 2 mL,刺激72 h,脱颈法处死,于75%乙醇中浸泡2~3 min,在无菌超净台里暴露小鼠腹腔,用预冷磷酸盐缓冲液(PBS)冲洗3次,每次5 mL,收集灌洗液,将灌洗液在5 000 r/min、4 ℃条件下离心3 min,弃上清,用含10% FBS的RPMI-1640培养基重悬细胞,加入培养板中,在37 ℃、5% CO2的培养箱中进行培养[11-12]。
1.5 指标测定 1.5.1 CCK-8法测定细胞增殖率将细胞以4×104个/孔接种于96孔板,贴壁2 h后,对照组添加含有0.1% DMSO的完全培养基[13],各沙葱总黄酮组加入不同浓度的沙葱总黄酮溶液,使其终浓度分别为12.5、25.0、50.0、100.0、200.0 μg/mL,分别培养24 h,再加入100 μL含10% CCK-8溶液的完全培养基,继续培养2 h后,在450 nm波长处测定吸光度(OD)值。
1.5.2 Griess法测定细胞上清液中NO含量将细胞以2.5×105个/孔接种于24孔板,贴壁2 h后,用预冷的PBS洗涤细胞2次,分为对照组、LPS组(应激模型组,1 μg/mL LPS)[14-16]、沙葱总黄酮低剂量组(25 μg/mL沙葱总黄酮+1 μg/mL LPS)、沙葱总黄酮中剂量组(50 μg/mL沙葱总黄酮+1 μg/mL LPS)、沙葱总黄酮高剂量组(100 μg/mL沙葱总黄酮+1 μg/mL LPS)。对照组添加含有0.1% DMSO的完全培养基,LPS组添加终浓度为1 μg/mL的LPS,各沙葱总黄酮组先用不同浓度沙葱总黄酮溶液对细胞预处理1 h后再添加1 μg/mL的LPS共同处理24 h。收集细胞上清液,用Griees法测定NO含量。
1.5.3 逆转录聚合酶链式反应(RT-PCR)法测定细胞中TNF-α、IL-10、IL-1β、IL-6、一氧化氮合酶(iNOS) mRNA表达将细胞以2.5×106个/孔接种于6孔细胞培养板,分组同上,培养2 h后将培养板里的培养基弃掉,用预冷的PBS洗涤细胞2次,对照组添加含有0.1% DMSO的完全培养基,LPS组添加终浓度为1 μg/mL的LPS,各沙葱总黄酮组先用不同浓度沙葱总黄酮溶液对细胞预处理1 h后再添加1 μg/mL的LPS共同处理4及12 h。培养4及12 h后,弃掉细胞上清,用预冷的PBS洗涤细胞,添加细胞裂解液,反复吹打细胞,1.5 mL EP管收集细胞,提取细胞总RNA。按照逆转录试剂盒说明书所述方法制备cDNA,通过特异性引物对细胞中TNF-α、IL-10、IL-1β、IL-6、iNOS及其内参β-肌动蛋白(β-actin)进行扩增,基因引物序列见表 1。本试验RT-PCR采用20 μL试验体系,其中无酶水6.4 μL, 染料10 μL, 上、下游引物各0.8 μL及逆转录反应产物2 μL。
|
|
表 1 基因引物序列 Table 1 The primer sequences of genes |
将细胞以2.5×106个/孔接种于6孔培养板,分组同上,贴壁2 h后用预冷PBS洗涤细胞2次,对照组添加含有0.1% DMSO的完全培养基,各沙葱总黄酮组先用不同浓度沙葱总黄酮溶液对细胞预处理1 h后再添加1 μg/mL的LPS共同处理24 h,收集细胞上清液。试验方法按ELISA试剂盒说明书进行操作,在450 nm波长处测定OD值。
1.6 数据统计与分析试验数据以平均值±标准误表示,应用SAS 9.0软件对试验数据进行统计学分析。组间比较采用单因素方差分析,P < 0.05为差异显著,P>0.05为差异不显著。
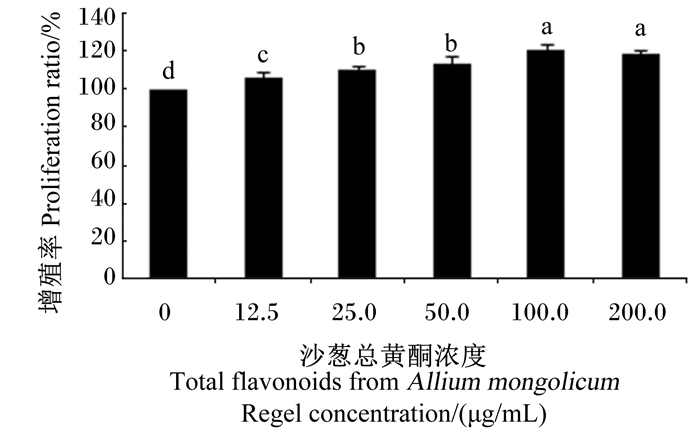
2 结果 2.1 沙葱总黄酮对小鼠腹腔巨噬细胞增殖率的影响如图 1所示,与对照组(0 μg/mL)相比,12.5~200.0 μg/mL浓度的沙葱总黄酮均可显著提高小鼠腹腔巨噬细胞的增殖率(P < 0.05),在12.5~100.0 μg/mL浓度,随着沙葱总黄酮浓度的增加细胞增值率也逐渐上升,当添加浓度为200.0 μg/mL时,细胞增殖率呈现下降趋势,因此在后续的试验中,将沙葱总黄酮的添加浓度确定为25.0~100.0 μg/mL。
|
数据柱标注不同字母表示差异显著(P < 0.05)。图 2~图 7同。 Data bars with different letters mean significant difference (P < 0.05). The same as Fig. 2 to Fig. 7. 图 1 沙葱总黄酮对小鼠腹腔巨噬细胞增殖率的影响 Figure 1 Effects of total flavonoids from Allium mongolicum Regel on proliferation ratio of mouse peritoneal macrophages |
|
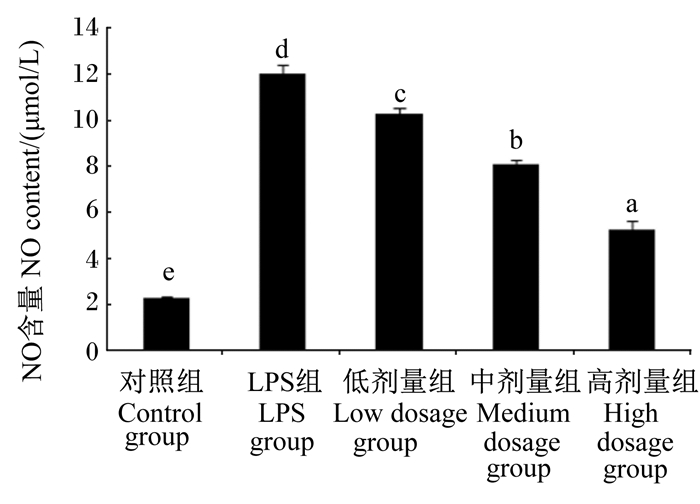
图 2 沙葱总黄酮对小鼠腹腔巨噬细胞上清液中NO含量的影响 Figure 2 Effects of total flavonoids from Allium mongolicum Regel on NO content in the supernatant of mouse peritoneal macrophages |
|
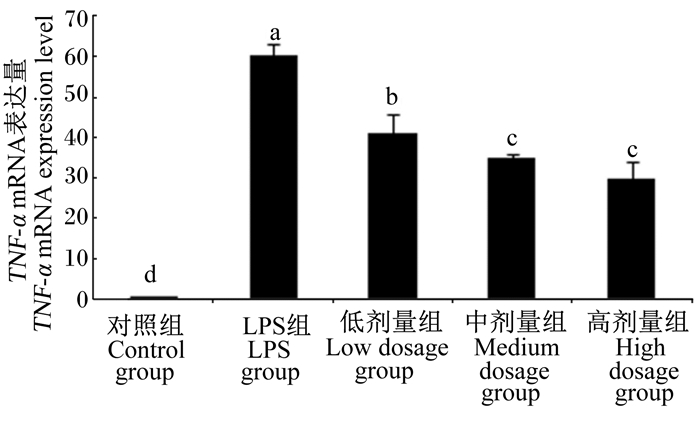
图 3 沙葱总黄酮对小鼠腹腔巨噬细胞TNF-α mRNA表达的影响 Figure 3 Effects of total flavonoids from Allium mongolicum Regel on TNF-α mRNA expression of mouse peritoneal macrophages |
|
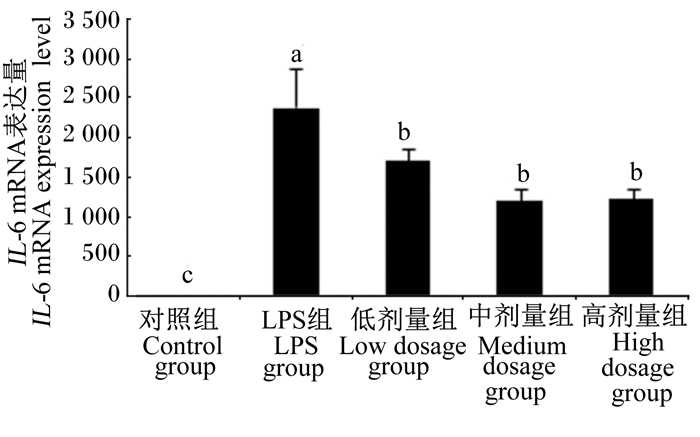
图 4 沙葱总黄酮对小鼠腹腔巨噬细胞IL-6 mRNA表达的影响 Figure 4 Effects of total flavonoids from Allium mongolicum Regel on the IL-6 mRNA expression of mouse peritoneal macrophages |
|
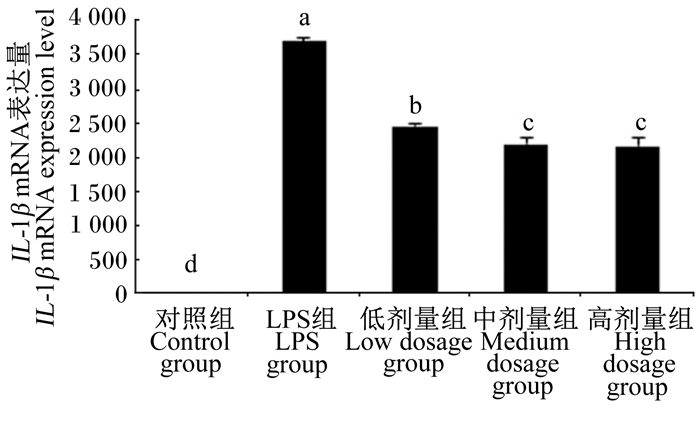
图 5 沙葱总黄酮对小鼠腹腔巨噬细胞IL-1β mRNA表达的影响 Figure 5 Effects of total flavonoids from Allium mongolicum Regel on IL-1β mRNA expression of mouse peritoneal macrophages |
|
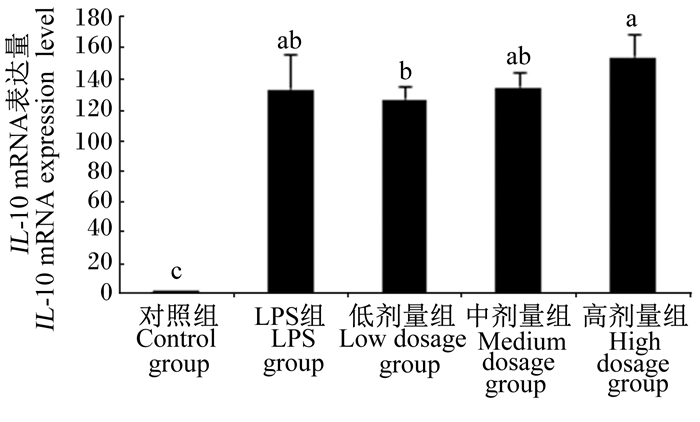
图 6 沙葱总黄酮对小鼠腹腔巨噬细胞IL-10 mRNA表达的影响 Figure 6 Effects of total flavonoids from Allium mongolicum Regel on IL-10 mRNA expression of mouse peritoneal macrophages |
|
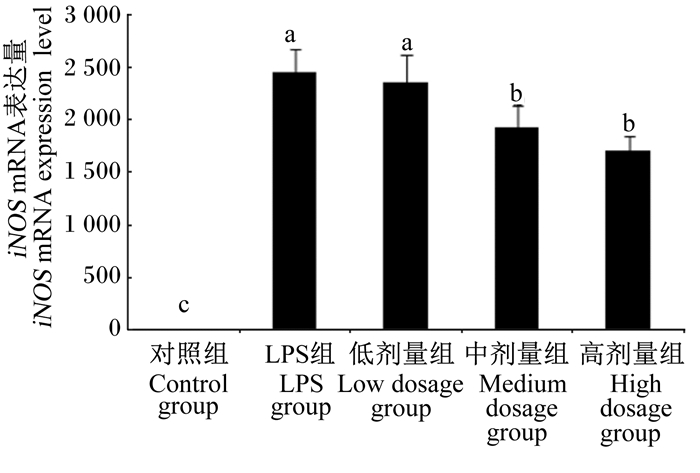
图 7 沙葱总黄酮对小鼠腹腔巨噬细胞iNOS mRNA表达的影响 Figure 7 Effects of total flavonoids from Allium mongolicum Regel on iNOS mRNA expression of mouse peritoneal macrophages |
如图 2所示,与对照组相比,LPS组小鼠腹腔巨噬细胞上清液中NO含量显著提高(P < 0.05);与LPS组相比,不同浓度沙葱总黄酮均能显著抑制NO的产生(P < 0.05),并且呈剂量依赖性。
2.3 沙葱总黄酮对小鼠腹腔巨噬细胞TNF-α、IL-10、IL-6、IL-1β、iNOS mRNA表达的影响如图 3~图 7所示,在对照组细胞中TNF-α、IL-6、IL-1β、iNOS mRNA表达量较低,但当单独添加1 μg/mL的LPS对细胞刺激培养后,TNF-α、IL-6、IL-1β、iNOS的表达均增加。与LPS组相比,除了低剂量组iNOS外,各浓度沙葱总黄酮均能显著抑制细胞中TNF-α、IL-6、IL-1β、iNOS mRNA的表达(P < 0.05),并具有一定的剂量效应关系。而对于IL-10来说,在沙葱总黄酮添加浓度为100 μg/mL时, IL-10 mRNA表达量最高,显著高于对照组(P < 0.05),与LPS组差异不显著(P>0.05)。
2.4 沙葱总黄酮对小鼠腹腔巨噬细胞上清液中TNF-α、IL-6、IL-1β、IL-10含量的影响如表 2所示,与对照组相比,LPS组炎症因子TNF-α、IL-6、IL-1β以及抗炎因子IL-10的含量均显著提高(P < 0.05);与LPS组相比,除了低剂量组的IL-1β,添加各浓度沙葱总黄酮均能显著降低小鼠腹腔巨噬细胞上清液中TNF-α、IL-6、IL-1β含量(P < 0.05);然而IL-10结果显示,与对照组相比,添加沙葱总黄酮高、中、低剂量均能不同程度地升高小鼠腹腔巨噬细胞上清液中IL-10的含量(P < 0.05)。
|
|
表 2 沙葱总黄酮对小鼠腹腔巨噬细胞上清液中TNF-α、IL-6、IL-1β、IL-10含量的影响 Table 2 Effects of total flavonoids from Allium mongolicum Regel on the contents of TNF-α, IL-6, IL-1β and IL-10 in the supernatant of mouse peritoneal macrophages (n=3) |
一般情况下,当机体内的抗炎因子和促炎因子保持平衡时,机体的生理生化功能维持正常。但是当体内的细胞因子、炎症因子等产生过多,超过机体自身的保护能力时,机体就会出现相应炎症[17]。炎症是机体对外抗衡的一种抗病反应,使细胞表面获取更多的氧及营养物质,所以对机体有利。但是在一些外界因素影响下,抗炎因子也可以转化成对机体有害的因素。炎症分为慢性炎症和急性炎症,在急性炎症所产生的高浓度炎症因子的持续刺激下,急性炎症会转变为相应的慢性炎症,慢性炎症与冠心病、高血压、甚至癌症等一些慢性疾病有密切相关[18]。在炎症反应中巨噬细胞的活化起着重要的作用,在未受到外界因素刺激时巨噬细胞并没有表现出免疫功能[19],但是当受到LPS等外界因素的刺激后,被激活的巨噬细胞释放大量的细胞因子,如TNF-α、IL-1β、IL-6、IL-10等,这些细胞因子相互影响,在炎症中起着重要的调节作用。因此,在本研究中选择在炎症反应中具有代表性的促炎因子IL-1β、IL-6、IL-10、TNF-α为测定指标,IL-1分为IL-1α和IL-1β 2种,IL-1α是一种结合性的细胞,只有与其他细胞相互结合后才能发挥作用;IL-1β在机体内有较强的生物学活性,能增强免疫细胞的杀伤力,引起炎症反应,也能促进免疫应答反应[20]。IL-6在机体内有非常广泛的作用,在免疫应答反应和细胞生长中起着很大的作用,同时刺激IL-1受体拮抗剂和可溶性TNF-α受体抑制IL-1、TNF-α等致炎因子的早期合成[21]。IL-10是机体内一种具有双重作用的细胞因子,既有抑制免疫作用也有免疫刺激作用。IL-10还可以抑制单核巨噬细胞免疫介质的释放,同时抑制促炎细胞因子的释放[22]。TNF-α是巨噬细胞被激活时产生的一种细胞因子,是在炎症反应中产生最早的炎症介质,在机体内的一些生理反应中起着多方面的作用[23]。
3.1 沙葱总黄酮对小鼠腹腔巨噬细胞增殖率的影响细胞活力是反映细胞增殖及细胞相对增殖率的重要的指标。巨噬细胞是机体内重要的免疫细胞,具有多种生物学功能,它能识别和吞噬入侵机体的一些病原及对机体产生危害的物质,引起机体的免疫应答反应[24]。且前人研究表明,在风湿性关节炎、纤维化肺炎及溃疡性结肠炎等炎症性疾病转归等方面巨噬细胞本身的一些功能有重要意义[25]。一些细胞炎症因子、LPS等物质能激活巨噬细胞,其中LPS称为内毒素,对单核巨噬细胞有很强的激活功能[26]。在本研究中发现沙葱总黄酮能显著提高小鼠腹腔巨噬细胞的增殖率,当沙葱总黄酮浓度为100.0~200.0 μg/mL时,细胞增殖率显著升高,浓度在12.5~50.0 μg/mL时, 增殖率明显不及前者,但是当浓度达到200.0 μg/mL时,增殖率会出现下降趋势,所以过低、过高浓度的黄酮类化合物都会影响细胞活力。
3.2 沙葱总黄酮对小鼠腹腔巨噬细胞释放NO能力及相关炎性因子的表达和分泌的影响在LPS等炎症物质的刺激下,巨噬细胞的活性增强,并合成和释放大量的NO、TNF-α、IL-1β、IL-10、IL-12、IL-6等炎症介质。在人体的病理过程中多种炎症细胞和细胞因子相互作用,从而保证人体的正常生理过程[27]。研究发现,黄酮、黄酮醇、查尔酮等黄酮类化合物均能在细胞水平上抑制LPS诱导的核因子κB(NF-κB)靶基因的表达和IL-1产生,并抑制机体内外的炎症反应[28]。急性肺损伤动物模型的研究结果表明,用黄酮醇、黄酮对动物进行干预后,动物机体支气管肺泡灌洗液中的炎症因子蛋白含量下降,嗜中性粒细胞减少,炎症得到缓解[29]。丹参酮类成分是白花丹参主要有效成分之一,有较好的抗炎活性,丹参酮ⅡA通过抑制炎症因子IL-10、TNF-α以及血小板的表达发挥抗炎作用[30]。甘草黄酮类单体异甘草素能抑制RAW264.7细胞IL-1β和IL-6基因表达及炎症因子的释放[31]。在体外抗炎研究中发现,茼麻叶总黄酮能显著降低巨噬细胞RAW264.7的炎症因子的含量,同时能显著提高IL-10的含量[32]。用LPS诱导的RAW264.7细胞炎症模型的研究也发现,一定浓度的伯叶黄酮能显著降低细胞中TNF-α、NO、IL-6的含量[33]。黄酮类化合物还能抑制LPS所引起的下游NF-κB靶基因的表达、TAK1蛋白激酶激活和一些炎症因子的释放[34],说明黄酮类化合物在体外抗炎反应中有很重要的作用。本研究结果表明,未受LPS刺激的巨噬细胞上清液中含有少量的NO、TNF-α、IL-1β、IL-6,当受到LPS刺激之后,上述炎症因子的含量显著提高;但给予黄酮类化合物后,能显著降低这些炎症因子的含量。同样,IL-10在没有LPS刺激前的含量很低,给予黄酮类化合物后,存在不同程度的上升。所以,沙葱总黄酮能降低LPS炎症模型中的细胞因子TNF-α、IL-1β、IL-6、iNOS的mRNA表达量,并提高IL-10含量。
4 结论沙葱总黄酮能提高小鼠腹腔巨噬细胞的增殖率,降低细胞上清液中NO、TNF-α、IL-1β、IL-6的含量以及细胞中TNF-α、IL-1β、IL-6、iNOS的mRNA表达,同时还能增加IL-10的含量以及IL-10 mRNA的表达。所以,沙葱总黄酮对LPS诱导的小鼠腹腔巨噬细胞具有显著的抗炎作用。
| [1] |
林曦. 家畜病理学[M]. 3版. 北京: 中国农业出版社, 1997: 74-99.
|
| [2] |
代艳文, 袁丁, 万静枝, 等. 竹节参总皂苷通过NF-κB通路对LPS致RAW264.7细胞炎症的保护作用研究[J]. 中国中药杂志, 2014, 39(11): 2076-2080. |
| [3] |
VODOVOTZ Y, CONSTANTINE G, FAEDER J, et al. Translational systems approaches to the biology of inflammation and healing[J]. Immunopharmacology and Immunotoxicology, 2010, 32(2): 181-195. DOI:10.3109/08923970903369867 |
| [4] |
程亮.褪黑素诱导肝癌细胞释放的外泌体对巨噬细胞免疫功能的影响及机制研究[D].硕士学位论文.合肥: 安徽医科大学, 2017.
|
| [5] |
中国科学院中国植物志编辑委员会. 中国植物志(14卷)[M]. 北京: 科学出版社, 1980: 170-172.
|
| [6] |
巴俊杰, 张春丽, 高建萍, 等. 沙葱营养成分分析[J]. 内蒙古农业大学学报(自然科学版), 2002, 23(4): 114-115. |
| [7] |
木其尔.沙葱黄酮对肉羊机体抗氧化和免疫功能的影响及其机理研究[D].博士学位论文.呼和浩特: 内蒙古农业大学, 2016.
|
| [8] |
鄢春旻.黄酮类化合物抗病毒及抗炎活性研究[D].硕士学位论文.南京: 南京大学, 2012.
|
| [9] |
王月乔.新型黄酮衍生物的合成研究[D].硕士学位论文.郑州: 河南大学, 2015.
|
| [10] |
萨茹丽.沙葱黄酮提取工艺优化、结构鉴定及其相关生物活性研究[D].博士学位论文.呼和浩特: 内蒙古农业大学, 2014.
|
| [11] |
刘博.小鼠巨噬细胞TLR2、TLR4及RP105在金黄色葡萄球菌感染中的天然免疫应答机制[D].博士学位论文.长春: 吉林大学, 2013.
|
| [12] |
RAY A, DITTEL B N. Isolation of mouse peritoneal cavity cells[J]. Journal of Visualized Experiments, 2010(35): 1488. |
| [13] |
FAN G W, JIANG X R, WU X Y, et al. Anti-inflammatory activity of tanshinone ⅡA in LPS-stimulated RAW264.7 macrophages via miRNAs and TLR4-NF-κB pathway[J]. Inflammation, 2016, 39(1): 375-384. DOI:10.1007/s10753-015-0259-1 |
| [14] |
武剑.柴胡多糖对巨噬细胞免疫功能的调节及对TLR4信号通路的影响[D].硕士学位论文.上海: 复旦大学, 2012.
|
| [15] |
徐艺荣.九种黄酮类化合物对LPS诱导的RAW264.7细胞PGE2、COX-2表达的影响[D].硕士学位论文.天津: 天津科技大学, 2012.
|
| [16] |
DONG D, ZHOU N N, PAN H X, et al. Sarsasapogenin-AA13 inhibits LPS-induced inflammatory responses in macrophage cells in vitro and relieves dimethylbenzene-induced ear edema in mice[J]. Acta Pharmacologica Sinica, 2017, 38(5): 699-709. DOI:10.1038/aps.2016.180 |
| [17] |
KIM J S, JOBIN C. The flavonoid luteolin prevents lipopolysaccharide-induced NF-κB signaling and gene expression by blocking IκB kinase activity in intestinal epithelial cells and bone-marrow derived dendritic cell[J]. Immunology, 2005, 115(3): 357-387. |
| [18] |
CHEN X J, YANG X F, LIU T J, et al. Kaempferol regulates MAPKs and NF-κB signaling pathways to attenuate LPS-induced acute lung injury in mice[J]. International Immunopharmacology, 2012, 14(2): 209-216. DOI:10.1016/j.intimp.2012.07.007 |
| [19] |
原俊.丹酚酸A通过抑制NF-κB的活化在小鼠腹腔巨噬细胞中的抗炎作用[D].硕士学位论文.大连: 大连医科大学, 2008.
|
| [20] |
BABCOCK A A, KUZIEL W A, RIVEST S O, et al. Chemokine expression by glial cells directs leukocytes to sites of axonal injury in the CNS[J]. Journal of Neuroscience, 2003, 23(21): 7922-7930. DOI:10.1523/JNEUROSCI.23-21-07922.2003 |
| [21] |
SIMS J E, SMITH D E. The IL-1 family:regulators of immunity[J]. Nature Reviews Immunology, 2010, 10(2): 89-102. DOI:10.1038/nri2691 |
| [22] |
YEE L J, TANG J M, GIBSON A W, et al. Interleukin 10 polymorphisms as predictors of sustained response in antiviral therapy for chronic hepatitis C infection[J]. Hepatology, 2001, 33(3): 708-712. DOI:10.1053/jhep.2001.22347 |
| [23] |
NORMAN J. The role of cytokines in the pathogenesis of acute pancreatitis[J]. The American Journal of Surgery, 1998, 175(1): 76-83. DOI:10.1016/S0002-9610(97)00240-7 |
| [24] |
MARTIN P, LEIBOVICH S J. Inflammatory cells during wound repair:the good, the bad and the ugly[J]. Trendsin in Cell Biology, 2005, 15(11): 599-607. DOI:10.1016/j.tcb.2005.09.002 |
| [25] |
ADEREM A, UNDERHILL D M.Mechanisms of phagocytosis in macrophages[J].Annual Review of Immunology, 17(1): 593-623.
|
| [26] |
SHAPIRO H, LUTATY A, ARIEL A. Macrophages, meta-inflammation, and immuno-metabolism[J]. The Scientific World Journal, 2011, 11: 2509-2529. DOI:10.1100/2011/397971 |
| [27] |
MARSH C B, WEWERS M D. The pathogenesis of sepsis:factors that modulate the response to gram-negative bacterial infection[J]. Clinics in Chest Medicine, 1996, 17(2): 183-197. DOI:10.1016/S0272-5231(05)70308-7 |
| [28] |
杨晓露, 刘朵, 卞卡, 等. 甘草总黄酮及其成分体外抗炎活性及机制研究[J]. 中国中药杂志, 2013, 38(1): 99-104. |
| [29] |
房蓓蓓.柑桔皮渣中黄酮类化合物的提取及其抗炎活性研究[D].硕士学位论文.重庆: 重庆工商大学, 2008.
|
| [30] |
MURRAY P J, WYNN T A. Protective and pathogenic functions of macrophage subsets[J]. Nature Reviews Immunology, 2011, 11(11): 723-737. DOI:10.1038/nri3073 |
| [31] |
郭轶. 血栓闭塞性脉管炎发病机制的研究进展[J]. 重庆医科大学学报, 2007, 32: 176-178. |
| [32] |
杨彩霞.茼麻叶总黄酮体外抗炎活性的研究[D].硕士学位论文.沈阳: 沈阳农业大学, 2016.
|
| [33] |
林泽华.侧柏叶黄酮和多糖分离纯化、结构表征及活性评价[D].硕士学位论文.广州: 华南理工大学, 2016.
|
| [34] |
杨杰, 沙金丹, 高翔, 等. 黄酮类化合物的免疫调节作用及机制[J]. 动物营养学报, 2017, 29(12): 4295-4300. DOI:10.3969/j.issn.1006-267x.2017.12.008 |




