2. 中国农业科学院哈尔滨兽医研究所, 兽医生物技术国家重点实验室, 黑龙江省实验动物与比较医学重点实验室, 哈尔滨 150069;
3. 牡丹江师范学院生命科学与技术学院, 牡丹江 157011
2. Harbin Veterinary Research Institute, Chinese Academy of Agricultural Sciences, State Key Laboratory of Veterinary Biotechnology, Heilongjiang Provincial Key Laboratory of Laboratory Animal and Comparative Medicine, Harbin 150069, China;
3. College of Life Science and Technology, Mudanjiang Normal University, Mudanjiang 157011, China
伏马毒素(fumonisins)主要是由串珠镰刀菌和多育镰刀菌在一定的温度和湿度下产生的一类由不同多氢醇和丙三羧酸组成的结构类似的双酯水溶性化合物[1],主要包括伏马毒素B1(fumonisin B1,FB1)、伏马毒素B2和伏马毒素B3等,其中FB1毒性最强,污染最普遍[2]。河南省玉米样品中FB1的阳性率为97.71%,湖北、广东、四川、广西和吉林5省全部为100%[3]。欧盟规定未加工玉米及婴儿食品中FB1的最大残留量为200 μg/kg[4]。我国规定FB1在粮食食品中的最大残留量为12 μg/kg[5],低于欧盟标准。动物毒害作用研究证明FB1可致马脑白质软化病[6]、猴动脉粥样硬化[7]、猪肺水肿[8]、大鼠肝癌[9-10]等。
近几年,适配体(aptamer)研究以其势不可挡的态势一跃成为科学家们的讨论焦点。它是利用指数富集的配体系统进化(systematic evolution of ligands by exponential enrichment,SELEX)技术,即从单链寡核苷酸文库中筛选出能与靶标高亲和力和特异性结合的寡核苷酸序列。适配体是通过链内碱基间的氢键作用折叠形成稳定的发卡、茎环、假结、口袋、凸环和G-四链体等二级或三级结构,与靶标空间结构匹配结合的RNA或单链脱氧核糖核酸(ssDNA)[11-12]。理论上任何靶标都可以筛选到对应的适配体,包括小分子物质[13]。适配体一般由几十个核苷酸组成,相对分子质量小、易穿透细胞膜、性质稳定、容易制备和修饰[14]。2002年O’Sullivan[15]首次将适配体用于生物识别。随后各类衍生SELEX技术不断发展和完善,适配体广泛应用于检测食品和饲料中重金属[16]、生物毒素[17]、抗生素[18]、非法添加物[19]等。Shi等[20]基于金纳米离子和石墨烯的信号放大作用将探针DNA和FB1适配体杂交作为FB1特定的信号识别元件进行检测,其线性范围为1~1×106 ng/L,检出限为1 ng/L。适配体检测方法具有良好的应用前景。
国内外已建立了多种针对FB1的检测方法,主要包括薄层色谱法[21]、酶联免疫法[22-23]、芯片法[24]、气相色谱法[25]、气相色谱-质谱连用法[26]、高效液相色谱法[27]等。以上方法的应用受到检测仪器昂贵、检测流程复杂等原因的限制。而胶体金方法具有简便、快捷、灵敏度高等优势,近年来得到迅速的发展[28]。目前胶体金在FB1检测上的应用,主要集中在抗原检测方法上[29-30],以适配体为基础的胶体金方法还未见报道。
基于以上内容,本研究旨在将筛选得到的适配体与胶体金检测方法相结合,开发FB1胶体金快速定量检测方法,以期为谷物和饲料中FB1含量的检测提供准确、快速、简便的检测手段,为适配体在农产品质量安全领域中的应用提供依据。
1 材料与方法 1.1 试验材料和仪器设备试验材料包括:FB1、黄曲霉毒素B1(aflatoxin B1,AFB1)、T-2毒素(T-2)、玉米赤霉烯酮(zearalenone,ZEN),购自青岛普瑞邦生物工程有限公司;Taq聚合酶、4种单碱基的混合溶液,购自北京康润诚业生物科技有限公司;链霉亲和素标记的磁珠,购自美国Thermo Fisher Scientific公司;UNIQ-10寡核苷酸试剂盒、变性电泳染料,购自上海生工生物工程有限公司;伏马毒素B1偶联牛血清白蛋白(FB1-BSA),购自上海阿拉丁生化科技股份有限公司;黄曲霉毒素B1偶联牛血清白蛋白(AFB1-BSA),购自上海户实医药科技有限公司;T-2毒素偶联牛血清白蛋白(T-2-BSA),购自上海药巢生物工程有限公司;氯金酸(HAuCl4·4H2O),购自国药集团化学试剂有限公司。本试验使用的ssDNA文库及生物素修饰的DNA探针均购自博仕生物有限公司。
仪器设备包括:超纯水系统(Elga Ultra Bioscience,英国)、电热恒温水槽(DK-8D,上海柏欣仪器设备厂)、台式微量高速离心机(Eppendorf A G,德国)、PCR仪(STANLEY,美国)、电泳仪(DYY-11B,北京六一生物科技有限公司)、紫外连续扫描分光光度计(Thermo,美国)、数显磁力搅拌电热套(天津市莱玻特瑞仪器设备有限公司)、一体化凝胶成像分析系统(SMartGel Ⅱ,美国)、聚焦式多功能荧光酶标仪(Envision,美国),超微量分光光度计(Implen,德国)、自动微板阅读器(PerkinElmer,德国)、透射电镜(日立H-7650,日本)、高效液相色谱仪(WATERS 6000,美国)。
1.2 试验方法 1.2.1 ssDNA文库的固定取10 μL链霉亲和素标记的磁珠,用2×Binding Buffer洗3次,重悬于500 μL的2×Binding Buffer中,加入12 μL生物素化适配体互补链B(GTC/ISP 18/GATCGAGCCTCA),室温孵育1 h。1×Binding Buffer清洗磁珠3次,重悬于300 μL磷酸盐缓冲液(PBS)中。将筛选所用的ssDNA文库(ATACCAGCTTATTCAATT-N10-TGAGGCTCG ATC-N40-AGATTGCACTTACTATCT)用PBS溶解后,于95 ℃变性8 min,迅速置于4 ℃冷却, 10 min再进行短暂的室温静置。将处理后的ssDNA文库加入到磁珠悬液中过夜孵育,即将文库固定在磁珠上。
1.2.2 FB1适配体的筛选已固定文库的磁珠用PBS清洗多次,磁分离弃上清。取100 μL 1 mg/mL的FB1加到磁珠中,对照组为PBS,室温孵育5 min,磁分离取上清备用,即获得第1轮的候选适配体库。第2轮开始进行反筛选,清洗固定文库的磁珠后,先分别加入ZEN、AFB1和T-2的PBS室温孵育10 min,去除与其他毒素结合的文库,再加入FB1靶标溶液,室温孵育5 min,磁分离取上清备用,即获得第2轮的候选适配体库。如此反复,共进行8轮筛选。整个筛选方案概述见表 1。
|
|
表 1 筛选方案概述 Table 1 Overview of screening program |
PCR扩增引物信息见表 2。
|
|
表 2 PCR扩增引物信息 Table 2 Primer information of PCR amplification |
PCR扩增的反应条件为:Mix,10 μL;ssDNA,0.5 μL;引物RA(10 μmol/L),0.5 μL;引物FF(10 μmol/L),0.5 μL;添加适量灭菌蒸馏水达到总反应体积20 μL。体系预变性95 ℃ 3 min后再95 ℃ 30 s、51 ℃ 30 s、72 ℃ 30 s重复30个循环,72 ℃延伸5 min。扩增产物用2%的琼脂糖凝胶电泳进行鉴定。
1.2.4 扩增文库的回收与纯化采用8%的变性聚丙烯酰胺凝胶电泳分离PCR扩增产物,收集带有羧基荧光素(FAM)的荧光条带。切胶后8 000 r/min离心3 min收集碎胶,煮沸15 min,8 000 r/min离心3 min收集上清,反复3次。收集管内加4 mL盐酸胍和8 mL无水乙醇,再次煮沸15 min后冰浴3 min,3 500 r/min离心10 min,4 ℃静置30 min。连接蠕动泵,利用UNIQ-10寡核苷酸试剂盒进行ssDNA的纯化,-20 ℃保存。高通量测序获得的富集序列利用Mega 6.0软件进行同源序列比对。
1.2.5 亲和力和特异性的测定通过酶联免疫吸附测定(ELISA)方法测定候选适配体序列的亲和力,具体方法为:5 μg/mL FB1-BSA抗原包被荧光酶标板,4 ℃过夜;PBS清洗3次;5%的FB1-BSA 37 ℃封闭1 h;PBS洗3次;加入90 μL 0~2 μmol/L(0、0.015 625、0.062 500、0.250 000、1.000 000和2.000 000 μmol/L)的FAM修饰的适配体,37 ℃孵育1 h;PBS洗3次,最后在490 nm处测定荧光强度。利用SigmaPlot 5.0软件进行非线性曲线的拟合,计算每条代表序列的解离常数(Kd)值。最后利用RNA Structure 3.0进行结构预测,分析其可能的结合位点。
特异性的测定方法为:分别用5 μg/mL的FB1-BSA、AFB1-BSA、ZEN-BSA和T-2-BSA抗原包被酶标板,4 ℃过夜;PBS洗3次;5%的BSA 37 ℃封闭1 h;PBS洗3次;加入90 μL 1 μmol/L的FAM修饰的候选适配体,37 ℃孵育1 h。PBS洗3次,荧光强度测定同亲和力分析。
1.2.6 胶体金溶液的制备采用柠檬酸三钠还原法制备胶体金溶液[31],配制浓度为50 mmol/L的氯金酸溶液和194 mmol/L的柠檬酸三钠溶液,4 ℃保存;带冷凝器的三口圆底烧瓶加入98 mL纯水,放入搅拌子,加入2 mL氯金酸溶液。加热沸腾后加入2 mL柠檬酸三钠溶液,持续沸腾20 min后,冷却至室温。透射电镜观察金粒子的制备情况。
1.2.7 适配体保护金的浓度及最佳胶体金显色pH的确定1 mL胶体金溶液中分别加入0、10、20、30、40和50 μL 0.1 mol/L的K2CO3用以调节pH;适配体稀释浓度分别为0、0.125、0.250、0.500、1.000和2.000 μmol/L,两者进行正交试验,确定适配体保护金的最低浓度以及最适pH。
1.2.8 FB1的检测程序按照Lu等[32]的方法,稍加改进:添加50 μL最适浓度适配体和50 μL不同浓度(0、0.062 5、0.125 0、0.250 0、0.500 0和1.000 0 ng/mL)的FB1室温下细胞板中孵化1 h;加入50 μL胶体金溶液静置5 min;而后加入5 μL 2 mol/L氯化钠并彻底混合;平衡5 min后,通过自动微板阅读器测量从450~750 nm波长的吸收光谱。
1.2.9 添加回收试验市售玉米粉碎后检测其FB1含量,而后向其中添加不同浓度(0、50、100和150 μg/kg)FB1标准品并混合均匀再次检测,样品制备和实验提取方法参照《饲料中伏马毒素的测定》(NY/T 1970—2010)执行,计算添加回收率。
1.2.10 样品检测随机选取5份FB1含量在10~100 μg/kg之间的市售玉米,分别用本试验建立的方法和NY/T 1970—2010中规定的液相色谱法进行检测,比较检测结果。
2 结果与分析 2.1 筛选条件的优化核酸文库在不适宜的PCR扩增条件下会产生非特异性扩增产物,本研究即对文库扩增的退火温度进行了优化,结果见图 1。退火温度高,非特异性扩增产物的量相对就会减少,但是特异性的扩增产物的量也会减少,综合考虑扩增效率和非特异性扩增的影响,选择最佳扩增退火温度为61 ℃。

|
a~j分别为55、56、57、58、59、60、61、62、63、64 ℃的扩增产物;M:DM2000。 a to j were amplification products of 55, 56, 57, 58, 59, 60, 61, 62, 63 and 64 ℃, respectively; M: DM2000. 图 1 扩增引物退火温度优化 Figure 1 Annealing temperature optimization of amplification primer |
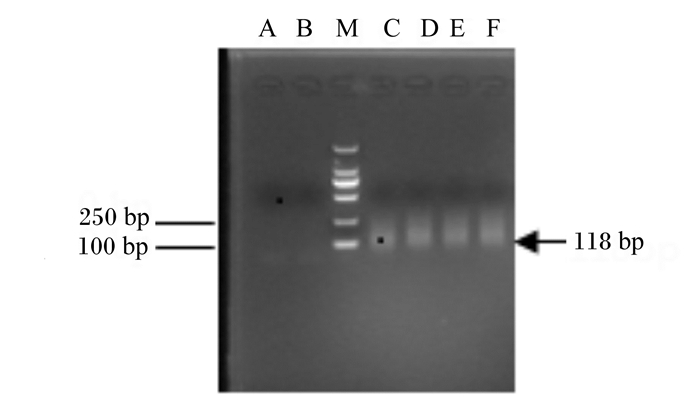
本研究进行了8轮筛选,对2、5和8轮文库的富集与回收纯化情况进行PCR验证,第8轮结果见图 2和图 3。PCR扩增得到了118 bp的特异性条带且变性聚丙烯酰胺凝胶电泳得到了带有FAM的荧光条带,同预期结果一致。
|
M:标记物;A、B:阴性对照;C~F:Pool8。 M: marker; A and B: negative control; C to F: Pool8. 图 2 8轮PCR产物 Figure 2 PCR product of 8 rounds |

|
图 3 变性聚丙烯酰胺凝胶电泳分离制备8轮ssDNA Figure 3 ssDNA of 8 rounds prepared by denaturing PAGE |
利用高通量测序评测每轮文库的富集情况,共测出10 000条序列。利用Mega 6.0软件进行同源性序列比对得到10条相似性较高的序列见图 4,且F102、F98和F92的富集倍数较高,见表 3。

|
图 4 富集文库序列同源性比对 Figure 4 Homology comparison of enrichment library sequence |
|
|
表 3 FB1候选适配体序列富集情况 Table 3 Enrichment of FB1 candidate aptamer sequences |
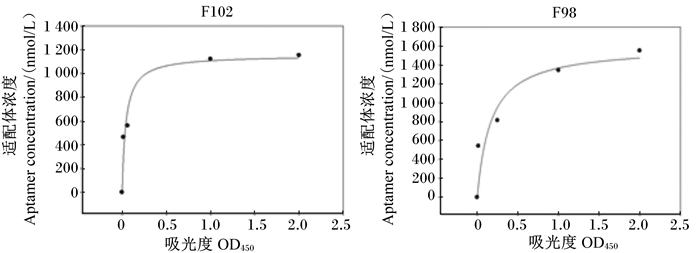
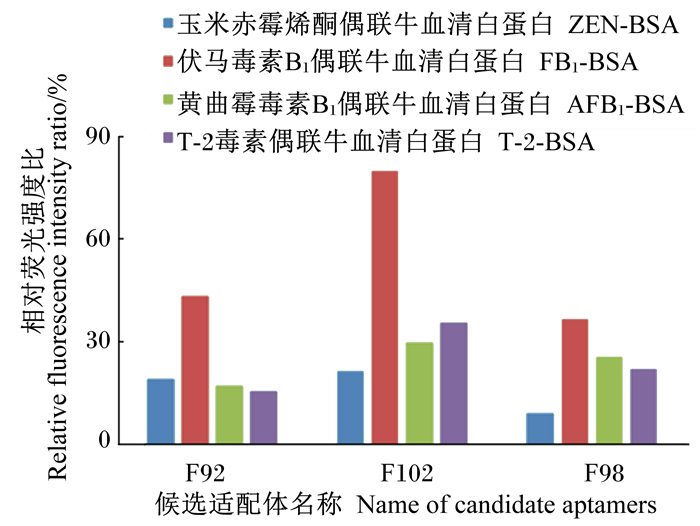
将获得的10条候选适配体进行亲和力测定。表 4是具有亲和力的适配体的序列及相应的亲和力测试结果,图 5是适配体F102和F98的非线性拟合亲和力分析结果。适配体F102对FB1的亲和力Kd值为(42.1±4.0) nmol/L。适配体F102、F98和F92的特异性结果见图 6所示。样品组的相对荧光强度比,代表的是真菌毒素分子竞争结合磁珠表面适配体致使构象改变、互补荧光短链脱落的能力,因此荧光强度比越高,特异性越强。适配体F92、F102、F98的荧光恢复率分别为43.3%、80.0%和36.6%,而三者对非靶标真菌毒素的荧光恢复率均在30%左右,表明3条适配体具有较好的特异性,其中F102特异性最强。本试验从另一方面论证了FB1适配体筛选过程中加入AFB1、T-2与ZEN等非靶标分子的磁竞争- SELEX方法是成功的。
|
|
表 4 适配体序列及Kd值 Table 4 Aptamer sequence and Kd value |
|
图 5 FB1候选适配体的亲和力分析 Figure 5 Affinity analysis of FB1 candidate aptamer |
|
图 6 适配体特异性分析 Figure 6 Specificity analysis of aptamer |
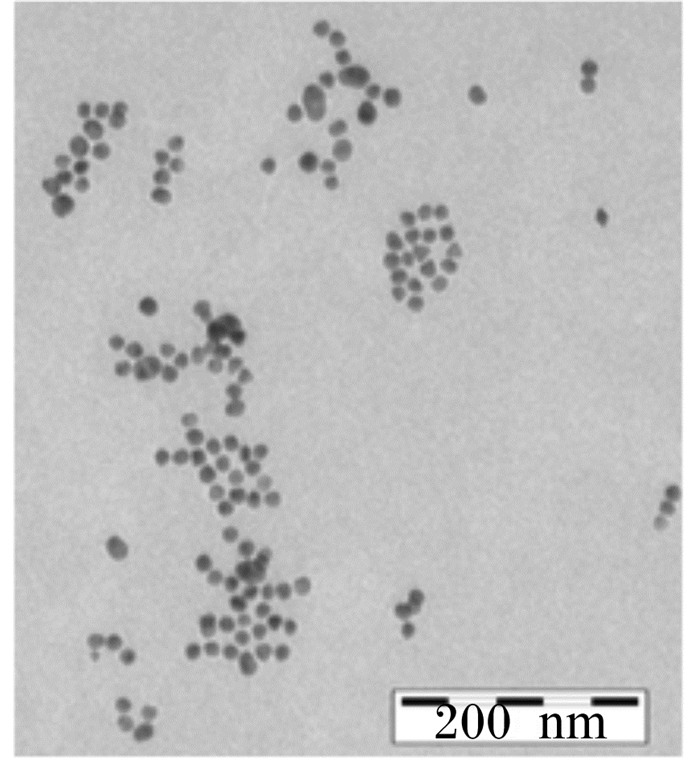
制备的胶体金溶液通过透射电镜观察可以看出,金粒子分布较均匀,颗粒大小均一,直径约为13 nm,颜色为透明的酒红色,液体无杂质,见图 7,可用于检测方法的建立。
|
图 7 胶体金透射电镜观察结果 Figure 7 Transmission electron microscopy observation of colloidal gold |
通过正交试验确定适配体保护金的最低浓度为0.25 μmol/L,以及最适K2CO3添加量为20 μL,胶体金溶液pH在7.0左右,此时胶体金的颜色适当,适配体用量最小。
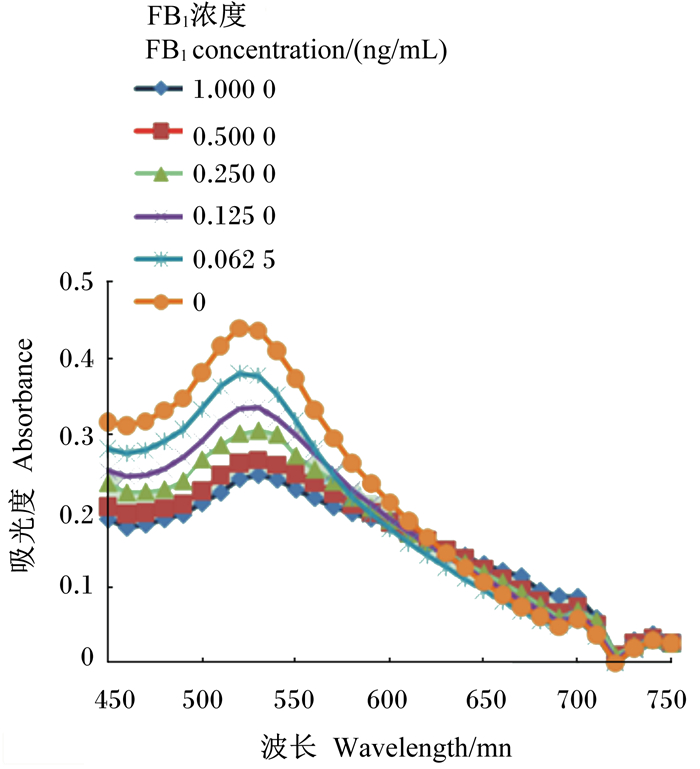
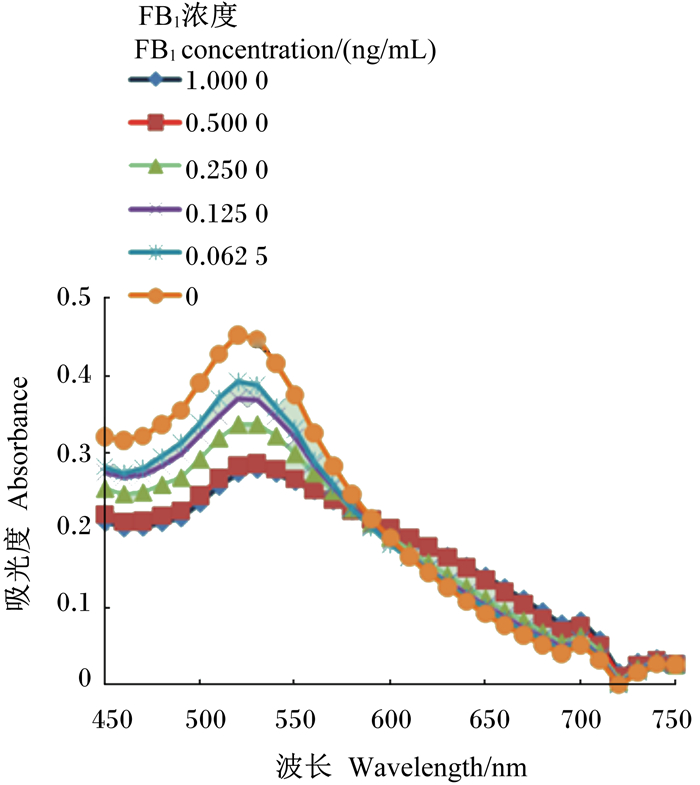
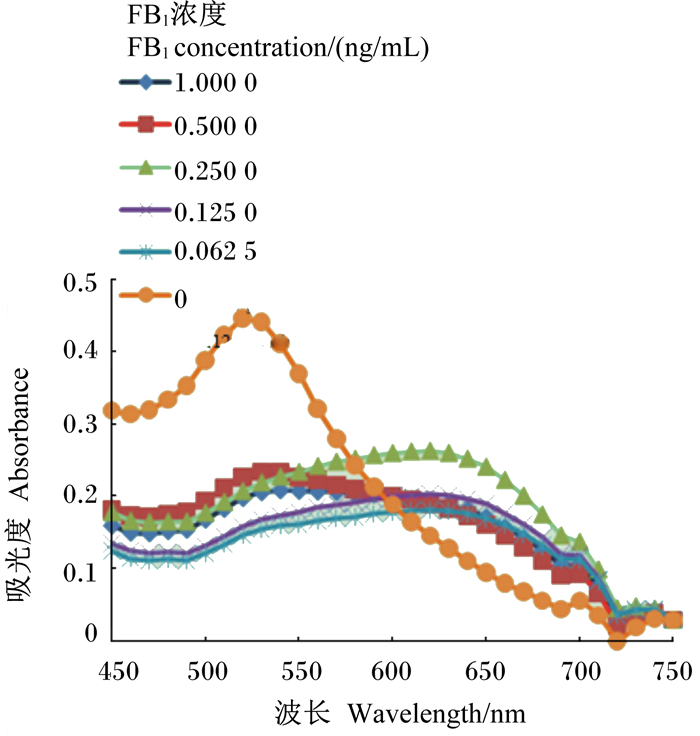
2.6 适配体对FB1的检测图 8、图 9和图 10是不同浓度适配体对不同浓度FB1的胶体金吸光度值。由图 8、9和10可以看出由于NaCl导致的胶体金的颜色变化,吸光度值发生变化,证明该适配体可用来建立检测FB1的方法,且整个检测过程不超过2 h,方法简便快速。
|
图 8 0.500 μmol/L适配体、FB1和胶体金混合溶液的吸收光谱 Figure 8 Absorption spectra of 0.500 μmol/L aptamer, FB1 and colloidal gold mixed solutions |
|
图 9 0.250 μmol/L适配体、FB1和胶体金混合溶液的吸收光谱 Figure 9 Absorption spectra of 0.250 μmol/L aptamer, FB1 and colloidal gold mixed solutions |
|
图 10 0.125 μmol/L适配体、FB1和胶体金混合溶液的吸收光谱 Figure 10 Absorption spectra of 0.125 μmol/L aptamer, FB1 and colloidal gold mixed solutions |
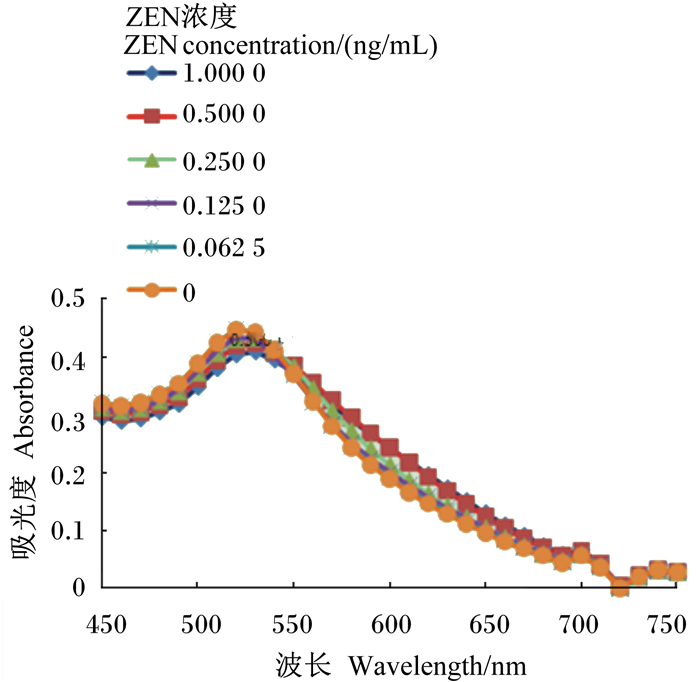
以ZEN为例检测适配体及方法的特异性,见图 11。从图中可以看出,0.500 μmol/L适配体不与ZEN结合,能够完全保护胶体金,在与FB1相同浓度梯度的条件下,ZEN的吸光度与0 mg/mL的吸光度基本吻合,证明适配体的特异性良好。AFB1和T-2的特异性结果与ZEN的相似。
|
图 11 0.500 μmol/L适配体、ZEN和胶体金混合溶液的吸收光谱 Figure 11 Absorption spectra of 0.500 μmol/L aptamer, ZEN and colloidal gold mixed solutions |
图 12为不同浓度FB1、适配体和胶体金混合溶液的吸光度校准曲线。在520 nm波长下,随着FB1浓度的增加,0.250和0.500 μmol/L的适配体的吸光度逐渐减小。由图可以看出,0.250和0.500 μmol/L的适配体吸光度都体现了良好的线性关系,线性范围是0.062 5~1.000 0 ng/mL检出限为0.125 ng/mL,相关系数(R2)分别为0.958 5和0.987 5。由此可以得出,0.250 μmol/L适配体满足对以上浓度的FB1进行检测的要求。
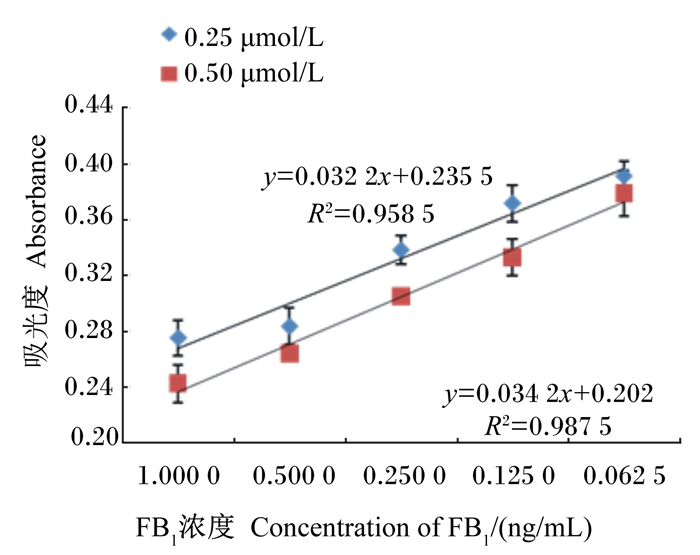
|
图 12 FB1适配体结合胶体金的吸光度校准曲线 Figure 12 Absorbance calibration curve of FB1 aptamer binding to colloidal gold |
取玉米样本检测其中FB1含量,然后分别添加50、100和150 μg/kg的FB1标准品进行检测,计算添加回收率,结果见表 5。样本的添加回收率在97%~121%。
|
|
表 5 玉米样本添加回收试验结果 Table 5 Results of supplementation recovery test of corn samples |
利用本方法检测5份样品,结果见表 6。结果显示,本方法的检测结果与液相色谱法检测结果相符,相对误差在低于15.7%。
|
|
表 6 FB1胶体金快速定量检测方法和液相色谱法检测结果 Table 6 Detection results of FB1 colloidal gold rapid and quantitative test method and liquid chromatography method |
FB1分子是一类由不同的多氢醇和丙三羧酸组成的结构类似的双酯化合物,没有可以固定的活性基团,从而只能借助其他活性基团如氨基基团固定在筛选介质上,但是这样大大增加了筛选的难度且对适配体的特异性有所影响,本研究据此选择固定文库的筛选策略以期获得特异性良好的适配体。筛选过程的另一大难点是消除非特异性干扰。非特异性DNA的干扰一方面是磁珠基底的非特异性吸附的DNA;另一方面来自于仅仅识别FB1部分分子结构的DNA,如分子结构上的个别基团或者某个部位。为此引入与FB1结构相似性化合物AFB1、T-2和ZEN进行反筛选,而AFB1与FB1具有相似的作用位点,因此利用它们提高筛选效率。
SELEX过程数学分析结果表明,从理论上讲,亲和性最强的适配体其富集效果应该最好[35-40],但是在这是在不考虑其他干扰因素的理想状态下。然而实际的筛选结果却显示富集水平最好的序列,其亲和力不一定是最理想的[41-45]。实际上,微小的试验条件如pH和温度变化都会影响最终的筛选结果。禹新良[46]采用数学方法对SELEX筛选适配体富集水平进行理论分析,论证了满足一定条件下,与靶标亲和力最强的适配体并不具有最高的富集水平。本文筛选得到的适配体F102富集水平并不是最高,但是它的亲和力却最好,印证了以上结论。
适配体可以选择性地与其靶标分子结合,高亲和力可与抗体相媲美,且具有比抗体更好的抗生物降解能力[13],这些特性使其成为一种特定目标物检测中非常理想的识别元件。本文获得FB1适配体的Kd为(42.1±4.0) nmol/L,并且选择性很好,与FB1结构相似性化合物ZEN、AFB1和T-2的结合远低于FB1。与已有报道的FB1适配体F39[33]和F10[34][Kd分别为(100±30) nmol/L和(62±5) nmol/L]相比,本文获得的FB1适配体的亲和力更高,建立的胶体金检测方法的适配体用量较低(0.250 μmol/L),与玉米赤霉烯酮等霉菌毒素的交叉反应较低,检测时间较短,为FB1的实际应用奠定了良好的基础。李永刚等[47]建立了一种超高效液相色谱-串联质谱法测定玉米油中的伏马毒素,其检测结果为FB1在5~200 ng/mL时线性良好,检出限分别为0.27 ng/mL。Wang等[48]用荧光微球标记FB1单克隆抗体,建立了一种用于检测玉米中FB1的免疫层析法,检测限达120 ng/L,与伏马毒素B2和伏马毒素B3的交叉反应率分别为1.5%和67.3%。与上述结果相比,本研究建立的检测方法特异性更强,效果更好。
本文通过选择适当筛选方法、增加筛选压力得到亲和力和特异性强的FB1适配体F102,分析其二级结构,推测其可能的结合机制,建立胶体金检测方法,对得到的适配体进行效果验证。以此为基础推广开来的适配体应用于农产品质量安全领域,不仅能够为农产品质量安全领域真菌毒素的快速检测提供理论参考,而且能够为替代传统抗体的传感器开发提供理论基础。
4 结论本研究利用筛选得到的适配体建立了可用于谷物和饲料中FB1含量的快速定量检测方法。
| [1] |
肖前青, 刁治民, 张程, 等. 镰刀菌及其毒素[J]. 安徽农学通报, 2008, 14(9): 164-166. DOI:10.3969/j.issn.1007-7731.2008.09.075 |
| [2] |
饶正华, 苏晓鸥. 饲料中的伏马毒素及其监控[J]. 饲料广角, 2005(14): 23-24. DOI:10.3969/j.issn.1002-8358.2005.14.009 |
| [3] |
张宏宇.我国六省玉米中伏马菌素B1的污染水平调查[D].硕士学位论文.沈阳: 中国医科大学, 2007. http://cdmd.cnki.com.cn/article/cdmd-10159-2007162521.htm
|
| [4] |
EC.Commission regulation (EC) No.1126/2007 of 28 September 2007 amending regulation(EC) No.1881/2006 setting maximum levels for certain contaminants in foodstuffs as regards fusarium toxins in maize and maize products[S].Official Journal of the European Union, 2007, L255: 14-17.
|
| [5] |
陈茹. 国内外饲料真菌毒素限量规定及评析[J]. 中国饲料, 2013(17): 38-42. |
| [6] |
王金昌, 王小红, 杨一兵, 等. 伏马菌素的毒害及脱毒防控技术的研究进展[J]. 江西科学, 2009, 27(1): 76-80, 83. DOI:10.3969/j.issn.1001-3679.2009.01.020 |
| [7] |
曹喜锋, 秦伟森, 熊永晅, 等. 伏马毒素B1对人脐静脉血管内皮细胞的毒性作用研究[J]. 畜牧兽医学报, 2017, 48(9): 1777-1784. |
| [8] |
李岩松.玉米中伏马菌素免疫学快速筛检方法研究[D].博士学位论文.长春: 吉林大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10183-1012257801.htm
|
| [9] |
金海涛, 陈道付, 李绍钰. 伏马菌素的毒性作用研究[J]. 饲料工业, 2007, 28(20): 55-57. DOI:10.3969/j.issn.1001-991X.2007.20.020 |
| [10] |
LI Y C, LEDOUX D R, BERMUDEZ A J, et al. Effects of fumonisin B1 on selected immune responses in broiler chicks[J]. Poultry Science, 1999, 78(9): 1275-1282. DOI:10.1093/ps/78.9.1275 |
| [11] |
ELLINGTON A D, SZOSTAK J W. In vitro selection of RNA molecules that bind specific ligands[J]. Nature, 1990, 346(6287): 818-822. DOI:10.1038/346818a0 |
| [12] |
TUERK C, GOLD L. Systematic evolution of ligands by exponential enrichment:RNA ligands to bacteriophage T4 DNA polymerase[J]. Science, 1990, 249(4968): 505-510. DOI:10.1126/science.2200121 |
| [13] |
KLUSSMANN S. The aptamer handbook:functional oligonucleotides and their applications spiegelmers for therapeutic applications-use of chiral principles in evolutionary selection techniques[M]. Weinheim: Wiley-VCH, 2006.
|
| [14] |
王勇, 赵新颖, 石冬冬, 等. 小分子靶标的核酸适配体筛选的研究进展[J]. 色谱, 2016, 34(4): 361-369. |
| [15] |
O'SULLIVAN C K. Aptasensors-the future of biosensing?[J]. Analytical and Bioanalytical Chemistry, 2002, 372(1): 44-48. DOI:10.1007/s00216-001-1189-3 |
| [16] |
王法泽.核酸探针应用于重金属的快速检测方法研究[D].硕士学位论文.上海: 上海交通大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10248-1013022764.htm
|
| [17] |
SHIM W B, MUN H, JOUNG H A, et al. Chemiluminescence competitive aptamer assay for the detection of aflatoxin B1 in corn samples[J]. Food Control, 2014, 36(1): 30-35. DOI:10.1016/j.foodcont.2013.07.042 |
| [18] |
陈丹, 姚冬生, 谢春芳, 等. 四环素核酸适配体电化学生物传感器的研制[J]. 中国生物工程杂志, 2013, 33(11): 56-62. |
| [19] |
HUANG L L, YANG X J, QI C, et al. A label-free electrochemical biosensor based on a DNA aptamer against codeine[J]. Analytica Chimica Acta, 2013, 787: 203-210. DOI:10.1016/j.aca.2013.05.024 |
| [20] |
SHI Z Y, ZHENG Y T, ZHANG H B, et al. DNA electrochemical aptasensor for detecting fumonisins B1 based on graphene and thionine nanocomposite[J]. Electroanalysis, 2015, 27(5): 1097-1103. DOI:10.1002/elan.201400504 |
| [21] |
SHELBY R A, ROTTINGHAUS G E, MINOR H C. Comparison of thin-layer chromatography and competitive immunoassay methods for detecting fumonisin on maize[J]. Journal of Agricultural and Food Chemistry, 1994, 42(9): 2064-2067. DOI:10.1021/jf00045a043 |
| [22] |
王雨晨, 王君, 王元凯, 等. 伏马毒素B1单克隆抗体的制备及间接竞争ELISA方法的建立[J]. 上海交通大学学报(农业科学版), 2011, 29(2): 69-74. DOI:10.3969/J.ISSN.1671-9964.2011.02.013 |
| [23] |
柳其芳, 刘桂华, 刘红河. 伏马菌素测定方法应用研究及对粮食污染状况调查[J]. 中国热带医学, 2008, 8(11): 1906-1908. DOI:10.3969/j.issn.1009-9727.2008.11.014 |
| [24] |
左小霞, 高志贤, 曹巧玲. 伏马菌素B1检测的免疫芯片技术研究[J]. 中国卫生检验杂志, 2008, 18(4): 597-598, 659. DOI:10.3969/j.issn.1004-8685.2008.04.009 |
| [25] |
SYDENHAM E W, GELDERBLOM W C A, THIEL P G, et al. Evidence for the natural occurrence of fumonisin B1, a mycotoxin produced by Fusarium moniliforme, in corn[J]. Journal of Agricultural and Food Chemistry, 1990, 38(1): 285-290. DOI:10.1021/jf00091a064 |
| [26] |
PLATTNER R D, NORRED W P, BACON C W, et al. A method of detection of fumonisins in corn samples associated with field cases of equine leukoencephalo-malacia[J]. Mycologia, 1990, 82(6): 698-702. DOI:10.1080/00275514.1990.12025950 |
| [27] |
林维宣, 裴轶君, 董伟峰. 固相萃取-高效液相色谱法测定玉米中伏马毒素B1[J]. 大连工业大学学报, 2004, 23(1): 15-17. DOI:10.3969/j.issn.1674-1404.2004.01.005 |
| [28] |
杨利国, 胡少昶, 魏平华, 等. 酶免疫测定技术[M]. 南京: 南京大学出版社, 1998: 7-9.
|
| [29] |
任文洁, 黄志兵, 许杨, 等. 伏马菌素B1胶体金免疫层析快速检测试纸条的研制[J]. 食品工业科技, 2015, 36(24): 58-63. |
| [30] |
樊海新, 李寒松, 李复辉, 等. 伏马菌素B1胶体金免疫层析试纸条的研制[J]. 南京农业大学学报, 2015, 38(3): 483-490. |
| [31] |
CHEN A L, JIANG X L, ZHANG W W, et al. High sensitive rapid visual detection of sulfadimethoxine by label-freeaptasensor[J]. Biosensors and Bioelectronics, 2013, 42: 419-425. DOI:10.1016/j.bios.2012.10.059 |
| [32] |
LU T F, MA Q, YAN W Z, et al. Selection of an aptamer against Muscovy duck parvovirus for highly sensitive rapid visual detection by label-free aptasensor[J]. Talanta, 2018, 176: 214-220. DOI:10.1016/j.talanta.2017.08.037 |
| [33] |
MCKEAGUE M, BRADLEY C R, DE GIROLAMO A, et al. Screening and initial binding assessment of fumonisin B1 aptamers[J]. International Journal of Molecular Sciences, 2010, 11(12): 4864-4881. DOI:10.3390/ijms11124864 |
| [34] |
陈秀娟.镰刀菌毒素核酸适配体的筛选及分析应用研究[D].博士学位论文.无锡: 江南大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10295-1015431057.htm
|
| [35] |
DJORDJEVIC M, SENGUPTA A M. Quantitative modeling and data analysis of SELEX experiments[J]. Physical Biology, 2006, 3(1): 13-28. |
| [36] |
CHEN C K. Complex SELEX against target mixture:stochastic computer model, simulation, and analysis[J]. Computer Methods and Programs in Biomedicine, 2007, 87(3): 189-200. DOI:10.1016/j.cmpb.2007.05.008 |
| [37] |
CHEN C K, KUO T C. Simulations of SELEX against complex receptors with a condensed statistical model[J]. Computers & Chemical Engineering, 2007, 31(9): 1007-1019. |
| [38] |
CHEN C K, KUO T L, CHAN P C, et al. Subtractive SELEX against two heterogeneous target samples:numerical simulations and analysis[J]. Computers in Biology and Medicine, 2007, 37(6): 750-759. DOI:10.1016/j.compbiomed.2006.06.015 |
| [39] |
LEVINE H A, NILSEN-HAMILTON M. A mathematical analysis of SELEX[J]. Computational Biology and Chemistry, 2007, 31(1): 11-35. DOI:10.1016/j.compbiolchem.2006.10.002 |
| [40] |
SEO Y J, CHEN S L, NILSEN-HAMILTON M, et al. A mathematical analysis of multiple-target SELEX[J]. Bulletin of Mathematical Biology, 2010, 72(7): 1623-1665. DOI:10.1007/s11538-009-9491-x |
| [41] |
郭秋平, 刘小丹, 谭誉宇, 等. 人肝细胞性肝癌细胞株的高特异识别核酸适配体筛选[J]. 科学通报, 2013, 58(27): 2745-2750. |
| [42] |
NINOMIYA K, KANEDA K, KAWASHIMA S, et al. Cell-SELEX based selection and characterization of DNA aptamer recognizing human hepatocarcinoma[J]. Bioorganic & Medicinal Chemistry Letters, 2013, 23(6): 1797-1802. |
| [43] |
SCHÜTZE T, WILHELM B, GREINER N, et al. Probing the SELEX process with next-generation sequencing[J]. PLoS One, 2011, 6(12): e29604. DOI:10.1371/journal.pone.0029604 |
| [44] |
YANG X H, WANG Y N, WANG K M, et al. DNA aptamer-based surface plasmon resonance sensing of human C-reactive protein[J]. RSC Advances, 2014, 4(58): 30934-30937. DOI:10.1039/C4RA05011H |
| [45] |
WAN J, YE L, YANG X H, et al. Cell-SELEX based selection and optimization of DNA aptamers for specific recognition of human cholangiocarcinoma QBC-939 cells[J]. Analyst, 2015, 140(17): 5992-5997. DOI:10.1039/C5AN01055A |
| [46] |
禹新良. SELEX筛选核酸适配体富集水平理论分析[J]. 中国科学(化学), 2017, 47(7): 891-895. |
| [47] |
李永刚, 张瑞, 聂晓明, 等. 超高效液相色谱-串联质谱法测定玉米油中的伏马毒素[J]. 中国卫生检验杂志, 2017, 27(3): 336-338, 343. |
| [48] |
WANG Z H, LI H, LI C L, et al. Development and application of a quantitative fluorescence-based immunochromatographic assay for fumonisin B1 in maize[J]. Journal of Agricultural and Food Chemistry, 2014, 62(27): 6294-6298. DOI:10.1021/jf5017219 |




