2. 广东省温氏食品集团股份有限公司, 新兴 527400;
3. 农业部华南热带农业环境重点实验室, 广州 510642
2. Guangdong Wens Foodstuffs Group Co., Ltd., Xinxing 527400, China;
3. Key Laboratory of Tropical Agriculture Environment, South China, Ministry of Agriculture, Guangzhou 510642, China
有益菌复合培养而成的微生物液体制剂,不但含有有益菌群,而且含有有益菌群在分解底物过程中所产生的多种活性物质[1]。因此,发酵菌液在畜禽养殖中的应用引起人们的关注。研究表明,发酵菌液应用于畜禽养殖中可提高饲料利用率,增强动物免疫力,有效控制大肠杆菌病,进而促进动物生长;还可以改善饲养环境,抑制并消除氨气[2-5]。袁玲等[6]饲喂雏鸡含有乳酸菌菌体和全菌液制剂的饲粮后发现,与空白对照组相比,活菌数为3.7×106和5.8×106 CFU/g的高剂量试验组可显著提高雏鸡的日增重,极显著降低料重比;与添加黄曲霉素的抗生素对照组相比,能够提高盲肠中乳酸菌数量,抑制大肠杆菌的繁殖;表明雏鸡饲粮中添加乳酸菌菌体和全菌液制剂具有促进生长和改善盲肠菌群的作用。姚红[7]研究表明,在蛋用雏鸡饲粮中添加0.3%酵母菌培养物和0.02%低聚木糖,其料重比显著低于空白对照组和添加盐酸恩诺沙星的抗生素对照组,表明酵母菌培养物和低聚木糖具有提高蛋用雏鸡生长性能和免疫功能的效果。张彩凤等[8]研究表明,乳酸菌和酵母菌复合制剂可以提高肉仔鸡的生长性能,改善肠道黏膜形态和肠道微生物区系,促进生长,且肉仔鸡饲粮中添加1 000 mg/kg乳酸菌和酵母菌复合制剂可以替代或部分替代维吉尼霉素的促生长作用。
目前饮用发酵菌液的相关研究主要集中在不同添加水平或不同菌剂方面,未见有关发酵菌液适宜添加阶段的报道。因此,本文选用2种不同来源的酵母菌制作发酵菌液,并分不同开始饮用日龄进行肉鸡饲养试验,比较2种发酵菌液替代抗生素在肉鸡生产中的应用效果,得出发酵菌液的适宜添加阶段,为发酵菌液在肉鸡生产中的应用提供依据。
1 材料与方法 1.1 试验设计试验所用2种发酵菌液(发酵菌液1和发酵菌液2)分别由广东温氏食品集团有限公司技术中心和广西助农畜牧科技有限公司提供,主要活性成分均为酵母菌。2种发酵菌液中酵母菌的平均活菌数分别为1.625×106和1.374×107 CFU/mL。发酵菌液制作过程为:20 kg清水+1 kg玉米粉+30 g菌种+0.25 kg红糖,搅拌均匀后密封,进行厌氧发酵,发酵2~3 d有酒精香味后即可给鸡饮用。试验所用维吉尼霉素有效含量为50%。
选取同批次1日龄矮脚黄肉鸡母鸡1 680只,随机分为6组,每组4个重复,每个重复70只鸡。A组为抗生素对照组,饮用清水,在基础饲粮中添加30 mg/kg维吉尼霉素;B组为空白对照组,饮用清水,饲喂基础饲粮;C组自14日龄起在饮水中添加3%发酵菌液1,饲喂基础饲粮;D组自14日龄起在饮水中添加3%发酵菌液2,饲喂基础饲粮;E组自27日龄起在饮水中添加3%发酵菌液1,饲喂基础饲粮;F组自27日龄起在饮水中添加3%发酵菌液2,饲喂基础饲粮。
1.2 饲养管理试验肉鸡采用网床平养模式饲养,试验全程自由采食和饮水,按照免疫程序进行免疫。试验过程中密切观察试验鸡情况,发现死鸡立即称重,记录并处理。试验期78 d。14~78日龄为正试期。肉鸡分阶段饲养,其中1~26日龄为第1阶段;27~56日龄为第2阶段;57~78日龄为第3阶段。不同饲养阶段采用不同的饲粮配方,营养指标参考NRC(1994)禽营养需要。各饲养阶段基础饲粮组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of basal diets (air-dry basis) |
分别于26、56和78日龄称重后,每个重复选取体重接近平均体重的3只鸡进行屠宰试验,采集十二指肠和盲肠内容物样品,以备处理和测定。
1.4 测定指标 1.4.1 生长性能试验开始时以重复为单位对全部鸡称重,之后分别于14、26、56和78日龄时以重复为单位称重。称重前1天22:00停料,自由饮水,次日08:00称重,称重后计算平均日增重。试验期间每天记录每个重复鸡的饲粮饲喂量,并在每个阶段停料时对剩料进行称重,分别计算每栏鸡的平均日采食量。平均日采食量和平均日增重的比值即为某时期肉鸡的料重比。
1.4.2 肠道指标 1.4.2.1 十二指肠内容物消化酶活性收集26、56和78日龄各组所屠宰的3只鸡的十二指肠内容物,取0.5 g加入4.5 mL 0.15 mol/L生理盐水,漩涡振荡器高速漩涡5 min至混合均匀,于冷冻离心机4 ℃、13 000 r/min离心15 min,取上清液作为十二指肠内容物酶液,用于测定淀粉酶和胰蛋白酶活性。采用南京建成生物工程研究所试剂盒测定,其中淀粉酶采用C016试剂盒,胰蛋白酶采用A080-2试剂盒。
1.4.2.2 盲肠内容物细菌多样性收集26、56和78日龄各组所屠宰的3只鸡的盲肠内容物,采用E.Z.N.A.TM Soil DNA Kit试剂盒(OMEGA公司)提取盲肠内容物细菌总DNA,将提取的DNA分装保存于-20 ℃冰箱备用。
采用聚合酶链式反应-变性梯度凝胶电泳(PCR-DGGE)技术测定盲肠内容物细菌群落结构多样性。采用细菌通用引物F357-GC/R518,对提取的DNA样品的16S rDNA基因V3区基因片段进行PCR扩增,引物均由北京奥科鼎盛生物科技有限公司合成,引物序列见表 2。
|
|
表 2 细菌引物序列 Table 2 Primer sequences of bacteria |
PCR反应体系为25 μL:上游和下游引物各0.5 μL,DNA模板1 μL,Premix Mix 12.5 μL,灭菌超纯水10.5 μL。PCR反应程序:94 ℃预变性5 min;94 ℃变性30 s,66.2 ℃退火30 s,72 ℃延伸1 min,35个循环;72 ℃再延伸5 min;4 ℃保存。PCR程序结束后将所得产物于2%琼脂糖凝胶、130 V电压下电泳23 min,采用凝胶成像系统检测目的条带,并拍照记录。采用BIO-RAD DCodeTM Universal Mutation Detection System(基因突变检测系统)对细菌PCR产物进行DGGE分析。
使用Quantity One软件分析DGGE图谱,并计算Shannon’s多样性指数[10]。
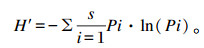
|
式中:H′为Shannon’s多样性指数,H′值越大说明样品的多样性程度越高;s为每个泳道条带数;Pi为每个条带强度占总条带强度的比例。
利用Phroetix-1D(Totallb)和Phroetix-1D Pro(Totallb)软件对DGGE电泳图谱进行相似性分析,得到各个泳道间的相似性指数,即戴斯系数(Dice’s coefficient,Cs),根据Cs得到各个泳道相似性系数矩阵图,用非加权组平均法(unweighted pair group mean average,UPGMA)将相似性系数矩阵转化为相似性聚类树状图,然后对聚类树状图进行分析。
1.5 数据统计分析数据统计结果用平均值±标准误(meam±SE)表示,数据分析时依据试验设计对所获数据进行单因素方差分析(one-way ANOVA),采用SPSS 17.0软件中的Duncan氏法进行多重比较检验分析,P < 0.05表示差异显著,P>0.05表示差异不显著。
2 结果与分析 2.1 饮用发酵菌液对肉鸡生长性能的影响饮用发酵菌液对肉鸡生长性能的影响见表 3。由表可知,各阶段各组间肉鸡的体重、平均日增重和平均日采食量均无显著差异(P>0.05)。14~26日龄,各组间的料重比无显著差异(P>0.05);27~56日龄,F组的料重比显著低于空白对照组(P < 0.05),其余各组间无显著差异(P>0.05);57~78日龄,C和D组的料重比显著低于空白对照组(P < 0.05),其余各组间无显著差异(P>0.05);14~78日龄,C和D组的料重比显著低于空白对照组(P < 0.05),其余各组间无显著差异(P>0.05)。值得注意的是,各饮用发酵菌液组的生长性能指标与抗生素对照组相比均无显著差异(P>0.05)。
|
|
表 3 饮用发酵菌液对肉鸡生长性能的影响 Table 3 Effects of drinking fermented microorganism inoculants on growth performance of broilers |
淀粉酶和蛋白酶是肉鸡肠道内重要的消化酶,其活性高低反映了肉鸡对营养物质的利用能力,直接影响肉鸡的生长性能,因此本试验测定了各组肉鸡不同日龄时的十二指肠内容物淀粉酶和胰蛋白酶活性。
2.2.1.1 淀粉酶活性饮用发酵菌液对肉鸡十二指肠内容物淀粉酶活性的影响见表 4。由表可知,26日龄时,C组肉鸡的十二指肠内容物淀粉酶活性最高,抗生素对照组其次,空白对照组最低,但各组间无显著差异(P>0.05)。56日龄时,C、D、E和F组的十二指肠内容物淀粉酶活性均高于空白对照组,且F组显著高于空白对照组和E组(P < 0.05),其余各组间差异不显著(P>0.05)。78日龄时,抗生素对照组、C和D组的十二指肠内容物淀粉酶活性均略高于空白对照组,但各组间差异不显著(P>0.05)。
|
|
表 4 饮用发酵菌液对肉鸡十二指肠内容物淀粉酶活性的影响 Table 4 Effects of drinking fermented microorganism inoculants on amylase activity in duodenal contents of broilers |
饮用发酵菌液对肉鸡十二指肠内容物胰蛋白酶活性的影响见表 5。由表可知,26日龄时,C组肉鸡的十二指肠内容物胰蛋白酶活性显著高于空白对照组、抗生素对照组和D组(P < 0.05),表明与空白对照组相比,14日龄起饮用发酵菌液1可提高26日龄肉鸡的十二指肠内容物胰蛋白酶活性,促进机体对饲粮蛋白质的消化吸收。56日龄时,抗生素对照组的十二指肠内容物胰蛋白酶活性最高,空白对照组最低,且2组间差异显著(P < 0.05);除F组外,各饮用发酵菌液组的十二指肠内容物胰蛋白酶活性均略高于空白对照组,但差异不显著(P>0.05)。78日龄时,各饮用发酵菌液组的十二指肠内容物胰蛋白酶活性均高于空白对照组,且以C组最高,C组显著高于空白对照组和E组(P < 0.05),其余各组间差异不显著(P>0.05)。这说明,与空白对照组相比,14日龄起饮用发酵菌液1可提高78日龄肉鸡的十二指肠内容物胰蛋白酶活性,进而促进机体对蛋白质的消化吸收。
|
|
表 5 饮用发酵菌液对肉鸡十二指肠内容物胰蛋白酶活性的影响 Table 5 Effects of drinking fermented microorganism inoculants on trypsin activity in duodenal contents of broilers |
利用Quantity One软件对PCR-DGGE电泳图谱进行分析,并计算多样性指数,结果见表 6。由表可知,26日龄时,各组肉鸡的盲肠内容物细菌多样性指数以抗生素对照组为最低,且显著低于空白对照组和C组(P < 0.05),其余各组间无显著差异(P>0.05),表明与空白对照组相比,饲粮中添加维吉尼霉素显著抑制了26日龄肉鸡的盲肠内容物细菌多样性,而饮用发酵菌液则无显著影响,这也说明饮用发酵菌液未显著影响26日龄肉鸡盲肠菌群的形成和发展。56日龄时,各组的盲肠内容物细菌多样性指数以饮用发酵菌液2的D和F组略高;与抗生素对照组和空白对照组相比,除E组外,其他饮用发酵菌液组的盲肠内容物细菌多样性指数均有所提高,但各组间差异不显著(P>0.05)。78日龄时,空白对照组的盲肠内容物细菌多样性指数最低,其次为抗生素对照组,各饮用发酵菌液组均高于对照组,且D和E组显著高于其他各组(P < 0.05),说明饮用发酵菌液可在一定程度上提高78日龄肉鸡的盲肠内容物细菌多样性。
|
|
表 6 饮用发酵菌液对肉鸡盲肠内容物细菌多样性指数的影响 Table 6 Effects of drinking fermented microorganism inoculants on diversity index of bacteria in cecum contents of broilers |
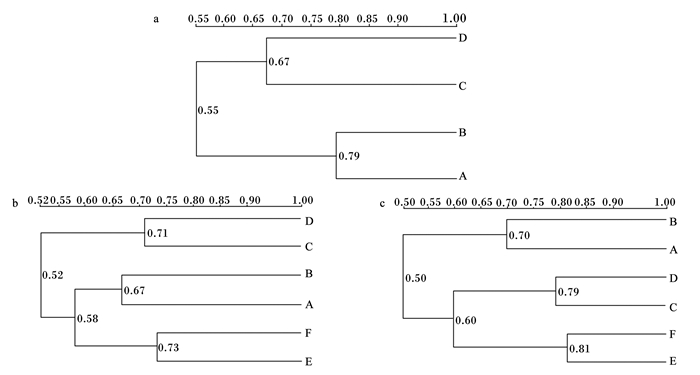
26日龄肉鸡盲肠内容物细菌群落结构相似性的聚类分析见图 1-a。由图可知,各组间相似性为0.55,其中空白对照组和抗生素对照组可先归为一类,相似性为0.79;C和D组归为一类,相似性为0.67。由于肉鸡盲肠微生物在6~7周龄才能建立起相对稳定的群落结构[11],因此在该阶段肉鸡盲肠微生物数量和种类变化较大[12],外源微生物的进入会使其种类发生变化,表现为与空白对照组的细菌群落结构相似性降低。56日龄肉鸡盲肠内容物细菌群落结构相似性的聚类分析如图 1-b。由图可知,抗生素对照组和空白对照组同样先归为一类,相似性为0.67;C和D组归为一类,相似性为0.71;E和F组归为一类,相似性为0.73。这说明在相同起始日龄饮用发酵菌液可促使盲肠细菌群落结构趋于一致,且与26日龄相比,C和D组的细菌群落结构相似性从0.67提高至0.71,说明继续饮用发酵菌液会使盲肠细菌群落结构更加相似,更好地促进盲肠细菌群落结构的建立与稳定。78日龄肉鸡盲肠内容物细菌群落结构相似性的聚类分析如图 1-c。由图可知,抗生素对照组和空白对照组同样先归为一类,相似性为0.70;C和D组归为一类,相似性为0.79;E和F组归为一类,相似性为0.81。由此说明,相同起始日龄饮用发酵菌液确实促进盲肠内容物细菌群落结构趋于一致,且78日龄与56日龄相比,C和D组的细菌群落结构相似性从0.71提高至0.79,E和F组的细菌群落结构相似性从0.73提高至0.81,表明持续饮用发酵菌液提高了盲肠内容物细菌群落结构的相似性和稳定性。
|
a:26日龄;b:56日龄;c:78日龄。 a: 26 days of age; b: 56 days of age; c: 78 days of age. 图 1 不同日龄肉鸡盲肠内容物细菌群落结构相似性的聚类分析 Figure 1 Clustering analysis on the similarity of bacterial community structure in cecum contents of broilers at different days of age |
微生态制剂在畜禽生产上的应用已经非常普遍,且研究表明饲粮中添加微生态制剂具有提高畜禽增重和饲料转化率的作用[13-14]。发酵菌液是由有益菌属培养而成的微生物液体制剂,目前在畜禽生产上的应用主要有饲粮中添加、饮水中添加、用于消毒和粪便处理等[15]。本试验将2种发酵菌液按肉鸡不同饲养阶段添加到饮水中后,发现与空白对照组相比,14日龄起饮用发酵菌液能显著降低饲养期肉鸡的料重比,而27日龄起饮用发酵菌液也降低了饲养期肉鸡的料重比,但无显著差异,2种发酵菌液间也无显著差异,说明14日龄起比27日龄起在饮水中添加发酵菌液更有利于提高养殖效率,取得更好的养殖效果。其原因可能是随着连续饮用发酵菌液,肉鸡逐步适应并建立了该条件下的肠道菌群,保证了肉鸡肠道健康并促进了对营养物质的消化吸收,由此显著降低了肉鸡的料重比,提高了养殖效益[16-17]。郭伶等[18]研究酵母培养物对肉仔鸡生长性能的影响,发现21~42日龄时试验组的料重比与对照组相比降低4.85%,说明饲喂酵母培养物对肉鸡的生长性能具有显著的促进作用,与本试验结果一致。
本研究还设置了抗生素对照组,以确定饮用发酵菌液替代维吉尼霉素的养殖效果,结果表明,与抗生素对照组相比,各饮用发酵菌液组肉鸡的平均日增重、平均日采食量和料重比等指标均无显著差异,且27日龄起饮用发酵菌液1的试验组和14日龄起饮用发酵菌液2的试验组显著增加盲肠内容物细菌多样性,14日龄起饮用发酵菌液1的试验组还能够有效提高26和78日龄肉鸡的十二指肠内容物胰蛋白酶活性,说明可在矮脚黄肉鸡养殖过程中用饮用发酵菌液替代饲粮中添加维吉尼霉素。丁小娟等[19]在研究酿酒酵母培养物替代抗生素的效果时得出,添加酿酒酵母培养物显著提高肉仔鸡的平均日增重和平均日采食量,料重比有一定程度改善,但无显著差异,与本研究结果一致。罗正等[20]研究也表明,益生菌可以替代促生长类兽用抗生素在肉鸡养殖中的应用。
3.2 饮用发酵菌液对肉鸡消化酶活性的影响微生态制剂作用于动物机体时,会通过自身所产生的多种酶类提高动物对营养物质的消化能力,进而提高饲料转化率,提高动物生长性能[21]。淀粉酶和蛋白酶是肉鸡肠道内重要的消化酶,研究指出,食糜在家禽小肠中停留时间最长[22],因此小肠消化酶活性的高低直接反映动物机体对营养物质的利用能力[23]。
本研究通过在饮水中添加发酵菌液研究其对肉鸡十二指肠内容物胰蛋白酶和淀粉酶活性的影响,结果显示,各饲养阶段均以空白对照组的酶活性略低,14日龄起饮用发酵菌液1的试验组26和78日龄时的十二指肠内容物胰蛋白酶活性显著高于空白对照组,这表明饮用发酵菌液可在一定程度上提高肉鸡十二指肠消化酶活性,增强对饲粮蛋白质和碳水化合物的消化吸收,进而降低肉鸡的料重比,提高饲料转化率。这可能是14日龄起饮用发酵菌液1组肉鸡的料重比显著低于空白对照组的原因之一。
3.3 饮用发酵菌液对肉鸡盲肠菌落结构的影响鸡的胃肠道中,盲肠含有数量最多的微生物,每克内容物可含1011个微生物[24],且多样性高,因此鸡的盲肠微生物成为人们研究关注的焦点。Mountzouris等[25]采用荧光原位杂交(FISH)技术分析肉鸡盲肠微生物时发现,饲粮中添加复合微生态制剂能够显著提高盲肠中双歧杆菌数量,有益菌群增加,从而提高肉鸡体增重。本研究通过PCR-DGGE技术分析饮用发酵菌液对肉鸡盲肠内容物细菌多样性及相似性的影响,细菌多样性指数的研究结果表明,与空白对照组相比,在肉鸡饮水中添加发酵菌液后,26和56日龄时未显著影响肉鸡肠道正常菌群的形成和发展,但提高了78日龄肉鸡的盲肠细菌多样性;同时,与抗生素对照组相比,饮用发酵菌液有利于26日龄肉鸡肠道正常菌群的形成和发展,而且可以提高78日龄肉鸡的盲肠内容物细菌多样性。细菌多样性提高意味着肠道菌群更易趋于稳定,更易维持肠道健康,进而有助于提高肉鸡的生长性能[26-27]。丁小娟等[19]研究表明,酿酒酵母培养物促进肠道中乳酸菌、双歧杆菌的增殖,抑制大肠杆菌的增殖,因此促进了肠道健康。
细菌群落结构相似性的研究结果表明,饮用发酵菌液组肉鸡的盲肠内容物细菌群落结构趋于一致,而且越到试验后期相似性越高,与此相反的是,越到试验后期饮用发酵菌液组与空白对照组盲肠细菌群落结构的相似性越低,这预示着饮用发酵菌液后可在盲肠内形成相对更为丰富而且不同于空白对照组的细菌群落结构,而且这种细菌群落结构可能能够更有效地消化吸收营养成分,进而使发酵菌液组肉鸡的料重比降低。
4 结论饲养矮脚黄肉鸡时,14日龄起饮用以酵母菌为主要成分的发酵菌液能在盲肠内形成相对更为丰富的细菌群落结构,有效提高26和78日龄肉鸡的十二指肠内容物胰蛋白酶活性,进而显著降低14~78日龄的料重比,提高养殖效率。
| [1] |
HU C, QI Y C. Long-term effective microorganisms application promote growth and increase yields and nutrition of wheat in China[J]. European Journal of Agronomy, 2013, 46: 63-67. DOI:10.1016/j.eja.2012.12.003 |
| [2] |
刘志健, 姜君. EM菌对育肥猪生产性能及猪舍内有害气体浓度的影响[J]. 黑龙江畜牧兽医, 2015(22): 62-63. |
| [3] |
王欣.植物乳杆菌及其培养物对肉仔鸡生长性能和免疫功能的影响[D].硕士学位论文.长春: 吉林农业大学, 2015. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=ZGXM201613014&dbname=CJFD&dbcode=CJFQ
|
| [4] |
马海东, 高印, 高康, 等. 产木聚糖酶乳酸杆菌对肉仔鸡生产性能、免疫器官指数及血清指标的影响[J]. 家畜生态学报, 2014, 35(4): 29-33. DOI:10.3969/j.issn.1673-1182.2014.04.006 |
| [5] |
NORDESTE R, TESSEMA A, SHARMA S, et al. Molecules produced by probiotics prevent enteric colibacillosis in pigs[J]. BMC Veterinary Research, 2017, 13(1): 335. DOI:10.1186/s12917-017-1246-6 |
| [6] |
袁玲, 许丽, 徐基利, 等. 乳酸菌菌体及全菌液制剂对雏鸡生长性能和盲肠菌群的影响[J]. 中国畜牧杂志, 2011, 47(13): 59-62. |
| [7] |
姚红. 酵母菌培养物与低聚木糖合用对蛋用雏鸡生长性能及免疫功能的影响研究[J]. 山东畜牧兽医, 2017, 38(11): 14-15. DOI:10.3969/j.issn.1007-1733.2017.11.008 |
| [8] |
张彩凤, 王晓翠, 张海军, 等. 乳酸菌和酵母菌复合制剂对肉仔鸡生长性能、屠宰性能和肠道健康的影响[J]. 动物营养学报, 2017, 29(4): 1248-1256. DOI:10.3969/j.issn.1006-267x.2017.04.021 |
| [9] |
MUYZER G, DE WAAL E C, UITTERLINDEN A G. Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S rRNA[J]. Applied and Environmental Microbiology, 1993, 59(3): 695-700. |
| [10] |
高亦豹.聚合酶链式反应-变性梯度电泳技术(PCR-DGGE)研究中国白酒大曲中微生物群落结构[D].硕士学位论文.无锡: 江南大学, 2010. http://cdmd.cnki.com.cn/article/cdmd-10295-1011042194.htm
|
| [11] |
王桂军, 魏建忠, 李郁. 肠道共生微生物群落与家禽健康[J]. 中国畜牧兽医, 2007, 34(02): 153-155. DOI:10.3969/j.issn.1671-7236.2007.02.057 |
| [12] |
MESA D, LAMMEL D R, BALSANELLI E, et al. Cecal microbiota in broilers fed with prebiotics[J]. Frontiers in Genetics, 2017, 8: 153. DOI:10.3389/fgene.2017.00153 |
| [13] |
ALKHALF A, ALHAJ M, AL-HOMIDAN I. Influence of probiotic supplementation on blood parameters and growth performance in broiler chickens[J]. Saudi Journal of Biological Sciences, 2010, 17(3): 219-225. DOI:10.1016/j.sjbs.2010.04.005 |
| [14] |
SEN S, INGALE S L, KIM Y W, et al. Effect of supplementation of Bacillus subtilis LS 1-2 to broiler diets on growth performance, nutrient retention, caecal microbiology and small intestinal morphology[J]. Research in Veterinary Science, 2012, 93(1): 264-268. DOI:10.1016/j.rvsc.2011.05.021 |
| [15] |
SHOKRYAZDAN P, FASELEH M J, LIANG J B, et al. Probiotics:from isolation to application[J]. Journal of the American College of Nutrition, 2017, 36(8): 666-676. DOI:10.1080/07315724.2017.1337529 |
| [16] |
殷璐瑶, 行浩, 杨海明, 等. 益生菌对蛋鸡早期生长、饲粮养分利用和肠道菌群的影响[J]. 动物营养学报, 2017, 29(8): 2800-2807. DOI:10.3969/j.issn.1006-267x.2017.08.024 |
| [17] |
冯会贤.益生菌的制备及其对固始鸡生产性能、免疫性能和肠道微生态的影响[D].硕士学位论文.郑州: 河南农业大学, 2015.
|
| [18] |
郭伶, 陈宝利. 酵母培养物对肉仔鸡生长性能及免疫功能的影响[J]. 中国家禽, 2013, 35(7): 24-26. DOI:10.3969/j.issn.1004-6364.2013.07.008 |
| [19] |
丁小娟, 张晓图, 王世琼, 等. 酿酒酵母培养物对817肉仔鸡生长性能、养分表观利用率及肠道菌群的影响[J]. 动物营养学报, 2017, 29(7): 2391-2398. DOI:10.3969/j.issn.1006-267x.2017.07.022 |
| [20] |
罗正, 张得玉, 孙业贵, 等. 益生菌替代肉鸡饲料中促生长抗生素的田间试验[J]. 饲料工业, 2014, 35(13): 22-24. |
| [21] |
陈静, 谢全喜, 刘乃芝, 等. 复合微生态制剂与饲用抗生素对肉鸡血清生化指标和肠道酶活性的影响[J]. 畜牧与饲料科学, 2012, 33(3): 15-18. DOI:10.3969/j.issn.1672-5190.2012.03.007 |
| [22] |
高俊勤.木聚糖酶对肉仔鸡肠道消化特性及微生物区系的影响[D].硕士学位论文.南京: 南京农业大学, 2007. http://cdmd.cnki.com.cn/Article/CDMD-10307-2008031036.htm
|
| [23] |
张亚伟, 李桂冠, 杨海增, 等. 饲喂蒸汽压片玉米对蛋鸡采食量、产蛋性能、蛋品质和小肠消化酶活性的影响[J]. 中国饲料, 2016(18): 39-42. |
| [24] |
SALANITRO J P, FAIRCHILDS I G, ZGORNICKI Y D. Isolation, culture characteristics, and identification of anaerobic bacteria from the chicken cecum[J]. Applied Microbiology, 1974, 27(4): 678-687. |
| [25] |
MOUNTZOURIS K C, DALAKA E, PALAMIDI I, et al. Evaluation of yeast dietary supplementation in broilers challenged or not with Salmonella on growth performance, cecal microbiota composition and Salmonella in ceca, cloacae and carcass skin[J]. Poultry Science, 2015, 94(10): 2445-2455. DOI:10.3382/ps/pev243 |
| [26] |
WANG Y, SUN J, ZHONG H, et al. Effect of probiotics on the meat flavour and gut microbiota of chicken[J]. Scientific Reports, 2017, 7: 6400. DOI:10.1038/s41598-017-06677-z |
| [27] |
GAO P F, MA C, SUN Z, et al. Feed-additive probiotics accelerate yet antibiotics delay intestinal microbiota maturation in broiler chicken[J]. Microbiome, 2017, 5: 91. DOI:10.1186/s40168-017-0315-1 |




