维生素B12是人和动物体内非常重要的水溶性维生素之一,具有广泛的生理作用,其最重要的作用是参与细胞内DNA生物合成和蛋白质代谢。缺乏维生素B12可能导致机体的红细胞DNA合成障碍,细胞分裂增殖受阻,红细胞体积变大,核染色质疏松,发生巨幼红细胞性贫血[1]。动物体内维生素B12缺乏时表现为厌食、生长不良、贫血等[2-3]。肠道微生物系统作为动物肠道内最复杂的微生态系统,其中的大量微生物参与养分的吸收、分布、代谢以及机体的免疫,并影响动物生长和健康[4]。动物肠道微生物可以产生大量益生菌,且肠道中的有益菌群在提高营养物质利用以及维护动物机体健康等方面起了很大的作用。为此,深入研究维生素B12对肠道菌群结构、养分利用率和生产性能的影响系对指导畜禽饲粮配制具有重要意义。食物中的维生素B12与蛋白质结合,进入人体消化道内,在胃酸、胃蛋白酶及胰蛋白酶的作用下维生素B12被释放,并与胃黏膜细胞分泌的一种糖蛋白内因子(IF)结合,维生素B12-IF复合物在回肠被吸收。机体肠道内的正常微生物,如双歧杆菌、乳酸杆菌等,能合成多种人体生长发育必需的B族维生素。黄苇等[5]研究表明,饲粮中添加0.008 mg/kg维生素B12能显著提高肉雏鸡的体重。目前,维生素B12在动物机体中的吸收和功能方面已有许多研究,但是有关研究维生素B12与肠道微生物关系的报道还较少,尤其是从分子水平上探索维生素B12与鹅生长性能、肠道发育与盲肠菌群结构的关系的研究还处于空白。鉴于此,本试验通过在饲粮中添加不同水平的维生素B12,研究其对鹅生长性能和肠道发育的影响,并利用16S rRNA高通量测序技术对鹅的盲肠菌群结构进行分析,比较盲肠菌群组成和结构,旨在探索维生素B12与肠道菌群结构的关系,科学确定5~15周龄鹅对维生素B12的需要量,为制订鹅营养需要量标准提供依据。
1 材料与方法 1.1 试验材料基础饲粮的配制以NRC(1994)[6]家禽营养需要为主要参考依据,其组成及营养水平见表 1。采用高效液相色谱法测得基础饲粮中不含维生素B12。试验所用维生素B12制剂(宁夏金维制药股份有限公司产品)的有效物质含量为1%。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
试验用鹅由国家水禽产业技术体系育种基地高密银河润雁鹅业有限公司提供。选择初始平均体重差异不显著(P>0.05)的360只4周龄末五龙鹅,随机分为6个组,每组6个重复,每个重复10只(公母各1/2)。Ⅰ组为对照组,饲喂不添加维生素B12的基础饲粮(实测基础饲粮中维生素B12含量为0),Ⅱ~Ⅵ组为试验组,分别饲喂在基础饲粮基础上添加0.005、0.010、0.015、0.020、0.025 mg/kg维生素B12的试验饲粮。试验期为11周。
1.3 饲养管理饲养试验开始前对鹅舍及器具进行冲洗和烧碱水喷雾消毒,然后用福尔马林和高锰酸钾熏蒸,密闭门窗24 h。采用网床饲养方式,全期自由采食与饮水。试验期间育雏舍为常温,采用自然光照。
1.4 样品采集与指标测定 1.4.1 样品的采集在15周龄末,空腹称重后各重复随机选择2只鹅(公母各占1/2),6个组共72只,颈静脉放血致死后迅速剖开腹腔,无菌操作取出盲肠,迅速收集到冻存管中,液氮速冻后转移到-80 ℃冰箱保存待测;每组分别取6只上述采集过盲肠的鹅,剪取近l cm的空肠段,用生理盐水清洗表面食糜后,迅速放入10%甲醛固定液中固定,常温放置过夜后置于4 ℃冰箱,待制作组织切片。
1.4.2 生长性能指标计算饲养试验结束后停饲6 h,然后逐只空腹称重,统计各组试验鹅的体重和增重情况,计算终末体重(FBW)、平均日增重(ADG)、平均日采食量(ADFI)和料重比(F/G)。
1.4.3 肠道组织切片测定方法将已经固定好的组织进行修整、水洗、脱水、透明、浸蜡、包埋、切片和苏木精-伊红(HE)染色,制成组织切片。每组选取6张组织切片,在10×10倍显微镜下测量空肠绒毛高度(VH)、隐窝深度(CD)、VH与CD的比值(V/C)。
1.4.4 盲肠微生物总DNA的提取对每个样品进行单独测定,采用天根生化科技有限公司的基因组DNA试剂盒提取出盲肠微生物总DNA。
1.4.5 盲肠微生物总DNA的定量和纯度检测DNA含量用DNA定量仪进行测定,DNA纯度用OD260/OD280进行表述,同时用0.8%琼脂糖凝胶电泳检测DNA片段大小。
1.4.6 PCR扩增及细菌16S rDNA测序分析细菌16S rRNA(V3+V4)区域引物:5′-ACTCCTACGGGAGGCAGCA-3′(上游引物);5′-GGACTACHVGGGTWTCTAAT-3′(下游引物)。样品检测时PCR试验的程序如下:95 ℃预变性5 min,95 ℃变性30 s,50 ℃退火30 s,72 ℃延伸40 s,共25个循环。
1.5 数据统计与分析利用SPSS 17.0软件中GLM程序进行主效应分析,再用ANOVA程序对数据进行方差分析,存在显著差异时,再用LSD法进行组间的多重比较,以P<0.05作为差异显著性判断标准。将优化序列进行聚类,划分操作分类单元(OTU),基于OTU分析结果,对样品在各个分类水平上进行分析,获得各样品在纲、科、属分类学水平上的群落结构图。
2 结果与分析 2.1 饲粮中维生素B12添加水平对五龙鹅生长性能的影响由表 2可知,饲粮添加不同水平的维生素B12对鹅的FBW和ADG有显著影响(P<0.05)。其中,Ⅱ~Ⅳ组的FBW显著或极显著高于对照组(P<0.05或P<0.01),Ⅲ~Ⅳ组的ADG显著或极显著高于对照组(P<0.05或P<0.01)。Ⅱ~Ⅵ组的ADFI和F/G与对照组差异不显著(P>0.05)。Ⅴ、Ⅵ组鹅的FBW、ADG、ADFI和F/G均无显著差异(P>0.05),即维生素B12添加水平由0.020 mg/kg增加到0.025 mg/kg时,对FBW、ADG、ADFI和F/G均无显著影响(P>0.05)。
|
|
表 2 饲粮中维生素B12添加水平对五龙鹅生长性能的影响 Table 2 Effects of vitamin B12 supplemental level on growth performance of Wulong geese |
|
|
表 3 饲粮中维生素B12添加水平对五龙鹅空肠VH、CD和V/C的影响 Table 3 Effects of vitamin B12 supplemental level on VH, CD and V/C in jejunum of Wulong geese |
将FBW(YFBW)、ADG(YADG)分别与维生素B12添加水平(X)进行二次曲线拟合,建立的回归方程如下:
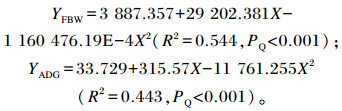
|
由上述回归方程得出:饲粮中维生素B12添加水平为0.012 6 mg/kg时FBW最大,添加水平为0.013 4 mg/kg时ADG最大。从综合效益角度分析,建议5~15周龄五龙鹅饲粮中维生素B12添加水平为0.012 6~0.013 4 mg/kg。
2.2 饲粮中维生素B12添加水平对五龙鹅空肠黏膜形态的影响 2.2.1 饲粮中维生素B12添加水平对五龙鹅空肠VH、CD及V/C的影响由表 3可知,随着维生素B12添加水平的升高,空肠VH呈现先升高后降低的趋势,且Ⅱ和Ⅲ组的VH极显著高于对照组(P<0.01),Ⅳ、Ⅴ和Ⅵ组的VH显著高于对照组(P<0.05),以Ⅲ组的VH最高;空肠CD无明显变化规律,但各试验组的CD均低于对照组,其中Ⅱ组与对照组的差异达到显著水平(P<0.05),Ⅲ~Ⅵ组与对照组的差异达到极显著水平(P<0.01),以Ⅲ组的CD最低;空肠V/C无明显变化规律,但各试验组的V/C均显著或极显著大于对照组(P<0.05或P<0.01),其中以Ⅲ组的V/C最大。这表明,饲粮中添加适宜水平的维生素B12能够促进五龙鹅空肠发育。
2.2.2 空肠绒毛组织切片由图 1可以看出,对照组的空肠VH均比各试验组低,且CD较深。Ⅱ和Ⅲ组的VH高且排列较整齐,CD较浅,表明饲粮中添加适宜水平的维生素B12对五龙鹅空肠绒毛形态有积极影响。

|
图 1 鹅空肠组织切片 Figure 1 Jejunal tissue sections of geese (100×) |
本试验样品测序共获得960 455对Reads,双端Reads拼接、过滤后共产生640 817条Clean tags,平均每个样品产生80 038条Clean tags。α多样性反映的是样品物种丰度及多样性。由各组α多样性指数统计结果(表 4)可以看出,Ⅲ组的OTU、ACE指数、Chao1指数最高,表明Ⅲ组盲肠菌群物种的丰度高于其他5组,Ⅴ组的Shannon指数最小,Simpson指数最高,表明Ⅴ组的群落多样性最高,个体分配最均匀。各组反映OTU的测序深度的指数覆盖率(coverage)均大于0.996,显示样本中物种被测出的概率很高。上述结果表明,饲粮中添加不同水平的维生素B12能够改变五龙鹅盲肠菌群物种的丰度和多样性。
|
|
表 4 α多样性指数 Table 4 α diversity indices |
物种累积曲线图反映了样本数量与注释到的物种数量之间的关系。由图 2可知,红色箱子组成积累曲线,随着样本数量的增加,曲线急剧上升直到曲线平缓,说明物种数量随着样本数量的增加而增加,而当样本增加到一定数量时,物种数量并不会随样本量增加持续增加。绿色箱子组成共有量曲线,随着样本数量的增加,曲线急剧下滑,表示样本中新发现的共有物种在逐渐减少,直到曲线趋于平缓,共有物种趋于饱和。上述结果表明本试验抽样充分,可以进行数据分析。
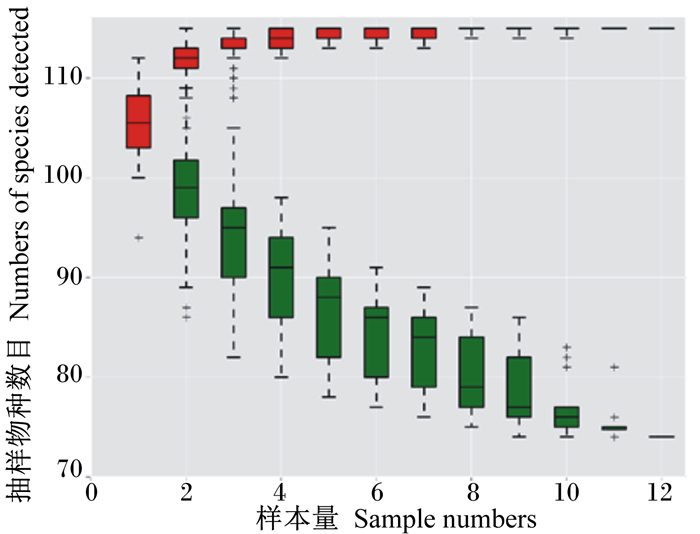
|
图 2 属水平物种累积曲线图 Figure 2 Cumulative curve chart of species in genus level |
图 3为基于β多样性分析得到的4种距离矩阵,使用R语言工具绘制的PCoA图。坐标图上距离越近的样品,相似性越大。Ⅰ组与Ⅵ组的坐标距离最近,说明二者相似性大;Ⅰ组与Ⅴ组的坐标距离最远,说明二者相似性小。上述结果表明,饲粮中维生素B12添加水平对五龙鹅盲肠菌群相似性产生了影响。
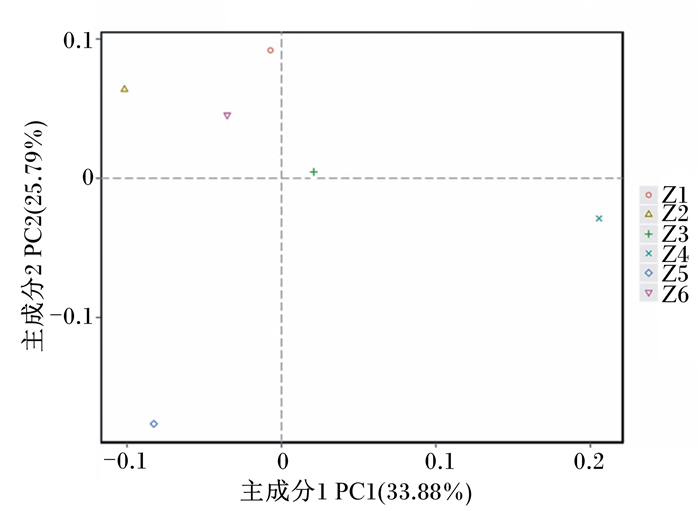
|
Z1:Ⅰ组;Z2:Ⅱ组;Z3:Ⅲ组;Z4:Ⅳ组;Z5:Ⅴ组;Z6:Ⅵ组。下图同。 Z1: group Ⅰ; Z2: group Ⅱ; Z3: group Ⅲ; Z4: group Ⅳ; Z5: group Ⅴ; Z6: group Ⅵ. The same as below. 图 3 PCoA图 Figure 3 PCoA chart |
图 4显示的是饲粮维生素B12添加水平对五龙鹅盲肠菌群纲水平相对丰度的影响。在相似性97%的纲水平下,分别计算盲肠样本微生物纲的相对丰度,其中拟杆菌纲(Bacteroidia)和梭菌纲(Clostridia)、δ-变形菌纲(Deltaproteobacteria)为主要的优势菌纲。对五龙鹅盲肠中排名前5的优势菌纲进行组间比较,结果见表 5。由表可知,Ⅵ组中拟杆菌纲的相对丰度最高,为53.40%,显著或极显著高于其他组(P<0.05或P<0.01);Ⅳ组中梭菌纲的相对丰度最高,为27.60%,显著或极显著高于其他组(P<0.05或P<0.01);Ⅴ组中δ-变形菌纲的相对丰度最高,为19.80%,显著或极显著高于其他组(P<0.05或P<0.01);Melainabacteria在Ⅲ组中相对丰度最高,为6.14%;脱铁杆菌纲(Deferribacteres)在Ⅱ组中相对丰度最高,为12.45%。可见,饲粮中添加不同水平的维生素B12使五龙鹅的盲肠菌群纲水平相对丰度发生了变化,其中梭菌纲、拟杆菌纲和δ-变形菌纲变化明显,说明饲粮中添加不同水平的维生素B12能够改变五龙鹅盲肠优势菌群纲水平相对丰度。
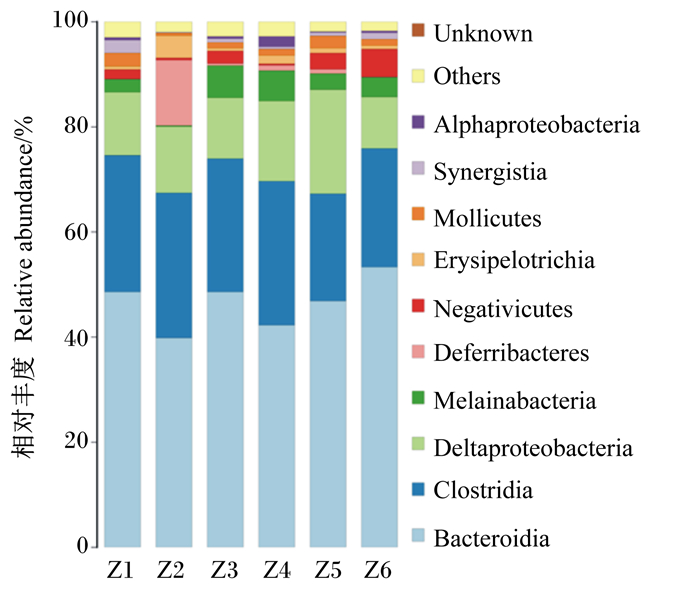
|
Unknown:未知;Others:其他;Alphaproteobacteria:α-变形菌纲;Synergisia:互养菌纲;Mullicutes:柔膜菌纲;Erysipelotrichia:丹毒丝菌纲;Deferribacteres:脱铁杆菌纲;Deltaproteobacteria:δ-变形菌纲;Clostridia:梭菌纲;Bacteroidia:拟杆菌纲。 图 4 纲水平物种分布柱状图 Figure 4 Distribution histogram of species in class level |
|
|
表 5 各组纲水平优势菌相对丰度 Table 5 Relative abundances of dominant microorganisms in class level of each group |
图 5显示的是饲粮维生素B12添加水平对鹅盲肠菌群科水平相对丰度的影响。在科水平上,相对丰度较高的为拟杆菌科(Bacteroidaceae)、疣微菌科(Ruminococcaceae)、脱磷弧菌科(Desulfovibrionaceae)。对五龙鹅盲肠中排名前5的优势菌科进行组间比较,结果见表 6。由表可知,Ⅴ组中拟杆菌科相对丰度为31.12%,与Ⅱ、Ⅲ和Ⅵ组差异不显著(P>0.05),显著或极显著高于其他组(P<0.05或P<0.01);Ⅲ组中疣微菌科相对丰度最高,为17.60%,显著高于Ⅱ组(P<0.05);Ⅴ组中脱磷弧菌科的相对丰度最高,为19.78%,或极显著高于其他组(P<0.05或P<0.01);Ⅰ组中普雷沃氏菌科(Prevotellaceae)的相对丰度最高,为7.43%,显著高于Ⅱ和Ⅳ组(P<0.05);Ⅳ组中未知菌类(unknown-bacterium)的相对丰度最高,为7.33%,与Ⅲ组差异不显著(P>0.05),显著或极显著高于其他组(P<0.05或P<0.01)。可见,饲粮中添加不同水平的维生素B12使五龙鹅的盲肠菌群科水平相对丰度发生了变化,其中拟杆菌科、疣微菌科和脱磷弧菌科变化明显,这说明饲粮中添加不同水平的维生素B12能够改变五龙鹅盲肠优势菌群科水平相对丰度。
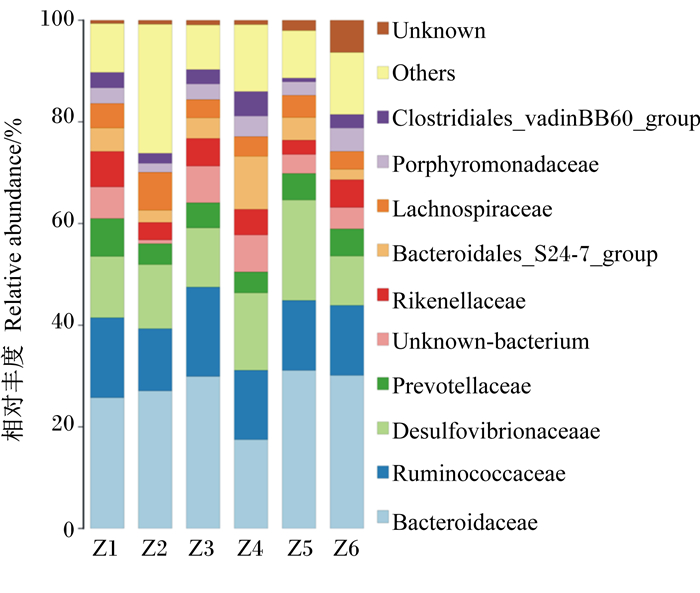
|
Unknown:未知;Others:其他;Porphyromonadaceae:紫单胞菌科;Lachnospiraceae:毛螺菌科;Bacteroidales_S24-7_group:拟杆菌目S24-7组;Rikenellaceae:理研菌科;Unknow-bacterium:未知菌类;Prevotellaceae:普雷沃氏菌科;Desulfovibrionaceae:脱磷弧菌科;Ruminococcaceae:疣微菌科;Bacteroidaceae:拟杆菌科。 图 5 科水平物种分布柱状图 Figure 5 Distribution histogram of species in family level |
|
|
表 6 各组科水平优势菌相对丰度 Table 6 Relative abundances of dominant microorganisms in family level of each group |
图 6显示的是饲粮维生素B12添加水平对鹅盲肠菌群属水平相对丰度的影响。在属水平上,相对丰度较高的为拟杆菌属(Bacteroides)、未知菌类、脱磷弧菌属(Desulfovibrio)。对五龙鹅盲肠中排名前5的优势菌属进行组间比较,结果见表 7。由表可知,Ⅴ组中拟杆菌属的相对丰度最高,为31.12%,显著高于Ⅰ组(P<0.05),极显著高于Ⅳ组(P<0.01);Ⅳ组中未知菌类的相对丰度最高,为27.49%,显著或极显著高于其他组(P<0.05或P<0.01);Ⅳ组中脱磷弧菌属的相对丰度最高,为19.75%,显著或极显著高于其他组(P<0.05或P<0.01);Ⅳ组中另枝菌属(Alistipes)的相对丰度最高,为4.70%,显著高于Ⅰ和Ⅱ组(P<0.05);Ⅱ组中Mucispirillum的相对丰度最高,为12.45%,显著高于其他组(P<0.05)。可见,饲粮中添加不同水平的维生素VB12使五龙鹅的盲肠菌群科水平相对丰度发生了变化,其中拟杆菌属和脱磷弧菌属变化明显,这说明饲粮中添加不同水平的维生素B12能够改变五龙鹅盲肠优势菌群属水平相对丰度。
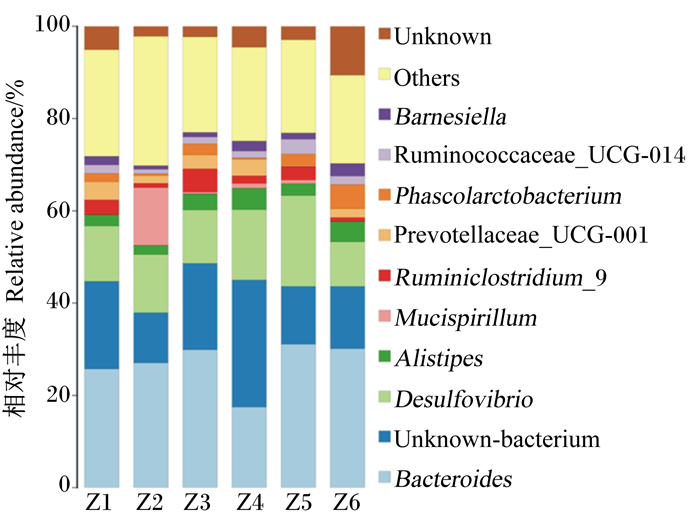
|
Unknown:未知;Others:其他;Barnesiella:巴那斯拉菌属;Ruminococcaceae_UCG-014:瘤胃球科菌UCG-014菌属;Phascolarctobacterium:考拉杆菌属;Prevotellaceae UCG-001:普雷沃氏菌科UCG-001;Alistipes:另枝菌属;Desulfovibrio:脱磷弧菌属;Unknow-bacterium:未知菌类; Bacteroides:拟杆菌属。 图 6 属水平物种分布柱状图 Figure 6 Distribution histogram of species in genus level |
|
|
表 7 各组属水平优势菌相对丰度 Table 7 Relative abundances of dominant microorganisms in genus level of each group |
早期研宄表明,缺乏维生素B12时,肉鸡的采食量降低,体增重和饲料转化效率下降[7]。高维生素B12添加水平在夏季降低北京鸭的采食量,而冬季则对其采食量未产生显著影响[8]。维生素B12仅存在于动物性饲料中,在生产中很容易缺乏,而且动物机体维生素B12含量在正常范围不一定表示机体不缺乏维生素B12[9],鸡自身不能合成维生素B12。饲料中的维生素B12主要来源于动物性饲料,植物性饲料基本不含维生素B12,以植物性饲料为主时,动物更容易发生维生素B12缺乏[10]。维生素B12的摄入量与血清维生素B12的含量呈正相关[11-12]。老龄畜禽容易发生维生素B12缺乏,约60%是由于胃肠原因造成食物中结合的钴胺素吸收不良[13]。黄苇等[5]研究表明,无论在高能还是低能条件下,在1~21日龄肉仔鸡饲粮中添加0.008 mg/kg维生素B12均能显著提高肉雏鸡的体重。饲料中添加适宜水平的维生素B12能提高饲料转化率,促进畜禽的生长,如果缺乏,则会导致食欲不振、生长停滞、单纯贫血,严重的还伴有神经症状[14]。本试验结果表明,FBW和ADG最大时饲粮中维生素B12添加水平分别为0.012 6和0.013 4 mg/kg。
3.2 饲粮中维生素B12添加水平对鹅肠道发育的影响肠道形态结构的完整性是决定其功能正常发挥的前提,主要包括肠绒毛结构变化、肠黏膜层变化、肌层厚度变化等,动物机体主要依靠肠管上的环形皱襞、肠绒毛及绒毛上的柱状上皮细胞来吸收和消化营养物质[15]。研究发现,VH影响小肠对营养物质的吸收面积,VH越高,越利于营养物质吸收[16]。本试验结果表明,随着维生素B12添加水平的升高,空肠VH呈现先增加后降低的趋势,且添加维生素B12的各试验组的VH均高于对照组,CD均低于对照组,V/C均大于对照组,说明饲粮中适宜添加水平的维生素B12有利于促进鹅肠道发育。其主要原因是:1)维生素B12作为甲基转移酶的辅因子,参与蛋氨酸、胸腺嘧啶等的合成,例如,使甲基四氢叶酸转变为四氢叶酸,而将甲基转移给甲基受体(如同型半胱氨酸),使甲基受体成为甲基衍生物(如甲硫氨酸);2)维生素B12具有活化氨基酸和促进核酸生物合成的作用,可促进蛋白质的合成;3)维生素B12可以增加叶酸的利用率,促进碳水化合物、脂肪和蛋白质的代谢;4)维生素B12还具有促进脂肪酸代谢的作用,使脂肪、碳水化合物被机体适当运用。
3.3 饲粮中维生素B12添加水平鹅盲肠菌群结构的影响动物体内的微生态是一个极其复杂的体系,它所包含的菌群与宿主的免疫、营养、慢性感染有着密切的联系[17]。动物体内含菌群最多的部分是肠道微生态体系,这一体系对维持肠道微生态平衡有着深远影响。
本试验从PCoA可以得出,Ⅰ组与Ⅵ组坐标距离最近,物种相似性大,Ⅰ组与Ⅴ组的坐标距离最远,物种相似性小。在相似性97%的纲水平下,分别计算鹅盲肠样本微生物纲的相对丰度,发现拟杆菌纲、梭菌纲和δ-变形菌纲为主要的优势菌纲。本试验分别从纲、科、属3个层面分析了优势菌群的相对丰度的组间分布差异。在纲水平上,Ⅵ组中拟杆菌纲的相对丰度最高,Ⅳ组中梭菌纲的相对丰度最高,Ⅴ组中变形菌门的相对丰度最高;在科水平上,Ⅴ组中拟杆菌科和脱磷弧菌科的相对丰度最高,Ⅲ组中疣微菌科的相对丰度最高;在属水平上,Ⅴ组中拟杆菌属和脱磷弧菌属的相对丰度最高。对于拟杆菌的益生作用,国内外学者从不同的方面进行了大量的研究,发现拟杆菌具有促进宿主分解多糖提高养分利用率[18]、加快肠黏膜的血管形成[19]以及免疫系统发育的作用,在提高宿主的免疫力[20]、维持肠道微生态平衡[21-22]等方面均有举足轻重的作用,拟杆菌对多糖利用方面的作用尤为突出。添加维生素B12的试验组与对照组相比盲肠菌群丰度都发生了变化,其中拟杆菌表现最为明显。这说明,饲粮中不同水平维生素B12的添加改变了15周龄鹅的盲肠菌群结构,增加了肠道拟杆菌优势,从而提高了鹅机体对多糖是分解能力,增加了蛋白质、碳水化合物和脂肪的利用率,进而提高生长性能;同时,由于维生素B12加快了肠黏膜血管的形成,促进了肠道发育,扩大了肠道养分吸收面积。笔者认为,这是饲粮中添加适宜水平维生素B12能够改善鹅生长性能的主要原因。
肠道拟杆菌有多种类型,有些拟杆菌具有有益和有害两面性。只有肠道微生态处于平衡状态,机体才有得到更好发育,并处于健康状态。本试验结果表明,饲粮中添加不同水平的维生素B12导致鹅的盲肠菌群结构发生变化,其原因是由于不同添加水平的维生素B12对肠道发育和养分消化吸收产生了不同程度的影响,导致肠道不同微生物的繁殖环境发生变化,进而使得菌群结构发生变化。
4 结论① 饲粮中添加适宜水平的维生素B12可提高ADG,维生素B12添加水平过低会降低生长性能,过高则无生物学意义。
② 饲粮中维生素B12添加水平为0.015 mg/kg时,鹅的空肠VH最高,CD最低。
③ 饲粮中添加不同水平的维生素B12能够改变鹅盲肠优势菌群纲、科、属水平相对丰度;在纲水平上梭菌纲、拟杆菌纲和δ-变形菌纲变化明显,在科水平上梭菌科、疣微菌科和脱磷弧菌科变化明显,在属水平上拟杆菌属和脱磷弧菌属变化明显。
④ 以FBW和ADG为评价指标,建议5~15周龄鹅饲粮中维生素B12的添加水平为0.012 6~0.013 4 mg/kg。
| [1] |
王镜岩, 朱圣庚, 徐长法. 生物化学[M]. 13版. 北京: 高等教育出版社, 2002: 454-458.
|
| [2] |
HERBERT V, DAS K C.Folic acid and vitamin B12[C]//SHILS M E, OLSON J A, SHIKE M.Modern Nutrition in Health and Disease.Philadelphia: Lea & Febiger, 1994: 402-425.
|
| [3] |
OACES M, CHAN M.Nutrition deficiencies in animals: vitamin B12[C]//RECHCIG M M.Nutrient deficiencies in animals.Boca Raton FL: CRC, 1978: 133-141.
|
| [4] |
陈双双, 司华哲, 李光玉, 等. 动物肠道菌群与营养物质代谢的研究进展[J]. 饲料工业, 2018, 39(2): 33-36. |
| [5] |
黄苇, 侯水生, 赵玲, 等. 日粮能量水平对0-3周龄肉仔鸡维生素B12需要量的影响[J]. 中国饲料, 2001(23): 18-19. DOI:10.3969/j.issn.1004-3314.2001.23.011 |
| [6] |
NRC.Nutrient requirements of poultry[S].9th ed.Washington, D.C.: National Academy Press, 1994.
|
| [7] |
LOOI S H, RENNER R. Effect of feeding "carbohydrate-free" diets on the chick's requirement for vitamin B12[J]. The Journal of Nutrition, 1974, 104(4): 394-399. DOI:10.1093/jn/104.4.394 |
| [8] |
庆云, 袁建敏, 闫磊, 等. 钴与维生素B12对北京鸭生产性能及生理生化指标的影响[J]. 中国畜牧杂志, 2008, 44(23): 26-31. |
| [9] |
VUGTEVEEN I, HOEKSMA M, MONSEN A L B, et al. Serum vitamin B12 concentrations within reference values do not exclude functional vitamin B12 deficiency in PKU patients of various ages[J]. Molecular Genetics and Metabolism, 2011, 102(1): 13-17. DOI:10.1016/j.ymgme.2010.07.004 |
| [10] |
HERRMANN W, SCHORR H, OBEID R, et al. Vitamin B12 status, particularly holotranscobalamin Ⅱ and methylmalonic acid concentrations, and hyperhomo ysteinemia in vegetarians[J]. The American Journal of Clinical Nutrition, 2003, 78(1): 131-136. DOI:10.1093/ajcn/78.1.131 |
| [11] |
JONES K M, RAMIREZ-ZEA M, ZULETA C, et al. Prevalent vitamin B12 deficiency in twelve-month-old Guatemalan infants is predicted by maternal B12 deficiency and infant diet[J]. The Journal of Nutrion, 2007, 137(5): 1307-1313. DOI:10.1093/jn/137.5.1307 |
| [12] |
MCLEAN E D, ALLEN L H, NEUMANN C G, et al. Low plasma vitamin B12 in Kenyan school children is highly prevalent and improved by supplemental animal source foods[J]. The Journal of Nutrion, 2007, 137(3): 676-682. DOI:10.1093/jn/137.3.676 |
| [13] |
RYAN-HARSHMAN M, ALDOOFI W. Vitamin B12 and health[J]. Canadian Family Physician, 2008, 54(4): 536-541. |
| [14] |
黄明明, 黄凯. 维生素B12对鸡的作用及缺乏症的防治[J]. 饲料博览, 2013(6): 17-19. DOI:10.3969/j.issn.1001-0084.2013.06.005 |
| [15] |
王蕾, 彭克美, 刘华珍, 等.泰和乌鸡小肠的发育形态学研究[C]//中国畜牧兽医学会动物解剖学及组织胚胎学分会第十七次学术研讨会论文集(上).太谷: 中国畜牧兽医学会, 2012.
|
| [16] |
王继凤, 李芙燕, 陈耀星, 等. 3种饲料添加剂对肉鸡小肠形态结构的影响[J]. 畜牧兽医学报, 2008, 39(8): 1111-1115. DOI:10.3321/j.issn:0366-6964.2008.08.018 |
| [17] |
何明清, 倪学勤. 我国动物微生态制剂研究、开发和应用动态[J]. 饲料广角, 2002(21): 1-7, 39. DOI:10.3969/j.issn.1002-8358.2002.21.001 |
| [18] |
BÄCKHED F, DING H, WANG T, et al. The gut microbiota as an environmental factor that regulates fat storage[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(44): 15718-15723. DOI:10.1073/pnas.0407076101 |
| [19] |
STAPPENBECK T S, HOOPER L V, GORDON J I. Developmental regulation of intestinal angiogenesis by indigenous microbes via Paneth cells[J]. Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(24): 15451-15455. DOI:10.1073/pnas.202604299 |
| [20] |
HOOPER L V. Bacterial contributions to mammalian gut development[J]. Trends in Microbiology, 2004, 12(3): 129-134. DOI:10.1016/j.tim.2004.01.001 |
| [21] |
SEARS C L. A Dynamic partnership:celebrating our gut flora[J]. Anaerobe, 2005, 11(5): 247-251. DOI:10.1016/j.anaerobe.2005.05.001 |
| [22] |
HOOPER L V, WONG M H, THELIN A, et al. Molecular analysis of commensal host-microbial relationships in the intestine[J]. Science, 2001, 291(5505): 881-885. DOI:10.1126/science.291.5505.881 |




