磷(P)是生物系统的重要组成部分,涉及到各种生理过程,包括能量代谢、细胞信号、核苷酸和磷脂生物合成以及牙齿、骨骼形成[1-2]。研究已证实钠磷转运载体蛋白Ⅱb(type Ⅱb sodium-phosphate cotransporter, NaPi-Ⅱb)是介导肠道磷主动转运的主要途径[3-4]。NaPi-Ⅱb受许多因素的调节,表皮生长因子(epidermal growth factor,EGF)是调节其表达的重要因素之一[5-8]。EGF是一种重要的生长因子,广泛存在于乳液、唾液、尿液、肠液、血液、羊水等体液中,对细胞生存、增殖与分化、迁移、凋亡等具有重要作用[9-11]。前人在人Caco2细胞及猪小肠上皮细胞(IPEC-J2)中的研究表明,EGF可抑制细胞NaPi-Ⅱb的表达,说明在正常培养条件下,EGF可能通过其他途径调节细胞对磷的吸收。理论上讲,在EGF对肠道屏障功能的修复过程中,必然伴随大量DNA、RNA和蛋白质的合成,其前提需要经肠道吸收更多的磷,此过程中所需更多的磷是通过何种途径满足机体需要还未见报道。因此,本研究通过细胞试验与动物试验相结合的方法,研究EGF对脂多糖(LPS)刺激的应激状态下断奶仔猪小肠磷吸收的影响,为进一步诠释EGF对磷的吸收提供新的认识。
1 材料与方法 1.1 细胞试验 1.1.1 主要试剂EGF购自Peprotech公司;LPS、Tris、十二烷基磺酸钠(SDS)、过硫酸铵(APS)、四甲基乙二胺(TEMED)、吐温-20(Tween-20)、丙烯酰胺、甲叉双丙烯酰胺、丽春红购自Sigma公司;胎牛血清(FBS)、胰蛋白酶、青链双抗购自Gibco公司;DMEM/F12(HyClon)培养基购自GE公司;CCK-8试剂盒、BCA蛋白试剂盒、磷酸缓冲液(PBS)、RIPA蛋白裂解液购自索莱宝公司;Trizol试剂购自Invitrogen公司;逆转录试剂盒、UltraSYBR Mixture及DM 2000 Plus DNA Marker均购自北京康维世纪公司;Super ECL Plus超敏发光液购自Thermo公司;一抗NaPi-Ⅱb(货号:21773-1-AP)、一抗β-肌动蛋白(β-actin)(货号:60008-1-Ig)、二抗(Goat Anti-Rabbit IgG/HRP)购自Proteintech公司。
1.1.2 细胞培养及分组IPEC-J2细胞由中国科学院亚热带农业生态研究所提供。细胞经活化后,培养在含10% FBS、1%青链双抗的培养基中,置于37 ℃,含有5% CO2的培养箱中培养。细胞生长至80%~90%融合后,用0.25%胰蛋白酶消化细胞,显微镜下计数,收集的细胞用于细胞传代或进行后续试验。试验设4个组:对照组(0 ng/mL EGF,0 μg/mL LPS)、EGF组(100 ng/ mL EGF,0 μg/mL LPS)、LPS组(0 ng/mL EGF,1.0 μg/mL LPS)、EGF+LPS组(100 ng/mL EGF,1.0 μg/mL LPS),每组3个重复。EGF、LPS剂量的选择及培养时间的确定参照文献[11]。将细胞以1×105个/孔接种于6孔板中,每孔加入2 mL含10% FBS、1%青链双抗的培养基,培养24 h后,弃去培养基,用37 ℃ PBS润洗2遍,然后分别加入相应剂量的EGF与LPS,加入培养基至2 mL,培养24 h。
1.1.3 EGF对LPS刺激的IPEC-J2细胞NaPi-Ⅱb mRNA表达的测定采用实时荧光定量PCR(qRT-PCR)检测细胞NaPi-Ⅱb mRNA的表达。细胞培养结束后,用PBS洗涤细胞2次,每孔加入Trizol 1 mL,按照Trizol试剂说明书提取总RNA,并测定总RNA浓度及1%琼脂凝胶检测RNA完整性。以细胞总RNA为模板,用逆转录试剂盒反转录为cDNA,具体步骤参照试剂盒说明书。定量PCR反应按照荧光定量PCR检测试剂盒操作。所用引物由上海生工生物工程技术服务有限公司合成。NaPi-Ⅱb引物序列为F:GCCCGAGCTTAAGAACACA,R:CATGACACCAGCACCATCGTT;β-actin引物序列为F:CATCCTGCGTCTGGACCTGG,R:TAATGTCACGCACGATTTCC。实时荧光定量PCR程序参照Tang[11]介绍的方法进行。以β-actin基因为内参,采用2-△△Ct法进行目的基因相对表达量计算。
1.1.4 EGF对LPS刺激的IPEC-J2细胞NaPi-Ⅱb蛋白表达的测定采用Western blot检测细胞NaPi-Ⅱb蛋白的表达。细胞培养结束后,弃去培养基,PBS洗涤细胞1次,加入250 μL RIPA细胞裂解液(含1 mmol/L蛋白酶抑制剂),冰上裂解15 min,4 ℃,12 000 r/min离心3~5 min,取上清分装后置于-80 ℃冰箱保存,待测。蛋白浓度测定采用南京建成的BCA蛋白浓度检测试剂盒测定,具体参照说明书步骤进行。Western blot程序参照Tang等[11]介绍的方法进行。
1.2 动物试验 1.2.1 试验材料EGF由长沙某公司提供,EGF含量为4 000 mg/kg;LPS(大肠杆菌血清型O55 : B5)、石蜡、中性树胶、伊红购自Sigma公司;RT-PCR所需试剂同1.1.3。
1.2.2 试验动物及分组选取24头体重接近、健康状况良好的21日龄“长白×大白”二元杂交断奶阉公猪[平均体重(5.76±0.38) kg],随机分为4个组:对照组(基础饲粮)、EGF组(基础饲粮+2 mg/kg EGF)、LPS组(基础饲粮+腹腔注射100 μg/kg BW LPS)、EGF+LPS组(基础饲粮+2 mg/kg EGF+腹腔注射100 μg/kg BW LPS),每组6个重复,每个重复1头猪,试验期14 d。基础饲粮配制参照NRC(2012)猪的营养需要,其组成及营养水平见表 1。在试验的第8天、第15天清晨,给LPS组和EGF+LPS组仔猪注射100 μg/kg BW的LPS[12],对照组和EGF组注射等量的生理盐水。
|
|
表 1 基础饲粮组成及营养水平(饲喂基础) Table 1 Composition and nutrient levels of the basal diet (as fed basis) |
本试验于2017年11月12日至2017年11月29日在益阳兆丰农牧科技有限公司猪舍进行。试猪单栏饲养,试验期间自由采食与饮水。每天08:00、12:00、16:00、20:00投喂饲粮,第2天投喂前收集剩余饲粮。每天中午通风15 min左右,猪舍温度控制在25~28 ℃,相对湿度50%~70%。
1.2.4 样品采集血样:试猪在试验的第15天,注射LPS 6 h后,采集前腔静脉血10 mL。血液样品在4 ℃,3 500 r/min离心10 min,收集血清,-20 ℃保存。
黏膜样:试猪在试验的第15天,注射LPS 6 h后,全部仔猪注射50 mg/kg BW的戊巴比妥钠,待完全麻醉后屠宰,屠宰后迅速从胸骨到耻骨切线打开腹腔,取出胃肠道,于空肠、回肠处分别采集约5 cm肠段,用4 ℃预冷1×PBS轻轻漂洗,于冰面上刮取黏膜,分装2管,液氮速冻后于-80 ℃保存。
1.2.5 EGF对LPS刺激的断奶仔猪血清钙、磷含量的测定血清钙含量的测定采用南京建成生物工程研究所生产的钙测试盒(微板法,货号C004-2)测定。血清磷含量的测定采用南京建成生物工程研究所生产的磷测试盒(磷钼酸法,货号C006)。测定步骤参照相应的试剂盒说明书进行。
1.2.6 EGF对LPS刺激的断奶仔猪血清碱性磷酸酶(ALP)活性的测定血清ALP活性采用迈瑞全自动生化分析仪(BS-200, 深圳迈瑞医疗电子股份有限公司)检测。试剂盒购自深圳迈瑞公司,测定步骤参照说明书进行。
1.2.7 肠黏膜NaPi-Ⅱb mRNA表达的测定采用qRT-PCR法测定空肠、回肠肠黏膜NaPi-Ⅱb mRNA的表达情况。具体操作同1.1.3。
1.3 统计分析试验结果以“平均值±标准差”(means±SD)表示,采用SPSS 21.0统计软件的一般线性模型(GLM)进行两因素方差分析,模型主效应包括EGF处理、LPS处理以及两者的互作,one-way ANOVA程序进行单因素方差分析,组间差异采用Duncan氏法进行多重比较,以P<0.05作为差异显著性判断标准。
2 结果与分析 2.1 EGF对LPS刺激的IPEC-J2细胞NaPi-Ⅱb mRNA表达的影响由图 1可知,与对照组相比,EGF组细胞NaPi-Ⅱb mRNA表达显著下降(P<0.05),EGF+LPS组细胞NaPi-Ⅱb mRNA表达显著提高(P<0.05)。与EGF组相比,EGF+LPS组细胞NaPi-Ⅱb mRNA表达显著提高(P<0.05)。与LPS组相比,EGF+LPS组细胞NaPi-Ⅱb mRNA表达显著提高(P<0.05)。EGF与LPS免疫应激的互作效应对NaPi-Ⅱb mRNA表达影响显著(P<0.05)。结果表明,EGF抑制细胞NaPi-Ⅱb mRNA的表达,但在应激状态下EGF促进细胞NaPi-Ⅱb mRNA的表达。
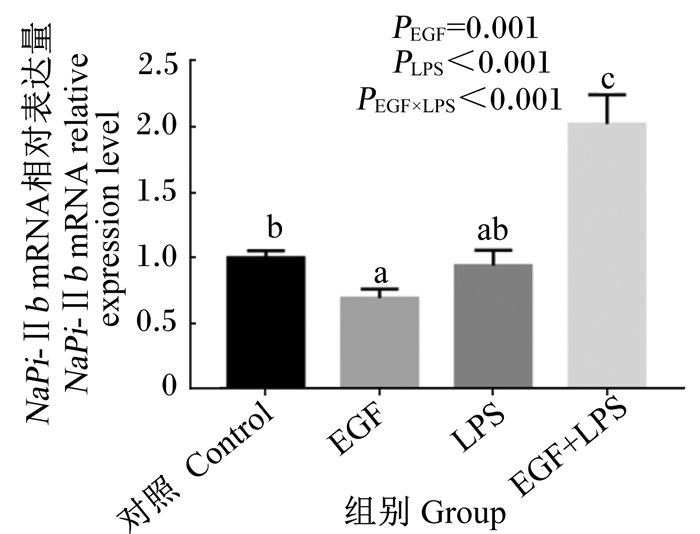
|
不同小写字母表示差异显著(P < 0.05),相同字母表示差异不显著(P>0.05),图 2、图 3同。 Values with different small letters mean significant difference (P < 0.05), while with the same letter mean no significant difference (P > 0.05). The same as Fig. 2 and Fig. 3. 图 1 EGF对LPS刺激的IPEC-J2细胞NaPi-Ⅱb mRNA表达的影响 Figure 1 Effects of EGF on NaPi-Ⅱb mRNA expression in IPEC-J2 cells challenged by LPS |
由图 2可知,与对照组相比,EGF组细胞NaPi-Ⅱb蛋白表达显著下降(P<0.05),EGF+LPS组细胞NaPi-Ⅱb蛋白表达显著提高(P<0.05)。与EGF组相比,EGF+LPS组细胞NaPi-Ⅱb蛋白表达显著提高(P<0.05)。与LPS组相比,EGF+LPS组细胞NaPi-Ⅱb蛋白表达显著提高(P<0.05)。EGF与LPS免疫应激的互作效应对NaPi-Ⅱb蛋白表达影响显著(P<0.05)。Western blot结果同样表明,EGF抑制细胞NaPi-Ⅱb蛋白表达,但在应激状态下EGF促进细胞NaPi-Ⅱb蛋白的表达。
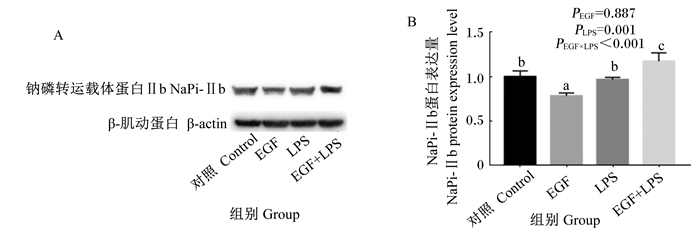
|
A: Western blot电泳图;B:NaPi-Ⅱb蛋白表达量。 A: Western blot electrophoretogram; B: NaPi-Ⅱb protein expression level. 图 2 EGF对LPS诱导的IPEC-J2细胞NaPi-Ⅱb蛋白表达影响 Figure 2 Effects of EGF on NaPi-Ⅱb protein expression in IPEC-J2 cells challenged by LPS |
由表 2可知,各组间血清钙含量无显著差异(P>0.05);EGF与LPS免疫应激互作效应对血清钙含量无显著影响(P>0.05)。LPS组血清磷含量显著高于对照组、EGF组、EGF+LPS组(P<0.05),且EGF与LPS免疫应激互作效应对血清磷含量影响显著(P<0.05);EGF组血清ALP活性显著高于LPS组(P<0.05),与对照组、EGF+LPS组差异不显著(P>0.05),EGF与LPS免疫应激互作效应对血清ALP活性无显著影响(P>0.05)。
|
|
表 2 EGF对LPS刺激的断奶仔猪血清钙、磷含量和碱性磷酸酶活性的影响 Table 2 Effects of EGF on serum Ca, P contents and ALP activity of weaned piglets challenged by LPS |
由图 3可知,与对照组相比,EGF组空肠(图 3-A)、回肠(图 3-B)黏膜NaPi-Ⅱb mRNA的表达均显著降低(P<0.05),EGF+LPS组空肠(图 3-A)、回肠(图 3-B)黏膜NaPi-Ⅱb mRNA的表达均显著增加(P<0.05)。与LPS组相比,EGF组空肠(图 3-A)、回肠(图 3-B)黏膜NaPi-Ⅱb mRNA的表达均显著降低(P<0.05),EGF+LPS组空肠(图 3-A)、回肠(图 3-B)黏膜NaPi-Ⅱb mRNA的表达均显著增加(P<0.05)。与EGF组相比,EGF+LPS组空肠(图 3-A)、回肠(图 3-B)黏膜NaPi-Ⅱb mRNA的表达均显著增加(P<0.05)。EGF与LPS免疫应激互作效应对空肠与回肠NaPi-Ⅱb mRNA的表达影响显著(P<0.05)。动物试验结果表明,EGF抑制小肠黏膜NaPi-Ⅱb mRNA表达,但在应激状态下促进小肠黏膜NaPi-Ⅱb mRNA表达。
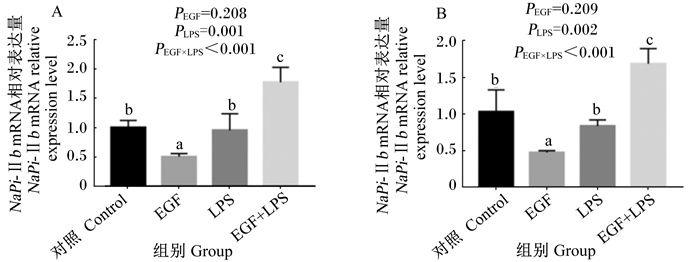
|
A:空肠NaPi-Ⅱb mRNA相对表达量;B:回肠NaPi-Ⅱb mRNA相对表达量。 A: NaPi-Ⅱb mRNA relative expression level in the jejunum; B: NaPi-Ⅱb mRNA relative expression level in the ileum. 图 3 EGF对LPS刺激的断奶仔猪小肠黏膜NaPi-Ⅱb mRNA表达影响 Figure 3 Effects of EGF on NaPi-Ⅱb mRNA expression in the small intestinal mucosa of weaned piglets challenged by LPS |
磷是动物必需的矿物质元素之一,在动物生长发育、骨骼形成、能量代谢、核酸合成、细胞信号转导以及维持血液酸碱平衡中起着重要作用[1, 3, 13]。血清碱性磷酸酶是反映动物机体钙磷代谢状况的血清生化指标,当机体缺乏钙磷时,碱性磷酸酶释放增加。本研究结果表明,EGF对LPS刺激的仔猪血清钙含量无显著影响,但对血清磷含量影响显著。EGF组血清ALP活性显著高于LPS组,但饲粮EGF与LPS免疫应激互作效应对血清碱性磷酸酶活性无显著影响。LPS是革兰氏阴性菌细胞壁破裂后释放的毒性物质,是导致急性肾损伤的主要因素之一[14]。本研究中LPS组血清磷含量显著高于其他组,可能是LPS刺激导致了仔猪肾脏功能损伤,影响肾脏对磷的重吸收,从而导致血清磷含量异常升高。
肠道磷的吸收主要有被动扩散和主动吸收2种方式,NaPi-Ⅱb是调节肠道磷主动转运的主要载体[3-5],介导机体70%~90%磷的主动转运[15-16]。NaPi-Ⅱb的调控受许多因素的影响,如磷[1]、维生素D3[17]、雌二醇[2]、神经肽Y[4]、降钙素基因相关肽、EGF[5-8]等。EGF是一种含有53个氨基酸残基的小肽,其生物学功能的发挥是通过与其表皮生长因子受体(EGFR)结合后实现的[9]。EGFR广泛存在于小肠刷状缘顶端及基底侧,当动物摄取的EGF递送到小肠黏膜后与EGFR结合,形成二聚物,激活酪氨酸激酶(RTK)活性,促进RTK自我磷酸化,随后激活Ras/丝裂原活化蛋白激酶(Ras/MAPK)、磷脂酰肌醇3激酶/蛋白激酶B(PI3K/AKT)、磷脂酶C-γ/蛋白激酶C(PLC-γ/PKC)等一系列的信号通路,对细胞生存、增殖与分化、迁移、凋亡等具有重要作用[9-11, 18]。前人在人Caco2细胞中的研究表明,EGF通过修饰c-myb蛋白,经蛋白激酶C/蛋白激酶A(PKC/PKA)和MAPK信号通路调节下游启动子功能,从而抑制细胞NaPi-Ⅱb的转录活性,降低其表达量[5-6]。本课题组在猪IPEC-J2细胞中同样发现EGF抑制了细胞中NaPi-Ⅱb的表达,进一步研究发现EGF作用NaPi-Ⅱb启动子区域位于-1 092~-1 085 bp区域(5′-TCCAGTTG-3′),且EGF通过激活EGFR、PKA、PKC、P38、细胞外信号调节激酶(ERK)、氨基末端激酶(JNK)等信号分子来下调IPEC-J2细胞中NaPi-Ⅱb的表达[7-8]。Tang等[11]研究表明,一定浓度的EGF可促进IPEC-J2细胞增殖,而细胞增殖过程中需要大量的磷用来合成RNA及DNA,说明EGF可促进磷的吸收,但不是通过NaPi-Ⅱb介导的磷的主动吸收,可能存在其他途径介导磷的吸收。
应激是动物生产过程中的普遍现象,可导致动物肠道损伤,影响生产成绩。LPS对小肠上皮细胞具有毒害作用,能刺激猪小肠上皮细胞分泌大量白介素(IL)-1β、IL-6、肿瘤坏死因子-α(TNF-α)等促炎细胞因子,最终导致炎症的发生[19-21]。Tang等[11]研究表明,LPS刺激诱导了细胞氧化应激及细胞凋亡的发生,而EGF可通过缓解氧化应激减少细胞凋亡来保护LPS刺激的肠上皮细胞损伤。理论上讲,在EGF对受损肠细胞修复过程中,必然伴随大量DNA、RNA和蛋白质的合成,其前提需要经肠道吸收更多的磷,此过程中EGF是否解除对NaPi-Ⅱb表达的抑制作用,从而促进磷的主动吸收,以满足机体对磷的需要,还未见报道。因此,本研究采用细胞试验与动物试验相结合的方法研究EGF对应激状态下(LPS刺激)猪小肠磷吸收的影响,结果表明,EGF抑制IPEC-J2细胞的NaPi-Ⅱb mRNA及蛋白的表达,抑制仔猪空肠与回肠黏膜NaPi-Ⅱb mRNA的表达,这与Xu等[4-5]、Xing等[6]、邢廷杰等[7]研究结果一致,而EGF可促进LPS刺激的IPEC-J2细胞NaPi-Ⅱb mRNA及蛋白的表达,促进LPS刺激的断奶仔猪空肠与回肠黏膜NaPi-Ⅱb mRNA的表达,说明在非应激状态下EGF抑制NaPi-Ⅱb介导的磷的主动转运,在应激状态下,EGF可解除对NaPi-Ⅱb的抑制,调控NaPi-Ⅱb介导的磷的主动吸收,以满足机体对磷的需要,加快肠道修复进程。前人研究表明,EGF对断奶仔猪的生长及肠道发育具有促进作用[22-23],说明EGF是促进磷吸收,但不是通过NaPi-Ⅱb介导的磷的主动吸收。机体磷稳态的维持是通过肠道磷吸收与肾脏磷重吸收实现的[24]。肠道磷吸收有被动扩散和主动转运,除了NaPi-Ⅱb介导的主动转运,Ⅲ型钠离子依赖转运载体蛋白(type Ⅲ transporters PiT1 and PiT2)也能介导部分磷的主动吸收[25],肾脏重吸收主要由NaPi-Ⅱa与NaPi-Ⅱc 2种蛋白介导,当肠道磷吸收不足时,肾脏磷重吸收加强,从而满足机体磷的需要[26]。因此,本研究中EGF可能通过增强肠道磷的被动扩散吸收,或通过增强PiT1和PiT2介导的磷主动转运,或通过加强肾脏重吸收满足机体磷的需要,但具体通过何种途径调节磷的吸收还需进一步的研究。应激条件下EGF如何解除对NaPi-Ⅱb的抑制,从而介导磷的主动转运以满足机体需求还需进一步的研究。
4 结论EGF对肠道NaPi-Ⅱb的表达起抑制作用,但在免疫应激状态下可促进NaPi-Ⅱb的表达。
| [1] |
FANG R J, XIANG Z F, CAO M H, et al. Different phosphate transport in the duodenum and jejunum of chicken response to dietary phosphate adaptation[J]. Asian-Australasian Journal of Animal Sciences, 2012, 25(10): 1457-1465. DOI:10.5713/ajas.2012.12187 |
| [2] |
FANG R J, XIANG Z F, HU L C, et al. Effects of mechanistic target of rapamycin signaling pathway on the estrogen-mediated NaPi-Ⅱb protein expression in pig small intestinal epithelial cells[J]. Journal of Animal Science, 2016, 94(Suppl.3): 303-306. |
| [3] |
XIANG Z, FANG R J, HU L C, et al. Molecular cloning and functional characterization of swine sodium dependent phosphate cotransporter type Ⅱb (NaPi-Ⅱb) gene[J]. Molecular Biology Reports, 2012, 39(12): 10557-10564. DOI:10.1007/s11033-012-1941-0 |
| [4] |
胡龙昌, 方热军. 神经肽Y对猪小肠上皮细胞NaPi-Ⅱb蛋白表达及无机磷吸收的影响[J]. 畜牧兽医学报, 2014, 45(10): 1640-1647. |
| [5] |
XU H, COLLINS J F, BAI L Q, et al. Regulation of the human sodium-phosphate cotransporter NaPi-Ⅱb gene promoter by epidermal growth factor[J]. American Journal of Physiology Cell Physiology, 2001, 280(3): C628-C636. DOI:10.1152/ajpcell.2001.280.3.C628 |
| [6] |
XU H, INOUYE M, HINES E R, et al. Transcriptional regulation of the human NaPi-Ⅱb cotransporter by EGF in Caco-2 cells involves c-myb[J]. American Journal of Physiology Cell Physiology, 2003, 284(5): C1262-C1271. |
| [7] |
XING T, TAN X, YU Q, et al. Identifying the location of epidermal growth factor-responsive element involved in the regulation of type Ⅱb sodium-phosphate cotransporter expression in porcine intestinal epithelial cells[J]. Journal of Animal Physiology and Animal Nutrition, 2017, 101(6): 1249-1258. DOI:10.1111/jpn.2017.101.issue-6 |
| [8] |
邢廷杰, 汤小朋, 曹满湖, 等. 表皮生长因子调控猪肠上皮细胞中钠依赖Ⅱb型磷转运蛋白表达的细胞信号通路研究[J]. 动物营养学报, 2017, 29(6): 1988-1955. DOI:10.3969/j.issn.1006-267x.2017.06.020 |
| [9] |
TANG X P, LIU H, YANG S F, et al. Epidermal growth factor and intestinal barrier function[J]. Mediators of Inflammation, 2016, 2016: 1927348. |
| [10] |
汤小朋, 刘虎, 杨淑芬, 等. 表皮生长因子在动物肠道无机离子及其他营养物质吸收中的作用[J]. 动物营养学报, 2016, 28(8): 2317-2323. DOI:10.3969/j.issn.1006-267x.2016.08.001 |
| [11] |
TANG X P, LIU B, WANG X R, et al. Epidermal growth factor, through alleviating oxidative stress, protect IPEC-J2 cells from lipopolysaccharides-induced apoptosis[J]. International Journal of Molecular Sciences, 2018, 19(3): 848. DOI:10.3390/ijms19030848 |
| [12] |
张伟, 杨震国, 侯永清, 等. N-乙酰半胱氨酸对脂多糖刺激仔猪空肠黏膜抗氧化能力的影响[J]. 动物营养学报, 2011, 23(5): 842-847. DOI:10.3969/j.issn.1006-267x.2011.05.019 |
| [13] |
WAGNER C A, HERNANDO N, FORSTER IC, et al. The SLC34 family of sodium-dependent phosphate transporters[J]. Pflügers Archiv-European Journal of Physiology, 2014, 466(1): 139-153. DOI:10.1007/s00424-013-1418-6 |
| [14] |
丁仁彧, 肇冬梅, 胡紫薇, 等. Rho激酶抑制剂通过抑制Toll样受体4和核因子κ核信号通路缓解脂多糖诱导的肾损伤[J]. 中国医科大学学报, 2018, 47(1): 1-5. |
| [15] |
SABBAGH Y, O'BRIEN S P, SONG W P, et al. Intestinal Npt2b plays a major role in phosphate absorption and homeostasis[J]. Journal of the American Society of Nephrology, 2009, 20(11): 2348-2358. DOI:10.1681/ASN.2009050559 |
| [16] |
WONG S H, GAO A, WARD S, et al. Development of a label-free assay for sodium-dependent phosphate transporter NaPi-Ⅱb[J]. Journal of the American Society of Nephrology, 2012, 17(6): 829-834. |
| [17] |
曹满湖, 贺建华, 方热军, 等. 低磷条件下VD3对大鼠小肠NaPi-Ⅱb mRNA表达及磷吸收的调控[J]. 中国农业科学, 2010, 43(18): 3838-3847. DOI:10.3864/j.issn.0578-1752.2010.18.019 |
| [18] |
WEE P, SHI H P, JIANG J, et al. EGF stimulates the activation of EGF receptors and the selective activation of major signaling pathways during mitosis[J]. Cell Signal, 2015, 27(3): 638-651. DOI:10.1016/j.cellsig.2014.11.030 |
| [19] |
PASZTI-GERE E, MATIS G, FARKAS O, et al. The effects of intestinal LPS exposure on inflammatory responses in a porcine enterohepatic co-culture system[J]. Inflammation, 2014, 37(1): 247-260. DOI:10.1007/s10753-013-9735-7 |
| [20] |
YANG F J, WANG A N, ZENG X F, et al. Lactobacillus reuteri I5007 modulates tight junction protein expression in IPEC-J2 cells with LPS stimulation and in newborn piglets under normal conditions[J]. BMC Microbiology, 2015, 15: 32. |
| [21] |
王雄, 李孟伟, 马杰, 等. 牛膝多糖对仔猪肠上皮细胞免疫应激的调控及其作用机制[J]. 动物营养学报, 2017, 29(11): 4116-4122. DOI:10.3969/j.issn.1006-267x.2017.11.034 |
| [22] |
BEDFORD A, CHEN T, HUYNH E, et al. Epidermal growth factor containing culture supernatant enhances intestine development of early-weaned pigs in vivo:potential mechanisms involved[J]. Journal of Biotechnology, 2015, 196-197: 9-19. DOI:10.1016/j.jbiotec.2015.01.007 |
| [23] |
WANG S J, GUO C H, ZHOU L, et al. Comparison of the biological activities of Saccharomyces cerevisiae-expressed intracellular EGF, extracellular EGF, and tagged EGF in early-weaned pigs[J]. Applied Microbiology and Biotechnology, 2015, 99(17): 7125-7135. |
| [24] |
MANGHAT P, SODI R, SWAMINATHAN R. Phosphate homeostasis and disorders[J]. Annals of Clinical Biochemistry, 2014, 51(6): 631-656. DOI:10.1177/0004563214521399 |
| [25] |
SABBAGH Y, GIRAL H, CALDAS Y, et al. Intestinal phosphate transport[J]. Advances in Chronic Kidney Disease, 2011, 18(2): 85-90. |
| [26] |
WAGNER C A, BIBER J, MURER H. Of men and mice:who is in control of renal phosphate reabsorption?[J]. Journal of the American Society of Nephrology, 2008, 19(9): 1625-1626. DOI:10.1681/ASN.2008060611 |




