幼龄动物肠道功能发育尚未完善,肠道健康对幼龄动物的生长发育至关重要,直接影响动物的生产性能和经济效益,鉴于抗生素滥用问题的多发,通过营养调控手段提高幼畜肠道功能具有切实的意义。苏氨酸不仅用于机体蛋白质合成,还参与机体其他生理功能如免疫等[1-2],哺乳动物从食物中摄取的苏氨酸有60%~80%被用于门静脉排流组织(partal-drained viscera, PDV)代谢[1]。近年的研究发现,苏氨酸对幼龄动物肠道黏膜免疫功能和消化功能具有一定的作用,苏氨酸缺乏会降低肠道消化酶活性,增加黏膜通透性并,降低肠道黏膜蛋白合成,进而直接影响机体健康[3-5];适宜浓度的苏氨酸可增强肠道黏膜屏障功能,促进肠道内免疫球蛋白A(IgA)分泌并提高消化酶活性[6-7]。有关苏氨酸的研究多集中在动物体内试验,苏氨酸对肠道功能调节作用的机制研究缺乏,尤其是在细胞水平的研究。肠道上皮细胞培养基中的苏氨酸浓度一般为0.449 mmol/L (0.053 45 g/L),本试验以此为基础设计了苏氨酸的添加浓度。前人研究表明,来源于大鼠空肠隐窝上皮的非转化细胞株IEC-6细胞与正常的小肠隐窝细胞具有相同的形态学特征、生长特性、合成细胞外基质的能力以及细胞专一性的质膜抗原[8]。IEC-6细胞存活力强、增殖速度快、易保存和培养,很适合用于肠道功能相关的试验研究。本研究以大鼠小肠上皮细胞系IEC-6细胞为对象,通过分析不同浓度苏氨酸对IEC-6细胞活性、增殖和紧密连接蛋白表达的影响,研究苏氨酸在不同浓度下对小肠上皮细胞的作用,初步探究苏氨酸对肠道屏障功能的可能作用机制,为苏氨酸在动物生产中的应用提供理论依据。
1 材料与方法 1.1 试验材料大鼠小肠上皮细胞系IEC-6细胞(中国医学科学院基础医学研究所细胞资源中心)、苏氨酸(99.9%,Sigma,美国)、高糖DMEM培养基(HyClone,美国)、胎牛血清(FBS)(Gibco,美国)、胰岛素(注射用)、胰蛋白酶(Gibco,美国)、噻唑兰(MTT)(Amresco,美国)、二甲基亚砜(DMSO)、伊红(国药集团化学试剂有限公司)、苏木精(国药集团化学试剂有限公司)、FSHR兔多克隆抗体(Abcam,英国)、山羊抗兔免疫球蛋白(H+L)抗体(拜力生物科技有限公司)、BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司)、十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(SDS-PAGE)凝胶配制试剂盒(上海碧云天生物技术有限公司)、Western-blot试剂(10×)(上海碧云天生物技术有限公司)、化学发光显影定影试剂盒(上海碧云天生物技术有限公司)。
1.2 细胞培养和测定 1.2.1 IEC-6细胞培养冻存的IEC-6细胞迅速在37 ℃水浴锅中溶解,转入离心管,加入含10%FBS、0.01 mg/mL胰岛素的高糖DMEM培养基,1 500 r/min离心5 min,弃上清液,用高糖DMEM培养基混匀细胞,转入培养皿,置于5%CO2 37 ℃培养箱中培养。
1.2.2 MTT法检测IEC-6细胞活性96孔板中每孔加入100 μL细胞悬液,每孔含104个细胞[边缘孔用无菌磷酸盐缓冲液(PBS)填充],5%CO2 37 ℃孵育24 h。小心吸去培养液,每孔加入100 μL苏氨酸处理液,苏氨酸处理液中苏氨酸浓度分别设定为0、0.1、0.5、1.0、5.0、10.0 mmol/L,每个浓度设置4~6个重复,同时设置调零孔和对照孔,5%CO2 37 ℃孵育24 h。每孔再加入20 μL终浓度为5 mg/mL的MTT溶液,继续培养4 h。小心吸去培养液,每孔加入150 μL DMSO,于酶联免疫检测仪低速振荡10 min,在490 nm处测量各孔的吸光度(OD)值。
1.2.3 苏木精-伊红(HE)染色观察IEC-6细胞增殖情况将细胞接种于6孔板内,底部铺上细胞爬片,待细胞生长愈合至80%时,加入不同浓度(0、0.1、0.5、1.0、5.0、10.0 mmol/L)的苏氨酸处理液,处理24 h后进行HE染色。用PBS洗涤2~3次,晾干,甲醇固定5~8 min,PBS再洗2~3次,蒸馏水冲洗1遍,玻片甩干,苏木精染色5 min,自来水冲洗干净,1% NaHCO3洗至蓝色,玻片晾干,伊红染色5 min,无水乙醇冲洗干净后,无水乙醇洗2次,每次1~2 min,醇苯洗2次,每次1~2 min,最后用二甲苯洗5~10 min,玻片自然晾干,中性树胶封片。显微镜下观察细胞形态和生长情况。
1.2.4 Western-blot法检测IEC-6细胞紧密连接蛋白表达情况蛋白样品的准备:细胞接种于6孔板,每孔3 mL培养基,待细胞生长融合至80%~90%,吸去培养基,PBS洗3遍,每孔加入2 mL无氨基酸培养基,处理2 h。吸去培养基,加入2 mL不同浓度(0、0.1、0.5、1.0、5.0、10.0 mmol/L)的苏氨酸处理液处理24 h。弃去处理液,每孔加入60 μL蛋白酶磷酸酶抑制剂混合物,10 min后收集细胞,蛋白质抽提试剂盒提取细胞蛋白,BCA蛋白浓度测定试盒测定蛋白浓度。按照5×上样缓冲液制备蛋白样品。配制SDS-PAGE凝胶,每孔上样30 μg蛋白样品,在90 V恒压下电泳至分离胶,然后再在120 V恒压下电泳至溴酚蓝刚跑出分离胶底部。电泳完毕后,聚偏氟乙烯(PVDF)膜转膜,封闭和抗体孵育,将PVDF膜放入AlphaImager 2200(Alpha Innotech,美国)系统中进行曝光、摄像。
1.3 数据分析与处理试验数据用SAS 9.4软件中的单因素方差分析程序进行分析,P<0.05表示差异显著。
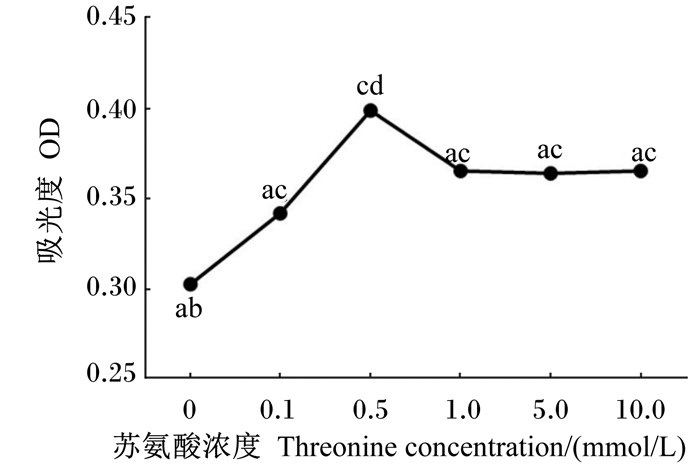
2 结果与分析 2.1 不同浓度苏氨酸对IEC-6细胞活性的影响如图 1所示,经不同浓度的苏氨酸处理后,IEC-6细胞活性均有不同程度的提高,苏氨酸浓度为0.5 mmol/L时IEC-6细胞的活性最高,且与未经苏氨酸处理的对照组差异显著(P < 0.05),但超过这个浓度后IEC-6细胞的活性开始下降,在数值上仍高于未经苏氨酸处理的IEC-6细胞,但差异不显著(P>0.05),说明适宜浓度的苏氨酸可提高大鼠小肠上皮细胞的活性。
|
数据点标注不同小写字母表示差异显著(P < 0.05),相同字母表示差异不显著(P>0.05)。 Data points with different small letters mean significant difference (P < 0.05), while with the same letters mean no significant difference (P>0.05). 图 1 不同浓度苏氨酸对IEC-6细胞活性的影响 Figure 1 Effects of threonine with different concentrations on IEC-6 cell activity |
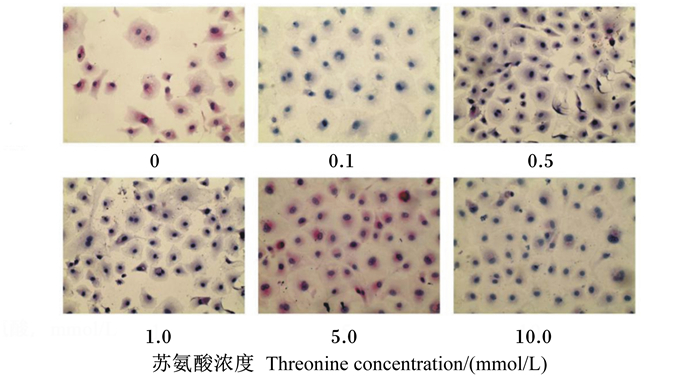
不同浓度苏氨酸处理IEC-6细胞24 h之后细胞形态和增殖情况如图 2所示。在空间和营养充足情况下,IEC-6细胞贴壁生长,形态上呈长椭圆形、梭形,细胞核呈圆形或卵圆形且位于细胞中央。与未经苏氨酸处理的对照组相比,不同浓度的苏氨酸均能促进IEC-6细胞的增殖,且在苏氨酸浓度为0.5~1.0 mmol/L时促增殖作用最明显,再增加苏氨酸浓度,则细胞浓度降低,但仍大于对照组,此结果与MTT法检测的细胞活性结果一致。
|
图 2 不同浓度苏氨酸对IEC-6细胞增殖的影响(HE染色,200×) Figure 2 Effects of threonine with different concentrations on IEC-6 cell proliferation (HE staining, 200×) |
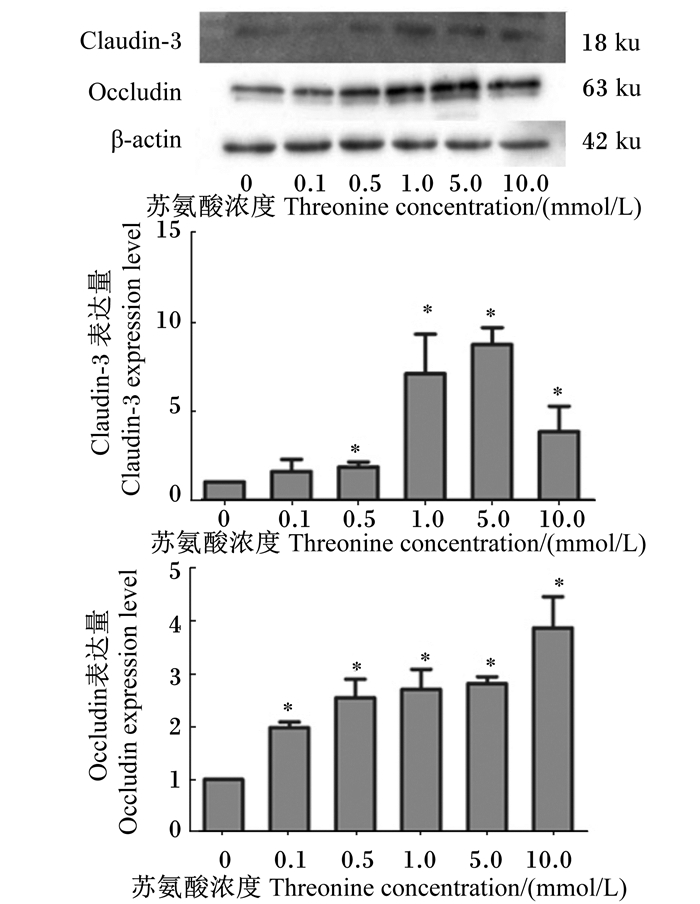
以β-肌动蛋白(β-actin)为内参,图 3所示为不同浓度苏氨酸对IEC-6细胞紧密连接蛋白表达的影响。分析结果表明,与未经苏氨酸处理的对照组相比,0.1 mmol/L的苏氨酸对紧密连接蛋白claudin-3的表达没有产生显著影响(P>0.05),但显著促进了occludin的表达(P < 0.05);苏氨酸浓度为0.5、1.0、5.0、10.0 mmol/L时均显著促进上述2种紧密连接蛋白的表达(P < 0.05),其中claudin-3的相对表达量分别增加了1.84、7.08、8.71、3.83倍,occludin的相对表达量分别增加了2.65、2.71、2.82、3.88倍,以苏氨酸浓度为5.0 mmol/L时claudin-3的相对表达量最高,以苏氨酸浓度为10.0 mmol/L时occludin的相对表达量最高。
|
“*”表示与未经苏氨酸处理的对照组相比差异显著(P < 0.05)。 "*"mean significant difference compared with control group which treated without threonine. 图 3 不同浓度苏氨酸对IEC-6细胞紧密连接蛋白occludin和claudin-3表达的影响 Figure 3 Effects of threonine with different concentrations on expression of tight junction proteins occludin and claudin-3 of IEC-6 cell |
目前,苏氨酸已在畜牧养殖、食品和医药等行业中广泛应用,其在维持畜禽正常的生长发育和免疫功能中发挥着重要的作用。适量苏氨酸可以平衡饲粮中氨基酸组成,降低饲粮蛋白质水平,并通过调节肠道内细胞因子表达[9]和肠道黏膜蛋白合成[10]等机制提高幼龄动物肠道屏障功能,增强对病原微生物的抵御作用,提高免疫力和抗病能力[11]。哺乳动物肠道不仅是机体消化吸收营养物质的首要部位,还是阻挡有害病原和病原菌入侵的首要屏障,对动物机体的生长发育起到重要作用[12]。肠道黏膜黏液含量、形态学状况、上皮细胞通透性、刷状缘酶活性等决定着肠道黏膜的完整性,其中肠道黏膜上皮细胞及其之间的连接共同构成了肠道的机械屏障,直接决定着肠道功能是否正常[3]。小肠隐窝上皮细胞在肠道细胞中是一种重要的功能性细胞,肠道黏膜损伤后主要依靠隐窝上皮细胞的不断增殖、分化来完成修复,以重建肠道的屏障功能[13]。研究发现,饲粮中标准回肠可消化苏氨酸水平为7.5~11.1 g/kg时可显著提高断奶仔猪肠道屏障功能并降低大肠杆菌感染率[11];在猪空肠上皮细胞培养中,53.45、106.90、160.35 mg/L的苏氨酸均可不同程度地提高细胞先天性免疫功能,并可上调白细胞介素-6(IL-6)和白细胞介素-5(IL-5)的表达[9]。本研究结果发现,适宜浓度的苏氨酸可提高大鼠小肠上皮细胞系IEC-6细胞的活性,增加其紧密连接蛋白的表达,从而提高小肠的机械屏障功能,促进肠道健康,与前人研究结果一致。其中,0.5 mmol/L苏氨酸对IEC-6细胞活性和增殖的促进作用最显著,5.0和10.0 mmol/L苏氨酸对occludin和claudin-3表达的促进作用最显著。细胞的增殖和活性需要多种营养素和生长因子的功能调控,而紧密连接蛋白的合成除了受基因调控外还有氨基酸底物的影响,底物浓度越高蛋白质合成速度越快,所以出现了本试验中的最适浓度差异。但当单一氨基酸浓度过高时会影响其他氨基酸的转运,进而降低蛋白质的合成,本试验结果表明,苏氨酸浓度达到10.0 mmo/L时并未造成其他氨基酸的转运拮抗。由于本试验中设计的苏氨酸浓度范围较大,需要缩窄浓度范围深入探究苏氨酸对小肠上皮细胞活性、增殖和紧密连接蛋白表达的最适浓度范围。紧密连接是上皮细胞之间的重要连接体,与肠道营养物质的吸收和微生物的黏附关系密切,参与多种信号通路,调控细胞增殖、分化等[14]。occludin是第1个被确认的紧密连接特异性跨膜蛋白,是上皮细胞紧密连接中主要表达的蛋白,其在细胞旁渗透性的调控中起着非常重要的作用[15]。claudin家族被认为是紧密连接蛋白的“脊梁”,其可调控肠道上皮的屏障功能[16],occludin与claudin直接或间接地相互作用。本研究中,不同浓度的苏氨酸可不同程度地促进小肠上皮细胞中occludin与claudin-3的表达,说明苏氨酸对肠道的通透性和屏障功能均具有调节作用,也证实了前人动物体内试验的结果[6-7]。国内外研究中有关苏氨酸对细胞活性和增殖影响的研究较为缺乏,已有研究发现,多种功能性氨基酸如亮氨酸、异亮氨酸、精氨酸等可提高小肠上皮细胞的增殖并增加肠道屏障功能[17-19]。亮氨酸、异亮氨酸、精氨酸和苏氨酸均可为肠道供能并参与多种肠道蛋白质的合成,其中大部分苏氨酸(71%)作为合成黏膜上皮细胞蛋白和分泌蛋白的底物,少部分(2%~9%)苏氨酸氧化为肠道上皮细胞供能[1]。结合本试验结果,苏氨酸可能是通过保证肠道上皮细胞的能量供给和为细胞活性和增殖所需的蛋白提供了底物,进而提高了细胞活性,促进了细胞增殖和紧密连接蛋白的表达。
4 结论综上,适宜浓度的苏氨酸对大鼠小肠上皮细胞系IEC-6细胞的活性和增殖具有促进作用,且在浓度为0.5 mmol/L时作用最显著,同时促进了紧密连接蛋白claudin-3和occludin的表达。
| [1] |
SCHAART M W, SCHIERBEEK H, VAN DER SCHOOR R D, et al. Threonine utilization is high in the intestine of piglets[J]. The Journal of Nutrition, 2005, 135(4): 765-770. |
| [2] |
LI P, YIN Y L, LI D F, et al. Amino acids and immune function[J]. British Journal of Nutrition, 2007, 98(2): 237-252. |
| [3] |
MAO X, ZENG X, QIAO S, et al. Specific roles of threonine in intestinal mucosal integrity and barrier function[J]. Frontiers in Bioscience, 2011, 3: 1192-1200. |
| [4] |
FAURE M, MOËNNOZ D, MONTIGON F, et al. Dietary threonine restriction specifically reduces intestinal mucin synthesis in rats[J]. The Journal of Nutrition, 2005, 135(3): 486-491. |
| [5] |
MUNASINGHE L L, ROBINSON J L, HARDING S V, et al. Protein synthesis in mucin-producing tissues is conserved when dietary threonine is limiting in piglets[J]. The Journal of Nutrition, 2017, 147(2): 202-210. |
| [6] |
AZZAM M M M, ZOU X T, DONG X Y, et al. Effect of supplemental L-threonine on mucin 2 gene expression and intestine mucosal immune and digestive enzymes activities of laying hens in environments with high temperature and humidity[J]. Poultry Science, 2011, 90(10): 2251-2256. |
| [7] |
TREVISI P, CORRENT E, MAZZONI M, et al. MAZZONI M, et al.Effect of added dietary threonine on growth performance, health, immunity and gastrointestinal function of weaning pigs with differing genetic susceptibility to Escherichia coli infection and challenged with E.coli K88ac[J]. Journal of Animal Physiology and Animal Nutrition, 2015, 99(3): 511-520. |
| [8] |
GÖKE M N, SCHNEIDER M, BEIL W, et al. Differential glucocorticoid effects on repair mechanisms and NF-κB activity in the intestinal epithelium[J]. Regulatory Peptides, 2002, 105(3): 203-214. DOI:10.1016/S0167-0115(02)00023-X |
| [9] |
韩国全, 余冰, 陈代文, 等. 苏氨酸对体外培养感染伪狂犬病毒猪空肠上皮细胞免疫相关基因表达的影响[J]. 动物营养学报, 2012, 24(3): 487-496. DOI:10.3969/j.issn.1006-267x.2012.03.015 |
| [10] |
WANG X, QIAO S Y, YIN Y L, et al. A deficiency or excess of dietary threonine reduces protein synthesis in jejunum and skeletal muscle of young pigs[J]. The Journal of Nutrition, 2007, 137(6): 1442-1446. |
| [11] |
REN M, LIU X T, WANG X, et al. Increased levels of standardized ileal digestible threonine attenuate intestinal damage and immune responses in Escherichia coli K88+ challenged weaned piglets[J]. Animal Feed Science and Technology, 2014, 195: 67-75. |
| [12] |
CUMMINS A G, THOMPSON F M. Effect of breast milk and weaning on epithelial growth of the small intestine in human[J]. Gut, 2002, 51(5): 748-754. |
| [13] |
李艳云, 张艳英, 史秋梅, 等. 紫锥菊多糖对LPS损伤后IEC-6细胞的增殖作用[J]. 安徽农业科学, 2015, 43(14): 19-21, 73. DOI:10.3969/j.issn.0517-6611.2015.14.007 |
| [14] |
CHIBA H, OSANAI M, MURATA M, et al. Transmembrane proteins of tight junctions[J]. Biochimcaet Biophysica Acta:Biomembranes, 2008, 1778(3): 588-600. |
| [15] |
MITIC L, VAN TIALLIE C M, ANDERSON J M. Molecular physiology and pathophysiology of tight junctions Ⅰ.Tight junction structure and function:lessons from mutant animals and proteins[J]. American Journal of Physiology:Gastrointestinal and Liver Physiology, 2000, 279(2): G250-G254. DOI:10.1152/ajpgi.2000.279.2.G250 |
| [16] |
FURUSE M, HATE M, FURUSE K, et al. Claudin-based tight junctions are crucial for the mammalian epidermal barrier:a lesson from claudin-1-deficient mice[J]. The Journal of Cell Biology, 2002, 156(6): 1099-1111. DOI:10.1083/jcb.200110122 |
| [17] |
ZHANG S H, REN M, ZENG X F, et al. Leucine stimulates ASCT2 amino acid transporter expression in porcine jejunal epithelial cell line (IPEC-J2) through PI3K/Akt/mTOR and ERK signaling pathways[J]. Amino Acids, 2014, 46(12): 2633-2642. |
| [18] |
REN M, ZHANG S H, LIU X T, et al. Different lipopolysaccharide branched-chain amino acids modulate porcine intestinal endogenous β-defensin expression through the Sirt1/ERK/90RSK pathway[J]. Journal of Agricultural and Food Chemistry, 2016, 64(17): 3371-3379. |
| [19] |
XIAO H, ZENG L M, SHAO F Y, et al. The role of nitric oxide pathway in arginine transport and growth of IPEC-1 cells[J]. Oncotarget, 2017, 8(18): 29976-29983. |




