β-受体激动剂是一类动物兴奋剂,具有促进蛋白质合成、降低脂肪沉淀等作用,当它们被用于家畜饲粮时,能显著提高胴体的瘦肉率和饲料转化率。由于用于家畜生产的β-受体激动剂通常剂量高,用药时间长,因此容易造成畜禽产品中β-受体激动剂残留超标,通过食物链的传递,最终被消费者食用,造成人体内的残留和蓄积损伤[1-3]。人在发生β-受体激动剂中毒反应时,会表现出严重的心悸、恶心、呕吐、心率加快等症状,严重的可能会危害生命健康[4-5]。我国农业部明令禁止将β-受体激动剂用于所有动物性食品。然而在利益的驱使下,仍有养殖户将β-受体激动剂应用于畜禽养殖过程中,因此建立畜禽产品中残留β-受体激动剂检测方法,通过生产链追溯至不法生产者,在食品安全监管中发挥着重要作用。
常见的β-受体激动剂检测方法有免疫检测方法(如酶联免疫法、胶体金免疫法、化学发光免疫法)和色谱法(高效液相色谱法、气相色谱-质谱法和液相色谱-质谱法)[6-10]。近年来,随着液相色谱-质谱联用仪的广泛运用,β-受体激动剂的液质检测方法也不断地得到优化[11-20]。本文研究了猪肝、牛肉、羊肉中5种β-受体激动剂(图 1)的超高效液相色谱-串联质谱(UPLC-MS/MS)快速检测分法,以期能为大批量畜禽产品中5种β-受体激动剂残留的检测提供参考。
|
图 1 5种β-受体激动剂分子结构 Figure 1 Molecular structures of five β-agonists |
UPLC-TQS Micro超高效液相色谱-串联质谱仪,配备电喷雾离子源(美国Waters);电子天平(德国赛多利斯);高速冷冻离心机(德国Sigma);固相萃取仪(美国Supelco);氮吹仪(美国Organomation);PRiME HLB固相萃取柱(美国Waters);精密pH计(上海精密科学仪器有限公司);基本型圆周混合器、数显振荡摇床(德国IKA)。
5种β-受体激动剂:莱克多巴胺纯度为98.0%,克伦特罗纯度为99.1%,沙丁胺醇纯度为99.2%,西马特罗纯度为99.9%,氯丙那林纯度为99.9%。5种β-受体激动剂内标:莱克多巴胺-D3纯度为99.0%,克伦特罗-D9纯度为99.4%,沙丁胺醇-D3纯度为98.4%,西马特罗-D7纯度为99.3%,氯丙那林-D7纯度为99.8%。甲醇、乙腈为默克色谱纯;水为超纯水;其余试剂为分析纯。
标准储备液:称取5种β-受体激动剂标准品及内标标准品适量,分别用纯甲醇配制成1 mg/mL单标储备液。于-18 ℃避光保存。准确吸取5种β-受体激动剂标准品溶液适量配制成混合标准溶液,再用纯甲醇逐级稀释为1 μg/mL的混合溶液,5种β-受体激动剂内标混合溶液配制方法同上,于4 ℃冷藏保存。
1.2 分析条件色谱条件:色谱柱为Waters Acquity BEH-C18 (2.1 mm× 100 mm,1.7 μm);进样量为4 μL;柱温30 ℃;流动相A:10 mmol/L乙酸铵(pH=5),流动相B:10 mmol/L乙酸铵(pH=5)甲醇溶液;流速为0.3 mL/min;梯度洗脱程序见表 1。
|
|
表 1 梯度洗脱程序 Table 1 Gradient elution procedure |
质谱条件:电喷雾离子源,正离子模式;毛细管电压0.6 kV;离子源温度500 ℃;去溶剂气流速1 000 L/Hr。
1.3 样品前处理准确称取绞碎后试样2.00 g于50 mL离心管中,添加适量内标。加入10 mL的80%乙腈水溶液,漩涡1 min,振荡提取10 min,10 000 r/min离心10 min。取6 mL上清液直接加载到6 mL规格PRiME HLB固相萃取柱,保持1 s每滴流速,收集全部流出液,振荡混匀。取4 mL流出液在50 ℃下氮气吹至近干。用1 mL浓度为10%甲醇水溶液复溶,用0.2 μm微孔滤膜过滤,待测定。
2 结果与分析 2.1 色谱条件的优化通过比较0.2%甲酸水溶液-40%甲醇乙腈溶液、0.1%甲酸乙腈溶液-0.1%甲酸水溶液和10 mmol/L乙酸铵水溶液-10 mmol/L乙酸铵甲醇溶液(pH=5)3种流动相,发现当流动相中有乙酸铵存在时,峰型较好,响应值较高,因此,用10 mmol/L乙酸铵水溶液-10 mmol/L乙酸铵甲醇溶液(pH=5)作为流动相进行梯度洗脱,5种β-受体激动剂正离子扫描特征离子色谱图见图 2。
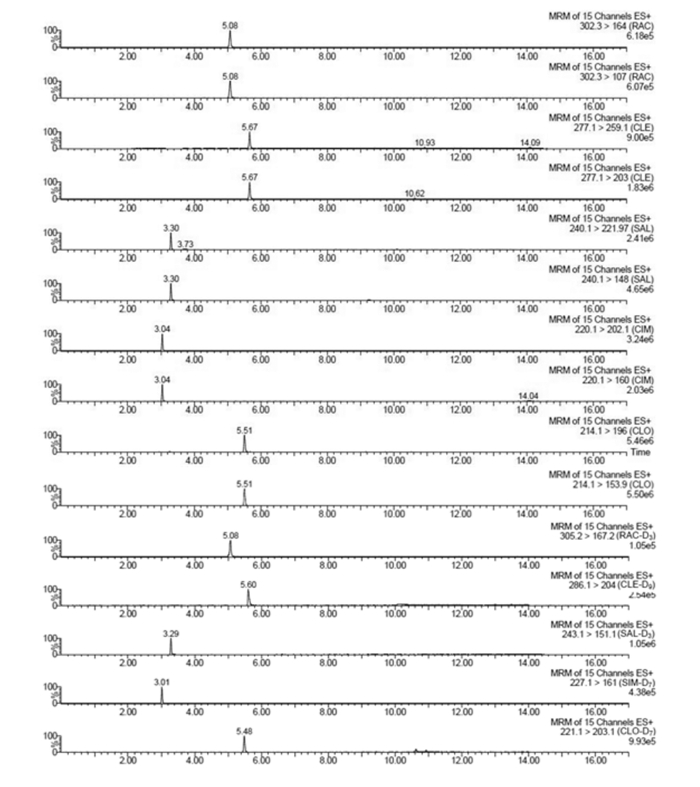
|
MRM:多反应监测;RAC:莱克多巴胺;CLE:克伦特罗;SAL:沙丁胺醇;CIM:西马特罗;CLO:氯丙那林;RAC-D3:莱克多巴胺-D3;CLE-D9:克伦特罗-D9;SAL-D3:沙丁胺醇-D3;CIM-D7:西马特罗-D7;CLO-D7:氯丙那林-D7。 MRM: multiple-reaction monitoring; RAC: ractopamine; CLE: clenbuterol; SAL: salbutamol; CIM: cimaterol; CLO: clorprenaline; RAC-D3: ractopamine-D3; CLE-D9: clenbuterol-D9; SAL-D3: salbutamol-D3; CIM-D7: cimaterol-D7; CLO-D7: clorprenaline-D7. 图 2 5种β-受体激动剂及其同位素内标的正离子扫描特征离子色谱图 Figure 2 Positive ion scanning characteristic ion chromatograms of 5 β-agonists and isotopic internal standard |
在电喷雾离子源正离子扫描(ESI+)模式下进行质谱条件优化。以5.0 μL/min的流速注入100 ng/mL的混合标准溶液,进行一级质谱扫描,获得合适的母离子条件,再对母离子进行二级扫描,调节碰撞能量和锥孔电压,筛选信号最强的子离子作为定量离子,信号次强的子离子作为定性离子,得出多反应监测条件:离子对、锥孔电压、碰撞能量(表 2)。
|
|
表 2 5种β-受体激动剂及其同位素内标多反应监测条件 Table 2 MRM conditions of 5 β-agonists and isotopic internal standard |
精密量取5种β-受体激动剂混合溶液,用10%甲醇水溶液稀释成浓度为0.5、2.0、5.0、10.0、20.0、50.0 ng/mL的标准工作溶液,含内标物浓度为5 ng/mL,供液相色谱-串联质谱仪测定。内标法以各特征离子质量色谱峰与相应同位素内标的峰面积比为纵坐标,对照溶液的浓度为横坐标,绘制标准曲线[6]。回归方程及相关系数见表 3。由表 3可以看出,5种β-受体激动剂浓度在0.5~50.0 ng/mL呈现良好的线性关系,线性相关系数(R2)在0.999 63~0.999 96。
|
|
表 3 5种β-受体激动剂回归方程及相关系数 Table 3 Regression equation and correlation coefficient of 5 β-agonists |
根据特征离子色谱峰信噪比(S/N)=3计算方法的检出限,得出5种β-受体激动剂检出限为0.01~0.04 μg/kg。按照S/N=10得出5种β-受体激动剂定量限为0.02~0.15 μg/kg。
2.4 回收率称取猪肝、牛肉、羊肉的空白样品,进行0.5、1.0、5.0 μg/kg 3个不同浓度的添加回收试验,按照1.3方法进行前处理,每个水平重复3次,计算平均回收率和相对标准偏差(RSD)。结果见表 4。5种β-受体激动剂回收率在猪肝中为93.7%~106.1%,牛肉中为95.2%~104.0%,羊肉中为95.1%~106.0%。结果表明,该方法具有较好的回收率,可以满足猪肝、牛肉、羊肉中5种β-受体激动剂残留的日常检测要求。
|
|
表 4 猪肝、牛肉、羊肉中5种β-受体激动剂的平均回收率和相对标准偏差 Table 4 Average recovery ratio and RSD of 5 β-agonists in pork liver, beef and mutton (n=3) |
按照1.3前处理方法,分别称取猪肝、牛肉、羊肉样品,进行阳性添加,制备0.5、1.0、5.0 μg/kg 3个不同浓度的样品,每个水平重复6次,进行分析测定。计算相对标准偏差(RSD)。同样操作方法,连续测定3 d,计算日间精密度RSD, 结果见表 5。猪肝中5种β-受体激动剂日内精密度RSD为0.6%~4.5%,日间精密度RSD为0.5%~4.4%;牛肉中5种β-受体激动剂日内精密度RSD为0.9%~4.1%,日内精密度RSD为0.9%~5.3%;羊肉中5种β-受体激动剂日内精密度RSD为1.2%~3.6%,日内精密度RSD为1.2%~4.1%。结果表明,该方法具有较好的重复性和日间精密度。可以满足猪肝、牛肉、羊肉中5种β-受体激动剂残留的日常检测要求。
|
|
表 5 猪肝、牛肉、羊肉中5种β-受体激动剂的精密度相对标准偏差 Table 5 Precision RSD of 5 β-agonists in pork liver, beef and mutton (n=6) |
畜禽产品中含有大量蛋白质和脂肪,本试验中用乙腈/水溶剂沉淀蛋白质,通过离心去除蛋白质。然后用PRiME HLB小柱进行简单、快速的净化。一般固相萃取需要活化、上样、淋洗、洗脱4个步骤达到净化目的。本试验过程中,样品提取液直接上样至PRiME HLB固相萃取柱,既省略了以往固相萃取过程中的活化、淋洗、洗脱3个步骤,又去除了样品中的脂肪等复杂基质,实现了一步净化,净化后的样品溶液通过24孔氮吹仪浓缩,实现批量快速处理,试验前处理省时高效,可提高检测效率。
3.2 液质条件的优化本法通过比较不同流动相对色谱峰的影响,最终确定用10 mmol/L乙酸铵水溶液-10 mmol/L乙酸铵甲醇溶液(pH=5)作为流动相进行梯度洗脱,通过优化液相梯度洗脱条件,使5种β-受体激动剂的出峰时间在6 min以内,可获得较好的峰型。
采用电喷雾离子源正离子模式扫描,获得5种β-受体激动剂的母离子和子离子信息,确定最佳定量离子对和定性离子对。通过对离子源参数进行优化,获得较好的响应值。
4 结论① 当5种β-受体激动剂浓度为0.5~5.0 μg/kg时,猪肝中回收率为93.7%~106.1%,牛肉中回收率为95.2%~104.0%,羊肉中回收率为95.1%~106.0%。
② 5种β-受体激动剂检出限为0.01~0.04 μg/kg,定量限为0.02~0.15 μg/kg。
③ 本试验方法具有较好的准确度和重复性,操作简便,灵敏度高,准确度好,适合大批量畜产品中β-受体激动剂残留的检测分析。
| [1] |
康升云. β受体激动剂对畜产品安全的影响[J]. 中国畜牧兽医文摘, 2012, 28(7): 211. |
| [2] |
王培龙. β-受体激动剂及其检测技术研究[J]. 农产品质量与安全, 2014(1): 44-52. DOI:10.3969/j.issn.1674-8255.2014.01.012 |
| [3] |
魏凤静. 关于"瘦肉精"分类、危害及检测标准的探讨[J]. 山东畜牧兽医, 2017, 38(4): 59-60. DOI:10.3969/j.issn.1007-1733.2017.04.042 |
| [4] |
COURTHEYN D, LE BIZEC B, BRAMBILLA G, et al. Recent developments in the use and abuse of growth promoters[J]. Analytica Chimica Acta, 2002, 473(1/2): 71-82. |
| [5] |
沈建忠, 江海洋. 畜产品中β-受体激动剂残留及其危害[J]. 中国动物检疫, 2011, 28(6): 27-28. DOI:10.3969/j.issn.1005-944X.2011.06.011 |
| [6] |
叶妮, 孙雷, 尹晖, 等. UPLC-MS/MS法检测动物性食品中19种β-受体激动剂残留[J]. 中国兽药杂志, 2015, 49(9): 51-59. |
| [7] |
聂婉, 伍晓红, 陈秋玲, 等. β-兴奋剂性质及其最新检测方法研究进展[J]. 黑龙江畜牧兽医, 2016(23): 75-77. |
| [8] |
熊琳, 李维红, 高雅琴, 等. 肉品中β-受体激动剂类药物残留检测技术研究进展[J]. 食品安全质量检测学报, 2015, 6(2): 528-533. |
| [9] |
朱坚, 李波, 方晓明, 等. 气相色谱-质谱法测定肝、肾和肉中11种β-受体激动剂残留量[J]. 质谱学报, 2005, 26(3): 129-137. DOI:10.3969/j.issn.1004-2997.2005.03.001 |
| [10] |
张旖, 赵善贞, 曲栗, 等. HPLC-q/LTQ-MS法测定肉及肉制品中10种β-受体激动剂[J]. 食品科学, 2014, 35(20): 202-207. DOI:10.7506/spkx1002-6630-201420040 |
| [11] |
MAURO D, CIARDULLO S, CIVITAREALE C, et al. Development and validation of a multi-residue method for determination of 18β-agonists in bovine urine by UPLC-MS/MS[J]. Microchemical Journal, 2014, 115: 70-77. DOI:10.1016/j.microc.2014.02.012 |
| [12] |
WANG P L, LIU X M, SU X O, et al. Sensitive detection of β-agonists in pork tissue with novel molecularly imprinted polymer extraction followed liquid chromatography coupled tandem mass spectrometry detection[J]. Food Chemistry, 2015, 184: 72-79. DOI:10.1016/j.foodchem.2015.03.073 |
| [13] |
PAN S D, ZHOU L X, ZHAO Y G, et al. Development and validation of a sensitive method for simultaneous determination of eight β2-agonists in pork by ultrasonic-assisted extraction and liquid chromatography/tandem mass spectrometry[J]. Chromatographic Science, 2015, 53(1): 104-111. |
| [14] |
SUNG I K, PARK S J, KANG K, et al. Development and application of a method for rapid and simultaneous determination of three β-agonists (clenbuterol, ractopamine, and zilpaterol) using liquid chromatography-tandem mass spectrometry[J]. Korean Journal for Food Science of Animal Resources, 2015, 35(1): 121-129. DOI:10.5851/kosfa.2015.35.1.121 |
| [15] |
周帅, 张飞云. UPLC-MS/MS检测运动食品中β-受体激动剂残留[J]. 食品研究与开发, 2017, 38(11): 148-152. DOI:10.3969/j.issn.1005-6521.2017.11.033 |
| [16] |
招钰娟, 邓晓华, 甘沛明, 等. 液相色谱串联质谱法测定动物组织中17种β-兴奋剂残留[J]. 安徽农业科学, 2017, 45(15): 95-99. DOI:10.3969/j.issn.0517-6611.2017.15.031 |
| [17] |
刘佳, 梁桂荣, 李少晖, 等. 液相色谱-串联质谱法检测饲料中26种β2-受体激动剂类药物残留[J]. 食品安全质量检测学报, 2015, 6(4): 1167-1173. |
| [18] |
刘畅, 吴小虎, 徐伟东, 等. LC-MS/MS测定动物源性食品中15种β-受体激动剂残留的研究[J]. 药物分析杂志, 2008, 28(12): 2085-2089. |
| [19] |
吉彩霓, 岳振峰, 欧阳姗. 固相萃取-高效液相色谱串联质谱法同时测定猪肉中克伦特罗和沙丁胺醇残留[J]. 中国预防医学杂志, 2006, 40(2): 123-125. |
| [20] |
倪炜华. UPLC-MS/MS测定动物源食品中9种β-受体激动剂[J]. 化学分析计量, 2017, 26(3): 67-71. DOI:10.3969/j.issn.1008-6145.2017.03.016 |




