2. 北京首朗生物科技有限公司, 北京 100041;
3. 华中农业大学水产学院, 武汉 430070;
4. 农业部饲料生物技术重点开放实验室, 北京 100081
2. Beijing Shoulang Bio-Technology Co., Ltd., Beijing 100041, China;
3. College of Fisheries, Huazhong Agricultural University, Wuhan 430070, China;
4. Key Laboratory of Aquaculture Nutrition and Feed, Ministry of Agriculture, Beijing 100081, China
我国是水产养殖大国,草鱼(Ctenopharyngodon idllus)产量居水产养殖之首,年产量超过500万t[1]。草鱼属于植物食性鱼类,配合饲料中鱼粉等动物性蛋白质的使用量很低,饲料中以豆粕、棉籽粕及菜籽粕等植物性蛋白质原料为主。相对于棉籽粕和菜籽粕而言,豆粕因其产量高、适口性好和消化率高,草鱼肠道肝胰脏对豆粕的酶解消化能力优于其他植物性蛋白质,应用最为广泛[2-3]。但已有许多研究表明,对于鱼类来说,植物性蛋白质存在必需氨基酸不平衡[4]、含有抗营养因子(如脲酶、胰蛋白酶等)[5-6]、产品质量不稳定等问题[7-9],并且豆粕中含蛋白酶抑制剂和大豆凝集素,会抑制鱼类的消化酶活性[10-11],导致其过量使用后不利于水产动物的生长和健康。虽然可以通过发酵、物理加工、多蛋白质源配伍、补充外源氨基酸等方法在一定程度弥补植物性蛋白质的一些缺陷,但是有报道表明,对于植物食性鱼类来说,过量使用豆粕引发的肠道和肝胰脏病变等问题依然很难得到有效解决[12-13],因此,寻找抗营养因子含量较低的非动物源性饲料蛋白质源,如单细胞蛋白质,对植物食性鱼类消化系统的健康十分重要。
随着微生物发酵技术逐步应用到饲料工业生产中,一些国家已经建立了菌体蛋白产业(MBP),菌体蛋白蛋白质含量高,且氨基酸组成相对齐全,富含维生素和多种微量元素[14],还能使饲料具有一定鲜味从而改善其适口性[15];同时,其具有生产效率高、生产原料来源广、可工业化生产等优点,目前已有相当部分菌体蛋白在畜禽和水产饲料中应用[16]。但菌体蛋白产品质量很大程度受非蛋白氮含量的影响,部分产品使用质量较差,例如味精菌体蛋白存在真蛋白质含量低、氨基酸不平衡和氨基酸消化率低等问题[17]。
乙醇梭菌蛋白是以乙醇梭菌(Clostridium autoethanogenum)为发酵菌种生产的一种新型菌体蛋白。乙醇梭菌最早由Abrini等[18]从兔子粪便中分离得到,在生产工艺中以一氧化碳(CO)为原料,进行液态发酵,发酵液经离心、干燥后获得高蛋白质生物饲料原料乙醇梭菌蛋白。乙醇梭菌蛋白目前在水产饲料中还没有明确的评估数据,为此,本试验设计了乙醇梭菌蛋白替代豆粕的梯度添加试验,研究其对草鱼生长性能、血浆生化指标及肝胰脏和肠道组织病理的影响,为乙醇梭菌蛋白在水产饲料中的应用提供参考。
1 材料与方法 1.1 试验材料试验用乙醇梭菌蛋白为淡黄色粉末,由北京首朗生物科技有限公司提供,粗蛋白质含量为84.69%,胃蛋白酶消化率为90.2%。
1.2 试验设计和试验饲料选择初始体重为(25.70±0.03) g的草鱼540尾,随机分为3组,每组6个重复,每个重复30尾鱼。对照组(J0组)饲喂基础饲料,试验组分别用5%(J5组)和10%(J10组)的乙醇梭菌蛋白替代基础饲料中27.5%和55.0%的豆粕。
豆粕中缺乏蛋氨酸,富含精氨酸,而乙醇梭菌蛋白与之相反,因此随着乙醇梭菌蛋白添加量增加,饲料中DL-蛋氨酸(DL-Met)的添加量逐步减少,而L-精氨酸(L-Arg)的添加量逐步增加。各饲料原料按照添加量从小到大的顺序逐级搅拌混匀,采用双螺杆干法膨化机制成粒径2 mm的挤压膨化浮性颗粒饲料(TSE65型,北京现代洋工机械科技发展有限公司)。3组饲料等氮等能且必需氨基酸均满足草鱼需求[19]。试验饲料组成及营养水平见表 1,试验饲料氨基酸组成见表 2。
|
|
表 1 试验饲料组成及营养水平(风干基础) Table 1 Composition and nutrient levels of experimental diets (air-dry basis) |
|
|
表 2 试验饲料氨基酸组成 Table 2 Amino acid composition of experimental diets |
试验正式开始前,试验鱼在养殖系统中暂养2周,暂养期间投喂对照组饲料。试验在北京南口国家水产饲料安全评价基地室内循环流水养殖系统中进行,水源为曝气井水,流量为9.64 L/min。用2%食盐水消毒试验鱼及养殖系统后,随机挑选体质健康、个体均匀的草鱼,分配到容积为0.26 m3的圆锥形养殖桶中。养殖试验从2016年9月26日到2016年12月4日,共10周。
试验期间每天表观饱食投喂4次,投喂时间分别为08:00、11:00、15:00、19:00。定期检测水质,条件保持在溶氧浓度>7.0 mg/L;总氨氮浓度<0.3 mg/L;pH 7.5~8.5;水温(22±1) ℃,自然光照。
1.4 样品采集及检测分析 1.4.1 样品采集试验开始时,取12尾鱼作为初始全鱼样品,每4尾作为1个混合样品。试验结束时,每桶鱼饥饿24 h后称重,每桶取3尾鱼做终末全鱼样品,每桶再随机取3~4尾鱼,用80 mg/L三氯叔丁醇(上海国药集团化学试剂有限公司)麻醉后,分别测量其体长(自吻端至椎骨末端的长度)、体重,之后尾部取血,加入30 μL/mL抗凝剂(2%NaF+4%草酸钾),在4 ℃、4 000 r/min的条件下离心10 min,取上清血浆保存于-80 ℃的冰箱中待测。每桶随机取2尾鱼的肝胰脏(胆管连接部位)和后肠(距离肛门10 mm)经4%多聚甲醛液中固定24~48 h,经脱水,包埋,连续切片6 μm,后经脱蜡并进行苏木精-伊红(HE)染色,显微观察。
1.4.2 检测分析分别采用105 ℃常压干燥法(GB/T 6435—2006)、凯氏定氮法(GB/T 6432—1994)、酸水解粗脂肪测定法(GB/T 6433—2006)、550 ℃灼烧法(GB/T 6438—2007)、过滤法(GB/T 17811—2008)测定原料、饲料和鱼体的水分、粗蛋白质、粗脂肪、粗灰分含量及胃蛋白酶消化率;总能的检测方法参照ISO-9831:1998[21]采用氧弹仪测定;饲料中氨基酸含量采用国标(GB/T 18246—2000)方法进行测定。每个样品至少测定2个重复。
血浆生化指标包括:总胆固醇(TC)、甘油三酯(TG)、葡萄糖(Glu)、免疫球蛋白M(IgM)、白细胞介素-8(IL-8)、白细胞介素-1α(IL-1α)、丙二醛(MDA)含量及谷丙转氨酶(ALT)、谷草转氨酶(AST)、总超氧化物歧化酶(T-SOD)活性,试验所用TC和TG试剂盒购自浙江东瓯诊断产品有限公司,其余试剂盒购自南京建成生物工程研究所,检测使用酶标仪(Bio-Tek,Burlington,美国)法。
生长性能和形体指标各指标计算公式如下:

|
式中:Nt为终末鱼数(尾);N0为初始鱼数(尾);IBW为鱼体初始均重(g);FBW为终末均重(g);W0为鱼体初始总重(g);Wt为鱼体终末总重(g);Wd为死亡鱼体总重(g);C为摄食量(g);Bpt为终末鱼体蛋白质含量(%);Bp0为初始鱼体蛋白质含量(%);Dp为饲料蛋白质含量(%);t为养殖天数。
1.5 数据统计试验数据以平均值±标准误(mean±SE)表示,所有数据用SPSS 20.0软件进行单因素方差分析(one-way ANOVA),Duncan氏多重比较法检验差异显著性,显著性水平为P < 0.05。
2 结果与分析 2.1 乙醇梭菌蛋白替代豆粕对草鱼生长性能和形体指标的影响乙醇梭菌蛋白替代豆粕对草鱼生长性能和形体指标的影响见表 3。J5组末均重、增重率和特定生长率均显著高于对照组(P < 0.05);J10组末均重、增重率和特定生长率低于J5组,高于对照组,但均没有显著差异(P>0.05)。J5和J10组饲料系数均显著低于对照组(P < 0.05),J5组最低。各组摄食率虽然没有显著差异(P>0.05),但随着乙醇梭菌蛋白添加量的增加有提高趋势。各组蛋白质沉积率没有显著差异(P>0.05)。J10组存活率显著低于对照组(P < 0.05)。J5组肝胰指数显著低于J10组(P < 0.05),但二者均与对照组没有显著差异(P>0.05)。各组脏体比、肥满度和脾脏指数没有显著差异(P>0.05)。
|
|
表 3 乙醇梭菌蛋白替代豆粕对草鱼生长性能和形体指标的影响 Table 3 Effects of soybean meal replaced by Clostridium autoethanogenum protein on growth performance and physical indices of grass carp |
乙醇梭菌蛋白替代豆粕对草鱼血浆生化指标的影响见表 4。J5和J10组血浆TC含量显著低于J0组(P < 0.05);J10组血浆Glu含量显著高于J0组(P < 0.05);J10组血浆AST活性显著高于J5组(P < 0.05),J5组显著高于J0组(P < 0.05);J10组血浆ALT活性显著低于J0和J5组(P < 0.05)。虽然各组血浆AST和ALT活性均低于文献报道的正常范围值,但J10组血浆AST/ALT剧烈升高,显著高于J0和J5组(P < 0.05)。
|
|
表 4 乙醇梭菌蛋白替代豆粕对草鱼血浆生化指标的影响 Table 4 Effects of soybean meal replaced by Clostridium autoethanogenum protein on plasma biochemical indexes of grass carp |
各组血浆特异性免疫指标IgM、IL-8和IL-1α含量没有显著差异(P>0.05)。J5组血浆MDA含量显著低于J0和J10组(P < 0.05)。各组血浆T-SOD活性没有显著差异(P>0.05)。
2.3 乙醇梭菌蛋白替代豆粕对草鱼体成分的影响乙醇梭菌蛋白替代豆粕对草鱼体成分的影响见表 5。J10组的全鱼水分含量显著高于J5组(P < 0.05),但各组的全鱼粗灰分、粗蛋白质和粗脂肪含量没有显著差异(P>0.05)。
|
|
表 5 乙醇梭菌蛋白替代豆粕对草鱼体成分的影响 Table 5 Effects of soybean meal replaced by Clostridium autoethanogenum protein on body composition of grass carp |
各组草鱼肝胰脏组织切片结果见图 1,肝胰脏组织病理诊断分析结果见表 6。各组草鱼肝胰脏均出现一定比例的轻微病理现象,其中J0组肝胰脏11个样本中,9尾正常(图 1-A),1尾出现细胞空泡,疑似脂肪肝现象(图 1-B),1尾出现细胞核增加聚集、肝细胞结节现象(图 1-C);J5组11个样本中, 8尾正常,1尾出现细胞空泡,2尾出现细胞核增加聚集、肝细胞结节现象;J10组11个样本中,7尾正常,1尾轻出现微脂肪肝,3尾出现肝细胞结节现象。以上结果说明,乙醇梭菌蛋白添加量增加有逐步加剧肝细胞核聚集、细胞致密化的趋势,结合J10组血浆中陡增的AST/ALT,推测该组肝组织损伤程度较J0、J5组较高。
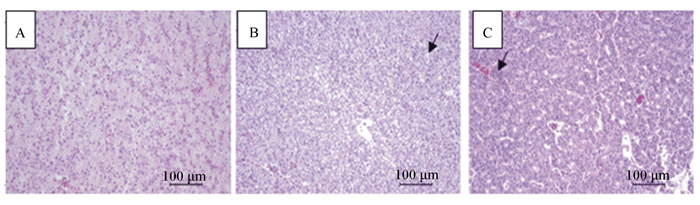
|
A:正常细胞;B:细胞空泡化,脂肪肝症状(黑色箭头);C:细胞结节化,核聚集(黑色箭头)。 A: normal cells; B: vacuoles cells, fatty liver symptom (black arrow); C: nodular cells, nucleus aggregation (black arrow). 图 1 肝胰脏组织切片 Figure 1 Histological sections of hepatopancreas |
|
|
表 6 肝胰脏组织病理诊断分析 Table 6 Pathological diagnosis analysis of hepatopancreas tissue |
各组草鱼后肠组织切片结果见图 2,后肠组织病理诊断分析结果见表 7。各组均出现不同程度地后肠组织损伤,其中J0组后肠11个样本中,6尾正常(图 2-A),4尾出现微绒毛脱落、固有层疏松、杯状细胞减少或消失症状(图 2-B);J5、J10组肠道结构均稍有改善,11个样品中均有8尾正常,J5组2尾出现微绒毛脱落、固有层疏松、杯状细胞减少或消失症状症状,1尾出现绒毛高度变浅、肌层变薄现象(图 2-C);J10组3尾出现微绒毛脱落、固有层疏松、杯状细胞减少或消失症状症状。
|
|
表 7 后肠组织病理诊断分析 Table 7 Pathological diagnosis analysis of posterior intestinal tissue |
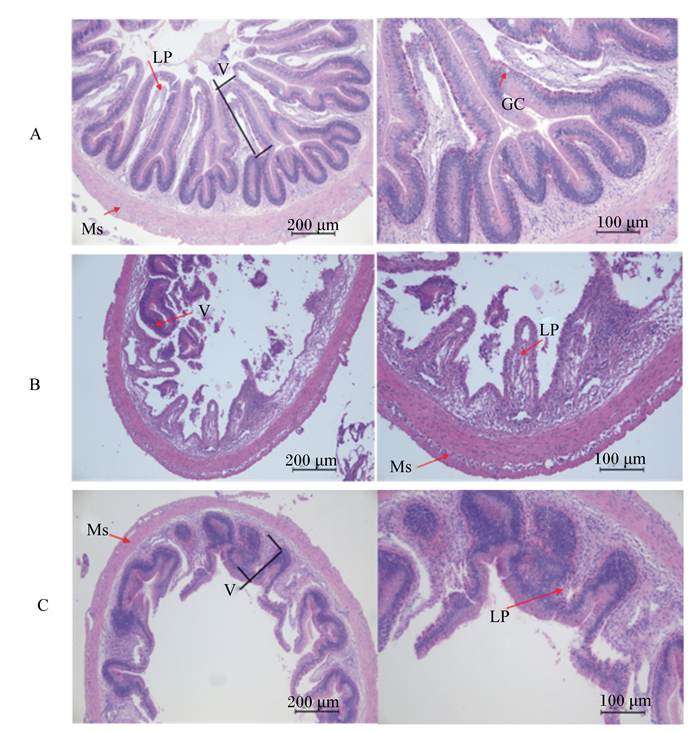
|
A:正常肠道组织结构;B:微绒毛(V)脱落,固有层(LP)疏松,杯状细胞(GC)消失;C:绒毛高度变浅,肌层(Ms)变薄。 A: normal intestinal tissue structure; B: microvillus (V) drop, lamina propria (LP) failure, and goblet cell (GC) lose; C: villus height short, muscularis (Ms) thinning. 图 2 后肠组织切片 Figure 2 Histological sections of posterior intestine |
乙醇梭菌蛋白由乙醇梭菌经生物发酵而得,乙醇梭杆菌细胞呈杆状,革兰氏染色阳性,严格厌氧生长,兼性化能自养,与环境隔离,性状稳定,对氯霉素、青霉素、氨苄青霉素和四环素敏感[18],目前已经获得了比较完整的基因组序列,无有毒基因的报道[26-27]。乙醇梭菌利用CO和二氧化碳(CO2)作为碳源生长,发酵CO或者CO2和氢气(H2)生成乙醇或乙酸盐,在生产工艺中以钢铁工业煤气(转炉煤气、高炉煤气)中的CO为碳源,以氨水为氮源,培养基由磷酸(H3PO4)、氢氧化钾(KOH)、硫酸镁(MgSO4)、硫酸亚铁(FeSO4)及少量维生素(维生素B1、维生素B2、维生素B5、维生素B6、维生素B12、烟酸、叶酸及生物素)组成,经气体预处理、发酵、蒸馏脱水、菌体分离、喷雾干燥及污水处理5个流程,最后得到乙醇等清洁能源及菌体蛋白,每生产1万t乙醇,大约可以获得1 500 t菌体蛋白,具有巨大的开发潜能。乙醇梭菌蛋白作为钢铁工业煤气发酵制燃料乙醇的附属产品,极大促进工业废弃物转化再利用,减少了有害气体的排放,与传统植物源性蛋白质相比,不含抗营养因子,而相对于动物源性蛋白质,具有较低的沙门氏菌、生物胺等,乙醇梭菌蛋白的生产具有绿色、节能、环保的特性。但是由于乙醇梭菌蛋白属于微生物发酵产品,且乙醇梭杆菌尚未进入我国饲料添加剂目录,因此针对乙醇梭杆菌菌种的生物安全性的全面评估需要进一步深入研究。
乙醇梭菌蛋白的粗蛋白质含量高达80%以上,且易于动物消化吸收,富含多种微量元素,不含抗营养因子,同时富含18种氨基酸,总氨基酸占蛋白质的含量≥85%,其中赖氨酸和含硫氨酸含量相对较高,但精氨酸相对缺乏。蛋白质是鱼类最主要的营养和能量来源,鱼类对蛋白质的需求实际是对必需氨基酸的需求,蛋白质营养平衡实际上是氨基酸平衡,必须氨基酸的缺乏,往往会导致鱼类的一些营养性疾病和症状的产生[28]。
蛋氨酸在机体代谢中有着十分重要的作用,是鱼类所必需而植物性蛋白质含量不足的限制性氨基酸,特别是豆类原料的第一限制性氨基酸。有研究表明,饲料中蛋氨酸缺乏会显著降低动物血浆胰岛素样生长因子1(IGF-1)含量[29],动物的摄食受到IGF-1的调节[30],因此,蛋氨酸的促生长作用可能与提高了生长中期草鱼血浆IGF-1含量有关,具体机制还有待深入研究。王胜[31]和唐炳荣等[32]报道,提高饲料中蛋氨酸水平能提高草鱼幼鱼和生长中期草鱼的增重、摄食量、饲料效率、特定生长率和蛋白质效率;廖英杰[33]在团头鲂幼鱼对蛋氨酸需要量的研究中也得到了相同的结论,同时王胜[31]还发现增重率、特殊生长率、饲料效率、蛋白质效率等还受饲料精氨酸水平影响。豆粕为饲料主要蛋白质源,相对于鱼类饲料理想蛋白模式以蛋氨酸/粗蛋白质约2%、精氨酸/粗蛋白质约5%来计,豆粕中缺乏蛋氨酸,而乙醇梭菌蛋白中的缺乏精氨酸,因此本试验补充了相应的限制性氨基酸,但草鱼属于无胃鱼,可能对晶体氨基酸的利用能力不足,无法同步吸收外源晶体氨基酸,郑宗林等[34]和谭芳芳[35]都曾有草鱼对晶体氨基酸利用效率相对不高的相关报道。本试验中,随着乙醇梭菌蛋白添加量的增加,豆粕添加量的减少,J5组饲料中的内源性结合态蛋氨酸高于J0组,这可能是J5组增重率、末均重、特定生长率和饲料效率高于J0组的原因,但J10组生长性能和J0组差异不显著,这可能是由于J10组内源性精氨酸缺乏引起氨基酸不平衡所致。
氨基酸也是保证肠道组织紧密连接和结构完整的重要营养素[36],特别是蛋氨酸和精氨酸对维持肠道健康具有重要作用。精氨酸在精氨酸酶(arginase)的作用下生成鸟氨酸,鸟氨酸经鸟氨酸脱羧酶的作用生成多胺(精胺、腐胺、精胺),多胺不仅对肠道上皮细胞的生长、分化和成熟起着重要作用,还对肠黏膜发育和肠道形态修复具有不可替代的作用[37],Cheng等[38-39]在杂交条纹鲈(Morone chrysops×Morone saxatilis)、美国红鱼(Sciaenops ocellatus)和迟淑艳等[40]在斜带石斑鱼(Epinephelus coioides)试验中均证实精氨酸对肠道健康具有重要意义。同样,在肠道组织中,蛋氨酸通过转甲基可生成S-腺苷甲硫氨酸(SAM),SAM脱去羧基可生成5′-腺苷甲基硫丙胺,该物质将氨丙基转移给腐胺或亚精胺也生成多胺[41],蛋氨酸还通过转硫作用生成谷胱甘肽的底物半胱氨酸,因此蛋氨酸可以调控细胞内还原型谷胱甘肽(GSH)含量及细胞存活,而GSH也具有保护肠上皮细胞等重要作用[42]。彭艳等[43]研究证实,蛋氨酸可促进幼建鲤肠道发育及增加皱壁高度。本试验中对照组和试验组均有一定比例的肠道损伤现象,对照组的肠道损伤可能与饲料中豆粕含量较高,饲料中大豆抗原的水平较J5和J10组高[44],并且内源蛋氨酸相对缺乏有关;J10组的肠道损伤可能是由于内源精氨酸缺乏所致,而乙醇梭菌蛋白替代豆粕后降低了饲料中的抗营养因子水平,所以缓减了J5和J10组后肠组织损伤程度。
然而,当随着乙醇梭菌蛋白添加量增加,草鱼肝胰脏组织病变的比例呈升高趋势,J10组血浆AST/ALT异常升高。彭艳等[43]发现,蛋氨酸对幼建鲤肝胰脏生长发育具有促进作用;Li等[45]研究发现,精氨酸可能通过降低肝促炎性细胞因子和自由基的释放来保护肝脏。本试验中由于草鱼可能对外源添加氨基酸的吸收利用能力不足[46],导致各组实际吸收利用的蛋氨酸和J10组实际吸收利用的精氨酸不足,从而各组均有肝脏损伤状况出现[47-48],并且本研究用乙醇梭菌蛋白为新开发蛋白质源,在开发过程中可能存在潜在未知因素,导致肝胰脏病变的比例随乙醇梭杆菌蛋白添加量增加而升高,Kiessling等[49]在菌体蛋白部分替代鱼粉饲喂虹鳟的试验中有过类似报道,目前相关报道较少,需要经进一步研究及生产工艺的不断改进才能明确其具体原因。唐炳荣[50]报道,蛋氨酸能够降低血清中的ALT活性,同时提高肝胰脏中的AST、ALT活性;魏祥云[51]研究表明,肝脏受损时,AST从线粒体大量释入血。本试验中,J0、J5、J10组内源性结合态蛋氨酸递增,可能是血浆ALT活性逐渐降低的原因,导致J10组血浆AST/ALT异常升高,提示肝胰脏功能有可能受损,这可能是导致J10组存活率下降的主要原因。此外,肝脏代谢障碍,也可能与高蛋白质含量的乙醇梭菌蛋白替代豆粕后导致J10组中淀粉含量增加有关。
此外,廖英杰等[52]报道,适量范围内增加精氨酸含量可以提高团头鲂幼鱼血细胞呼吸爆发活性, 同时降低感染嗜水气单胞菌后累计死亡率;赵红霞等[53]也研究表明,军曹鱼幼鱼的存活率在一定范围类随饲料中精氨酸含量升高而升高。这说明J10组内源精氨酸缺乏可能也是直接导致其存活率低另一个原因。
4 结论饲料中添加5%乙醇梭菌蛋白替代27.5%的豆粕可以有效提高饲料效率、增重率和特定生长率,降低血浆TC、MDA含量,改善脂肪代谢和抗氧化能力,同时有利于肠道组织健康,从而提高生长性能,在此范围内使用安全有效; 而进一步提高乙醇梭菌蛋白添加量至10%则造成肝细胞损伤,肝脏功能受损,存活率降低。本试验中,建议乙醇梭菌蛋白在草鱼饲料中添加量为5%。
| [1] |
农业部渔业渔政管理局. 中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2016.
|
| [2] |
叶元土, 薛敏, 林仕梅, 等. 草鱼肠道、肝胰脏对饲料蛋白质酶解速度的比较[J]. 中国水产科学, 2003, 10(2): 173-176. DOI:10.3321/j.issn:1005-8737.2003.02.018 |
| [3] |
刘利晓, 黄志伟, 许小友, 等. 微生物发酵对豆粕中抗营养因子及其营养价值的影响研究进展[J]. 河南畜牧兽医(综合版), 2014, 35(4): 8-10. |
| [4] |
MAMBRINI M, ROEM A J, CARVÈDI J P, et al. Effects of replacing fish meal with soy protein concentrate and of DL-methionine supplementation in high-energy, extruded diets on the growth and nutrient utilization of rainbow trout, Oncorhynchus mykiss[J]. Journal of Animal Science, 1999, 77(11): 2990-2999. DOI:10.2527/1999.77112990x |
| [5] |
杨玉娟, 姚怡莎, 秦玉昌, 等. 豆粕与发酵豆粕中主要抗营养因子调查分析[J]. 中国农业科学, 2016, 49(3): 573-580. DOI:10.3864/j.issn.0578-1752.2016.03.015 |
| [6] |
GATLIN Ⅲ D M, BARROWS F T, BROWN P, et al. Expanding the utilization of sustainable plant products in aquafeeds:a review[J]. Aquaculture Research, 2007, 38(6): 551-579. DOI:10.1111/are.2007.38.issue-6 |
| [7] |
朱长生, 尹荣华, 赵艳平. 发酵豆粕的生产工艺与产品品质关系的研究进展[J]. 广东饲料, 2014, 23(5): 35-37. |
| [8] |
付亭亭, 李爱科, 梁新晓, 等. 豆粕中抗营养因子检测技术研究进展[J]. 粮油食品科技, 2014, 22(1): 85-90. DOI:10.3969/j.issn.1007-7561.2014.01.021 |
| [9] |
陈广信, 曹赞, 高振华. 不同发酵豆粕营养价值及应用[J]. 中国畜牧兽医, 2014, 41(2): 111-114. |
| [10] |
XUE M, XIE S Q, CUI Y B. Effect of a feeding stimulant on feeding adaptation of gibel carp Carassius auratus gibelio (Bloch), fed diets with replacement of fish meal by meat and bone meal[J]. Aquaculture Research, 2004, 35(5): 473-482. DOI:10.1111/are.2004.35.issue-5 |
| [11] |
LUO L, XUE M, WU X F, et al. Partial or total replacement of fishmeal by solvent-extracted cottonseed meal in diets for juvenile rainbow trout (Oncorhynchus mykiss)[J]. Aquaculture Nutrition, 2006, 12(6): 418-424. DOI:10.1111/anu.2006.12.issue-6 |
| [12] |
向枭, 周兴华, 陈建, 等. 饲料中豆粕蛋白替代鱼粉蛋白对齐口裂腹鱼幼鱼生长性能、体成分及血液生化指标的影响[J]. 水产学报, 2012, 36(5): 723-731. |
| [13] |
于晓彤. 不同蛋白源对草鱼摄食反应、免疫应答及肉质的影响研究[D]. 硕士学位论文. 北京: 中国农业科学院, 2016: 28-32.
|
| [14] |
熊智辉. 单细胞蛋白在饲料业中的研究进展[J]. 养殖与饲料, 2006(7): 11-15. DOI:10.3969/j.issn.1671-427X.2006.07.003 |
| [15] |
胡梦红, 王有基. 菌体蛋白发展现况及其在水产饲料中的应用前景[J]. 北京水产, 2006(3): 42-45. |
| [16] |
李婷婷, 邓雪娟. 单细胞蛋白饲料研究进展及其在动物中的应用[J]. 饲料与畜牧, 2015(5): 57-61. |
| [17] |
赵晓芳. 味精菌体蛋白资源调研及营养价值评定[D]. 硕士学位论文. 泰安: 山东农业大学, 2003.
|
| [18] |
ABRINI J, NAVEAU H, NYNS E J, et al. Clostridium autoethanogenum, sp.nov., an anaerobic bacterium that produces ethanol from carbon monoxide[J]. Archives of Microbiology, 1994, 161(4): 345-351. DOI:10.1007/BF00303591 |
| [19] |
N RC. Nutrient requirements of fish and shrimp[M]. Washington, D.C: The National Academics Press, 2011.
|
| [20] |
KAUSHIK S J, SEILIEZ I. Protein and amino acid nutrition and metabolism in fish:current knowledge and future needs[J]. Aquaculture Research, 2010, 41(3): 322-332. DOI:10.1111/are.2010.41.issue-3 |
| [21] |
ISO. ISO-9831: 1998 Animal feeding stuffs, animal products, and faeces or urine-determination of gross calorific value-bomb calorimeter method[S]. Berlin: Deutsches Institut für Normung, 1998.
|
| [22] |
张玉蓉. 草鱼血液指标的测定[C]//中国海洋湖沼学会鱼类学分会、中国动物学会鱼类学分会2012年学术研讨会论文集. 兰州: 中国海洋湖沼学会, 2012.
|
| [23] |
温安祥, 周定刚. 几种不同食性鱼类部分血液生化指标的比较研究[J]. 四川动物, 2005, 24(4): 80-84. |
| [24] |
米瑞芙. 草鱼、鲤和鲢血液学指标的测定[J]. 淡水渔业, 1982(4): 10-16. |
| [25] |
周玉, 郭文场, 杨振国, 等. 鱼类血液学指标研究的进展[J]. 上海水产大学学报, 2001, 10(2): 163-165. |
| [26] |
UTTURKAR S M, KLINGEMAN D M, KLINGEMAN J M, et al. Sequence data for Clostridium autoethanogenum using three generations of sequencing technologies[J]. Scientific Data, 2015, 2: 150014. DOI:10.1038/sdata.2015.14 |
| [27] |
HUMPHREYS C M, MCLEAN S, SCHATSCHNEIDER S, et al. Whole genome sequence and manual annotation of Clostridium autoethanogenum, an industrially relevant bacterium[J]. BMC Genomics, 2015, 16: 1085. DOI:10.1186/s12864-015-2287-5 |
| [28] |
周凡, 邵庆均. 鱼类必需氨基酸营养研究进展[J]. 饲料与畜牧, 2010(8): 20-26. |
| [29] |
TAKENAKA A, OKI N, TAKAHASHI S I, et al. Dietary restriction of single essential amino acids reduces plasma insulin-like growth factor-Ⅰ (IGF-Ⅰ) but does not affect plasma IGF-binding protein-1 in rats[J]. The Journal of Nutrition, 2000, 130(12): 2910-2914. DOI:10.1093/jn/130.12.2910 |
| [30] |
TATAR M, BARTKE A, ANTEBI A. The endocrine regulation of aging by insulin-like signals[J]. Science, 2003, 299(5611): 1346-1351. DOI:10.1126/science.1081447 |
| [31] |
王胜. 草鱼幼鱼蛋白质和主要必需氨基酸需求的研究[D]. 博士学位论文. 广州: 中山大学, 2006.
|
| [32] |
唐炳荣, 冯琳, 刘扬, 等. 生长中期草鱼蛋氨酸需要量的研究[J]. 动物营养学报, 2012, 24(11): 2263-2271. DOI:10.3969/j.issn.1006-267x.2012.11.027 |
| [33] |
廖英杰. 团头鲂幼鱼对蛋氨酸、赖氨酸和精氨酸需要量的研究[D]. 硕士学位论文. 南京: 南京农业大学, 2014.
|
| [34] |
郑宗林, 宋宏斌, 李洪琴, 等. 不同缓释处理氨基酸在草鱼鱼种饲料中的利用效率研究[J]. 粮食与饲料工业, 2009(6): 42-45. DOI:10.3969/j.issn.1003-6202.2009.06.015 |
| [35] |
谭芳芳. 在草鱼(Ctenopharyngodon idellus)饲料中补充微囊和晶体氨基酸的研究[D]. 硕士学位论文. 苏州: 苏州大学, 2010.
|
| [36] |
张京, 戴兆来, 朱伟云. 肠道必需氨基酸代谢及其功能的研究进展[J]. 肠外与肠内营养, 2010, 17(1): 55-59. DOI:10.3969/j.issn.1007-810X.2010.01.019 |
| [37] |
JOHNSON L R. Regulation of gastrointestinal mucosal growth[J]. World Journal of Surgery, 1979, 3(4): 477-486. DOI:10.1007/BF01556110 |
| [38] |
CHENG Z Y, GATLIN Ⅲ D M, BUENTELLO A. Dietary supplementation of arginine and/or glutamine influences growth performance, immune responses and intestinal morphology of hybrid striped bass (Morone chrysops Morone saxatilis)[J]. Aquaculture, 2012, 362. |
| [39] |
CHENG Z Y, BUENTELLO J A, GATLIN Ⅲ D M. Effects of dietary arginine and glutamine on growth performance, immune responses and intestinal structure of red drum, Sciaenops ocellatus[J]. Aquacture, 2011, 319(1/2): 247-252. |
| [40] |
迟淑艳, 韩凤禄, 谭北平, 等. 饲料精氨酸水平对斜带石斑鱼幼鱼生长和肠道形态的影响[J]. 水生生物学报, 2016, 40(2): 388-394. |
| [41] |
SEILER N, RAUL F. Polyamines and the intestinal tract[J]. Critical Reviews in Clinical Laboratory Sciences, 2007, 44(4): 365-411. DOI:10.1080/10408360701250016 |
| [42] |
WANG J J, CHEN L X, LI P, et al. Gene expression is altered in piglet small intestine by weaning and dietary glutamine supplementation[J]. The Journal of Nutrition, 2008, 138(6): 1025-1032. DOI:10.1093/jn/138.6.1025 |
| [43] |
彭艳, 唐凌, 帅柯, 等. 蛋氨酸对幼建鲤生长及消化吸收功能的影响[J]. 中国畜牧杂志, 2009, 45(13): 33-38. |
| [44] |
吴莉芳, 邢秀苹, 赖红娥, 等. 大豆抗原蛋白Glycinin对鲤稚鱼和幼鱼肠道组织的影响[J]. 西北农林科技大学学报(自然科学版), 2014, 42(10): 7-14. |
| [45] |
LI Q, LIU Y L, CHE Z Q, et al. Dietary L-arginine supplementation alleviates liver injury caused by Escherichia coli LPS in weaned pigs[J]. Innate Immunity, 2012, 18(6): 804-814. DOI:10.1177/1753425912441955 |
| [46] |
陈宏民, 钟文彪, 许合金, 等. 鱼类对外源氨基酸利用的研究进展[J]. 饲料与畜牧, 2015(1): 29-32. |
| [47] |
郭俊生, 赵法伋. 肝病用氨基酸制剂研究进展[J]. 新药与临床, 1990, 9(5): 293-295. |
| [48] |
汤习锋. L-精氨酸:一氧化氮通路与肝病研究进展[J]. 重庆医科大学学报, 1994, 19(2): 157-160. |
| [49] |
KIESSLING A, ASKBRANDT S. Nutritive value of 2 bacterial strains of single-cell protein for rainbow trout (Oncorhynchus mykiss)[J]. Aquaculture, 1993, 109(2): 119-130. DOI:10.1016/0044-8486(93)90209-H |
| [50] |
唐炳荣. 蛋氨酸对生长中期草鱼消化吸收能力和抗氧化能力影响的研究[D]. 硕士学位论文. 雅安: 四川农业大学, 2012.
|
| [51] |
魏祥云. 肝功能检查的现状及研究进展[J]. 国外医学(卫生学分册), 1992(3): 141-146. |
| [52] |
廖英杰, 刘波, 任鸣春, 等. 精氨酸对团头鲂幼鱼生长、血清游离精氨酸和赖氨酸、血液生化及免疫指标的影响[J]. 中国水产科学, 2014, 21(3): 549-559. |
| [53] |
赵红霞, 曹俊明, 吴建开, 等. 军曹鱼幼鱼对饲料中精氨酸的需要量[J]. 华南农业大学学报, 2007, 28(4): 87-90. DOI:10.3969/j.issn.1001-411X.2007.04.021 |




