2. 农业部华南水产与畜禽饲料重点实验室, 湛江 524000
2. Key Laboratory of Aquatic, Livestock and Poultry Feed Science and Technology in South China, Ministry of Agriculture, Zhanjiang 524000, China
多鳞


高不饱和脂肪酸(highly unsaturated fatty acids,HUFAs)是指碳原子数目≥20且双键数目≥3的一类不饱和脂肪酸。根据甲基端第1个双键所连碳原子的位置,可将高不饱和脂肪酸分为n-3、n-6等系列,其中n-3HUFA主要包括二十碳五烯酸(EPA)、二十二碳六烯酸(DHA)。n-3HUFA的生理功能主要包括:1)抑制促炎症因子产生,抑制炎症反应,减轻疾病症状;2)视网膜的重要结构成分,对视力发育有促进作用;3)作为细胞膜的重要组成成分,可影响甚至决定细胞膜的功能,同时可影响细胞膜的流动性,对细胞之间的信号传递起到重大的作用等[2-4]。在海水鱼中,EPA、DHA是类花生酸等高活性旁分泌激素类的前体[5],参与生理功能的调控。已有的报道证明,多数淡水鱼具有合成EPA和DHA的能力,饲料中只需补充其合成原料亚麻酸即可满足其对n-3HUFA的需要[6]。对于缺乏脂肪酸延长和去饱和能力的海水鱼而言,n-3HUFA则是其必需脂肪酸[6]。饲料中添加n-3HUFA能提高海水鱼的生长性能,有利于脂类代谢平衡,加强机体免疫功能[7-10]。
多鳞




以鱼粉、小麦谷朊粉等为蛋白质源,鱼油和玉米油为脂肪源,调整饲料中玉米油和鱼油的含量,配制n-3HUFA水平分别为0.53%、0.80%、1.22%、1.62%、2.12%和2.56%的6组等氮等能饲料,试验饲料组成及营养水平见表 1,试验饲料脂肪酸组成见表 2。饲料原料粉碎后过60目筛,根据饲料配方称取各原料。饲料制作过程中,微量成分采用逐级扩大法混合均匀,再添加不同含量的鱼油和玉米油并搅拌均匀,然后添加30%~40%的水制成团状,用双螺杆挤条机制成粒径为1.5 mm的饲料,在阴凉干燥环境中风干后封口带密封,-20 ℃保存。
|
|
表 1 试验饲料组成及营养水平(风干基础) Table 1 Composition and nutrient levels of experimental diets (air-dry basis) |
|
|
表 2 试验饲料脂肪酸组成(占总脂肪酸的百分比) Table 2 Fatty acid composition in experiment diets (percentage of total fatty acids) |
养殖试验在湛江市东海岛广东海洋大学海洋生物研究基地进行。试验所用的多鳞
试验前多鳞

养殖试验结束禁食24 h后取样。每桶鱼用丁香酚麻醉后称重,计数,计算生长指标。每桶随机选5尾鱼量取体长、称体重、肝脏重,计算形态学指标。再取5尾鱼,吸干体表水分,编号于-20 ℃冰箱中保存,备测常规成分。另取10尾鱼心脏采血,血液置于1.5 mL离心管中于-20 ℃冰箱过夜后4 000 r/min离心10 min,取上清液置于-80 ℃备用,待测血清生化指标。剖取肝脏及肌肉,液氮冷存,然后转移至-80 ℃冰箱,备测肝脏酶活性及肝脏和肌肉脂肪酸含量。
1.3.2 常规成分分析全鱼和饲料常规成分采用国际标准方法[12]进行分析。样品在105 ℃下烘干测定水分含量,凯氏定氮仪(KjeltecTM 8400,瑞典)测定样品中粗蛋白质含量,索氏抽提法(抽提剂为石油醚)测定样品中粗脂肪含量,550 ℃马弗炉灼烧法测定样品中粗灰分含量。
1.3.3 脂肪酸含量分析测定根据GB/T 21514—2008进行脂肪酸含量的测定,原理为用氢氧化钠-甲醇溶液皂化,皂化物与三氟化硼-甲醇溶液反应生成脂肪酸甲酯。用毛细管气相色谱分离,色谱峰用已知组成的标准品进行鉴定,以内标法定量。
1.3.4 血清生化指标测定使用全自动生化分析仪(日立7600-110型)测定血清中甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、总胆固醇(T-CHOL)含量及谷丙转氨酶(ALT)、谷草转氨酶(AST)活性,所需试剂盒均购自南京威特曼生物科技有限公司。
1.3.5 组织酶活性测定肝脏中的过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、碱性磷酸酶(AKP)、酸性磷酸酶(ACP)活性均使用南京建成生物工程研究所提供的试剂盒测定,测定步骤按试剂盒说明书进行。
1.4 生长指标和形态学指标计算公式

|
试验数据用平均值±标准差表示,采用SPSS 20.0对试验数据进行单因素方差分析(one-way ANOVA),若有显著性差异则进行Duncan氏法多重比较,P < 0.05表示差异显著。
2 结果 2.1 饲料n-3HUFA水平对多鳞
由表 3可见,WGR随着饲料n-3HUFA水平增加呈现先上升后下降趋势,2.12%组最高,显著高于0.53%组和0.80%组(P < 0.05),与其他各组差异不显著(P > 0.05)。SGR随着饲料n-3HUFA水平增加呈现先上升后下降的趋势,2.12%组最高,显著高于0.53%组和2.56%组(P < 0.05),与其他各组差异不显著(P > 0.05)。FCR随着n-3HUFA水平的增加呈现先下降后上升的趋势,2.12%组最低,显著低于0.53%组(P < 0.05),与其他各组差异不显著(P > 0.05)。各组之间SR没有显著差异(P > 0.05)。随着饲料n-3HUFA水平的增加,HSI呈现出先下降后稳定的趋势,在2.12%组达到最低值,显著低于0.53%组和0.80%组(P < 0.05),与其他各组无显著差异(P > 0.05);而CF则呈现出先上升后下降的趋势,在2.12%组达到最大值,显著高于除1.62%组外的其他各组(P < 0.05)。
|
|
表 3 饲料n-3HUFA水平对多鳞 |
由图 1可见,以WGR为依据,折线模型得出多鳞
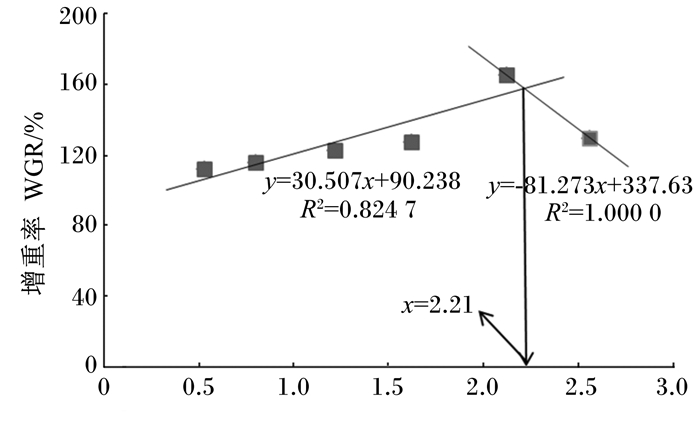
|
图 1 饲料n-3HUFA水平与多鳞 |

由表 4可见,各组之间全鱼水分、粗蛋白质、粗灰分含量无显著差异(P > 0.05)。随着饲料n-3HUFA水平的增加,全鱼粗脂肪含量呈现先上升后下降的趋势,1.62%组和2.12%组之间全鱼粗脂肪含量无显著差异(P > 0.05),但显著高于其他各组(P < 0.05),其他各组之间无显著差异(P > 0.05)。
|
|
表 4 饲料n-3HUFA水平对多鳞 |

由表 5可见,饲料HUFA水平在0.53%~1.62%之间时,血清HDL-C含量显著上升(P < 0.05),2.56%组血清HDL-C含量显著高于除2.12%组外的其他各组(P < 0.05)。血清LDL-C含量则是先上升后逐渐下降,在0.80%组达到最大值并显著高于其他各组(P < 0.05)。血清ALT、AST活性呈现出先下降后上升再下降的趋势,血清ALT活性在1.22%组达到最低值并显著低于其他各组(P < 0.05),血清AST活性则在0.80%组达到最低值并显著低于其他各组(P < 0.05)。随着饲料n-3HUFA水平的增加,血清T-CHOL含量呈先上升后下降并稳定的趋势,血清TG含量呈先上升后下降的趋势;0.53%组的血清T-CHOL、TG含量显著低于其他各组(P < 0.05),0.80%组的血清T-CHOL、TG含量显著高于其他各组(P < 0.05)。
|
|
表 5 饲料n-3HUFA水平对多鳞 |

由表 6可见,各组之间的血清SOD和ACP活性没有显著差异(P > 0.05)。2.12%组和2.56%组之间的血清AKP活性无显著差异(P > 0.05),但显著低于除1.62%组外的其他各组(P < 0.05)。1.62%组的血清CAT活性最低,与1.22%组和2.12%组无显著差异(P > 0.05),但显著低于其他各组(P < 0.05)。
|
|
表 6 饲料n-3HUFA水平对多鳞 |

由表 7可见,多鳞
|
|
表 7 饲料n-3HUFA水平对多鳞 |
由表 8可见,随着饲料n-3HUFA水平的提高,肌肉C18:2n-6、C20:4n-6含量呈降低趋势,2.12%组和2.56组显著低于其他各组(P < 0.05);肌肉C20:5n-3、C22:6n-3含量呈升高趋势,2.56%组显著高于其他各组(P < 0.05);肌肉C16:0含量呈先升高后稳定趋势,在1.22%组达到最高。肌肉C16:1n-9含量在1.62%组达到最高。
|
|
表 8 饲料n-3HUFA水平对多鳞 |

已有研究表明,适宜水平的n-3HUFA可促进海水鱼生长,提高饲料利用率[13]。各动物之间适宜n-3HUFA水平差异较大。饲料n-3HUFA水平为0.85%时,黑鲷(Sparus macrocephalus)幼鱼有最高的WGR[14]。常杰等[15]报道,饲料n-3HUFA水平为0.75%时能显著提高细鳞鲑(Brachymystax lenok)的WGR、SGR。Kim等[16]建议牙鲆(Paralichthys olivaceus)饲料n-3HUFA水平应在0.8%~1.0%。饲料n-3HUFA水平为0.98%时可显著提高大黄鱼(Larmichthys crocea)的生长性能[17]。饲料n-3HUFA水平为1%时可使金头鲷(Sparus aurata)幼鱼有最佳的生长性能和饲料效率[18]。饲料n-3HUFA水平分别为2.53%和3.93%时,斜带石斑鱼(Epinephluscoioides)幼鱼和中鱼有最高SGR[19]。本试验结果表明,饲料n-3HUFA水平显著影响多鳞

黄斑蓝子鱼(Siganus canaliculatus)[20]、俄罗斯鲟(Acipenser gueldenstaedti)幼鱼[21]的研究中发现,不同的饲料n-3HUFA水平对黄斑篮子鱼WGR、SGR和FCR均无显著影响,且随着饲料n-3HUFA水平的增加,HSI呈现出先上升后下降的趋势。试验结果的不同可能与试验鱼的食性差异有关,植性食物亚油酸含量较亚麻酸丰富,从而使得植食性鱼类形成对饲料中亚油酸的需求,黄斑蓝子鱼作为植食性鱼类,n-3HUFA的变化对其生长性能等的影响较小或无影响。试验鱼种也影响试验结果,部分鱼类如大西洋鲑(Salmo salar)[22]可以将18:2n-6合成EPA、DHA,且合成能力受环境等因素影响。在本次试验中,随着饲料n-3HUFA水平的增加,多鳞



本试验中,饲料n-3HUFA水平对多鳞


血清生化指标可作为衡量机体健康状况的指标,通过对血液的检测可了解机体的营养、代谢与疾病等情况。刘玉军等[35]研究发现,DHA可有效降低高脂血患者血清T-CHOL和TG含量。EPA和DHA可显著降低蛋鸡血清T-CHOL含量[36]。EPA和DHA可抑制机体T-CHOL和TG合成,降低其在人类血清中的含量[37]。EPA和DHA可改善血液循环,降低能诱发动脉硬化和血栓的低密度脂蛋白的含量[38]。本试验中,多鳞


在机体内,SOD、CAT与过氧化物酶POD组成体内活性氧防御系统,能有效地清除体内超氧自由基、过氧化氢及其他过氧化物[41]。CAT在机体内参与活性氧代谢过程,可催化细胞内过氧化氢的分解,维持自由基代谢平衡,防止过氧化对机体造成损伤[42]。AKP作为一种非特异性磷酸单酯酶,可催化所有磷酸单酯的水解并生成磷酸根离子和自由羟基[43],当存在于肝脏中时可参与肝细胞的排泄功能[44]。在本试验中,饲料n-3HUFA水平不影响肝脏SOD和ACP活性。但饲料n-3HUFA水平由0.80%增加到1.62%时,多鳞


饲料n-3HUFA水平可显著影响试验对象组织中脂肪酸含量[46-50],组织脂肪酸的组成能一定程度上反映饲料脂肪酸组成[51]。本试验中,随着饲料n-3HUFA水平的增加,多鳞






本试验条件下,各测定指标表明饲料中添加1.62%~2.12%的n-3HUFA能促进多鳞

| [1] |
杜涛, 黄洋, 曹剑香. 多鳞采捕暂养的初步研究[J]. 养殖与饲料, 2009(10): 15-17. DOI:10.3969/j.issn.1671-427X.2009.10.009 |
| [2] |
张晓图, 杜晨红, 丁小娟, 等. 多不饱和脂肪酸的生物学功能及其在动物生产中的应用[J]. 动物营养学报, 2017, 29(9): 3059-3067. DOI:10.3969/j.issn.1006-267x.2017.09.006 |
| [3] |
弓剑, 晓敏. 多不饱和脂肪酸代谢及其对炎症的调节[J]. 动物营养学报, 2017, 29(1): 1-7. DOI:10.3969/j.issn.1006-267x.2017.01.001 |
| [4] |
许友卿, 李伟峰, 丁兆坤. 多不饱和脂肪酸对鱼类免疫与成活的影响及机理[J]. 动物营养学报, 2010, 22(3): 551-556. DOI:10.3969/j.issn.1006-267x.2010.03.006 |
| [5] |
BELL J G, TOCHER D R, FARNDALE B M, et al. Effects of essential fatty acid-deficient diets on growth, mortality, tissue histopathology and fatty acid compositions in juvenile turbot (Scophthalmus maximus)[J]. Fish Physiology and Biochemistry, 1999, 20(3): 263-277. DOI:10.1023/A:1007743532618 |
| [6] |
王裕玉, 杨雨虹. 水生生物对高不饱和脂肪酸的营养需求[J]. 中国饲料, 2008(18): 31-33. DOI:10.3969/j.issn.1004-3314.2008.18.011 |
| [7] |
JIN M, LU Y, YUAN Y, et al. Regulation of growth, antioxidant capacity, fatty acid profiles, hematological characteristics and expression of lipid related genes by different dietary n-3 highly unsaturated fatty acids in juvenile black seabream (Acanthopagrus schlegelii)[J]. Aquaculture, 2017, 471: 55-65. DOI:10.1016/j.aquaculture.2017.01.004 |
| [8] |
薛敏, 李爱杰, 张显娟. 牙鲆幼鱼对EPA和DHA的营养需求[J]. 水产学报, 2004, 28(3): 285-291. |
| [9] |
许友卿, 庄丽, 丁兆坤. 多不饱和脂肪酸对海水仔稚鱼生长发育的影响及机理[J]. 饲料工业, 2010, 31(14): 13-18. DOI:10.3969/j.issn.1001-991X.2010.14.005 |
| [10] |
刘镜恪, 陈晓琳. 海水仔稚鱼的必需脂肪酸-n-3系列高度不饱和脂肪酸研究概况[J]. 中国海洋大学学报(自然科学版), 2002, 32(6): 897-902. |
| [11] |
黄洋, 杜涛, 黄海立. 多鳞  Sillago sihama Forskál人工繁殖研究[J]. 广东海洋大学学报, 2013, 33(1): 15-21. DOI:10.3969/j.issn.1673-9159.2013.01.005 Sillago sihama Forskál人工繁殖研究[J]. 广东海洋大学学报, 2013, 33(1): 15-21. DOI:10.3969/j.issn.1673-9159.2013.01.005 |
| [12] |
HORWITZ W, SENZEL A J, REYNOLDS H, et al. Official methods of analysis of de association of official analytical chemists[J]. Journal of Pharmaceutical Sciences, 1997, 60(4): 465. |
| [13] |
王秀英, 邵庆均, 黄磊. 饵料中高不饱和脂肪酸对海水鱼苗养殖的影响[J]. 中国饲料, 2004(20): 29-31. DOI:10.3969/j.issn.1004-3314.2004.20.014 |
| [14] |
马晶晶, 邵庆均, 许梓荣, 等. n-3高不饱和脂肪酸对黑鲷幼鱼生长及脂肪代谢的影响[J]. 水产学报, 2009, 33(4): 639-649. |
| [15] |
常杰, 牛化欣, 胡宗福, 等. 细鳞鲑幼鱼n-3 HUFA需求量的研究[J]. 淡水渔业, 2017, 47(6): 81-87. DOI:10.3969/j.issn.1000-6907.2017.06.012 |
| [16] |
KIM K D, LEE S M. Requirement of dietary n-3 highly unsaturated fatty acids for juvenile flounder (Paralichthys olivaceus)[J]. Aquaculture, 2004, 229(1/2/3/4): 315-323. |
| [17] |
ZUO R T, AI Q H, MAI K S, et al. Effects of dietary n-3 highly unsaturated fatty acids on growth, nonspecific immunity, expression of some immune related genes and disease resistance of large yellow croaker (Larmichthys crocea) following natural infestation of parasites (Cryptocaryon irritans)[J]. Fish & Shellfish Immunology, 2012, 32(2): 249-258. |
| [18] |
IBEAS C, CEJAS J, GÓMEZ T, et al. Influence of dietary n-3 highly unsaturated fatty acids levels on juvenile gilthead seabream (Sparus aurata) growth and tissue fatty acid composition[J]. Aquaculture, 1996, 142(3/4): 221-235. |
| [19] |
何流健.两种规格斜带石斑鱼n-3高度不饱和脂肪酸和卵磷脂需要量的研究[D].硕士学位论文.湛江: 广东海洋大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10566-1013225132.htm
|
| [20] |
刘雪兵.黄斑蓝子鱼对多不饱和脂肪酸的需求特性研究[D].硕士学位论文.汕头: 汕头大学, 2011. http://med.wanfangdata.com.cn/Paper/Detail/DegreePaper_D236397
|
| [21] |
李琦.俄罗斯鲟幼鱼(Acipenser gueldenstaedti)的脂肪酸需要量和适宜脂肪源研究[D].博士学位论文.上海: 华东师范大学, 2017.
|
| [22] |
ZHENG X Z, TOCHER D R, DICKSON C A, et al. Effects of diets containing vegetable oil on expression of genes involved in highly unsaturated fatty acid biosynthesis in liver of Atlantic salmon (Salmo salar)[J]. Aquaculture, 2004, 236(1/2/3/4): 467-483. |
| [23] |
朱庆国, 林建斌, 黄种持, 等. 饲料中不同水平n-3 HUFA对斜带石斑鱼幼鱼生长及肌肉脂肪酸组成的影响[J]. 广东海洋大学学报, 2012, 32(4): 20-27. |
| [24] |
GLENCROSS B D. Exploring the nutritional demand for essential fatty acids by aquaculture species[J]. Reviews in Aquaculture, 2009, 1(2): 71-124. DOI:10.1111/raq.2009.1.issue-2 |
| [25] |
THOMASSEN M S, REIN D, BERGE G M, et al. High dietary EPA does not inhibit Δ5 and Δ6 desaturases in Atlantic salmon (Salmo salar L.) fed rapeseed oil diets[J]. Aquaculture, 2012, 360-361: 78-85. DOI:10.1016/j.aquaculture.2012.07.001 |
| [26] |
史俊.三个生长阶段军曹鱼对卵磷脂和n-3HUFA需要量的研究[D].硕士学位论文.湛江: 广东海洋大学, 2013. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=D329479
|
| [27] |
李杰.高不饱和脂肪酸对草鱼稚鱼生长、脂质代谢的影响及其分子机理的研究[D].硕士学位论文.杨凌: 西北农林科技大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10712-1011402606.htm
|
| [28] |
刘兴旺, 谭北平, 麦康森, 等. 饲料中不同水平n-3 HUFA对军曹鱼生长及脂肪酸组成的影响[J]. 水生生物学报, 2007, 31(2): 190-195. DOI:10.3321/j.issn:1000-3207.2007.02.007 |
| [29] |
LEE S M, LEE J H, KIM K D. Effect of dietary essential fatty acids on growth, body composition and blood chemistry of juvenile starry flounder (Platichthys stellatus)[J]. Aquaculture, 2003, 225(1/2/3/4): 269-281. |
| [30] |
TAKADA R, SAITOH M, MORI T. Dietary γ-linolenic acid-enriched oil reduces body fat content and induces liver enzyme activities relating to fatty acid β-oxidation in rats[J]. The Journal of Nutrition, 1994, 124(4): 469-474. DOI:10.1093/jn/124.4.469 |
| [31] |
OM A D, UMINO T, NAKAGAWA H, et al. The effects of dietary EPA and DHA fortification on lipolysis activity and physiological function in juvenile black sea bream Acanthopagrus schlegeli (Bleeker)[J]. Aquaculture Research, 2015, 32(1): 255-262. |
| [32] |
王凤美.不同生长阶段凡纳滨对虾对卵磷脂、胆固醇和n-3HUFA需要量的研究[D].硕士学位论文.湛江: 广东海洋大学, 2013. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=D329461
|
| [33] |
彭墨, 徐玮, 麦康森, 等. 亚麻籽油替代鱼油对大菱鲆幼鱼生长、脂肪酸组成及脂肪沉积的影响[J]. 水产学报, 2014, 38(8): 1131-1139. |
| [34] |
HUANG S S Y, OO A N, HIGGS D A, et al. Effect of dietary canola oil level on the growth performance and fatty acid composition of juvenile red sea bream, Pagrus major[J]. Aquaculture, 2007, 271(1/2/3/4): 420-431. |
| [35] |
刘玉军, 孙明堂, 黄元伟, 等. 浓缩鱼油对高脂血患者血脂和血小板聚集及体外血栓形成的影响[J]. 营养学报, 1992, 14(1): 17-22. DOI:10.3321/j.issn:0512-7955.1992.01.006 |
| [36] |
汪鲲.n-3多不饱和脂肪酸在蛋黄和组织中的富集规律及其对产蛋鸡脂类代谢的影响[D].博士学位论文.北京: 中国农业科学院, 2000. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y350860
|
| [37] |
DYERBERG J, BANG H O, STOFFERSEN E, et al. Eicosapentaenoic acid and prevention of thrombosis and atherosclerosis[J]. Lancet, 1978, 312(8081): 117-119. DOI:10.1016/S0140-6736(78)91505-2 |
| [38] |
陈秀丽.不同来源n-3 PUFA在蛋鸡中应用效果的评价[D].硕士学位论文.杨凌: 西北农林科技大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10712-1014420140.htm
|
| [39] |
福利, 林泽邦, 欧志君, 等. 高密度脂蛋白功能研究进展[J]. 中国循环杂志, 2015, 30(9): 919-921. DOI:10.3969/j.issn.1000-3614.2015.09.023 |
| [40] |
王爱民.饲料脂肪水平对吉富罗非鱼生长及脂肪代谢调节的研究[D].博士学位论文.南京: 南京农业大学, 2011. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2038452
|
| [41] |
刘冰, 梁婵娟. 生物过氧化氢酶研究进展[J]. 中国农学通报, 2005, 21(5): 223-224, 232. DOI:10.3969/j.issn.1000-6850.2005.05.066 |
| [42] |
张坤生, 田荟琳. 过氧化氢酶的功能及研究[J]. 食品科技, 2007, 32(1): 8-11. |
| [43] |
许明珠, 张琴, 童潼, 等. 饲料锌含量对方格星虫稚虫生长性能、体成分、体腔液中锌含量及碱性磷酸酶活性的影响[J]. 动物营养学报, 2016, 28(7): 2292-2299. DOI:10.3969/j.issn.1006-267x.2016.07.037 |
| [44] |
王石莹, 闫素梅. 碱性磷酸酶在动物骨骼代谢中的研究进展[J]. 饲料博览, 2009(4): 14-17. DOI:10.3969/j.issn.1001-0084.2009.04.005 |
| [45] |
岳彦峰, 彭士明, 施兆鸿, 等. 饲料n-3HUFA水平对褐菖鲉血清生化指标、主要脂代谢酶活力及抗氧化能力的影响[J]. 海洋渔业, 2013, 35(4): 460-467. DOI:10.3969/j.issn.1004-2490.2013.04.012 |
| [46] |
SARGENT J R, MCEVOY L A, BELL J G. Requirements, presentation and sources of polyunsaturated fatty acids in marine fish larval feeds[J]. Aquaculture, 1997, 155(1/2/3/4): 117-127. |
| [47] |
FOUNTOULAKI E, ALEXIS M N, NENGAS I, et al. Effects of dietary arachidonic acid (20:4n-6), on growth, body composition, and tissue fatty acid profile of gilthead bream fingerlings (Sparus aurata L.)[J]. Aquaculture, 2003, 225(1/2/3/4): 309-323. |
| [48] |
SUI L Y, WILLE M, CHENG Y X, et al. The effect of dietary n-3 HUFA levels and DHA/EPA ratios on growth, survival and osmotic stress tolerance of Chinese mitten crab Eriocheir sinensis larvae[J]. Aquaculture, 2007, 273(1): 139-150. DOI:10.1016/j.aquaculture.2007.09.016 |
| [49] |
COPEMAN L A, PARRISH C C, BROWN J A, et al. Effects of docosahexaenoic, eicosapentaenoic, and arachidonic acids on the early growth, survival, lipid composition and pigmentation of yellowtail flounder (Limanda ferruginea):a live food enrichment experiment[J]. Aquaculture, 2002, 210(1/2/3/4): 285-304. |
| [50] |
REZEK T C, WATANABE W O, HAREL M, et al. Effects of dietary docosahexaenoic acid (22:6n-3) and arachidonic acid (20:4n-6) on the growth, survival, stress resistance and fatty acid composition in black sea bass Centropristis striata (Linnaeus 1758) larvae[J]. Aquaculture Research, 2010, 41(9): 1302-1314. DOI:10.1111/are.2010.41.issue-9 |
| [51] |
IBEAS C, RODRÍGUEZ C, BADÍA P, et al. Efficacy of dietary methyl esters of n-3 HUFA vs. triacylglycerols of n-3 HUFA by gilthead seabream (Sparus aurata L.) juveniles[J]. Aquaculture, 2000, 190(3/4): 273-287. |
| [52] |
MOZANZADEH M T, MARAMMAZI J G, YAVARI V, et al. Dietary n-3 LC-PUFA requirements in silvery-black porgy juveniles (Sparidentex hasta)[J]. Aquaculture, 2015, 448: 151-161. DOI:10.1016/j.aquaculture.2015.06.007 |
| [53] |
HALVER J E. Fish nutrition[M]. 2nd ed. San Diego: Academic Press, 1989.
|
| [54] |
TAKEUCHI T, TOYOTA M, WATANABE T. Dietary value of Artemia enriched with various types of oil for larval striped knifejaw and red sea bream[J]. Nippon Suisan Gakkaishi, 1992, 58(2): 283-289. DOI:10.2331/suisan.58.283 |
| [55] |
GONZÁLEZ-FÉLIX M L, LAWRENCE A L, GATLIN Ⅲ D, et al. Growth, survival and fatty acid composition of juvenile Litopenaeus vannamei fed different oils in the presence and absence of phospholipids[J]. Aquaculture, 2002, 205(3/4): 325-343. |
| [56] |
DEERING M J, FIELDER D R, HEWITT D R. Growth and fatty acid composition of juvenile leader prawns, Penaeus monodon, fed different lipids[J]. Aquaculture, 1997, 151(1/2/3/4): 131-141. |
| [57] |
郑海波.中华绒螯蟹的品质分析与比较[D].硕士学位论文.无锡: 江南大学, 2008. http://cdmd.cnki.com.cn/Article/CDMD-10295-2009014223.htm
|
| [58] |
薛长湖, 汪贻生, 林洪, 等. 虾蟹海产品香味的前体物质的加热变化[J]. 中国海洋大学学报(自然科学版), 1994, 24(4): 491-496. |




