糖和脂肪是水产动物重要的非蛋白质能量来源,相比蛋白质,其不仅价格低廉,而且能提高蛋白质的利用效率[1-3]。因此,近年来关于糖和脂肪的营养与生理研究受到越来越多的关注。脂肪是能量、必需脂肪酸、磷脂和甾醇的重要来源,能维持细胞膜正常生理活动、生物学构造和生理功能[4-5]。动物体内适宜的脂肪和必需脂肪酸含量能提高机体的生长性能、抗氧化能力和免疫应答效应[6-7]。值得注意的是,水产动物饲料中脂肪含量过高可能会引发一系列问题,如抑制机体生长、造成过多的脂肪沉积以及影响代谢水平等[8-12]。相比脂肪,糖是水产动物更廉价且更易获得的能量来源。然而,机体内糖含量不足或过多可能会抑制机体生长、影响代谢、减弱机体的免疫应答效应[13-17]。因此,饲料中最适宜的糖脂比对促进水产动物生长、维持正常生理功能和健康状况十分重要。一旦饲料中脂肪和糖含量以及比例失衡,就很可能会影响到机体的代谢途径[18]。因此,越来越多的学者致力于研究既能促进水产动物生长又能取得最大经济效益的饲料适宜糖脂比。
研究发现,当饲料糖脂比适宜时,黄颡鱼(Pelteobagrus fulvidraco)幼鱼的生长性能最佳[19],大黄鱼(Larmichthys crocea)的生长性能和饲料利用率得到提高[20],类似的研究结果在对罗非鱼(Oreochromis niloticus)[18]的研究中也得到证实。然而,当糖脂比持续升高时,鲤鱼(Cyprinus carpio)的组织消化酶活性受到抑制[21],抗氧化能力下降,生长性能受到影响[22]。当饲料糖脂比降低时,建鲤(Cyprinus carpio var. Jian)幼鱼全鱼、胴体和肝脏中脂肪含量以及脏体比均显著升高,且较高的脂肪含量抑制了建鲤对蛋白质和糖的利用[23]。
在哺乳动物中,肝脏是体内脂质代谢的主要器官,肝细胞中一些关键蛋白质参与了脂质代谢的过程。甘油三酯进入淋巴循环,在脂肪甘油三酯脂肪酶、激素敏感性脂肪酶(HSL)和单脂脂肪酶的作用下,水解为甘油和脂肪酸,失去绝大部分甘油三酯的残留乳糜微粒与肝脏中的受体如低密度脂蛋白(LDL)受体、LDL受体相关蛋白或B类Ⅰ型清道夫受体(SR-BⅠ)结合,通过胞吞作用进入肝细胞[24]。随后,在肝脏中,完整的跨膜蛋白如脂肪酸转运蛋白(FATP)家族(FATP-1~6)促进了长链和极长链脂肪酸从血浆池转运入细胞内[25-26]。在胞膜上,脂肪酸与脂肪酸结合蛋白(FABPs)结合并通过细胞溶胶进行降解或储存[27]。因此,SR-BⅠ、FATP4和FABP10与胞膜或胞内脂肪酸转运密切相关。此外,对无脊椎动物的研究发现,Toll样受体(TLRs)通路在其先天免疫中发挥重要的作用[28],饲料营养与该通路的基因表达密切相关[29-32]。
日本沼虾(Macrobrachium nipponense)又名青虾,是东南亚以及我国的主要淡水经济养殖种类之一[33]。目前未见有关日本沼虾饲料糖脂比研究的相关报道。基于糖脂比对水产动物有重要的生理作用,本试验以日本沼虾为研究对象,探讨饲料糖脂比对日本沼虾生长性能、抗氧化性能以及肝胰腺代谢酶活性、脂肪酸转运和TLRs通路相关基因表达的影响,确定日本沼虾饲料适宜的糖脂比,旨在为日本沼虾高效环保配合饲料的研发提供理论数据参考。
1 材料与方法 1.1 试验饲料配制本试验以酪蛋白和鱼粉为蛋白质源,预糊化玉米淀粉为糖源,鱼油和豆油为脂肪源,配制糖脂比分别为1.12(CL1)、2.00(CL2)、3.56(CL3)、7.10(CL4)和24.12(CL5)的5种等氮(粗蛋白质含量为39%)试验饲料,糖脂比的设定过程为:总能恒定、脂肪源添加量为0时,获得预糊化玉米淀粉最大可添加量;预糊化玉米淀粉添加量最低时,获得脂肪源最大可添加量;将脂肪源和预糊化玉米淀粉的添加量按比例递减或递增。饲料配制时,首先将各种原料粉碎过60目筛,按配方准确称量,采用逐级扩大法将维生素和矿物质预混料等微量成分按比例充分混匀,然后加入鱼油与豆油的混合油、卵磷脂继续搓匀,最后加入水搅拌混匀,用小型饲料造粒机制成粒径为1.5 mm的颗粒饲料,40 ℃烘干至饲料中水分含量达到约10%后,密封后置于-20 ℃保存备用。
饲料中粗蛋白质含量的测定采用凯氏定氮法(Kjeltec 2200凯式定氮仪,FOSS,丹麦),粗脂肪含量的测定采用索氏抽提法(SoxtecTM2043脂肪仪,FOSS,丹麦),粗灰分含量的测定采用马福炉550 ℃灼烧(14 h)法,水分含量的测定采用105 ℃烘干(24 h)恒重法,总能使用氧弹仪(WELL 9000,上海)测定,粗纤维含量的测定采用纤维素测定仪(ANKOM A200i,美国),无氮浸出物含量通过公式[无氮浸出物=100-(水分+粗灰分+粗蛋白质+粗脂肪+粗纤维)]计算获得,糖脂比的计算参照文献[18-20]的方法计算,即无氮浸出物含量与粗脂肪含量的比值。
|
|
表 1 试验饲料组成及营养水平(风干基础) Table 1 Composition and nutrient levels of experimental diets (air-dry basis) |
试验用日本沼虾购于湖州邦达生态农业有限公司,暂养1周后,选择健康、体重均匀[平均体重为(0.104±0.003) g]的虾体用于试验。将试验虾随机分为5组,每组5个重复,每个重复50只,以重复为单位随机放入到体积为300 L的水族箱中,每个水族箱内放置一定量的网片作为躲避物,以减少日本沼虾互残。试验于2017年7—9月进行,每天早晨吸污并换水(换水量约为1/3),试验使用的水源为曝气的自来水,水质条件为:温度25~29 ℃,pH 7.6~8.1,溶氧浓度 > 6.5 mg/L,总氨氮浓度 < 0.01 mg/L。每日上午、下午各投喂1次,投喂量为虾体重的4%~5%,养殖试验持续8周。
1.3 样品采集养殖试验结束,饥饿24 h后,称重、统计各组虾的存活数。使用解剖器从头胸部取出每组存活虾的肝胰腺,保存于-80 ℃用于后续代谢酶活性、抗氧化指标测定及脂肪酸转运及免疫相关基因表达分析。
1.4 生长性能生长性能相关指标计算公式如下:

|
用电子天平称取肝胰腺约0.500 g,按质量体积比1:9加入预冷的0.86%生理盐水制成10%的匀浆液,3 500 r/min离心15 min,吸取上清液。根据各种不同指标的测定要求将上清液稀释成不同浓度,上清液中蛋白质含量的测定采用考马斯亮蓝法。肝胰腺糖原、丙二醛(MDA)含量与己糖激酶(HK)、丙酮酸激酶(PK)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性以及总抗氧化能力(T-AOC)的测定均按照试剂盒(南京建成生物工程研究所生产)说明书进行。
1.6 脂肪酸转运和TLRs通路相关基因表达分析使用RNA提取试剂盒(北京艾德莱生物科技有限公司生产)提取肝胰腺RNA,具体操作按照试剂盒说明书进行,电泳检测RNA的完整性、核酸蛋白测定仪检测其浓度和纯度。用反转录试剂盒(TaKaRa, 日本)将RNA反转录为cDNA,cDNA保存在-20 ℃用于荧光定量PCR(qRT-PCR)分析。
采用在线Primer 3设计脂肪酸转运相关基因SR-B Ⅰ、FABP10、FATP4和TLRs通路相关基因髓样分化蛋白88(MyD88)、Toll样受体3(TLR3)、丝裂原激活蛋白激酶激酶激酶7(MAP3K7)、肿瘤坏死因子受体相关因子6(TRAF6)、白细胞介素1受体相关激酶4(IRAK4)和丝裂原活化蛋白激酶14(MAPK14)qRT-PCR所用引物,具体见表 2。
|
|
表 2 qRT-PCR所用引物序列 Table 2 Primer sequences used for qRT-PCR |
qRT-PCR反应体积为20 μL,包括10 μL的2×SYBR Green Premix Ex Taq (TaKaRa,日本),10 μmol/L的上、下游引物各0.2 μL,2 μL模板,7.6 μL ddH2O。qRT-PCR反应条件为:95 ℃预变性30 s;94 ℃变性15 s,58 ℃退火20 s,72 ℃延伸20 s,共40个循环,PCR反应后温度以每5 s 5 ℃的速度从60 ℃上升到95 ℃,绘制熔解曲线,以判断扩增产物的正确性。以日本沼虾β-肌动蛋白(β-actin)(上游引物:5′-GTGCCCATCTACGAGGGTTA-3′,下游引物:5′-CGTCAGGGAGCTCGTAAGAC-3′)为内参基因,对得到的各样品Ct值进行均一化处理,以CL5组基因mRNA为基准,使用2-ΔΔCt法[34]对基因表达水平进行分析。
1.7 统计分析试验结果以平均值±标准差(mean±SD)表示,采用SPSS 19.0对数据进行单因素方差分析(one-way ANOVA),若差异达到显著水平,则进行Tukey’s法多重比较,显著水平为P < 0.05。
2 结果 2.1 饲料糖脂比对日本沼虾生长性能的影响由表 3可知,当糖脂比从1.12(CL1组)增加到7.10(CL4组)时,日本沼虾的增重率和特定生长率变化不显著(P > 0.05),当糖脂比继续增加到24.12(CL5组)时,日本沼虾的增重率和特定生长率显著降低(P < 0.05)。各组日本沼虾的存活率无显著差异(P > 0.05)。
|
|
表 3 饲料糖脂比对日本沼虾生长性能的影响 Table 3 Effects of carbohydrate to lipid ratio on growth performance of oriental river prawn (Macrobrachium nipponense) |
由表 4可知,CL5组肝胰腺糖原含量显著高于CL4组(P < 0.05),但CL1、CL2、CL3和CL4组之间无显著差异(P > 0.05)。CL4组肝胰腺HK和PK活性最高,其HK活性显著高于CL1组(P < 0.05),PK活性显著高于其余各组(P < 0.05)。
|
|
表 4 饲料糖脂比对日本沼虾肝胰腺中糖原含量及糖代谢酶活性的影响 Table 4 Effects of carbohydrate to lipid ratio on glycogen content and glucose metabolic enzyme activities in hepatopancreas of oriental river prawn (Macrobrachium nipponense) |
由表 5可知,日本沼虾摄食不同糖脂比的饲料后,肝胰腺中MDA含量、T-AOC、CAT活性未表现出显著差异(P > 0.05)。CL1和CL2组肝胰腺中SOD活性显著高于CL4和CL5组(P < 0.05)。
|
|
表 5 饲料糖脂比对日本沼虾肝胰腺中抗氧化指标的影响 Table 5 Effects of carbohydrate to lipid ratio on antioxidant indices in hepatopancreas of oriental river prawn (Macrobrachium nipponense) |
图 1显示了饲料糖脂比对日本沼虾肝胰腺中脂肪酸转运相关基因表达的影响。肝胰腺中SR-BⅠ基因的表达水平在CL1组最高,显著高于其余各组(P < 0.05),其余各组间无显著差异(P > 0.05);同样,肝胰腺中FATP4基因的表达水平也在CL1组最高,显著高于其余各组(P < 0.05);CL4组肝胰腺中FABP10基因的表达水平显著高于CL1、CL2和CL3组(P < 0.05),有较低糖脂比的CL1、CL2和CL3组之间无显著差异(P > 0.05),有较高糖脂比的CL4、CL5组之间也无显著差异(P > 0.05)。
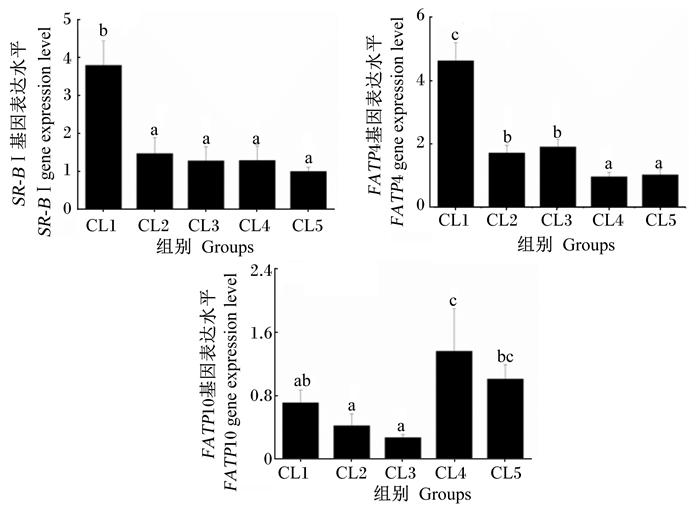
|
数据柱标注不同小写字母表示差异显著(P < 0.05),相同小写字母表示无显著差异(P > 0.05)。下图同。 Value columns with different small letters mean significant difference (P < 0.05), while with the same letter superscripts mean no significant difference (P > 0.05). The same as below. 图 1 饲料糖脂比对日本沼虾肝胰腺脂肪酸转运相关基因表达的影响 Figure 1 Effects of carbohydrate to lipid ratio on fatty acid transport-related gene expression in hepatopancreas of oriental river prawn (Macrobrachium nipponense) |
图 2显示了饲料糖脂比对日本沼虾肝胰腺中免疫相关基因表达的影响。肝胰腺中TLRs通路相关基因(TLR3、MyD88、IRAK4、TRAF6、MAP3K7和MAPK14)的表达都受到饲料糖脂比的调节。其中,CL3组肝胰腺中TLR3、MyD88、IRAK4、TRAF6、MAP3K7和MAPK14基因的表达水平均显著高于其余各组(P < 0.05)。
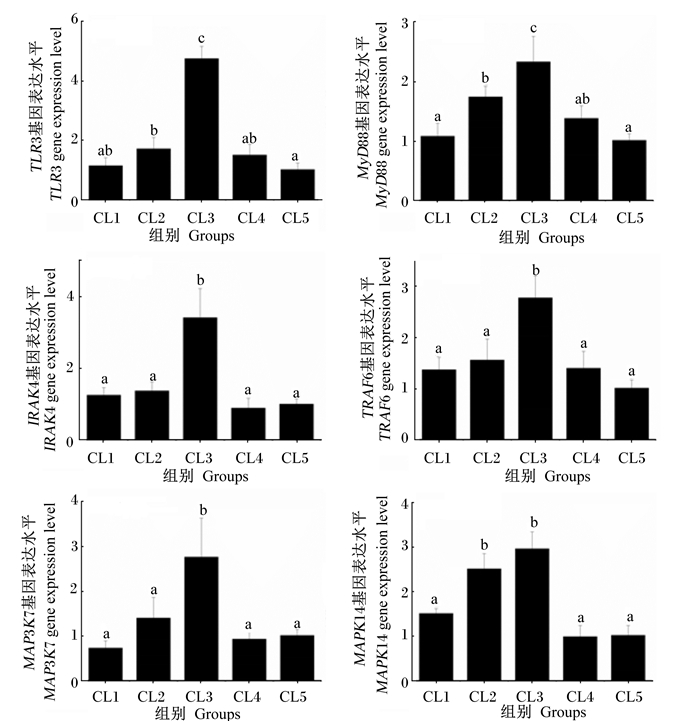
|
图 2 饲料糖脂比对日本沼虾肝胰腺中TLRs通路相关基因表达的影响 Figure 2 Effects of carbohydrate to lipid ratio on TLRs pathway-related gene expression in hepatopancreas of oriental river prawn (Macrobrachium nipponense) |
本研究发现,饲料糖脂比在1.12~7.10时,日本沼虾生长性能无显著差异,但糖脂比过高达到24.12时,日本沼虾的生长性能受到抑制,说明日本沼虾对糖的利用能力有限,这与之前的研究结果一致,即饲料中过高的糖含量不利于日本沼虾的生长[14]。同时,这也与在对红螯螯虾[35]以及鱼类[18, 20, 36]上的研究结果类似,即过高的糖脂比不利于水产动物的生长。有趣的是,饲料中较高的脂肪含量与较低的糖含量(糖脂比为1.12)并没有降低或提高日本沼虾的生长性能,但是否引起代谢紊乱还有待于进一步研究。由于甲壳动物对脂肪的需求受到各种营养物质的影响,因此不能精确得出甲壳动物对脂肪的需求量[37]。研究表明,饲料中脂肪含量在4.20%~13.76%时可满足三疣梭子蟹的正常生长[38],高脂饲料未对罗非鱼的生长性能产生显著影响[39]。这也说明无论是甲壳动物还是鱼类,对饲料中脂肪含量较高时可能存在一定的调节机制。
PK和HK是糖酵解途径的关键酶[40],本研究发现糖脂比对肝胰腺中糖代谢酶活性有显著影响,当饲料糖脂比由1.12升高到7.10时,日本沼虾肝胰腺中HK和PK活性显著增加,说明日本沼虾能将一定水平的饲料糖进行氧化作为能量利用。这与在建鲤[23]上的研究结果相似,即当饲料糖脂比由2.3升高到7.7时,建鲤幼鱼肝脏PK和HK活性均显著升高。同样,当糖脂比从1.33升高到10.75时,红螯螯虾肝胰腺HK和PK活性均显著增加[35]。然而,当糖脂比进一步增加时,日本沼虾肝胰腺中PK活性显著降低,这可能是由于高含量的糖(35%)不能激发PK活性,也间接说明日本沼虾对糖的利用能力有限。而从肝胰腺中糖原含量的变化来看,高含量的糖显著增加了日本沼虾肝胰腺中糖原含量,说明日本沼虾将不能利用的糖作为肝糖原储存起来[41-42]。
肝胰腺是甲壳动物自由基的主要代谢中心[43]。由于细胞膜包含磷脂双分子层,很容易受到自由基的攻击而导致脂质过氧化[44]。MDA是脂质过氧化的产物,常被用来衡量机体内源性氧化应激的状态[45]。为了减少氧化应激,维持体内自由基的动态平衡,生物体进化出了多种抗氧化防御反应,比如专门的抗氧化酶如SOD和CAT等[46]。本研究发现,饲料糖脂比未对日本沼虾肝胰腺中MDA含量产生显著影响,说明不同糖脂比的饲料未对机体产生显著的氧化应激。但较多的研究表明,高脂或高糖饲料会引起机体的氧化应激[13, 43, 47],这可能是由于不同物种对糖或脂肪的耐受性能不一致造成的。但从肝胰腺中抗氧化酶SOD的活性来看,随着糖脂比的增加,肝胰腺中SOD活性呈下降趋势,说明随着饲料脂肪含量的下降,机体产生的活性氧(ROS)水平也开始下降。
为了进一步了解饲料糖脂比是否影响了虾体的脂质代谢和免疫性能,我们进一步测定了肝胰腺脂肪酸转运和TLRs通路相关基因的表达水平。CD36清道夫受体超家族在脂质代谢调节和先天免疫中起着非常重要的作用[48],SR-BⅠ作为该家族的一员,参与细胞脂质代谢,维持细胞内胆固醇代谢稳态,且在细胞膜脂表达和细胞凋亡等方面具有重要作用[49-50]。日本沼虾的SR-BⅠ包含CD36结构域,可能具有类似CD36脂肪酸转运功能,其表达受到饲料脂肪源的调节[51]。本研究发现,饲料较低的糖脂比不仅促进了日本沼虾肝胰腺中SR-BⅠ基因的表达,还促进了长链脂肪酸转运蛋白FATP4基因的表达。这与在罗非鱼[18]上得出的结果有一定差异,对罗非鱼的研究显示饲料糖脂比对罗非鱼肝胰脏中脂肪酸转运蛋白FATP5基因的表达无显著影响。出现这样的差异可能与脂肪酸转运蛋白类型有关,也可能与物种有关。然而,日本沼虾胞内肝脏型脂肪酸转运蛋白FABP10[52]基因的表达水平在糖脂比增加时(即低脂时)却显著增加,该结果提示胞内脂肪酸转运可能与胞膜脂肪酸转运无一定相关性。对罗非鱼的研究同样表明,相比高脂和中脂组,低脂组罗非鱼肝脏中FABP4基因的表达水平最低,说明低脂组增加了胞内脂肪酸转运[39]。然而,有关饲料糖脂比对上述脂肪酸转运相关基因表达的调节机制尚未清晰,仍然需要进一步的深入研究。
相比脊椎动物发达的免疫系统,无脊椎动物主要依赖于先天性的免疫系统防御病原菌。TLRs通路在先天免疫系统中发挥重要的作用[28]。TLRs可以通过MyD88依赖性和MyD88非依赖性通路激活炎症因子的表达[53-55]。研究表明,营养物质如脂肪酸可以调控TLRs和MyD88基因的表达[29-31]。本研究发现饲料糖脂比为3.56(CL3组)时,显著上调了TLR3和MyD88基因的表达。TRAF6可以作为分子桥,连接着上游的TLR、MyD88、IRAK基因和下游的核因子-κB(NF-κB)、丝裂原活化蛋白激酶(MAPK)信号通路[56]。本试验中,这些上游或下游分子如IRAK4、TRAF6、MAP3K7和MAPK14基因同样受到饲料糖脂比的调节,且变化趋势与TLR3和MyD88基因的变化基本一致。尽管有关糖脂比对TLRs通路相关基因表达的可参考资料较少,但研究表明,饲料中适宜的糖脂比可以提高机体的免疫力[1, 19]。因此,TLRs通路相关基因表达的上调可能与日本沼虾非特异性免疫反应提高有关。研究表明,TLRs通路相关基因除了与机体免疫相关,还参与了机体的炎症反应过程,可缓解病原菌或氧化应激带来的组织损伤[57-58]。本研究中,饲料糖脂比提高降低了日本沼虾肝胰腺中SOD活性,说明虾体产生的ROS减少,尽管CL4和CL5组肝胰腺中TLRs通路相关基因的表达显著降低,但CL1、CL2和CL3组肝胰腺中TLRs通路相关基因的表达与SOD活性变化趋势不一致,说明TLRs通路相关基因表达的变化可能不是完全由氧化应激引起的。研究发现,脂多糖(LPS)可激活TLRs通路[59],但多次LPS刺激后,机体细胞会对LPS的刺激产生耐受和交叉耐受性,即细胞对再次刺激的LPS表现为低反应性,且对TLRs配体表现为广泛的低反应性[60]。本研究中,日本沼虾在摄食高脂饲料(CL1和CL2组)或高糖饲料(CL4和CL5组)长达8周后,肝胰腺TLRs通路相关基因的低表达不排除存在相似的耐受机制,但需要在今后研究时在中间时段取样进一步验证。也有研究表明,TLRs通路相关基因的表达特性与所分析的组织密切相关,Toll样受体22(TLR22)和MyD88基因在草鱼(Ctenopharyngodon idellus)的肝脏和肾脏中表达变化趋势相反[7],而本研究仅仅分析了肝胰腺中TLRs通路相关基因的表达,其他组织是否有类似的或相反的调节方式,有待于进一步分析。
4 结论① 日本沼虾对饲料糖脂比有较大的适应性,糖脂比在1.12~7.10时日本沼虾增重率无显著变化,但过高的糖脂比(24.12)会抑制其生长,降低肝胰腺糖酵解关键酶活性,增加肝糖原的累积。
② 饲料糖脂比可调节肝胰腺脂肪酸转运相关基因(SR-BⅠ、FATP4和FABP10)和TLRs通路相关基因(TLR3、MyD88、IRAK4、TRAF6、MAP3K7和MAPK14)的表达。
| [1] |
LI X F, JIANG Y Y, LIU W B, et al. Protein-sparing effect of dietary lipid in practical diets for blunt snout bream (Megalobrama amblycephala) fingerlings:effects on digestive and metabolic responses[J]. Fish Physiology and Biochemistry, 2012, 38(2): 529-541. DOI:10.1007/s10695-011-9533-9 |
| [2] |
NANKERVIS L, MATTHEWS S J, APPLEFORD P. Effect of dietary non-protein energy source on growth, nutrient retention and circulating insulin-like growth factor Ⅰ and triiodothyronine levels in juvenile barramundi (Lates cacarifer)[J]. Aquaculture, 2000, 191(4): 323-335. DOI:10.1016/S0044-8486(00)00436-1 |
| [3] |
WATANABE T. Strategies for further development of aquatic feeds[J]. Fisheries Science, 2002, 68(2): 242-252. DOI:10.1046/j.1444-2906.2002.00418.x |
| [4] |
WATANABE T. Lipid nutrition in fish[J]. Comparative Biochemistry and Physiology Part B:Comparative Biochemistry, 1982, 73(1): 3-15. DOI:10.1016/0305-0491(82)90196-1 |
| [5] |
SARGENT J R, HENDERSON R J, TOUCHER D R.The lipids in fish[M]//HALVER J E.Nutrition.2nd ed.New York: Academic Press, 1989: 153-218.
|
| [6] |
CHOU B S, SHIAU S Y. Optimal dietary lipid level for growth of juvenile hybrid tilapia, Oreochromis niloticus ×Oreochromis aureus[J]. Aquaculture, 1996, 143(2): 185-195. DOI:10.1016/0044-8486(96)01266-5 |
| [7] |
TIAN J J, JI H, OKU H, et al. Effects of dietary arachidonic acid (ARA) on lipid metabolism and health status of juvenile grass carp, Ctenopharyngodon idellus[J]. Aquaculture, 2014, 430: 57-65. DOI:10.1016/j.aquaculture.2014.03.020 |
| [8] |
DAVIS D A, ROBINSON E H. Estimation of the dietary lipid requirement level of the white crayfish Procambarus acutus acutus[J]. World Aquaculture Society, 2010, 17(1/2/3/4)): 37-43. |
| [9] |
SHEEN S S, D'ABRAMO L R. Response of juvenile freshwater prawn, Macrobrachium rosenbergii, to different levels of a cod liver oil/corn oil mixture in a semi-purified diet[J]. Aquaculture, 1991, 93(2): 121-134. DOI:10.1016/0044-8486(91)90211-O |
| [10] |
SHEEN S S. Lipid supplementation of semi-purified diets for Penaeus chinensis juvenile[J]. Fish Society Taiwan, 1997, 24(3): 235-242. |
| [11] |
DU Z Y, CLOUET P, HUANG L M, et al. Utilization of different dietary lipid sources at high level in herbivorous grass carp (Ctenopharyngodon idella):mechanism related to hepatic fatty acid oxidation[J]. Aquaculture Nutrition, 2010, 14(1): 77-92. |
| [12] |
LU K L, XU W N, LI X F, et al. Hepatic triacylglycerol secretion, lipid transport and tissue lipid uptake in blunt snout bream (Megalobrama amblycephala) fed high-fat diet[J]. Aquaculture, 2013, 408-409. |
| [13] |
WU C L, YE J Y, GAO J E, et al. The effects of dietary carbohydrate on the growth, antioxidant capacities, innate immune responses and pathogen resistance of juvenile black carp Mylopharyngodon piceus[J]. Fish & Shellfish Immunology, 2016, 49: 132-142. |
| [14] |
DING Z L, KONG Y Q, LI J F, et al. Growth and metabolic responses of juvenile Macrobrachium nipponense to different dietary carbohydrate levels[J]. Aquaculture Nutrition, 2017, 23(5): 1136-1144. DOI:10.1111/anu.2017.23.issue-5 |
| [15] |
LIU B, XIE J, Ge X P, et al. Effect of high dietary carbohydrate on growth, serum physiological response, and hepatic heat shock cognate protein 70 expression of the top-mouth culter Erythroculter ilishaeformis Bleeker[J]. Fisheries Science, 2012, 78(3): 613-623. DOI:10.1007/s12562-012-0486-4 |
| [16] |
ROSAS C, CUZON G, GAXIOLA G, et al. Influence of dietary carbohydrate on the metabolism of juvenile Litopenaeus stylirostris[J]. Journal of Experimental Marine Biology and Ecology, 2000, 249(2): 181-198. DOI:10.1016/S0022-0981(00)00184-2 |
| [17] |
ROSAS C, CUZON G, GAXIOLA G, et al. Metabolism and growth of juveniles of Litopenaeus vannamei:effect of salinity and dietary carbohydrate levels[J]. Journal of Experimental Marine Biology and Ecology, 2001, 259(1): 1-22. DOI:10.1016/S0022-0981(01)00222-2 |
| [18] |
XIE D Z, YANG L P, YU R M, et al. Effects of dietary carbohydrate and lipid levels on growth and hepatic lipid deposition of juvenile tilapia Oreochromis niloticus[J]. Aquaculture, 2017, 479: 696-703. DOI:10.1016/j.aquaculture.2017.07.013 |
| [19] |
WANG L N, LIU W B, LU K L, et al. Effects of dietary carbohydrate/lipid ratios on non-specific immune responses, oxidative status and liver histology of juvenile yellow Catfish Pelteobagrus fulvidraco[J]. Aquaculture, 2014, 426-427: 41-48. DOI:10.1016/j.aquaculture.2014.01.022 |
| [20] |
ZHOU P P, WANG M Q, XIE F J, et al. Effects of dietary carbohydrate to lipid ratios on growth performance, digestive enzyme and hepatic carbohydrate metabolic enzyme activities of large yellow croaker (Larmichthys crocea)[J]. Aquaculture, 2016, 452: 45-51. DOI:10.1016/j.aquaculture.2015.10.010 |
| [21] |
曲木, 李长娥, 刘宏超, 等. 饲料不同糖脂比对鲤鱼生长、体成分及消化酶活性的影响[J]. 动物营养学报, 2016, 28(7): 2069-2078. DOI:10.3969/j.issn.1006-267x.2016.07.011 |
| [22] |
陈天翔, 曲木, 吕春双, 等. 饲料不同糖脂比对鲤鱼生长、免疫及抗氧化相关酶活性的影响[J]. 天津农学院学报, 2016, 23(1): 5-9. DOI:10.3969/j.issn.1008-5394.2016.01.002 |
| [23] |
王菲, 李向飞, 李贵锋, 等. 不同糖脂比对建鲤幼鱼生长、体组成、消化及糖酵解能力的影响[J]. 水产学报, 2015, 39(9): 1386-1394. |
| [24] |
KARAGIANNI P, TALIANIDIS I. Transcription factor networks regulating hepatic fatty acid metabolism[J]. Biochimica et Biophysica Acta:Molecular and Cell Biology of Lipids, 2015, 1851(1): 2-8. DOI:10.1016/j.bbalip.2014.05.001 |
| [25] |
STAHL A. A current review of fatty acid transport proteins (SLC27)[J]. Pflügers Archiv, 2004, 447(5): 722-727. DOI:10.1007/s00424-003-1106-z |
| [26] |
POHL J, RING A, HERMANN T, et al. Role of FATP in parenchymal cell fatty acid uptake[J]. Biochimica et Biophysica Acta:Molecular and Cell Biology of Lipids, 2003, 1686(1/2): 1-6. |
| [27] |
SCHWENK R W, HOLLOWAY G P, LUIKEN J J F P. Fatty acid transport across the cell membrane:regulation by fatty acid transporters[J]. Prostaglandins, Leukotrienes and Essential Fatty Acids, 2010, 82(4/5/6): 149-154. |
| [28] |
LI F H, XIANG J H. Recent advances in researches on the innate immunity of shrimp in China[J]. Developmental & Comparative Immunology, 2013, 39(1/2): 11-26. |
| [29] |
DING Z L, ZHOU J B, KONG Y Q, et al. Dietary arachidonic acid promotes growth, improves immunity, and regulates the expression of immune-related signaling molecules in Macrobrachium nipponense (De Haan)[J]. Aquaculture, 2018, 484: 112-119. DOI:10.1016/j.aquaculture.2017.11.010 |
| [30] |
ZUO R T, AI Q H, MAI K S, et al. Effects of dietary docosahexaenoic to eicosapentaenoic acid ratio (DHA/EPA) on growth, nonspecific immunity, expression of some immune related genes and disease resistance of large yellow croaker (Larmichthys crocea) following natural infestation of parasites (Cryptocaryon irritans)[J]. Aquaculture, 2012, 334/335/336/337: 101-109. |
| [31] |
ZUO R T, AI Q H, MAI K S, et al. Effects of dietary n-3 highly unsaturated fatty acids on growth, nonspecific immunity, expression of some immune related genes and disease resistance of large yellow croaker (Larmichthys crocea) following natural infestation of parasites (Cryptocaryon irritans)[J]. Fish & Shellfish Immunology, 2012, 32(2): 249-258. |
| [32] |
GABLER N K, SPENCER J D, WEBEL D M, et al. n-3 PUFA attenuate lipopolysaccharide-induced down-regulation of Toll-like receptor 4 expression in porcine adipose tissue but does not alter the expression of other immune modulators[J]. The Journal of Nutritional Biochemistry, 2008, 19(1): 8-15. DOI:10.1016/j.jnutbio.2006.11.014 |
| [33] |
YANG Y, XIE S Q, LEI W, et al. Effect of replacement of fish meal by meat and bone meal and poultry by product meal in diets on the growth and immune response of Macrobrachium nipponense[J]. Fish & Shellfish Immunology, 2004, 17(2): 105-114. |
| [34] |
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△CT method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [35] |
ZHU H, JIANG Q, WANG Q, et al. Effect of dietary carbohydrate-to-lipid ratios on growth performance, body composition, hepatic enzyme activities, and digestive enzyme activities of juvenile australian redclaw crayfish, Cherax quadricarinatus (von Martens)[J]. Journal of the World Aquaculture Society, 2013, 44(2): 173-186. DOI:10.1111/jwas.2013.44.issue-2 |
| [36] |
GAO W, LIU Y J, TIAN L X, et al. Effect of dietary carbohydrate-to-lipid ratios on growth performance, body composition, nutrient utilization and hepatic enzymes activities of herbivorous grass carp (Ctenopharyngodon idella)[J]. Aquaculture Nutrition, 2010, 16(3): 327-333. |
| [37] |
JOBLING M. National Research Council (NRC):nutrient requirements of fish and shrimp[J]. Aquaculture International, 2012, 20(3): 601-602. DOI:10.1007/s10499-011-9480-6 |
| [38] |
韩涛, 王骥腾, 胡水鑫, 等. 饲料脂肪水平对三疣梭子蟹(Portunus trituberculatus)幼蟹生长及体组成的影响[J]. 海洋与湖沼, 2013, 44(5): 1276-1281. |
| [39] |
HE A Y, NING L J, CHEN L Q, et al. Systemic adaptation of lipid metabolism in response to low-and high-fat diet in Nile tilapia (Oreochromis niloticus)[J]. Physiological Reports, 2015, 3(8): e12485. DOI:10.14814/phy2.12485 |
| [40] |
NEIDHARDT F C. Escherichia coli and salmonella:cellular and molecular biology[M]. Washington, D.C.: ASM Press, 1996: 1325-1343.
|
| [41] |
HUTCHINS C G, RAWLES S D, GATLIN Ⅲ D M. Effects of dietary carbohydrate kind and level on growth, body composition and glycemic response of juvenile sunshine bass (Morone chrysops ♀ × M.saxatilis ♂)[J]. Aquaculture, 1998, 161(1/2/3/4): 187-199. |
| [42] |
GÜMÜŞ E, IKIZ R. Effect of dietary levels of lipid and carbohydrate on growth performance, chemical contents and digestibility in rainbow trout, Oncorhynchus mykiss Walbaum, 1792[J]. Pakistan veterinary Journal, 2009, 29(2): 59-63. |
| [43] |
ZHANG S P, LI J F, WU X C, et al. Effects of different dietary lipid level on the growth, survival and immune-relating genes expression in Pacific white shrimp, Litopenaeus vannamei[J]. Fish & Shellfish Immunology, 2013, 34(5): 1131-1138. |
| [44] |
CATALÁ A. Lipid peroxidation of membrane phospholipids generates hydroxy-alkenals and oxidized phospholipids active in physiological and/or pathological conditions[J]. Chemistry and Physics of Lipids, 2009, 157(1): 1-11. |
| [45] |
VALAVANIDIS A, VLAHOGIANNI T, DASSENAKIS M, et al. Molecular biomarkers of oxidative stress in aquatic organisms in relation to toxic environmental pollutants[J]. Ecotoxicology and Environmental Safety, 2006, 64(2): 178-189. DOI:10.1016/j.ecoenv.2005.03.013 |
| [46] |
NOZIK-GRAYCK E, SULIMAN H B, PIANTADOSIC A. Extracellular superoxide dismutase[J]. The International Journal of Biochemistry & Cell Biology, 2002, 349(12): 74-80. |
| [47] |
ZHAO J, WEN X B, LI S K, et al. Effects of dietary lipid levels on growth, feed utilization, body composition and antioxidants of juvenile mud crab Scylla paramamosain (Estampador)[J]. Aquaculture, 2015, 435: 200-206. DOI:10.1016/j.aquaculture.2014.09.018 |
| [48] |
NECULAI D, SCHWAKE M, RAVICHANDRAN M, et al. Structure of LIMP-2 provides functional insights with implications for SR-BⅠ and CD36[J]. Nature, 2013, 504(7478): 172-176. DOI:10.1038/nature12684 |
| [49] |
CONNELLY M, KLEIN S, AZHAR S, et al. Comparison of class B scavenger receptors, CD36 and scavenger receptor BⅠ (SR-BⅠ), shows that both receptors mediate high density lipoprotein-cholesteryl ester selective uptake but SR-BⅠ exhibits a unique enhancement of cholesteryl ester uptake[J]. The Journal of Biological Chemistry, 1999, 274(1): 41-47. DOI:10.1074/jbc.274.1.41 |
| [50] |
SHEN W J, HU W, HU Z G, et al. Scavenger receptor class B type Ⅰ (SR-BⅠ):a versatile receptor with multiple functions and actions[J]. Metabolism, 2014, 63(7): 875-886. DOI:10.1016/j.metabol.2014.03.011 |
| [51] |
DING Z L, LUO N, KONG Y Q, et al. Scavenger receptor class b, type Ⅰ, a CD36 related protein in Macrobrachium nipponense:characterization, RNA interference, and expression analysis with different dietary lipid sources[J]. International Journal of Genomics, 2016, 2016: 6325927. |
| [52] |
DING Z L, CHEN L Q, QIN J G, et al. Molecular cloning, characterization and expression analysis of the fatty acid-binding protein (MnFABP), involved in dietary lipid sources response in oriental river prawn, Macrobrachium nipponense[J]. Aquaculture Nutrition, 2014, 20(4): 309-409. |
| [53] |
MEDZHITOV R, PRESTON-HURLBURT P, JANEWAY C A, J r, et al. A human homologue of the Drosophila Toll protein signals activation of adaptive immunity[J]. Nature, 1997, 388(6640): 394-397. DOI:10.1038/41131 |
| [54] |
SCHNARE M, BARTON G M, HOLT A C, et al. Toll-like receptors control activation of adaptive immune responses[J]. Nature Immunology, 2001, 2(10): 947-950. DOI:10.1038/ni712 |
| [55] |
YAMAMOTO M, SATO S, HEMMI H, et al. Role of adaptor TRIF in the MyD88-independent Toll-like receptor signaling pathway[J]. Science, 2003, 301(5633): 640-643. DOI:10.1126/science.1087262 |
| [56] |
KIM H Y, RIKIHISA Y. Roles of p38 mitogen-activated protein kinase, NF-kappa B, and protein kinase C in proinflammatory cytokine mRNA expression by human peripheral blood leukocytes, monocytes, and neutrophilsin response to Anaplasma phagocytophila[J]. Infection and Immunity, 2002, 70(8): 4132-4141. DOI:10.1128/IAI.70.8.4132-4141.2002 |
| [57] |
CHEN C, WANG Y L, ZHANG Z Z, et al. Toll-like receptor 4 regulates heme oxygenase-1 expression after hemorrhagic shock induced acute lung injury in mice:requirement of p38 mitogen-activated protein kinase activation[J]. Shock, 2009, 31(5): 486-492. DOI:10.1097/SHK.0b013e318188f7e1 |
| [58] |
GILL R, TSUNG A, BILLIAR T. Linking oxidative stress to inflammation:Toll-like receptors[J]. Free Radical Biology and Medicine, 2010, 48(9): 1121-1132. DOI:10.1016/j.freeradbiomed.2010.01.006 |
| [59] |
LENDEMANS S, KREUZFELDER E, RANI M, et al. Toll-like receptor 2 and 4 expression after severe injury is not involved in the dysregulation of the innate immune system[J]. Journal of Trauma & Acute Care Surgery, 2007, 63(4): 740-746. |
| [60] |
DE VOS A F, PATER J M, VAN DER PANGAART P S, et al. In vivo lipopolysaccharide exposure of human blood leukocytes induces cross-tolerance to multiple TLR ligands[J]. The Journal of Immunology, 2009, 183(1): 533-542. DOI:10.4049/jimmunol.0802189 |




