2. 山东健源生物科技有限公司, 泰安 271000;
3. 四川省草原科学研究院, 成都 610091
2. Shandong Jianyuan Science and Technology Co., Ltd., Tai'an 271000, China;
3. Sichuan Academy of Grassland Sciences, Chengdu 610091, China
限饲影响动物许多的生理代谢过程。在人方面的研究发现,限饲能延长寿命、减少疾病[1]、改变能量代谢和免疫反应[2]。在幼龄动物方面的研究发现,限饲可提高肉或胴体质量[3]、促进胃肠排空、提高营养物质消化[4]以及控制肥胖以防后期肥胖带来的生殖问题[5]。生长肉兔的肠道壁薄,易损伤,尤其是刚断奶后的生长肉兔体内消化酶分泌不足,极易导致消化功能紊乱[6],自由采食容易带来严重的肠道问题。通过限饲(饲喂量为自由采食85%左右)1周,可明显观察到限饲促进了生长肉兔小肠绒毛和隐窝发育[7]。Gidenne等[8]通过采用较温和的限饲试验发现,一定程度的限饲可以降低生长肉兔的发病率和死亡率。并且通过一定量限饲可以改善生长肉兔的肠道生理状态,引导食粪行为,降低饲粮在消化道通过的速率,改善其在盲肠的发酵[9]。在生长肉兔生产中常采用限饲方式,不仅可改善肠道问题,还可以影响脂肪代谢在体内的沉积,从而改变肉品质,但限饲对生长肉兔脂肪代谢的影响机制仍未确定。
生长肉兔是一种草食性动物,脂肪组织在脂质代谢过程中发挥重要的作用,它不仅是脂肪储存的主要组织,也在脂肪合成过程中发挥重要的作用。其中,一些相关的酶在脂肪代谢过程中发挥控制作用,如激素敏感脂肪酶(HSL)是调节脂肪动员的关键酶,是脂肪分解的限速酶[10];脂肪酸合成酶(FAS)和乙酰辅酶A羧化酶(ACC)是脂肪酸合成过程的关键酶,而肉碱脂酰转移酶(CPT)是长链脂肪酸分解的限速酶[11];脂蛋白脂酶(LPL)是脂质代谢中的关键酶,可水解极低密度脂蛋白和乳糜微粒中的甘油三酯[12]。此外,脂肪代谢过程还受到体内一些信号通路的影响,如过氧化物酶体增殖物激活受体(PPARs)、G蛋白偶联受体(GPR41/43)、磷酸腺苷激活蛋白酶(AMPK)等。本试验旨在研究短期限饲对生长肉兔脂肪组织中脂质代谢相关基因表达和相关信号通路的影响,阐明短期限饲对生长肉兔脂肪代谢的作用机制。
1 材料与方法 1.1 试验设计及饲养管理试验选取40日龄、体重相近[(1 510±10) g]的伊拉肉兔40只,随机分为2组:对照组(自由采食组)和限饲组(饲喂量是对照组的70%左右),每组20个重复,每个重复1只兔,试验持续5 d。限饲量和持续时间参考文献[7-8]设置。试验饲粮组成及营养水平见表 1。试验兔单笼饲养,自然采光、通风,自由饮水。
|
|
表 1 试验饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the experimental diet (air-dry basis) |
试验期间每天记录生长肉兔的采食量和体重。试验结束后,采用颈脱位法将生长肉兔处死,分离并称重肩周脂肪和肾周脂肪,收集样品,放置于液氮快速冷冻,并将样品储存于-80 ℃。
1.3 基因表达的测定脂肪组织中总RNA用异硫氰二胍盐法提取,利用琼脂糖凝胶电泳和生物分光光度计分别检测RNA的质量和浓度,具体步骤参考文献[13-14]的描述。按照TaKaRa RNA PCR反转录和荧光定量试剂盒操作说明进行反转录和荧光定量PCR,表 2为相关基因的引物序列。采用2-ΔΔCt法定量目标基因的表达量,以磷酸甘油醛脱氢酶(GAPDH)作为参照基因进行校正。
|
|
表 2 相关基因的引物序列 Table 2 Primer sequences of related genes |
使用南京建成生物工程研究所试剂盒,通过酶标仪(SpectraMax iD3,美国)测定脂肪组织中甘油三酯浓度。
用蛋白裂解液裂解脂肪组织后,取上清液用BCA蛋白浓度试剂盒(康为世纪生物科技有限公司,北京)测定上清液中总蛋白含量,然后在100 ℃下煮沸5 min使蛋白质变性,加入到制备好的聚丙酰胺凝胶中,上样量为20 μL,20 mA电泳分离蛋白,至分离出目的蛋白条带,随后在4 ℃、100 V下将蛋白转移到硝酸纤维素膜上,室温下封闭液封闭1 h,然后经一抗二抗孵育后用ECL显色液进行荧光显色,置于蛋白凝胶成像仪器(Vilber,法国)下成像,利用Fusion软件进行目的蛋白定量分析,得到脂肪组织目的蛋白表达量。
1.5 数据统计分析试验数据统计采用SAS 8.0统计软件的ANOVA程序进行单因素方差分析,如果处理效应差异显著(P < 0.05),采用Duncan氏法进行多重比较,数据用平均值±标准误表示,P < 0.05为差异显著。
2 结果 2.1 短期限饲对生长肉兔生长性能的影响如表 3所示,短期限饲显著降低了生长肉兔的日增重(P < 0.05),有降低生长肉兔体内总脂肪沉积量的趋势,对生长肉兔体内肩胛脂肪和肾周脂肪的沉积量影响不显著(P > 0.05)。
|
|
表 3 短期限饲对生长肉兔生长性能的影响 Table 3 Effects of short-term feed restriction on growth performance of growing meat rabbits |
如图 1所示,与对照组相比, 短期限饲显著降低了FAS、ACC、LPL的基因表达(P < 0.05),却显著升高了PPARα、PPARγ、CPT1、CPT2和GPR41的基因表达(P < 0.05),对HSL和GPR43的基因表达无显著影响(P > 0.05)。
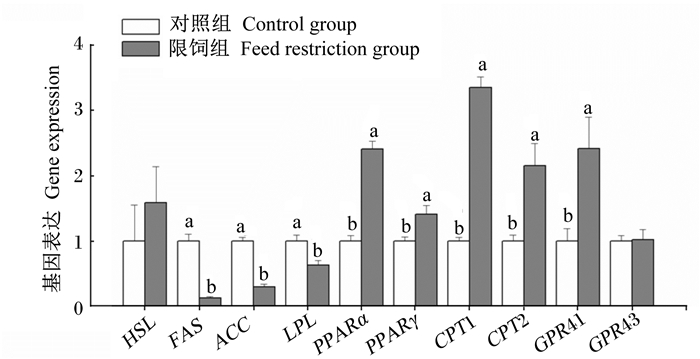
|
HSL:激素敏感脂肪酶hormone sensitive lipase;FAS:脂肪酸合成酶fatty acid synthetase;ACC:乙酰辅酶A羧化酶acetylCoA carboxylase;LPL:脂蛋白脂酶lipoprotein lipase;PPARα:过氧化物酶体增殖物激活受体α peroxisome proliferatoractivated receptor α; PPARγ:过氧化物酶体增殖物激活受体γ peroxisome proliferator-activated receptor γ;CPT1:肉碱脂酰转移酶1 carnitine acyl transferase 1;CPT2:肉碱脂酰转移酶2 carnitine acyl transferase 2; GPR41:G蛋白偶联受体41 G-protein-coupled receptors 41;GPR43:G蛋白偶联受体43 G-protein-coupled receptors 43。 同一指标数据柱标注无字母表示差异不显著(P > 0.05),不同小写字母表示差异显著(P < 0.05)。下图同。 For the same item, data bars with no letters mean no significant difference (P > 0.05), while with different small letters mean significant difference (P < 0.05). The same as 图 1 短期限饲对生长家兔脂肪组织中脂质代谢相关基因表达的影响 Figure 1 Effects of short-term feed restriction on expression of genes related lipid metabolism in adipose tissue of growing meat rabbits |
如图 2所示,短期限饲对脂肪中甘油三酯的浓度和磷酸化的AMPK蛋白表达的影响均不显著(P > 0.05)。
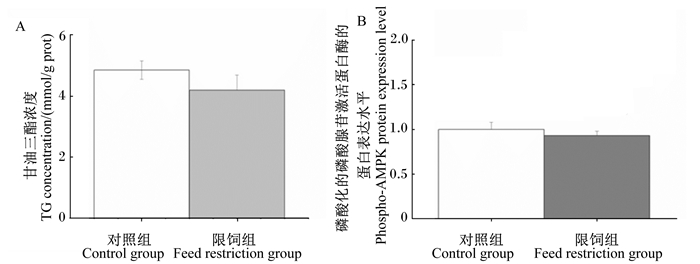
|
图 2 短期限饲对生长肉兔脂肪组织中甘油三酯浓度(A)和磷酸化的磷酸腺苷激活蛋白酶蛋白表达(B)的影响 Figure 2 Effects of short-term feed restriction on TC concentration (A) and phospho-AMPK protein expression (B) in adipose tissue of growing meat rabbits |
动物体脂沉积是一个复杂的生理生化过程,品种、生长阶段及营养水平都可影响动物机体脂肪的沉积。动物体脂沉积的多少取决于脂肪酸的合成、分解、转运以及脂肪细胞的分化和脂质的分解等过程。HSL是脂肪分解的关键酶,主要表达在脂肪组织中,将甘油三酯分解成甘油和脂肪酸以满足动物体的需要[10],本试验中短期限饲并未显著改变脂肪中HSL的基因表达和甘油三酯的浓度,说明短期限饲并未显著改变脂肪组织中脂质分解这一过程。LPL主要由脂肪组织合成并分泌到血液中,将血液中乳糜微粒和极低密度脂蛋白中的甘油三酯水解为脂肪酸[12],LPL与机体的脂类代谢及肥胖密切相关,白色脂肪组织中LPL的活性升高有助于机体脂类的贮存[15]。本试验中发现,短期限饲显著降低了脂肪组织中LPL的基因表达,这与骨骼肌中的研究结果不同,张慧等[16]发现,限饲显著提高了家禽骨骼肌中LPL的基因表达。这些结果说明,短期限饲中血液的乳糜微粒和极低密度脂蛋白水解产生的甘油三酯主要流向骨骼肌去供能,而非脂肪组织。CPT位于线粒体外膜,负责将长链脂肪酸转运进入线粒体[17]。本试验中,短期限饲显著提高了脂肪组织中CPT1和CPT2的基因表达,与前人研究结果[18]相似,说明进入线粒体进行β-氧化的脂肪酸增多,脂肪酸的氧化作用增强,较多的脂肪酸为机体提供能量。FAS催化乙酰辅酶A和丙二酸单酰辅酶A合成脂肪酸;ACC催化乙酰辅酶A生成丙二酸单酰辅酶A反应的生物素酶,是催化脂肪酸合成代谢第一步反应的限速酶。本研究发现,短期限饲显著降低了脂肪组织中FAS和ACC的基因表达,表明脂肪酸的从头合成过程降低。总之,短期限饲抑制了脂肪组织中脂肪酸合成过程,促进长链脂肪酸酸的β-氧化过程;同时血液中的乳糜微粒和极低密度脂蛋白水解产生的甘油三酯流向脂肪组织过程降低。
PPARs是调节脂质代谢的重要转录因子,PPARα和PPARγ属于PPARs超家族成员,通过线粒体及过氧化物酶体的β-氧化作用调控游离脂肪酸的氧化、吸收,参与调控脂肪代谢[19]。PPARγ是一类由配体激活的核转录因子,是刺激脂肪细胞分化的关键因子[20],本试验中发现,短期限饲增加了脂肪组织中PPARγ的转录,表明脂肪细胞分化过程加强。PPARα能与配体结合而活化,从而增强与脂质代谢有关的酶和基因转录,如CPT、酰基辅酶A合成酶、酰基辅酶A氧化酶等,使组织氧化脂肪酸能力加强[21]。本试验中,短期限饲处理后PPARα、CPT1和CPT2基因表达一致,表明限饲过程中PPARα可能参与了脂肪酸氧化过程。
GPR41和GPR43是目前已发现的仅有的2种特异性短链脂肪酸受体,在调控脂类代谢和免疫反应等生物学过程以及在动物肠道对营养物质的吸收中发挥重要作用。激活GPR41和GPR43后促进了脂肪组织分泌瘦素[22]。GPR41激活后还可引起交感神经的兴奋,提高心率,并在采食后增加能量的消耗[23]。前期试验发现,在家兔的脂肪组织中有大量的GPR41和GPR43的基因表达[24],并且限饲显著增加了GPR41的基因表达,但未显著改变GPR43的基因表达,表明GPR41在家兔的能量代谢中发挥重要的作用,激活GPR41后能通过上调PPARγ的转录调节脂肪细胞的分化。因此,短期限饲后PPARγ基因表达的增加可能是因为GPR41基因表达上调引起的[25]。
AMPK是细胞内能量代谢的重要调节因子,其主要功能是根据机体的需能状况来调节产能和耗能。在脂质代谢过程中,AMPK作为能量调节器,调控细胞并对多种胞内刺激信号做出应答。在牛乳腺上皮细胞中激活AMPK可抑制脂肪酸合成[26]。在3T3-L1细胞中激活AMPK下调了PPARγ的表达[27]。活化的AMPK可以抑制胆固醇、甘油二酯、甘油三酯以及脂肪酸的合成,使ACC的活性显著下降或丧失,提高脂肪酸的氧化速度[28]。以上研究均表明,AMPK在脂质代谢及脂肪细胞成脂分化中扮演重要的角色。但在本试验中未发现生长肉兔脂肪中AMPK的蛋白磷酸化水平有显著变化,这一结果与肝脏中的发现相一致[18],但与骨骼肌中的结果不一致,限饲显著增加了骨骼肌中AMPK的蛋白磷酸化水平[29]。这些结果说明,不同部位的AMPK对饲粮中能量状态的改变程度不一样。
4 结论短期限饲显著增加了生长肉兔脂肪组织中CPT1、CPT2、PPARγ的基因表达,却显著降低了FAS、ACC、LPL的基因表达,表明生长肉兔脂肪组织中脂肪酸合成过程受到抑制,分解过程增加,细胞分化过程增加;此外,PPARα和GPR41信号通路可能参与了生长肉兔脂肪组织能量稳态的调节。
| [1] |
POLIVY J. Continuing education questionaire for RDs[J]. Journal of the American Dietetic Association, 1996, 96(6): 593-594. DOI:10.1016/S0002-8223(96)00162-9 |
| [2] |
JOLLY R A, CIURLIONIS R, MORFITT D, et al. Microvesicular steatosis induced by a short chain fatty acid:effects on mitochondrial function and correlation with gene expression[J]. Toxicologic Pathology, 2004, 32(Suppl.2): 19-25. |
| [3] |
LOVATTO P A, SAUVANT D, NOBLET J, et al. Effects of feed restriction and subsequent refeeding on energy utilization in growing pigs[J]. Journal of Animal Science, 2006, 84(12): 3329-3336. DOI:10.2527/jas.2006-048 |
| [4] |
GIDENNE T, PEREZ J M. Effect of dietary starch origin on digestion in the rabbit.2.Starch hydrolysis in the small intestine, cell wall degradation and rate of passage measurements[J]. Animal Feed Science and Technology, 1993, 42(3/4): 249-257. |
| [5] |
ROMMERS J M, MEIJERHOF R, NOORDHUIZEN J P, et al. Effect of feeding program during rearing and age at first insemination on performances during subsequent reproduction in young rabbit does[J]. Reproduction Nutrition Development, 2004, 44(4): 321-332. DOI:10.1051/rnd:2004037 |
| [6] |
De Blas J C. Nutritional impact on health and performance in intensively reared rabbits[J]. Animal, 2013, 7(Suppl.1): 102-111. |
| [7] |
TÜMOVÁ E, VOLEK Z, CHODOVÁ D, et al. The effect of 1-week feed restriction on performance, digestibility of nutrients and digestive system development in the growing rabbit[J]. Animal, 2016, 10(1): 1-9. DOI:10.1017/S1751731115001810 |
| [8] |
GIDENNE T, COMBES S, FEUGIER A, et al. Feed restriction strategy in the growing rabbit.2.Impact on digestive health, growth and carcass characteristics[J]. Animal, 2009, 3(4): 509-515. DOI:10.1017/S1751731108003790 |
| [9] |
GIDENNE T, FEUGIER A. Feed restriction strategy in the growing rabbit.1.Impact on digestion, rate of passage and microbial activity[J]. Animal, 2009, 3(4): 501-508. DOI:10.1017/S1751731108003789 |
| [10] |
MERSMANN H J. Lipoprotein and hormone-sensitive lipases in porcine adipose tissue[J]. Journal of Animal Science, 1998, 76(5): 1396-1404. DOI:10.2527/1998.7651396x |
| [11] |
GOBIN S, THUILLIER L, JOGL G, et al. Functional and structural basis of carnitine palmitoyltransferase 1A deficiency[J]. Journal of Biological Chemistry, 2003, 278(50): 50428-50434. DOI:10.1074/jbc.M310130200 |
| [12] |
WANG Y X, FRIED S R, PETERSEN R N, et al. Somatotropin regulates adipose tissue metabolism in neonatal swine[J]. Journal of Nutrition, 1999, 129(1): 139-145. DOI:10.1093/jn/129.1.139 |
| [13] |
LIU L, SONG Z G, JIAO H C, et al. Glucocorticoids increase NPY gene expression via hypothalamic AMPK signaling in broiler chicks[J]. Endocrinology, 2014, 155(6): 2190-2198. DOI:10.1210/en.2013-1632 |
| [14] |
WANG X J, XU S H, LIU L, et al. Dietary fat alters the response of hypothalamic neuropeptide Y to subsequent energy intake in broiler chickens[J]. Journal of Experimental Biology, 2016, 220(4): 607-614. |
| [15] |
TAKAHASHI Y, IDE T. Effect of dietary fats differing in degree of unsaturation on gene expression in rat adipose tissue[J]. Annals of Nutrition and Metabolism, 1999, 43(2): 86-97. DOI:10.1159/000012772 |
| [16] |
张慧, 徐良梅, 牛树鹏, 等.肉种鸡产蛋中期饲粮能量限饲对子代脂肪代谢的影响[C]//中国畜牧兽医学会动物营养学分会第十一次全国动物营养学术研讨会.长沙: 中国畜牧兽医学会, 2012. http://cpfd.cnki.com.cn/Article/CPFDTOTAL-SEKM201210001421.htm
|
| [17] |
DEBERARDINIS R J, LUM J J, THOMPSON C B. Phosphatidylinositol 3-kinase-dependent modulation of carnitine palmitoyltransferase 1A expression regulates lipid metabolism during hematopoietic cell growth[J]. Journal of Biological Chemistry, 2006, 281(49): 37372-37380. DOI:10.1074/jbc.M608372200 |
| [18] |
庄君英.早期和后期限饲对肉鸡脂肪代谢的影响[D].硕士学位论文.南京: 南京农业大学, 2007. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1215493
|
| [19] |
FEIGE J N, GELMAN L, MICHALIK L, et al. From molecular action to physiological outputs:peroxisome proliferator-activated receptors are nuclear receptors at the crossroads of key cellular functions[J]. Progress in Lipid Research, 2006, 45(2): 120-159. DOI:10.1016/j.plipres.2005.12.002 |
| [20] |
杨智, 刘昭前. PPARγ在脂肪细胞分化和糖脂代谢中的作用[J]. 临床与病理杂志, 2008, 28(1): 14-18. DOI:10.3969/j.issn.1673-2588.2008.01.004 |
| [21] |
FIDOAMORE A, CRISTIANO L, LAEZZA C, et al. Energy metabolism in glioblastoma stem cells:PPARα a metabolic adaptor to intratumoral microenvironment[J]. Oncotarget, 2017, 8(65): 108430-108450. |
| [22] |
ZAIBI M S, STOCKER C J, O'DOWD J, et al. Roles of GPR41 and GPR43 in leptin secretory responses of murine adipocytes to short chain fatty acids[J]. FEBS Letters, 2010, 584(11): 2381-2386. DOI:10.1016/j.febslet.2010.04.027 |
| [23] |
KIMURA I, INOUE D, MAEDA T, et al. Short-chain fatty acids and ketones directly regulate sympathetic nervous system via G protein-coupled receptor 41(GPR41)[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(19): 8030-8035. DOI:10.1073/pnas.1016088108 |
| [24] |
FU C Y, LIU L, GAO Q, et al. Cloning, molecular characterization, and spatial and developmental expression analysis of GPR41 and GPR43 genes in New Zealand rabbits[J]. Animal, 2017, 11(10): 1798-1806. DOI:10.1017/S175173111700043X |
| [25] |
LI G L, YAO W, JIANG H L. Short-chain fatty acids enhance adipocyte differentiation in the stromal vascular fraction of porcine adipose tissue[J]. Journal of Nutrition, 2014, 144(12): 1887-1895. DOI:10.3945/jn.114.198531 |
| [26] |
MCFADDEN J W, CORL B A. Activation of AMP-activated protein kinase(AMPK)inhibits fatty acid synthesis in bovine mammary epithelial cells[J]. Biochemical and Biophysical Research Communications, 2009, 390(3): 388-393. DOI:10.1016/j.bbrc.2009.09.017 |
| [27] |
DAGON Y, AVRAHAM Y, BERRY E M. AMPK activation regulates apoptosis, adipogenesis, and lipolysis by eIF2α in adipocytes[J]. Biochemical and Biophysical Research Communications, 2006, 340(1): 43-47. DOI:10.1016/j.bbrc.2005.11.159 |
| [28] |
HUANG B, YUAN H D, KIM D Y, et al. Cinnamaldehyde prevents adipocyte differentiation and adipogenesis via regulation of peroxisome proliferator-activated receptor-γ (PPARγ) and AMP-activated protein kinase (AMPK) pathways[J]. Journal of Agricultural and Food Chemistry, 2011, 59(8): 3666-3673. DOI:10.1021/jf104814t |
| [29] |
HU X Y, LIU L, SONG Z G, et al. Effects of feed deprivation on the AMPK signaling pathway in skeletal muscle of broiler chickens[J]. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 2016, 191: 146-154. DOI:10.1016/j.cbpb.2015.10.007 |




