2. 广东省农业科学院动物科学研究所, 农业部华南动物营养与饲料重点实验室, 畜禽育种国家重点实验室, 广东省动物育种与营养公共实验室, 广东省畜禽育种与营养研究重点实验室, 广州 510640
2. State Key Laboratory of Livestock and Poultry Breeding, Ministry of Agriculture Key Laboratory of Animal Nutrition and Feed Science in South China, Guangdong Public Laboratory of Animal Breeding and Nutrition, Guangdong Key Laboratory of Animal Breeding and Nutrition, Institute of Animal Science, Guangdong Academy of Agricultural Sciences, Guangzhou 510640, China
断奶常常会使仔猪面临环境、营养等方面的应激,伴随着仔猪胃肠道生理、微生物和免疫的巨大改变, 表现为采食量降低、体重减少、饲料消化能力降低等[1]。过去常常运用抗生素作为生长促进剂来克服此类问题和减少经济损失。然而,大量使用抗生素会带来药物残留、细菌耐药性等负面影响,禁抗或限抗已势在必行,因此,寻找抗生素替代物成为养殖业的迫切任务。益生菌制剂是公认的比较有效的抗生素替代物的选择之一,是一类当摄入足够量时对宿主有益的活性微生物[2]。大量研究表明,在仔猪饲粮中添加益生菌能提高仔猪生长性能(提高仔猪平均日增重、平均日采食量和饲料转化率等)[3],可以推测,益生菌在营养物质吸收方面有促进作用。一方面,益生菌可提高仔猪或生长猪氮(N)全消化道表观消化率(ATTD)[4]和粗蛋白质、粗脂肪、粗纤维、粗灰分、钙、磷等几大营养物质的消化率[5];另一方面,益生菌又可通过提高肠道消化酶的活性来促进营养物质的消化吸收[6]。但是,益生菌在体内通过何种分子机制促进肠道营养物质代谢鲜有报道。本课题前期的试验表明,罗伊氏乳杆菌LR1(L. reuteri LR1)可提高仔猪断奶后1~14 d的生长性能[7],因此,我们假设,罗伊氏乳杆菌可能通过促进仔猪肠道营养物质转运载体的表达,从而加快营养物质的吸收,进而提高生长性能。本试验拟研究罗伊氏乳杆菌LR1对肠道中胃肠激素、营养物质代谢过程中合成和转运相关的转运载体和关键酶的调控作用,来探讨罗伊氏乳杆菌对仔猪肠道营养物质转运吸收功能的影响,以期为罗伊氏乳杆菌在养猪生产中的应用提供科学依据。
1 材料与方法 1.1 试验材料本试验所用益生菌制剂为罗伊氏乳杆菌LR1,前期由广东省农业科学院动物科学研究所分离筛选并鉴定,符合作为猪益生菌饲料添加剂的条件[8]。罗伊氏乳杆菌LR1经喷雾干燥制成粉剂,以便后期在饲粮中混合。本试验所用抗生素为喹乙醇(olaquindox)和金霉素(aureomycin),有效成分含量分别为50%和20%。
1.2 试验动物与试验设计试验采用单因素试验设计,选取144头杜×长×大21日龄断奶仔猪[初始体重为(6.49±0.01) kg], 随机分配至3个组:对照组(CON),饲喂基础饲粮;抗生素组(OA),饲喂基础饲粮+100 mg/kg喹乙醇+75 mg/kg金霉素;罗伊氏乳杆菌组(LR1),饲喂基础饲粮+5.0×1010 CFU/kg罗伊氏乳杆菌LR1。每组8个重复,每个重复6头仔猪,试验期为14 d。
1.3 基础饲粮与饲养管理基础饲粮参照NRC(2012)中7~11 kg生长阶段猪推荐营养需要配制,其组成及营养水平见表 1,基础饲粮制成粉料。试验地点位于广东省农业科学院动物科学研究所试验场,栏舍为全封闭建筑带有温控装置,仔猪圈养于离地的漏缝栏,配备饮水头和可控流量喂料器,以便仔猪自由采食和饮水。各组仔猪按一致的免疫程序进行疫苗接种、保健等。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
试验第14天08:00,从每个组的每个重复中随机选取1头仔猪,前腔静脉采血5 mL后分离血清,保存于-20 ℃冰箱,用于血清生化指标测定;麻醉后完全放血处死,剖开腹腔,完整取出消化道,分离内脏,用细线按解剖学理论将小肠分为十二指肠、空肠和回肠;取上述中段肠段约2 cm,用冰冷的磷酸盐缓冲液(PBS)冲洗内容物,用滤纸吸干水分后置于无菌EP管,液氮速冻,其后转移至-80 ℃冰箱保存。
1.5 测定指标和方法 1.5.1 血清生化指标测定血清中白蛋白(ALB)、球蛋白(GLB)、总蛋白(TP)、尿素氮(UN)、葡萄糖(GLU)的含量和谷草转氨酶(AST)、谷丙转氨酶(ALT)、碱性磷酸酶(ALP)、乳酸脱氢酶(LDH)的活性。上述血生化清指标采用试剂盒法检测,按照试剂盒附带方法进行。
1.5.2 实时荧光定量PCR检测胃肠激素和肠道营养物质转运载体mRNA表达 1.5.2.1 肠道组织总RNA提取和cDNA合成将-80 ℃保存的各肠段放于预先灭菌的研钵中,加入液氮后研磨成粉末状。取适量粉末至无菌EP管中,用Trizol法提取肠道组织总RNA,然后将总RNA用试剂盒法(TaKaRa,日本)反转录为cDNA,将cDNA稀释成适当浓度即可进行实时荧光定量PCR(qPCR)。
1.5.2.2 qPCR引物设计在NCBI上获取目的基因序列,运用Prime Primer 5软件设计引物,引物合成由上海生工生物工程有限公司完成,引物序列及其他参数见表 2。
|
|
表 2 qPCR引物参数 Table 2 Primer parameters for qPCR |
qPCR反应体系组成:总体积10 μL,其中iTaq Universal SYBR Green Supermix为5 μL,上、下游引物(10 μmol/L)各0.5 μL,cDNA模板4 μL。每个样品2个重复孔。
扩增程序设定:95.0 ℃预变性30 s; 95.0 ℃变性15 s;退火30 s;72.0 ℃延伸30 s;40个循环,之后进行熔解曲线分析。
1.6 数据处理采用SPSS 18.0软件的单因素方差分析(one-way ANOVA)模块进行数据分析, 以最小显著性差异(LSD)法进行多重比较,显著水平为P < 0.05。结果表示为平均值±标准误(mean±SE)。
2 结果 2.1 罗伊氏乳杆菌LR1对断奶仔猪血清生化指标的影响从表 3可以看出,试验第14天,与对照组相比,饲粮添加抗生素可显著升高血清中葡萄糖含量而显著降低尿素氮含量(P < 0.05),对其他血清生化指标无显著影响(P > 0.05);饲粮添加罗伊氏乳杆菌LR1对血清生化指标无显著影响(P > 0.05),但有降低尿素氮含量的趋势,使尿素氮含量降低29.11%(P > 0.05)。
|
|
表 3 罗伊氏乳杆菌LR1对断奶仔猪血清生化指标的影响 Table 3 Effects of L. reuteri LR1 on serum biochemical indexes of weaned piglets |
由图 1可以看出,与对照组相比,饲粮添加罗伊氏乳杆菌LR1显著提高了空肠胆囊收缩素(CCK)的mRNA表达量(P < 0.05),但显著降低了回肠CCK的mRNA表达量(P < 0.05);与抗生素组相比,饲粮添加罗伊氏乳杆菌LR1显著提高了十二指肠CCK的mRNA表达量(P < 0.05)。与对照组相比,饲粮添加罗伊氏乳杆菌LR1和抗生素都可显著提高十二指肠胃动素(MLN)的mRNA表达量(P < 0.05),且添加抗生素还可显著降低空肠MLN的mRNA表达量(P < 0.05)。
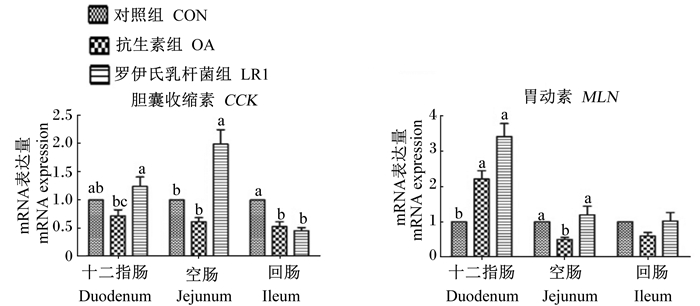
|
数据柱形标注无字母或相同字母表示差异不显著(P > 0.05),不同小写字母表示差异显著(P < 0.05)。下图同。 Value columns with no letters or the same letters mean no significant difference (P > 0.05), while with different small letters mean significant difference (P < 0.05). The same as below. 图 1 罗伊氏乳杆菌LR1对断奶仔猪肠道胃肠激素mRNA表达的影响 Figure 1 ffects of L. reuteri LR1 on mRNA expressions of intestinal gastrointestinal hormones of weaned piglets |
由图 2可以看出,与对照组相比,饲粮添加罗伊氏乳杆菌LR1显著提高了十二指肠氨基酸转运载体Na+依赖性谷氨酰胺载体2(ASCT2)、阳离子氨基酸运载体1(CAT1)、小肽转运体1(PepT1)和空肠中性和碱性氨基酸转运载体(rBAT)以及空肠与回肠y+L氨基酸转运体1(y+LAT1)的mRNA表达量(P < 0.05),但显著降低了十二指肠y+LAT1和回肠CAT1的mRNA表达量(P < 0.05);饲粮添加抗生素提高了空肠y+LAT1、CAT1、PepT1以及空肠与回肠哺乳动物雷帕霉素靶蛋白(mTOR)的mRNA表达量(P < 0.05),显著降低了十二指肠和回肠PepT1、空肠ASCT2的mRNA表达量(P < 0.05)。
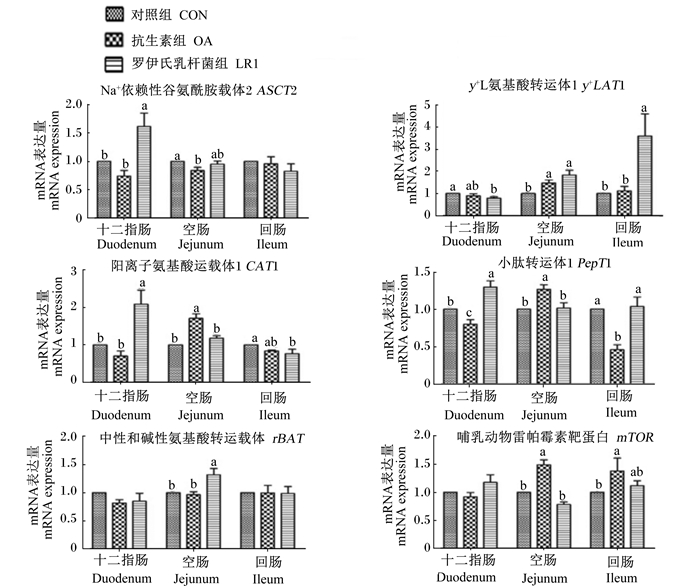
|
图 2 罗伊氏乳杆菌LR1对断奶仔猪肠道氨基酸转运载体mRNA表达的影响 Figure 2 Effects of L. reuteri LR1 on mRNA expressions of intestinal amino acid transporters of weaned piglets |
关于肠道脂肪酸合成转运载体和关键酶,由图 3可以看出, 与对照组相比,饲粮添加罗伊氏乳杆菌LR1可显著提高十二指肠小肠脂肪酸结合蛋白(I-FABP)、乙酰辅酶A羧化酶α(ACCα)、脂肪酸合成酶(FASN)和十二指肠与空肠脂肪酸结合蛋白3(FABP3)以及十二指肠、空肠与回肠过氧化物体增殖物激活受体γ(PPARγ)的mRNA表达量(P < 0.05),但显著降低了空肠I-FABP和回肠FABP3、固醇调节元件结合蛋白1(SREBP1)的mRNA表达量(P < 0.05);饲粮添加抗生素显著提高了空肠ACCα的mRNA表达量(P < 0.05),但显著降低了回肠FABP3和SREBP1的mRNA表达量(P < 0.05)。
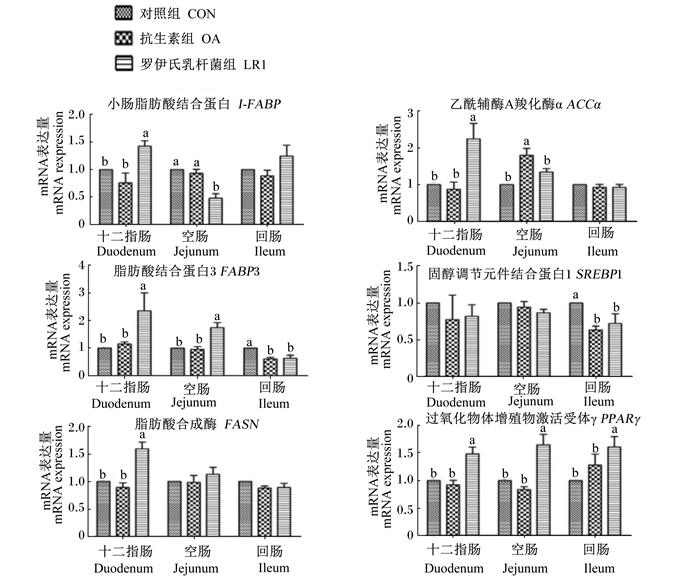
|
图 3 罗伊氏乳杆菌LR1对断奶仔猪肠道脂肪酸合成转运载体和关键酶mRNA表达的影响 Figure 3 Effects of L. reuteri LR1 on mRNA expressions of intestinal transporters and key enzymes related with fatty acid synthesis of weaned piglets |
如图 4所示,与对照组相比,饲粮添加罗伊氏乳杆菌LR1可显著提高空肠和回肠钠-葡萄糖协同转运蛋白1(SGLT1)的mRNA表达量(P < 0.05),饲粮添加抗生素则显著提高了十二指肠SGLT1、钠-葡萄糖协同转运蛋白3(SGLT3)的mRNA表达量(P < 0.05)。但是,与对照组相比,饲粮添加罗伊氏乳杆菌LR1显著降低了空肠葡萄糖转运体2(GLUT2)的mRNA表达量(P < 0.05),同时发现饲粮添加抗生素显著降低了十二指肠GLUT2、葡萄糖转运体4(GLUT4)以及回肠GLUT2的mRNA表达量(P < 0.05)。
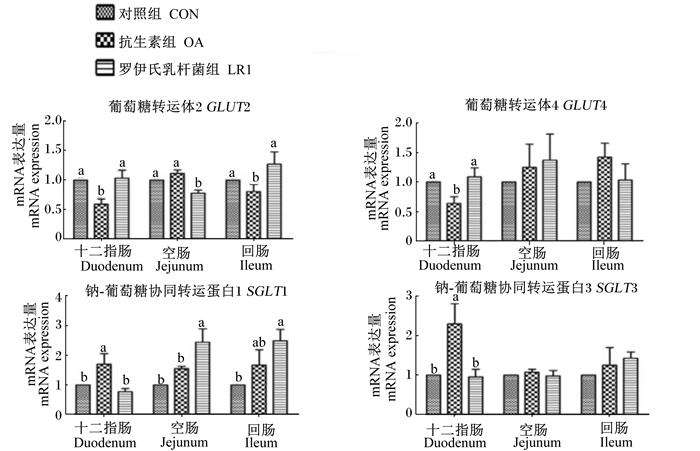
|
图 4 罗伊氏乳杆菌LR1对断奶仔猪肠道葡萄糖转运载体mRNA表达的影响 Figure 4 Effects of L. reuteri LR1 on mRNA expressions of intestinal glucose transporters of weaned piglets |
血清生化指标通常被用来反映体内器官功能和新陈代谢的变化情况,例如,血清总蛋白含量可在一定程度上反映机体对饲粮蛋白质的利用情况,球蛋白含量可反映体内的抗体水平[9];尿素氮作为蛋白质代谢的主要产物之一,其含量可反映蛋白质利用效率或氨基酸的平衡状态,若血清尿素氮含量较低,表明氮的利用率较高,蛋白质合成代谢旺盛,而分解代谢弱,对蛋白质沉积有利[10]。本研究中,饲粮添加抗生素能使血清尿素氮含量显著降低,此外,饲粮添加罗伊氏乳杆菌LR1也能使血清尿素氮含量在一定程度上降低,表明仔猪体内蛋白质的合成代谢大于分解代谢,蛋白质获得沉积。这个结果部分解释了动物试验中罗伊氏乳杆菌组和抗生素组仔猪平均日增重获得提高的结果。血清葡萄糖的两大来源为肠道吸收和肝糖原的分解,而禁食情况下葡萄糖来源主要依靠后者。本试验结果表明,饲粮添加抗生素能显著提高禁食情况下血清葡萄糖含量,表明该组仔猪具有更高的能量代谢水平,可能与仔猪试验期内采食量显著增加有关;此外,饲粮添加罗伊氏乳杆菌LR1对血清葡萄糖含量也有一定的提高,但差异不显著,以上结果与Zhou等[9]的报道相似。
3.2 罗伊氏乳杆菌LR1对断奶仔猪肠道胃肠激素的影响CCK是一种多肽激素,由胃肠道黏膜Ⅰ型细胞分泌,具有收缩胆囊和促进胰脏消化酶分泌的作用[11]。本试验结果表明,罗伊氏乳杆菌LR1可提高空肠CCK mRNA的表达,此外,与抗生素组相比,饲粮添加罗伊氏乳杆菌LR1能显著提高十二指肠CCK mRNA的表达,可能引起更多胆汁和胰腺消化酶的释放,表明罗伊氏乳杆菌LR1比抗生素具有更强的促化学消化能力,可能是罗伊氏乳杆菌LR1发酵产生的代谢产物所致。
MLN是由小肠前段嗜铬细胞产生的一种激素,可刺激胃肠道的蠕动,特别是胃窦和十二指肠前段,参与消化间期肠道运动。研究表明,MLN与动物的采食调节有关,还参与了消化间期胃肠动力调节[12]。本试验结果表明,饲粮添加罗伊氏乳杆菌LR1或抗生素均可显著提高十二指肠MLN mRNA的表达,说明这两者都可以促进胃肠道的蠕动和分节运动,即促进了物理性消化,提高了肠道对营养物质的吸收利用率。
3.3 罗伊氏乳杆菌LR1对断奶仔猪肠道氨基酸转运的影响蛋白质、糖类和脂肪进入小肠后被分别分解为结构简单的游离氨基酸、单糖和脂肪酸,由相应的转运载体或其他形式吸收进入细胞以供机体利用[13]。本研究前期动物试验表明,罗伊氏乳杆菌LR1可提高断奶仔猪的平均日增重(提高22.73%),与抗生素的作用相似(平均日增重提高29.63%),改善了仔猪的生长性能[7]。因此我们推测,罗伊氏乳杆菌LR1可能通过促进营养转运载体mRNA的表达, 从而改善肠道营养物质的吸收功能。研究表明,植物乳杆菌(Lactobacillus plantarum)可促进猪上皮细胞氨基酸转运载体y+LAT1和CAT1的表达[14]。周响艳[15]发现,乳酸杆菌能显著提高猪十二指肠b0, +氨基酸转运体(b0, +AT)和y+LAT1 mRNA的表达。本研究结果表明,饲粮添加罗伊氏乳杆菌LR1显著提高了十二指肠ASCT2、CAT1、PepT1和空肠rBAT以及空肠与回肠y+LAT1 mRNA的表达,与上述研究结果一致,且与抗生素的作用相似,表明罗伊氏乳杆菌LR1可能促进氨基酸的吸收。但是,饲粮添加罗伊氏乳杆菌LR1显著降低了十二指肠y+LAT1和回肠CAT1 mRNA的表达,可能由于CAT1 mRNA的表达量在不同肠段存在差异,也可能与肠腔中的氨基酸浓度和需要水平有关[16]。然而,有关罗伊氏乳杆菌LR1如何调节肠道氨基酸转运载体的表达的机理仍有待进一步研究。
3.4 罗伊氏乳杆菌LR1对断奶仔猪肠道脂肪酸合成的影响饲粮脂肪主要由甘油三酯(TG)组成,TG在肠道内被消化为脂肪酸和甘油单酯,然后被肠上皮细胞吸收并重新合成TG,TG被包装成乳糜微粒,运输到外周组织以供利用[17]。脂肪合成发生于胞浆中,涉及很多关键的转运载体或关键酶,例如,脂肪酸结合蛋白(FABP)可催化肠道游离脂肪酸进入细胞,ACCα则是脂肪酸合成第1阶段的限速酶,而FASN则是催化脂肪链合成的关键酶。本研究显示,罗伊氏乳杆菌LR1能显著上调十二指肠I-FABP、FABP3和空肠FABP3 mRNA的表达,以参与脂肪酸的转运。前人报道,芽孢杆菌(Bacillus subtilis)能使猪皮下脂肪组织中ACCα和FASN的mRNA表达上调[18],在本研究中也发现二者的mRNA表达量在罗伊氏乳杆菌LR1组仔猪十二指肠中被显著提高,与上述研究一致,说明罗伊氏乳杆菌LR1可促进脂肪酸转运和细胞内脂肪酸从头合成相关基因的表达,从而加快肠道脂肪酸合成。
SREBP1和PPARγ是重要的调控脂肪酸合成的转录因子和核转录基因[19]。研究发现,约氏乳杆菌(Lactobacillus johnsonii)可提高肉鸡肝脏PPARγ mRNA的表达,同时发现固醇调节元件结合蛋白1c(SREBP1c)mRNA表达量被下调[20]。本研究结果类似于此,罗伊氏乳杆菌LR1对小肠3个肠段的PPARγ mRNA的表达都有显著提高的作用,而SREBP1 mRNA的表达量在各组小肠前段没有显著差异,在回肠其mRNA表达量被降低。因此,我们推测PPARγ是罗伊氏乳杆菌组仔猪肠道脂肪酸合成最重要的调控因子。
小肠组织对饲粮中脂肪含量的适应性反映在其对脂肪吸收能力的变化,尤其是通过脂肪结合蛋白的协同诱导[21]。脂肪的消化吸收多数发生于小肠前部[13]。因此,前文提到,罗伊氏乳杆菌LR1提高了CCK的mRNA表达量,引起胆囊收缩并释放胆汁、胰腺释放消化酶。经过小肠前段的脂肪被胆汁(胆盐)乳化为乳糜微粒,也被胰腺所分泌的脂肪酶消化为脂肪酸等产物。因此,为了适应肠道中脂肪酸含量的提高,小肠前段负责脂肪酸转运的I-FABP、FABP3的mRNA表达量提高,更多的脂肪酸进入肠上皮细胞,在PPARγ调控下和ACCα、FASN等关键酶参与下进行TG合成。同样,小肠后段对肠道脂肪酸的变少产生适应,因此我们观察到,罗伊氏乳杆菌LR1对仔猪回肠脂肪酸合成相关基因表达的影响不大,甚至出现负调控。本研究结果表明,罗伊氏乳杆菌LR1也对仔猪肠道葡萄糖转运产生一定影响。Faseleh等[22]的研究显示乳酸菌可使肉鸡肠道GLUT2、葡萄糖转运体5(GLUT5)、SGLT1、钠-葡萄糖协同转运蛋白4(SGLT4)等葡萄糖转运载体的mRNA表达上调,也有研究表明用植物乳杆菌预处理后进行大肠杆菌攻毒的猪肠道上皮细胞中SGLT1的mRNA表达显著上调[14]。本研究中,罗伊氏乳杆菌LR1提高了空肠和回肠SGLT1 mRNA的表达,但降低了GLUT2 mRNA在空肠的表达,与上述研究部分不同,可能由于试验所用菌株和试验对象不同造成的。
mTOR信号通路在细胞调控蛋白质合成中发挥重要作用[23],本试验发现抗生素使空回肠mTOR的表达上调,表明抗生素可能通过促进mTOR信号通路的激活,从而促进蛋白质的合成,其机制需要进一步验证。本研究发现抗生素对十二指肠葡萄糖转运体SGLT1、SGLT3 mRNA的表达有促进作用;此外,抗生素提高了空肠氨基酸转运载体y+LAT1、CAT1、PepT1 mRNA的表达。研究表明,在仔猪饲粮中添加恩拉霉素可以促进仔猪肠道SGLT1和PepT1 mRNA的表达[24],结果与本研究一致,提示抗生素可促进空肠小肽和氨基酸的吸收。
正常的肠黏膜结构是肠道发挥正常消化吸收功能的前提条件之一。一般认为,肠黏膜绒毛高度增加与表面积增大可使小肠上的转运载体与营养物质的接触面积增大,有利于营养物质吸收[25]。本试验前期已经发现,罗伊氏乳杆菌LR1改善了仔猪肠道形态,表现为更高的回肠绒毛高度以及空肠和回肠绒毛高度和隐窝深度比值[7]。周响艳[15]的研究认为,乳酸菌改善小肠绒毛生长状况的作用与乳酸菌对肠道营养物质转运载体mRNA表达的上调有关。另据研究表明,氨基酸转运载体的上调可能有助于肠道形态的完整及营养物质的吸收,进而有利于动物生长[26]。因此,罗伊氏乳杆菌LR1对仔猪肠道营养物质转运载体mRNA表达的调控作用从另一方面证实罗伊氏乳杆菌LR1改善了肠道黏膜形态的作用,进而有利于营养物质的吸收。
4 结论① 饲粮中添加5.0×1010 CFU/kg罗伊氏乳杆菌LR1可促进断奶仔猪肠道对营养物质的消化能力。
② 罗伊氏乳杆菌LR1和抗生素对仔猪肠道营养物质转运载体mRNA表达有相似的调控作用,可促进氨基酸吸收和脂肪酸合成,因此,罗伊氏乳杆菌LR1可考虑作为抗生素替代物以改善仔猪生长性能。
| [1] |
PLUSKE J R. Feed-and feed additives-related aspects of gut health and development in weanling pigs[J]. Journal of Animal Science and Biotechnology, 2013, 4(1): 1. DOI:10.1186/2049-1891-4-1 |
| [2] |
PRIETO M L, O'SULLIVAN L, TAN S P, et al. Evaluation of the efficacy and safety of a marine-derived Bacillus strain for use as an in-feed probiotic for newly weaned pigs[J]. PLoS One, 2014, 9(2): e88599. DOI:10.1371/journal.pone.0088599 |
| [3] |
HOU C L, ZENG X F, YANG F J, et al. Study and use of the probiotic Lactobacillus reuteri in pigs:a review[J]. Journal of Animal Science and Biotechnology, 2015, 6: 14. DOI:10.1186/s40104-015-0014-3 |
| [4] |
MENG Q W, YAN L, AO X, et al. Influence of probiotics in different energy and nutrient density diets on growth performance, nutrient digestibility, meat quality, and blood characteristics in growing-finishing pigs[J]. Journal of Animal Science, 2010, 88(10): 3320-3326. DOI:10.2527/jas.2009-2308 |
| [5] |
黄金华, 梁珠民, 宁国信, 等. 复合益生菌制剂对断奶仔猪的生长性能、养分消化率和血清生化指标的影响[J]. 饲料工业, 2014, 35(12): 27-31. |
| [6] |
杨凤娟, 曾祥芳, 谯仕彦. 罗伊氏乳杆菌I5007对新生仔猪肠道形态、二糖酶活性和紧密连接蛋白表达的影响[J]. 中国农业科学, 2014, 47(22): 4506-4515. DOI:10.3864/j.issn.0578-1752.2014.22.016 |
| [7] |
YI H B, YANG G, XIONG Y X, et al. Effects of Lactobacillus reuteri LR1 on the growth performance, intestinal morphology, and intestinal barrier function in weaned pigs[J]. Journal of Animal Science, 2018, 96(6): 2342-2351. DOI:10.1093/jas/sky129 |
| [8] |
WANG Z L, WANG L, CHEN Z, et al. In vitro evaluation of swine-derived Lactobacillus reuteri:probiotic properties and effects on intestinal porcine epithelial cells challenged with enterotoxigenic Escherichia coli K88[J]. Journal of Microbiology and Biotechnology, 2016, 26(6): 1018-1025. DOI:10.4014/jmb.1510.10089 |
| [9] |
ZHOU H, WANG C Z, YE J Z, et al. Effects of dietary supplementation of fermented Ginkgo biloba L.residues on growth performance, nutrient digestibility, serum biochemical parameters and immune function in weaned piglets[J]. Animal Science Journal, 2015, 86(8): 790-799. DOI:10.1111/asj.2015.86.issue-8 |
| [10] |
LI Y H, WEI H K, LI F N, et al. Regulation in free amino acid profile and protein synthesis pathway of growing pig skeletal muscles by low-protein diets for different time periods[J]. Journal of Animal Science, 2016, 94(12): 5192-5205. DOI:10.2527/jas.2016-0917 |
| [11] |
杨茹洁, 臧建军, 岳斌. 胆囊收缩素的研究进展及其在动物生产中的应用[J]. 畜禽业, 2007(214): 18-19. |
| [12] |
ASAKAWA A, INUI A, MOMOSE K, et al. Motilin increases food intake in mice[J]. Peptides, 1998, 19(6): 987-990. DOI:10.1016/S0196-9781(97)00477-4 |
| [13] |
陈守良. 动物生理学[M]. 3版. 北京: 北京大学出版社, 2015.
|
| [14] |
吴云鹏.植物乳杆菌调节猪肠上皮细胞屏障功能和转运载体的研究[D].博士学位论文.广州: 华南农业大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10564-1016923607.htm
|
| [15] |
周响艳.猪肠道碱性氨基酸转运载体mRNA的表达及营养调控[D].博士学位论文.广州: 华南农业大学, 2007. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1174033
|
| [16] |
周响艳, 左建军, 职爱民, 等. 猪肠道碱性氨基酸转运载体(CAT1)mRNA表达的组织特异性和发育性变化[J]. 畜牧兽医学报, 2008, 39(2): 170-175. DOI:10.3321/j.issn:0366-6964.2008.02.007 |
| [17] |
LAGAKOS W S, GAJDA A M, AGELLON G L, et al. Different functions of intestinal and liver-type fatty acid-binding proteins in intestine and in whole body energy homeostasis[J]. American Journal of Physiology:Gastrointestinal and Liver Physiology, 2011, 300(5): G803-G814. DOI:10.1152/ajpgi.00229.2010 |
| [18] |
CUI C, SHEN C J, JIA G, et al. Effect of dietary Bacillus subtilis on proportion of Bacteroidetes and Firmicutes in swine intestine and lipid metabolism[J]. Genetics and Molecular Research, 2013, 12(2): 1766-1776. DOI:10.4238/2013.May.23.1 |
| [19] |
BIONAZ M, LOOR J J. Gene networks driving bovine milk fat synthesis during the lactation cycle[J]. BMC Genomics, 2008, 9: 366. DOI:10.1186/1471-2164-9-366 |
| [20] |
WANG H S, NI X Q, QING X D, et al. Live probiotic Lactobacillus johnsonii BS15 promotes growth performance and lowers fat deposition by improving lipid metabolism, intestinal development, and gut microflora in broilers[J]. Frontiers in Microbiology, 2017, 8: 1073. DOI:10.3389/fmicb.2017.01073 |
| [21] |
BUTTET M, TRAYNARD V, TRAN T T, et al. From fatty-acid sensing to chylomicron synthesis:role of intestinal lipid-binding proteins[J]. Biochimie, 2014, 96: 37-47. DOI:10.1016/j.biochi.2013.08.011 |
| [22] |
FASELEH J M, WESAM A Y, SHOKRYAZDAN P, et al. Dietary supplementation of a mixture of Lactobacillus strains enhances performance of broiler chickens raised under heat stress conditions[J]. International Journal of Biometeorology, 2016, 60(7): 1099-1110. DOI:10.1007/s00484-015-1103-x |
| [23] |
姜伟, 王修启, 束刚, 等. 雷帕霉素靶蛋白(mTOR)结构功能及其对骨骼肌蛋白质合成影响的研究进展[J]. 中国畜牧兽医, 2010, 37(6): 21-25. |
| [24] |
罗亚波.饲粮中添加及停用恩拉霉素对断奶仔猪生长性能和消化生理的影响[D].硕士学位论文.雅安: 四川农业大学, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10626-2009258679.htm
|
| [25] |
SHIRAZI-BEECHEY S P, MORAN A W, BATCHELOR D J, et al. Glucose sensing and signalling; regulation of intestinal glucose transport[J]. Proceedings of the Nutrition Society, 2011, 70(2): 185-193. DOI:10.1017/S0029665111000103 |
| [26] |
YIN J, REN W K, DUAM J L, et al. Dietary arginine supplementation enhances intestinal expression of SLC7A7 and SLC7A1 and ameliorates growth depression in mycotoxin-challenged pigs[J]. Amino Acids, 2014, 46(4): 883-892. DOI:10.1007/s00726-013-1643-5 |




