在现代规模化养殖生产中,为了促进动物的快速生长,防治动物疾病,抗生素在畜禽生产中被广泛应用,甚至滥用。抗生素使用带来的抗生素残留、细菌耐药性等问题,给人类的生存环境和身体健康带来了巨大的威胁。鉴于滥用抗生素造成的危机,许多国家和地区都禁止或限制在饲料中添加抗生素。因此,开发绿色、高效、无污染的安全饲料添加剂成为当前养殖业发展的必然趋势。
植物提取物具有绿色、无污染、低毒、易降解等特点,是一类最常用且具有巨大潜力的抗生素替代物,近年来得到了广泛的研究和应用。博落回生物碱具有较强的抗菌消炎作用[1];而多糖能够促进自由基的清除,对动物机体的特异性免疫、非特异性免疫以及细胞免疫、体液免疫均有重要影响[2]。研究发现,博落回血根碱能抑制植物性细菌、霉菌和病毒的增殖[3]。郁建生[4]报道,博落回注射液对禽巴氏杆菌、大肠杆菌和鸡白痢沙门氏菌具有较好的抑菌效果,对禽霍乱和仔猪白痢亦具有较好的治疗效果。孙波等[5]研究发现,饲粮中添加黄芪多糖能降低49日龄肉鸡盲肠中大肠杆菌和沙门氏菌数量,增加乳酸杆菌和双歧杆菌数量。但是,目前关于茶籽多糖和博落回生物碱对畜禽特别是肉鸡肠道健康的研究较少。因此,本试验旨在研究茶籽多糖和博落回生物碱对黄羽肉鸡肠道健康的影响及博落回血根碱的抑菌效果和最低抑菌浓度(MIC),为茶籽多糖和博落回生物碱在畜禽肠道健康上的研究及其在畜禽生产中的应用提供依据。
1 材料与方法 1.1 试验材料博落回生物碱:总碱含量为70%,其中血根碱占60%,白屈菜红碱占20%,由湖南中药提取工程研究中心提供;茶籽多糖:纯度为43.4%,由湖南农业大学食品科技学院油脂教研室提供;博落回血根碱:纯度约为40%,用20%甲醇配制浓度为9.6 mg/mL的溶液,由湖南中药提取工程研究中心提供;抗生素:前期为抗敌素,后期为黄霉素;青霉素钠:纯度为95%,用20%甲醇配制浓度为4.8 mg/mL的溶液。
试验菌株:金黄色葡萄球菌(Staphylococcus aureus)BNCC186335、大肠杆菌(Escherichia coil)BNCC336953、沙门氏菌(Salmonella paratyphi β)BNCC103169、巴氏杆菌(Pasteurella multocida)BNCC126487,均由湖南农业大学动物医学院提供。
1.2 试验设计 1.2.1 饲养试验选择同批次、遗传背景相同、发育正常的1日龄黄羽肉鸡750羽,随机分为5个组,每组6个重复,每个重复25只鸡。各组鸡的初始体重无显著差异(P>0.05)。采用单因子随机试验设计,对照组饲喂基础饲粮,试验组分别在基础饲粮中添加抗生素(1~28日龄为10 mg/kg抗敌素,29~56日龄为5 mg/kg黄霉素;抗生素组)、茶籽多糖(0.04%;多糖组)、博落回生物碱(1~28日龄为10 mg/kg,29~56日龄为20 mg/kg;博落回组)、茶籽多糖(0.04%)+博落回生物碱(1~28日龄为10 mg/kg,29~56日龄为20 mg/kg;多糖+博落回组)。抗生素的添加符合我国现行法律法规规定。试验鸡采用粉料饲喂。试验期56 d。
1.2.2 抑菌试验将已活化的4种细菌菌种分别接种于试管斜面培养基(蛋白胨10 g,牛肉膏10 g,氯化钠5 g,琼脂15~20 g,水1 000 mL,灭菌前调pH为7.2~7.4,121 ℃灭菌30 min),置恒温培养箱中37 ℃培养24 h。用接种环挑取一环菌体放入装有玻璃珠的生理盐水中,充分振摇,用血球记数板记数,调至107~108个/mL。
1.3 试验饲粮基础饲粮参照NRC(1994)和《鸡饲养标准》(NY/T 33—2004)中的肉鸡营养需要,选用玉米、豆粕等原料配制而成,其组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of basal diets (air-dry basis) |
试验鸡舍选用开放式,采用高低床平养,光照为14 h光明:10 h黑暗(14 L:10 D);1~7日龄30~33 ℃、8~14日龄27~29 ℃、15~21日龄24~26 ℃、22~28日龄22~23 ℃、29~56日龄20~21 ℃,保持正常温度,舍内采取锅炉控温,自然通风。定期打扫鸡舍卫生,相对湿度保持在55%~65%,自由饮水和采食,按常规程序免疫。
1.5 样品采集于56日龄早晨,分别从每个重复中选择1只接近该组平均体重的试验鸡,屠宰后取空肠内容物1 g,用于肠道微生物的测定;取2段2 cm长的空肠组织,用10%甲醛溶液固定,用于肠道形态结构的测定。
1.6 测定指标与方法 1.6.1 空肠形态结构将固定的标本经脱水→透明→浸蜡→包埋→修块→切片→展片→常规苏木精-伊红(HE)染色等处理后,制成石蜡切片;之后用100倍光镜(Motic AE67)随机选择多个非连续性视野观察切片,并挑选典型视野拍摄成图片,用DT2000通用图像分析软件2.0进行观察测量,测定空肠绒毛高度、隐窝深度,并计算绒毛高度/隐窝深度(V/C)。
1.6.2 空肠内容物中大肠杆菌和乳酸杆菌数量在无菌操作台中称取0.5 g左右的空肠内容物置于无菌试管中,加入无菌稀释液(生理盐水)4.5 mL,在磁力振荡器上振荡3~5 min,此液为10-1倍稀释液;离心后吸取上清液0.5 mL加入盛有4.5 mL无菌稀释液的另一个试管中进行10-2倍稀释;然后继续用无菌稀释液进行系列稀释(10-3~10-5)。分别从10-3、10-4、10-5倍稀释溶液中取0.1 mL接种到各培养基上,用涂布棒进行涂板。大肠杆菌采用伊红美蓝培养基(北京陆桥技术股份有限公司)培养,37 ℃有氧培养24 h后计数;乳酸杆菌采用乳酸杆菌培养基(北京陆桥技术股份有限公司)培养,37 ℃厌氧培养48 h后计数。样品菌落数计算公式如下:
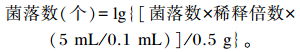
|
抑菌活性定性试验:采用琼脂扩散纸片法测定。倒好平板后,用灭菌棉签沾取菌悬液,涂满整个平板,倒置,干20 min;用镊子夹取滤纸片(己干热灭菌、直径7 mm)在待测液中浸湿,吸去多余的液体,顺次放在含菌平板上,每个平板各种待测物滤纸片各1片,20%甲醇溶剂对照滤纸片1片;细菌于37 ℃培养18~24 h,测定平皿内抑菌圈直径(D),重复4次。抑菌效果判断标准为:D≤8 mm为不敏感;8 < D≤13 mm为低度敏感;13 < D≤18 mm为中度敏感;D>18 mm为高度敏感。
MIC测定:采用试管液体二倍稀释法进行测定。将药液试管进行2倍稀释至第24管,每管加入菌液使其浓度为105 CFU/mL,同时平行进行前23管阴性和第24管阳性对照。于37 ℃恒温培养箱内培养24 h,以目测法和对照组比较法判断结果,以完全无细菌生长的最低药物浓度作为细菌对该药物的敏感度,即为该药物MIC。相同过程重复3次,求平均值。
1.7 数据处理与统计分析试验数据用Excel 2007软件进行初步处理后,采用SPSS 16.0软件的one-way ANOVA程序进行系统分析,组间差异显著者则采用Duncan氏法进行多重比较,P < 0.05为差异显著,P < 0.01为差异极显著。试验结果以“平均值±标准差”表示。
2 结果 2.1 空肠形态结构由表 2可知,与对照组和抗生素组相比,多糖组、博落回组和多糖+博落回组黄羽肉鸡的空肠绒毛高度和隐窝深度无显著差异(P>0.05)。多糖组、博落回组和多糖+博落回组的空肠V/C显著高于对照组(P < 0.05),与抗生素组无显著差异(P>0.05);空肠V/C在多糖组、博落回组和多糖+博落回组之间无显著差异(P>0.05)。
|
|
表 2 茶籽多糖和博落回生物碱对黄羽肉鸡空肠绒毛高度和隐窝深度的影响 Table 2 Effects of tea seed polysaccharide and Macleaya cordata alkaloids on villus height and crypt depth of jejunum of yellow-feathered broilers |
由表 3可知,多糖组、博落回组和多糖+博落回组黄羽肉鸡的空肠内容物中大肠杆菌数量与对照组和抗生素组相比无显著差异(P>0.05),但均低于对照组。与对照组和抗生素组相比,多糖组、博落回组和多糖+博落回组的空肠内容物中乳酸杆菌数量极显著升高(P < 0.01),但多糖组、博落回组和多糖+博落回组之间无显著差异(P>0.05)。
|
|
表 3 茶籽多糖和博落回生物碱对黄羽肉鸡空肠内容物中大肠杆菌和乳酸杆菌数量的影响 Table 3 Effects of tea seed polysaccharide and Macleaya cordata alkaloids on the numbers of Escherichia coil and Lactobacillus of jejunal contents of yellow-feathered broilers |
由表 4可知,博落回血根碱对4种试验菌株的抑菌圈直径分别为14、13、22和18 mm。结果表明,博落回血根碱对金黄色葡萄球菌和巴氏杆菌中度敏感,对大肠杆菌低度敏感,对沙门氏菌高度敏感。与青霉素钠相比,博落回血根碱除对巴氏杆菌的抑菌效果较弱之外,对其他3种试验菌株的抑菌效果都有不同程度的增强,特别是沙门氏菌。
|
|
表 4 博落回血根碱对试验菌株的抑菌圈直径 Table 4 Antibacterial circle diameter of Macleaya cordata sanguinarine on test bacteria |
由表 5可知,博落回血根碱对金黄色葡萄球菌和大肠杆菌的MIC均为25.00 μg/mL,对巴氏杆菌的MIC为12.50 μg/mL,对沙门氏菌的MIC为1.56 μg/mL,说明博落回血根碱对沙门氏菌的抑菌效果较好。与青霉素钠相比,博落回血根碱对金黄色葡萄球菌和巴氏杆菌的MIC较高。
|
|
表 5 博落回血根碱对试验菌株的MIC Table 5 Minimum inhibitory concentration of Macleaya cordata sanguinarine on test bacteria |
小肠绒毛高度和隐窝深度与肠道的消化吸收功能密切相关,小肠发育越完善,对营养物质的消化吸收就越好[6]。绒毛高度增加,密度增大,成熟的上皮细胞增多,小肠的吸收面积增大,吸收能力增强[7]。隐窝变浅,肠上皮细胞成熟率上升,分泌功能增强[8]。V/C综合反映小肠功能状况,比值上升,肠道黏膜结构改善,消化吸收能力增强。戴波[9]研究发现,饲粮中添加0.5和1.0 mg/kg血根碱能预防和治疗仔猪腹泻。博落回生物碱中血根碱具有抗菌和抗炎作用,肠道绒毛受损时能直接作用于绒毛并修复绒毛,从而调节肠道健康[10]。本试验结果显示,各组黄羽肉鸡的空肠绒毛高度和隐窝深度无显著差异;多糖组、博落回组和多糖+博落回组的空肠V/C显著高于对照组,与抗生素组无显著差异。这表明饲粮中添加茶籽多糖和博落回生物碱改善空肠黏膜结构的作用与抗生素相当,可以有效促进营养物质的消化吸收,从而提高动物的生产效率,而茶籽多糖和博落回生物碱的联合使用与单独添加效果一致。
3.2 茶籽多糖和博落回生物碱对黄羽肉鸡空肠内容物中大肠杆菌和乳酸杆菌数量的影响微生物、动物机体和环境是一种相互依存的关系,微生态平衡状态下,肠道中正常的微生物菌群能改善肠道结构和功能,增强肠道免疫功能和抵抗疾病能力[11]。肠道微生物菌群可为重要的淋巴细胞亚群的发育提供信号,维护肠道T、B细胞的发育;也可以通过影响辅助性T细胞1(Th1)和辅助性T细胞2(Th2)效应细胞比率进而影响全身性免疫应答[12]。外源性添加物质可以改变肠道微生物的组成。Lee等[13]研究显示,饲粮中添加20 mg/kg血根碱能显著提高肉鸡盲肠内容物中乳酸杆菌数量。本试验结果显示,饲粮中添加茶籽多糖和博落回生物碱对黄羽肉鸡空肠内容物中大肠杆菌数量无显著影响,但极显著提高空肠内容物中乳酸杆菌数量。袁钟宇等[14]研究发现,茶籽多糖对肉鸡盲肠中的大肠杆菌具有抑制作用,作用效果与抗生素相当。本试验结果与之相一致,结果显示,饲粮中添加茶籽多糖降低肉鸡空肠内容物中的大肠杆菌数量,但差异不显著,与抗生素的效果相当。本试验结果亦表明,饲粮中添加茶籽多糖和博落回生物碱对空肠内容物中大肠杆菌和乳酸杆菌的作用效果与单独添加茶籽多糖或博落回生物碱效果一致。这表明博落回生物碱和茶籽多糖可能通过促进肠道有益菌的增殖,从而直接或间接抑制有害菌的生长,改善肠道菌群平衡,而二者联合使用并没有起到拮抗作用和叠加作用。
3.3 博落回血根碱的抑菌活性博落回最早是作为植物源农药使用,其有效成分为天然物质,使用后易降解,对环境污染小,且病虫对其不易产生抗药性。赵东亮等[15]研究发现,博落回生物碱对金黄色葡萄球菌、四连球菌和枯草芽孢杆菌具有较强的抑菌效果,对大肠杆菌无效果;血根碱对金黄色葡萄球菌、四连球菌、枯草芽孢杆菌和蜡样芽孢杆菌的抑菌效果较强,对大肠杆菌效果较弱。郁建平等[16]研究发现,博落回总碱对毛霉的抑菌效果较好,而盐酸血根碱对根霉、黄曲霉、黑曲霉、米曲霉、毛霉和木霉的抑菌效果较强,对青霉和酵母的抑菌效果较弱。本试验研究发现,博落回血根碱对大肠杆菌低度敏感,这与本试验的体内试验结果相一致;博落回血根碱对金黄色葡萄球菌和巴氏杆菌中度敏感,对沙门氏菌高度敏感。王朝元等[17]试验发现,博落回生物碱对金黄色葡萄球菌的抑菌效果较好,与本试验结果相似。而李美奎等[18]研究显示,随着博落回生物碱(生物总碱含量为64%,其中血根碱含量为45%,白屈菜红碱含量为19%)浓度的增加,其对金黄色葡萄球菌、沙门氏菌、大肠杆菌和枯草芽孢杆菌的抑制效果增强,抑制效果为金黄色葡萄球菌>枯草芽孢杆菌>大肠杆菌>沙门氏菌。这与本试验的结果有不同之处,可能是由于博落回生物碱中有效成分含量的不同所产生的差异。本试验结果发现,博落回血根碱对金黄色葡萄球菌和大肠杆菌的MIC均为25 μg/mL;对巴氏杆菌的MIC为12.5 μg/mL,对沙门氏菌的MIC为1.56 μg/mL,说明博落回血根碱对金黄色葡萄球菌和巴氏杆菌的抑菌效果较弱,对沙门氏菌的抑菌效果较强,抑菌活性强于青霉素钠。
4 结论① 饲粮中添加茶籽多糖和博落回生物碱能够改善黄羽肉鸡的空肠形态结构,其作用效果与抗生素相当。
② 饲粮中添加茶籽多糖和博落回生物碱能显著增加空肠内容物中乳酸杆菌数量,二者联合使用与单独添加效果相当,且效果均优于抗生素,说明茶籽多糖和博落回生物碱均能替代抗生素。
③ 博落回血根碱对沙门氏菌的抑菌效果较强,优于青霉素钠,MIC为1.56 μg/mL。
| [1] |
周婉, 印丽娟, 贺安娜.博落回生物碱及药理作用研究进展[C]//全国第六届(2015)侗族医药学术研讨会暨侗族医药理论培训会论文集.贵州: 中国民族医药学会, 2015.
|
| [2] |
张彬, 薛立群, 李丽立, 等. 多糖对动物免疫调控的作用及其机理[J]. 家畜生态学报, 2008, 29(1): 1-5. DOI:10.3969/j.issn.1673-1182.2008.01.001 |
| [3] |
荀兰. 民间草药博落回的药用与化学成份[J]. 兴义民族师范学院学报, 2006(4): 92-94. DOI:10.3969/j.issn.1009-0673.2006.04.025 |
| [4] |
郁建生. 博落回制剂对禽霍乱、仔猪白痢的对比治疗试验[J]. 黑龙江畜牧兽医, 2007(2): 91-93. DOI:10.3969/j.issn.1004-7034.2007.02.045 |
| [5] |
孙波, 陈静, 刘江, 等. 饲料中添加黄芪多糖对肉鸡肠道菌群及免疫器官指数的影响[J]. 黑龙江畜牧兽医, 2014(7): 86-88. |
| [6] |
郭航, 王永军, 谢鹏, 等. 日粮添加二氢杨梅素对肉仔鸡肠黏膜形态结构、碱性磷酸酶及生产性能的影响[J]. 中国饲料, 2008(6): 19-22. DOI:10.3969/j.issn.1004-3314.2008.06.008 |
| [7] |
戴必胜, 蒋林, 陈少雄. 中草药和芦荟多糖对肉仔鸡肠道微生态、免疫功能及生产性能的影响[J]. 中国家禽, 2007, 29(16): 21-24. DOI:10.3969/j.issn.1004-6364.2007.16.007 |
| [8] |
EWTUSHIK A L, BERTOLO R F P, BALL R O. Intestinal development of early-weaned piglets receiving diets supplemented with selected amino acids or polyamines[J]. Canadian Journal of Animal Science, 2000, 80(4): 653-662. DOI:10.4141/A99-134 |
| [9] |
戴波.血根碱对断奶仔猪生产性能的影响及腹泻防治效果的研究[D].硕士学位论文.长沙: 湖南农业大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10537-1017036721.htm
|
| [10] |
LENFELD J, KROUTIL M, MARŠÁLEK E, et al. Antiinflammatory activity of quaternary benzophenanthridine alkaloids from Chelidonoum majus[J]. Planta Medica, 1981, 43(10): 161-165. DOI:10.1055/s-2007-971493 |
| [11] |
张文飞, 刘苹苹, 管武太, 等. 饲粮中添加卵黄抗体对断奶仔猪生长性能、血清生化指标、肠道形态及肠道微生物菌群的影响[J]. 动物营养学报, 2017, 29(1): 271-279. DOI:10.3969/j.issn.1006-267x.2017.01.031 |
| [12] |
VAN DER HORST Y, ESCUREDO J A M, BOUWENS M.控制肠道微生物菌群以扶持动物的免疫力[J].王晶晶, 译.国外畜牧学(猪与禽), 2016, 36(7): 11-12.
|
| [13] |
LEE K W, KIM J S, OH S T, et al. Effects of dietary sanguinarine on growth performance, relative organ weight, cecal microflora, serum cholesterol level and meat quality in broiler chickens[J]. Journal of Poultry Science, 2015, 52(1): 15-22. DOI:10.2141/jpsa.0140073 |
| [14] |
袁钟宇, 张石蕊, 贺喜, 等. 茶籽多糖及茶皂素对肉鸡生长性能和肠道微生物的影响[J]. 中国畜牧杂志, 2010, 46(7): 28-31. |
| [15] |
赵东亮, 郁建平, 周晓秋, 等. 博落回生物碱的抑菌作用研究[J]. 食品科学, 2005, 26(1): 45-47. DOI:10.3321/j.issn:1002-6630.2005.01.004 |
| [16] |
郁建平, 赵东亮, 孟祥斌, 等. 博落回生物碱对八种真菌的抑菌作用研究[J]. 贵州大学学报(自然科学版), 2006, 23(1): 77-80. DOI:10.3969/j.issn.1000-5269.2006.01.017 |
| [17] |
王朝元, 童胜兰, 胡鑫. 博落回生物碱成分及其抗菌活性的研究[J]. 中南民族大学学报(自然科学版), 2015, 34(1): 39-42. DOI:10.3969/j.issn.1672-4321.2015.01.010 |
| [18] |
李美荃, 张春勇, 满意, 等. 博落回提取物在仔猪生产中的应用效果研究[J]. 家畜生态学报, 2013, 34(9): 50-55. DOI:10.3969/j.issn.1673-1182.2013.09.010 |




