甘薯渣是甘薯经过脱淀粉后的副产物,具有高粗纤维、低粗蛋白质和低脂肪含量的特性,而反刍动物瘤胃微生物可以有效利用粗纤维,故甘薯渣可作为反刍动物饲料资源加以利用。白酒糟是生产白酒后的副产物,我国白酒糟年产量约为1 500万t,常作为肉牛养殖中主要的糟渣类饲料,可以缓解我国饲料资源紧张,在节粮型畜牧业方面具有重要的作用[1-3]。肌内脂肪(IMF)含量与肉品风味、嫩度和多汁性等密切相关[4],直接影响牛肉的分级、牛肉产品的开发以及市场竞争力[5]。IMF沉积是脂肪酸的合成与分解相互竞争的结果,受到固醇调节元件结合蛋白-1(SREBP-1)、乙酰辅酶A羧化酶(ACC)、脂肪酸合成酶(FAS)和过氧化物酶增殖激活受体γ(PPARγ)等脂肪合成基因的调控[6-7]以及激素敏感脂肪酶(HSL)和肉碱转移酶-1(CPT-1)等脂肪分解基因的调控[8-9]。以前的研究多集中在饲粮添加酒糟对肉牛生长性能及肉品质的影响,而研究甘薯渣替代白酒糟对育肥牛IMF沉积相关基因表达的研究较少。因此,本研究旨在研究甘薯渣替代白酒糟对育肥牛生长性能、屠宰性能、血清生化指标及与IMF沉积相关基因表达的影响,为育肥牛合理添加甘薯渣和白酒糟提供理论依据和基本参数。
1 材料与方法 1.1 试验设计、饲粮及饲养管理将16月龄、体重约400 kg的健康西杂阉公育肥牛(西门塔尔牛×本地黄牛)30头,随机分为3组,每组10头,每个重复1头牛。A组(对照组)饲喂基础饲粮,B组和C组分别用甘薯渣替代基础饲粮中50%和100%的白酒糟(分别含10%甘薯渣和20%甘薯渣)。试验期为9周(预试期1周和正试期8周)。
甘薯渣来自同一个红薯淀粉厂,经脱水后窖藏,供整个试验用。白酒糟来自同一个酒厂生产的高粱鲜酒糟。饲喂时将白酒糟和甘薯渣拌入精补料。精粗比40 : 60。基础饲粮的配制参考肉牛营养需要[10],试验饲粮组成及营养水平见表 1。白酒糟的营养成分(干物质基础)为:粗蛋白质24.83%,粗脂肪13.21%,酸性洗涤纤维41.12%,中性洗涤纤维47.79%,钙0.31%,磷0.42%。甘薯渣的营养成分(干物质基础)为:粗蛋白质3.90%,粗脂肪0.60%,酸性洗涤纤维14.63%,中性洗涤纤维24.10%,钙0.19%,磷0.02%。
|
|
表 1 试验饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of experimental diets (air-dry basis) |
试验牛的管理按照肉牛常规管理进行,每头牛单独拴养饲喂,在每天固定时间(08:00和16:00)饲喂2次,自由采食,自由饮水。
1.2 样品采集试验结束后,每组选择5头接近组平均体重的牛进行屠宰试验,牛屠宰后立即采集背最长肌样品,一部分立刻放入液氮罐中冻存,然后放入-80 ℃超低温冰箱保存备用,用于提取RNA后测定基因表达;另外一部分放入-20 ℃冰箱,用于酶活性的测定。试验结束后空腹颈静脉采血15 mL,3 000 r/min离心10 min,收集血清后马上-20 ℃冰箱保存,用于血清生化指标的测定。
1.3 生长性能和屠宰性能的测定在试验开始和结束后分别称取牛的体重用于计算平均日增重(ADG),其计算公式为ADG=(末重-初重)/天数。每天记录精、粗料实际饲喂量,并计算平均日采食量和料重比。动物饲养试验结束后,每组选择5头接近组平均体重的牛进行屠宰,测定胴体产肉率和屠宰率。
1.4 血清生化指标的测定用全自动生化仪测定血清中胆固醇、甘油三酯、低密度脂蛋白和高密度脂蛋白的含量。
1.5 背最长肌IMF含量及酶活性的测定牛背最长肌IMF含量参照Zhang等[11]的方法测定。按照南京建成生物工程研究所的试剂盒说明书测定牛背最长肌的FAS、ACC、CPT-1和HSL的活性。
1.6 基因表达的测定采用RNAiso试剂盒提取牛背最长肌总RNA,用NanoDrop 2000(Thermo Scientific,美国)测定总RNA的浓度,然后用琼脂糖凝胶电泳检查其完整性。用反转录试剂盒将总RNA转录为cDNA。采用Zhang等[11]的方法设计引物和测定基因表达,用β-肌动蛋白做内参基因,计算目标基因的表达量,引物序列见表 2。
|
|
表 2 实时荧光定量PCR引物序列 Table 2 Primer sequences for PT-PCR |
数据用Excel 2003处理,经SPSS 19.0统计软件进行单因素方差分析后,采用Duncan氏法对各组间平均值进行多重比较,结果表示为平均值±标准差,P < 0.05为差异显著。
2 结果 2.1 甘薯渣替代白酒糟对育肥牛生长性能和屠宰性能的影响由表 3可知,平均日采食量、初始体重、屠宰率和胴体产肉率组间差异均不显著(P>0.05)。C组的ADG和IMF含量显著低于A组和B组(P < 0.05),但料重比显著高于A组和B组(P < 0.05)。A组和B组之间终末体重、ADG、料重比和IMF含量差异均不显著(P>0.05)。
|
|
表 3 甘薯渣替代白酒糟对育肥牛生长性能和屠宰性能的影响 Table 3 Effects of sweet potato residue replace distiller's grains on growth performance and slaughter performance in fattening cattle |
由表 4可知,C组血清中甘油三酯、总胆固醇、高密度脂蛋白和低密度脂蛋白含量显著低于A组(P < 0.05)。A组和B组血清中甘油三酯、总胆固醇、高密度脂蛋白和低密度脂蛋白含量差异均不显著(P>0.05)。
|
|
表 4 甘薯渣替代白酒糟对育肥牛血清生化指标的影响 Table 4 Effects of sweet potato residue replace distiller's grains on serum biochemical indexes in fattening cattle |
由表 5可知,C组背最长肌FAS和ACC活性显著低于A组和B组(P < 0.05),HSL和CPT-1活性显著高于A组和B组(P < 0.05)。B组背最长肌FAS和ACC活性显著低于A组(P < 0.05),HSL和CPT-1活性显著高于A组(P < 0.05)。
|
|
表 5 甘薯渣替代白酒糟对育肥牛背最长肌酶活性的影响 Table 5 Effects of sweet potato residue replace distiller's grains on enzyme activities in longissimus dorsi muscle of fattening cattle |
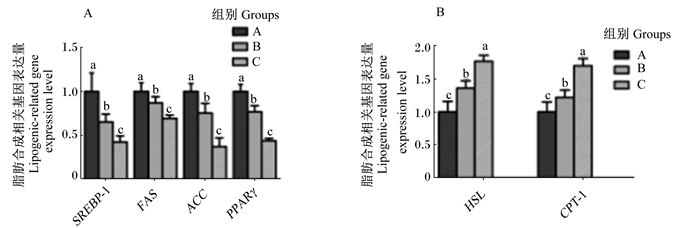
由图 1可知,C组背最长肌SREBP-1、FAS、ACC和PPARγ基因表达量显著低于A组和B组(P < 0.05),HSL和CPT-1基因表达量显著高于A组和B组(P < 0.05)。B组背最长肌SREBP-1、FAS、ACC和PPARγ基因表达量显著低于A组(P < 0.05),HSL和CPT-1基因表达量显著高于A组(P < 0.05)。
|
SREBP-1:受到固醇调节元件结合蛋白-1 sterol regulator element binding protein-1; FAS:脂肪酸合成酶fatty acid synthetase; ACC:乙酰辅酶A羧化酶acetyl coenzyme A carboxylase; PPARγ:过氧化物酶增殖激活受体γ peroxidase activation receptor γ; HSL:激素敏感脂肪酶hormone sensitive lipase; CPT-1:肉碱转移酶-1 carnitine transferase-1。 同一指标数据柱标注不同小写字母表示差异显著(P < 0.05)。 For the same item, value columns with different small letters mean significant difference (P < 0.05). 图 1 甘薯渣替代白酒糟对育肥牛背最长肌IMF沉积相关基因表达的影响 Figure 1 Effects of sweet potato residue replace distiller's grains on IMF deposition related genes expression in longissimus dorsi muscle of fattening cattle |
本试验结果表明,提高甘薯渣替代白酒糟的比例,育肥牛终末体重和ADG降低,料重比增加,这与Peng等[12]、Zhang等[13]的研究结果类似。Peng等[12]研究了甘薯渣替代酒糟对育肥牛生长性能的影响,结果表明20%的甘薯渣能降低其生长性能。Zhang等[13]通过高甘薯渣替代白酒糟调控饲粮能量水平,研究其对肉牛生长性能的影响,结果表明20%的甘薯渣降低终末体重和ADG。这可能是因为随着甘薯渣替代白酒糟的比例增加,降低了饲粮能量和粗蛋白质含量,不利于提高育肥牛的生长性能。另外,本试验结果也表明,甘薯渣替代白酒糟的比例增加,降低了饲粮的能量和粗蛋白质含量,育肥牛背最长肌IMF含量降低,这与Peng等[12]、陈智亮等[14]的研究结果一致。Peng等[12]试验表明,甘薯渣替代白酒糟可降低饲粮的能量,从而降低育肥牛背最长肌IMF含量。综上,甘薯渣替代白酒糟的比例在50%的时候(总饲粮的10%),对育肥牛生长性能和背最长肌IMF含量无显著影响;而当替代的比例在100%的时候(总饲粮的20%),显著降低育肥牛生长性能和背最长肌IMF含量,说明甘薯渣替代白酒糟的比例不宜过高,甘薯渣添加量应控制在总饲粮的10%以内。
3.2 甘薯渣替代白酒糟对育肥牛血清生化指标的影响血清甘油三酯、总胆固醇、高密度脂蛋白和低密度脂蛋白含量是反映脂肪代谢活跃程度的重要参数,其含量在一定范围内越高,表明脂肪合成代谢越旺盛。本试验结果表明,随着甘薯渣替代白酒糟的比例增加,血清甘油三酯、总胆固醇、高密度脂蛋白和低密度脂蛋白含量降低,这与Zhang等[13]、陈智亮等[14]的研究结果一致。这可能是因为随着甘薯渣替代白酒糟的比例增加,降低了饲粮能量和粗蛋白质含量,从而降低育肥牛血清甘油三酯、总胆固醇、高密度脂蛋白和低密度脂蛋白含量。Zhang等[13]研究结果表明,提高甘薯渣替代白酒糟的比例可降低饲粮能量,从而降低育肥牛血清甘油三酯、总胆固醇、高密度脂蛋白和低密度脂蛋白含量。
3.3 甘薯渣替代白酒糟对育肥牛背最长肌IMF沉积相关基因表达的影响IMF沉积是脂肪酸的分解与合成相互竞争的结果,当合成代谢大于分解代谢,表现为脂肪酸积累增加。首先,IMF沉积与脂肪酸合成能力密切相关,当脂肪酸的合成加强就促进IMF沉积,提高IMF含量。PPARγ基因的主要作用是正向调控脂肪代谢相关基因的表达,从而控制脂肪酸的合成与释放[6]。SREBP-1通过调节ACC、FAS等脂肪合成基因的表达,从而控制脂肪酸的合成与释放[15]。FAS的主要作用是在脂肪酸合成的过程中起催化作用,促进脂肪酸的合成,是脂肪酸合成的关键酶之一[6]。ACC的主要作用是促进脂肪酸的合成,是脂肪酸合成的限速酶之一[7]。本试验结果表明,甘薯渣替代白酒糟的比例增加,下调育肥牛背最长肌PPARγ、SREBP-1、FAS和ACC基因的表达量,以及降低背最长肌FAS和ACC活性,表明脂肪酸的合成能力减弱,从而育肥牛背最长肌IMF沉积减少,降低IMF含量。陈智亮等[14]研究表明,提高甘薯渣替代白酒糟的比例可降低牛背最长肌PPARγ基因表达。Peng等[12]研究结果表明,提高甘薯渣替代白酒糟的比例可降低饲粮的能量,从而下调牛背最长肌PPARγ、SREBP-1、FAS和ACC基因表达量。
其次,IMF沉积与脂肪酸分解能力密切相关,当脂肪酸分解作用减弱,促进IMF沉积,提高IMF含量。HSL的主要作用是将脂肪组织中的甘油三酯水解成甘油、游离脂肪酸以及少量的甘油二酯[8]。CPT-1的主要作用是将脂肪酸进行β氧化从而分解脂肪酸[9]。本试验结果表明,甘薯渣替代白酒糟的比例增加,育肥牛背最长肌的HSL和CPT-1活性和基因表达量都增加,使脂肪酸分解能力加强,进而减少IMF沉积,降低IMF含量,与Peng等[12]研究结果一致。
4 结论① 甘薯渣替代饲粮中白酒糟的比例不宜过高,应控制在饲粮组成的10%以内。
② 当提高甘薯渣替代白酒糟比例,通过下调育肥牛背最长肌脂肪酸合成相关基因(SREBP-1、FAS、ACC和PPARγ)表达以及上调脂肪分解相关基因(HSL和CPT-1)表达,从而减少背最长肌IMF沉积。
致谢: 感谢宜春学院生命科学与资源环境学院丁松林、郭冬生博士对文稿所提的宝贵意见。| [1] |
高路. 酒糟的综合利用[J]. 酿酒科技, 2004(5): 101-102. DOI:10.3969/j.issn.1001-9286.2004.05.036 |
| [2] |
何光中, 刘镜, 尚以顺, 等. 酒糟型全混合日粮对肉牛生产性能的影响[J]. 畜牧与兽医, 2014, 46(7): 44-47. |
| [3] |
刘镜, 罗治华, 何光中, 等. 不同比例酒糟全混合日粮对肉牛屠宰性能的影响[J]. 酿酒科技, 2014(3): 90-92, 96. |
| [4] |
FRANK D, BALL A, HUGHES J, et al. Sensory and flavor chemistry characteristics of australian beef:influence of intramuscular fat, feed, and breed[J]. Journal of Agricultural and Food Chemistry, 2016, 64(21): 4299-4311. DOI:10.1021/acs.jafc.6b00160 |
| [5] |
PIAO M Y, YONG H I, LEE H J, et al. Comparison of fatty acid profiles and volatile compounds among quality grades and their association with carcass characteristics in longissimus dorsi and semimembranosus muscles of Korean cattle steer[J]. Livestock Science, 2017, 198: 147-156. DOI:10.1016/j.livsci.2017.02.021 |
| [6] |
MENDES K L, DE PINHO L, ANDRADE J M O, et al. Distinct metabolic effects of resveratrol on lipogenesis markers in mice adipose tissue treated with high-polyunsaturated fat and high-protein diets[J]. Life Sciences, 2016, 153: 66-73. DOI:10.1016/j.lfs.2016.04.014 |
| [7] |
MYSORE R, ZHOU Y, SÄDEVIRTA S, et al. MicroRNA-192 impairs adipocyte triglyceride storage[J]. Biochimica et Biophysica Acta:Molecular and Cell Biology of Lipids, 2016, 1861(4): 342-351. DOI:10.1016/j.bbalip.2015.12.019 |
| [8] |
ZENG W W, PIRZGALSKA R M, PEREIRA M M A, et al. Sympathetic neuro-adipose connections mediate leptin-driven lipolysis[J]. Cell, 2015, 163(1): 84-94. DOI:10.1016/j.cell.2015.08.055 |
| [9] |
JU J, SONG J L, PARK E S, et al. Korean solar salts reduce obesity and alter its related markers in diet-induced obese mice[J]. Nutrition Research and Practice, 2016, 10(6): 629-634. DOI:10.4162/nrp.2016.10.6.629 |
| [10] |
中华人民共和国农业部.NY/T 815-2004肉牛饲养标准[S].北京: 中国农业出版社, 2004.
|
| [11] |
ZHANG H B, DONG X W, WANG Z S, et al. Dietary conjugated linoleic acids increase intramuscular fat deposition and decrease subcutaneous fat deposition in Yellow breed×Simmental cattle[J]. Animal Science Journal, 2016, 87(4): 517-524. DOI:10.1111/asj.2016.87.issue-4 |
| [12] |
PENG Q H, WANG Z S, TAN C, et al. Effects of different pomace and pulp dietary energy density on growth performance and intramuscular fat deposition relating mRNA expression in beef cattle[J]. Journal of Food Agriculture & Environment, 2012, 10(1): 404-407. |
| [13] |
ZHANG H B, ZHANG X F, WANG Z S, et al. Effects of dietary energy level on lipid metabolism-related gene expression in subcutaneous adipose tissue of Yellow breed×Simmental cattle[J]. Animal Science Journal, 2015, 86(4): 392-400. DOI:10.1111/asj.12316 |
| [14] |
陈智亮, 胡永娜, 段迎凯, 等.糟渣类日粮不同能量水平对肉牛血液指标和相关调控肉质基因表达的影响[C]//第五届中国牛业发展大会论文集.滨州: 中国畜牧业协会, 2010: 387-392.
|
| [15] |
SMITH S, WITKOWSKI A, JOSHI A K. Structural and functional organization of the animal fatty acid synthase[J]. Progress in Lipid Research, 2003, 42(4): 289-317. DOI:10.1016/S0163-7827(02)00067-X |



