抗生素具有提高动物生产性能、降低腹泻率和抑制肠道有害菌生长等多方面功效[1]。虽然这些优点使其在动物生产中获得广泛使用, 但是抗生素的滥用、过度使用导致耐药性[2]和肉类食品中抗生素残留等问题, 严重威胁人类健康。因此, 欧盟于2006年开始全面禁用抗生素, 近年来我国也逐渐加大了对抗生素的限用力度。然而, 减少抗生素的使用, 会大大增加动物对病原菌的易感性, 严重威胁动物的健康, 给动物生产带来巨大的经济损失。因此, 目前迫切需要寻找一种可行的措施来解决这一现状。
β-葡聚糖是一类广泛分布于动物、植物和微生物细胞结构中的多糖。燕麦是较理想的β-葡聚糖的来源, 燕麦β-葡聚糖的基本结构是由β-1, 4和β-1, 3糖苷键连而形成的短链葡聚糖[3]。不同植物中的β-葡聚糖化学结构相似, 但分子中的β-1, 4和β-1, 3糖苷键存在差异, 燕麦β-葡聚糖中2个糖苷键的比值一般认为是2.1~2.4[4]。研究发现, β-葡聚糖具有促进动物生长、增强机体免疫力及抗癌等作用[5]。此外, β-葡聚糖能抑制大肠杆菌、沙门氏菌等有害细菌生长, 促进双歧杆菌、乳酸菌等有益菌生长, 在维持肠道微生态平衡和促进动物健康方面发挥着重要的作用[6-7]。因此, 本研究旨在研究β-葡聚糖对荣昌内三元断奶仔猪的生长性能、肠道微生物区系和氨基酸脱羧酶活力的影响, 为β-葡聚糖在断奶仔猪上的应用提供参考依据。
1 材料与方法 1.1 试验材料和试验设计试验选用30头28日龄断奶健康的(大约克×荣昌)×长白内三元杂交阉公仔猪, 采取单因素完全随机分组试验设计, 分3个组:对照组(基础饲粮)、杆菌肽锌组(在基础饲粮中添加100 mg/kg杆菌肽锌, 杆菌肽锌购自大东方动物药业有限公司)、β-葡聚糖组(在基础饲粮中添加400 mg/kg β-葡聚糖, β-葡聚糖购自安徽中南科技生物有限公司, 纯度99%)。每个组10个重复, 每个重复1头仔猪。试验在西南大学养殖场进行。试验预试期4 d, 正试期28 d。预试期后即正试期第1天08:00空腹称重并记录初重, 正试期结束后次日08:00空腹称重并记录末重。
1.2 饲养管理和饲粮组成本次试验动物采用单栏饲养, 饲喂粉料饲粮, 每天共投料3次(08:00、12:00和18:00), 自由饮水, 室内温度保持在25~30 ℃。基础饲粮参照NRC(2012)标准设计, 其组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
按以下公式计算生长性能:

|
试验期间每天观察仔猪发病和腹泻情况。目测粪便状态及统计腹泻指数, 评分标准为:正常粪便记5分, 成型软便记3~4分, 不成型稀粪记1~2分, 水样粪、黏液便或脓血便记0分。腹泻指数为试验期每头猪腹泻评分之和除以试验天数。腹泻指数的高低反映腹泻程度的轻重。腹泻指数越高, 表明仔猪腹泻情况越低; 相反, 腹泻指数越低, 仔猪腹泻程度越严重。
1.3.2 肠道内容物的采集及微生物的分离试验结束后每组选取5头体重相近的仔猪进行颈动脉放血, 剖开胸腔和腹腔, 迅速采集回肠、结肠内容物20 g左右于离心管中, 液氮速冻, 用于微生物的分离。测定肠道内容物微生物氨基酸脱羧酶活力及氨基酸组成, 方法参照赖星等[8]的方法进行。收集结肠内容物于10 mL离心管中, 置于-80 ℃保存, 用于DNA的提取。
1.3.3 肠道微生物氨基酸脱羧酶活力的测定将分离所得的微生物样品梯度解冻后, 于10 000 r/min、4 ℃条件下离心5 min, 倾去上清, 用预冷的生理盐水反复清洗沉淀2~3次, 同样条件下离心弃上清。将带有沉淀的离心管置于冰上待用。将收集的沉淀用生理盐水稀释至600 nm波长处的吸光度值(OD600)为0.8的溶液。取OD600为0.8的菌悬液10 mL, 于10 000 r/min、4 ℃离心5 min后, 倾去上清, 将带有沉淀离心管插入冰中待用。在预冷的沉淀中加入500 μL预冷生理盐水, 用振幅30 μm超声处理20 s后, 置于冰上冷却。反复超声处理3次, 使细胞充分破碎。将破碎液于16 000 r/min、4 ℃条件下离心15 min。小心地移取上清液并分装至预冷的1.5 mL离心管中后, 置于冰槽里待用。氨基酸脱羧酶活力的测定参照唐志如等[9]的方法进行。
1.3.4 结肠微生物区系的测定结肠内容物DNA的提取按照试剂盒Power Fecal DNA Isolation Kit(购自MO BIO Laboratories)进行。提取的DNA进行微生物高通量测序[10]。具体测定步骤如下:将检测合格的样品DNA构建文库, 回收目的扩增产物片段, 用T4 DNA聚合酶、克列诺(Klenow)DNA聚合酶和T4多聚核苷酸激酶(PNK)将打断形成的黏性末端修复成平末端, 再通过3′端加碱基腺嘌呤(A), 使得DNA片段能与3′端带有胸腺嘧啶(T)碱基的特殊接头连接; 设计合成含有测序接头的双索引融合引物, 以基因组DNA为模板, 进行融合引物PCR, 磁珠筛选目的扩增产物片段, 用合格的文库进行集群制备和测序, 对测序得到的数据进行相应的生物信息分析[11]。
1.4 数据处理及统计试验数据用Excel 2013和SAS 9.2软件进行整理和方差分析, 组间差异性比较采用LSD法, 结果以平均值和均值标准误(SEM)表示, P < 0.05为差异显著。
2 结果与分析 2.1 饲粮添加β-葡聚糖对断奶仔猪生长性能的影响由表 2可知, β-葡聚糖组和杆菌肽锌组的仔猪末重、平均日增重、平均日采食量和腹泻指数均显著高于对照组(P < 0.05), 料重比显著低于对照组(P < 0.05)。β-葡聚糖组与杆菌肽锌组相比, 仔猪末重、平均日增重、平均日采食量、腹泻指数和料重比差异均不显著(P>0.05)。
|
|
表 2 饲粮添加β-葡聚糖对断奶仔猪生长性能的影响 Table 2 Effects of dietary β-glucan on growth performance of weaned piglets (n=10) |
|
|
表 3 饲粮添加β-葡聚糖对断奶仔猪肠道微生物氨基酸脱羧酶活力的影响 Table 3 Effects of dietary β-glucan on microbial amino acid decarboxylase activity in intestine of weaned piglets (n=5) |
由表 3可知, 杆菌肽锌组断奶仔猪回肠微生物色氨酸脱羧酶活力显著高于对照组和β-葡聚糖组(P < 0.05), 对照组与β-葡聚糖组之间差异不显著(P < 0.05)。回肠蛋氨酸脱羧酶活力的大小依次为杆菌肽锌组、对照组、β-葡聚糖组, 且各组之间差异显著(P < 0.05), 其中β-葡聚糖组比杆菌肽锌组降低了86.03%。杆菌肽锌组回肠微生物赖氨酸脱羧酶活力显著高于对照组和β-葡聚糖组(P < 0.05), 对照组与β-葡聚糖组之间差异不显著(P>0.05)。回肠微生物鸟氨酸脱羧酶活力3组之间均差异不显著(P>0.05), β-葡聚糖组分别比杆菌肽锌组和对照组降低了35.36%和3.13%。在结肠中, β-葡聚糖组和杆菌肽锌组结肠微生物蛋氨酸脱羧酶和鸟氨酸脱羧酶活力均显著低于对照组(P < 0.05), β-葡聚糖组与杆菌肽锌组之间差异不显著(P>0.05)。断奶仔猪结肠微生物赖氨酸脱羧酶活力的大小依次为对照组、杆菌肽锌组、β-葡聚糖组, 且各组之间差异显著(P < 0.05)。杆菌肽锌组和β-葡聚糖组结肠微生物色氨酸脱羧酶活力显著高于对照组(P < 0.05), 而杆菌肽锌组与β-葡聚糖组之间差异不显著(P>0.05)。
2.3 结肠微生物区系分析 2.3.1 物种注释分析由图 1可以直观看出不同物种在每个样品中所占的比例。通过β多样性分析可知, 断奶仔猪饲粮中添加β-葡聚糖和杆菌肽锌提高了断奶仔猪结肠微生物的相对丰度, 且杆菌肽锌和β-葡聚糖效果是相当的。由图 1-A可知, 在门水平上, 3个组中的拟杆菌门、厚壁菌门、螺旋体菌门和WPS-2是断奶仔猪结肠微生物组成的主要优势菌群, 占到结肠微生物的90%以上。由图 1-B可知, β-葡聚糖组螺旋体纲微生物相对丰度显著高于对照组和杆菌肽锌组(P < 0.05);对照组拟杆菌纲微生物相对丰度显著高于杆菌肽锌组和β-葡聚糖组(P < 0.05);杆菌肽锌组和β-葡聚糖组杆菌纲微生物相对丰度高于对照组(P < 0.05);梭状芽孢杆菌纲微生物相对丰度从大到小依次为杆菌肽锌组、对照组、β-葡聚糖组, 并且差异显著(P < 0.05)。由图 1-C可知, β-葡聚糖组螺旋体科微生物相对丰度显著高于对照组和杆菌肽锌组(P < 0.05);拟杆菌科微生物相对丰度从大到小依次为对照组、杆菌肽锌组、β-葡聚糖组, 并且差异显著(P < 0.05);乳酸杆菌科微生物相对丰度β-葡聚糖组和杆菌肽锌组显著高于对照组(P < 0.05);梭状芽孢杆菌科微生物相对丰度对照组和杆菌肽锌组显著高于β-葡聚糖组(P < 0.05)。
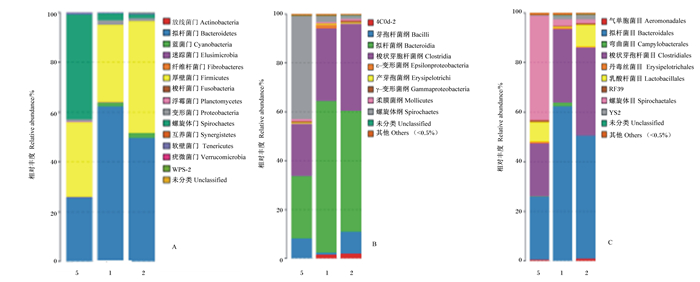
|
图 1 物种注释分析 Figure 1 Species annotation analysis |
根据门水平热图(图 2-D)可知, 3组厚壁菌门、拟杆菌门相对丰度都比较高, 并且β-葡聚糖组螺旋体菌门微生物的相对丰度高于其他2组; 由横向类聚的枝长和距离情况可知, 对照组和杆菌肽锌组的结肠微生物相对丰度和组成相似, 而β-葡聚糖组和另外2组在物种丰度和组成均存在差异; 由纵向聚类得出厚壁菌门和拟杆菌门在各组中的相对丰度和组成相似, 且相对丰度高于其他物种。此外, 由纵向类聚还得出变形菌门和厚壁菌门在各组中的相对丰度和组成相似, 其相对丰度不高。根据纲水平热图(图 2-E)可知, 在纲水平, 横向聚类结果得出杆菌肽锌组和β-葡聚糖组物种相对丰度和组成相似, 并且由颜色图标可知, 各结肠微生物在杆菌肽锌组和β-葡聚糖组的相对丰度要高于对照组; 而纵向类聚可知拟杆菌纲和梭状芽孢杆菌纲在各组相对丰度及组成相似, 并且相对丰度高于其他物种; 螺旋体纲和杆菌纲在各样品中的相对丰度和组成相似。根据目水平热图(图 2-F)可知, 杆菌肽锌组和β-葡聚糖组结肠微生物相对丰度和组成相似, 结合数值分析可知, β-葡聚糖组和杆菌肽锌组的相对丰度高于对照组; 由纵向类聚可知, 拟杆菌目和梭状芽孢杆菌目在各组中的相对丰度和组成相似, 并且相对丰度高于乳酸杆菌目和螺旋体菌目及其他物种; 乳酸杆菌目和螺旋体菌目在各组中的相对丰度和组成相似。根据科水平热图(图 2-G)可知, 杆菌肽锌组和β-葡聚糖组结肠微生物的相对丰度和组成相似, 且相对丰度高于对照组。乳酸杆菌的相对丰度在β-葡聚糖组和杆菌肽锌组高于对照组。螺旋体科在β-葡聚糖组相对丰度高于其他2组; 由纵向聚类分析可知, 普雷沃氏菌科和韦荣球菌科在各组的相对丰度相似, 并且其相对丰度高于其他物种。此外, 各组毛螺菌科菌的相对丰度相似, 但由图上的数值可知, 对照组和β-葡聚糖组高于杆菌肽锌组。
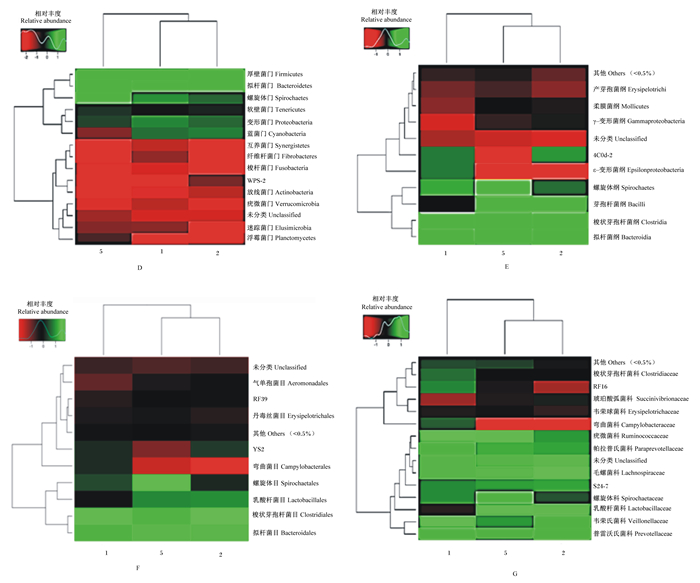
|
图 2 物种热图分析 Figure 2 Species heat map analysis |
本研究发现, 与杆菌肽锌组相比, 断奶仔猪饲粮中添加β-葡聚糖显著降低断奶仔猪回肠中色氨酸脱羧酶、蛋氨酸脱羧酶和赖氨酸脱羧酶的活力; 与对照组相比, β-葡聚糖组回肠鸟氨酸脱羧酶和赖氨酸脱羧酶的活力均有所降低但差异不显著。在结肠中, 与对照组相比, 断奶仔猪饲粮中添加β-葡聚糖显著降低蛋氨酸脱羧酶、赖氨酸脱羧酶和鸟氨酸脱羧酶的活力; 虽然添加杆菌肽锌对降低蛋氨酸脱羧酶、赖氨酸脱羧酶和鸟氨酸脱羧酶的活力也具有显著性效果, 但降低程度不如β-葡聚糖。因此我们认为, 断奶仔猪饲粮添加β-葡聚糖能有效地降低回肠和结肠微生物氨基酸脱羧酶活力, 继而有利于降低回肠和结肠中生物胺的浓度和减少仔猪疾病的发生。氨基酸脱羧酶是指催化脱去某种氨基酸的羧基, 生成对应的胺的裂解酶的总称。在细菌中已知的脱羧酶有分别对应于赖氨酸-尸胺、酪氨酸-酪胺、精氨酸-鲱精胺、鸟氨酸-腐胺、谷氨酸-γ-氨基丁酸等专一性的脱羧酶, 这些均以磷酸吡哆醛为辅酶。在动物组织中对这些氨基酸脱羧也各有专门作用的酶。动物体内由氨基酸脱羧生成的胺类在生理和药理方面有重要的作用, 在细菌中有中和酸性培养基的作用。脱羧酶脱羧需要辅酶磷酸吡哆醛诱导。赖氨酸脱羧后变成对应有毒性的尸碱。脱羧作用会产生多种生物胺, 体内生物胺的浓度低时, 对动物影响不大, 而且低浓度的生物胺是机体必不可少的, 一旦浓度过高, 将引起宿主发生疾病例如腹泻[12]。生成的生物胺还会降低肠道的紧密连接和通透性, 同时会降低蛋白质的利用率。
在本研究中, 饲粮添加β-葡聚糖后降低了断奶仔猪结肠中梭状芽孢杆菌的相对丰度, 这可能是脱羧酶活力下降的一个原因。有研究发现梭状芽孢杆菌和消化链球菌主要降解一些氨基酸产生生物胺, 如降解丝氨酸产生乙醇胺、降解赖氨酸产生尸胺和降解天冬氨酸产生天门冬酰胺等[13]。机体中的大肠杆菌也经常通过脱羧作用产生生物胺, 而本试验研究发现, 饲粮中添加β-葡聚糖降低了肠杆菌属菌群的相对丰度。因此, 我们得出β-葡聚糖降低脱羧酶活力的一种可能潜在机制:β-葡聚糖通过降低肠道中产生生物胺的菌群丰度来降低肠道微生物脱羧酶的活力。
肠道中的微生物种类很多, 猪肠道中的微生物最主要由厚壁菌门和拟杆菌门构成, 其中厚壁菌门的比例占35%~80%, 拟杆菌门占17%~60%, 2个菌门有30多个属、500~1 000种菌[14-15]。本研究采用高通量进行测序和分析, 在门水平, 断奶仔猪饲粮中添加β-葡聚糖和杆菌肽锌组与对照组相比, 厚壁菌门和拟杆菌门仍是优势菌门, 可见添加β-葡聚糖和杆菌肽锌并不会造成肠道微生态的改变。肠道菌群中某些拟杆菌门细菌基因组中含有较多编码糖苷水解酶和多糖裂解酶的基因, 编码的酶类能促进多糖的降解[16]。本研究在门水平、纲水平、目水平上均发现拟杆菌门是主要的肠道微生物, 且β-葡聚糖组中拟杆菌门的相对丰度和杆菌肽锌组是相当的。β-葡聚糖组和杆菌肽锌组有益菌乳酸杆菌科微生物的相对丰度高于对照组, 乳酸杆菌在肠道内可通过产生乳酸来降低肠道的pH进而杀死在低pH下无法生长的细菌, 如大肠杆菌、沙门氏菌, 这与周怿等[17]和王忠等[18]的研究一致。对照组和杆菌肽锌组的梭状芽孢杆菌科微生物相对丰度高于β-葡聚糖组。毛螺菌科在猪肠道中能降解纤维, 有助于将不易消化的纤维素降解为单糖和短链脂肪酸, 为宿主提供能量[19]。在科水平, 本研究结果表明对照组和β-葡聚糖组的毛螺菌科微生物相对丰度高于杆菌肽锌组。肠道梭菌属中的致病菌会分解肌肉组织和结缔组织等组织中的糖, 产生气体, 导致严重气肿和造成组织坏死, 因此被认为是有害菌, 并且梭菌属和肠杆菌科的比例升高会引起坏死性小肠结肠炎[20]。在本研究中, 断奶仔猪饲粮中添加β-葡聚糖和杆菌肽锌, 降低了芽孢杆菌科微生物的相对丰度, 其中的梭菌属属于芽孢杆菌科。此外, 通过β多样性分析可知, 断奶仔猪饲粮中添加β-葡聚糖和杆菌肽锌提高了断奶仔猪结肠微生物菌群的相对丰度, 且杆菌肽锌和β-葡聚糖效果是相当的。
4 结论① 饲粮中添加400 mg/kg的β-葡聚糖提高了断奶仔猪的生长性能, 降低了断奶仔猪回肠和结肠中微生物氨基酸脱羧酶的活力。
② 饲粮中添加400 mg/kg的β-葡聚糖提高了断奶仔猪结肠微生物相对丰度和有益菌相对丰度, 并且降低了有害菌相对丰度。
③ β-葡聚糖在降低断奶仔猪肠道微生物氨基酸脱羧酶活力和减少有害菌相对丰度方面与抗生素杆菌肽锌没有显著性差异, 在促进肠道有益菌生长方面优于杆菌肽锌。
| [1] |
王书凤, 龚月生. 不同抗生素组合对哺乳仔猪生产性能及肠道菌群的影响[J]. 西北农业学报, 2007, 16(5): 63-66. DOI:10.3969/j.issn.1004-1389.2007.05.015 |
| [2] |
LOOFT T, ALLEN H K, CANTAREL B L, et al. Bacteria, phages and pigs:the effects of in-feed antibiotics on the microbiome at different gut locations[J]. The ISME Journal, 2014, 8(8): 1566-1576. DOI:10.1038/ismej.2014.12 |
| [3] |
刘灿, 姜燕飞, 张召锋, 等. 燕麦β-葡聚糖对2型糖尿病大鼠肠黏膜屏障的影响[J]. 食品科学, 2016, 37(11): 167-173. DOI:10.7506/spkx1002-6630-201611029 |
| [4] |
管骁, 姚惠源, 李景军, 等. 燕麦β-葡聚糖研究进展[J]. 食品科学, 2009, 30(15): 231-237. DOI:10.3321/j.issn:1002-6630.2009.15.055 |
| [5] |
李万坤, 闫鸿斌, 才学鹏, 等. β-葡聚糖的免疫增强作用机理研究进展[J]. 中国畜牧兽医, 2007, 34(7): 151-155. DOI:10.3969/j.issn.1671-7236.2007.07.062 |
| [6] |
ZHOU T X, JUNG J H, ZHANG Z F, et al. Effect of dietary β-glucan on growth performance, fecal microbial shedding and immunological responses after lipopolysaccharide challenge in weaned pigs[J]. Animal Feed Science and Technology, 2013, 179(1/2/3/4): 85-92. |
| [7] |
SHAO Y, LEI Z, YUAN J, et al. Effect of zinc on growth performance, gut morphometry, and cecal microbial community in broilers challenged with Salmonella enterica, serovar typhimurium[J]. Journal of Microbiology, 2014, 52(12): 1002-1011. DOI:10.1007/s12275-014-4347-y |
| [8] |
赖星, 石宝石, 刘金艳, 等. 日粮蛋白水平对生长育肥猪肠道微生物酶活性的影响[J]. 中国兽医学报, 2017, 37(2): 327-334. |
| [9] |
唐志如, 邓欢, 孙志洪, 等.一种快速定量检测氨基酸脱羧酶的比色方法: 中国, 104374768A[P].2015-02-25.
|
| [10] |
KIM H B, ISAACSON R E. The pig gut microbial diversity:understanding the pig gut microbial ecology through the next generation high throughput sequencing[J]. Veterinary Microbiology, 2015, 177(3/4): 242-251. |
| [11] |
SCHLOSS P D, WESTCOTT S L, RYABIN T, et al. Introducing mothur:open-source, platform-independent, community-supported software for describing and comparing microbial communities[J]. Applied and Environmental Microbiology, 2009, 75(23): 7537-7541. DOI:10.1128/AEM.01541-09 |
| [12] |
ASCHENBACH J R, SCHWELBERGER H G, AHRENS F, et al. Histamine inactivation in the colon of pigs in relationship to abundance of catabolic enzymes[J]. Scandinavian Journal of Gastroenterology, 2006, 41(6): 712-719. DOI:10.1080/00365520500419540 |
| [13] |
VOLTOLINI C, BATTERSBY S, ETHERINGTON S L, et al. A novel antiinflammatory role for the short-chain fatty acids in human labor[J]. Endocrinology, 2012, 153(1): 395-403. DOI:10.1210/en.2011-1457 |
| [14] |
HOOPER L V, LITTMAN D R, MACPHERSON A J. Interactions between the microbiota and the immune system[J]. Science, 2012, 336(6086): 1268-1273. DOI:10.1126/science.1223490 |
| [15] |
SEKIROV I, RUSSELL S L, ANTUNES L C M, et al. Gut microbiota in health and disease[J]. Physiological Reviews, 2010, 90(3): 859-904. DOI:10.1152/physrev.00045.2009 |
| [16] |
El KAOUTARI A, ARMOUGOM F, GORDON J I, et al. The abundance and variety of carbohydrate-active enzymes in the human gut microbiota[J]. Nature Reviews Microbiology, 2013, 11(7): 497-504. DOI:10.1038/nrmicro3050 |
| [17] |
周怿, 刁其玉, 屠焰, 等. 酵母β-葡聚糖和抗生素对早期断奶犊牛生长性能和肠道菌群的影响[J]. 畜牧兽医学报, 2010, 41(6): 685-691. |
| [18] |
王忠, 强文军, 呙于明, 等. β-1, 3-葡聚糖对感染沙门菌鸡免疫功能和肠道菌群数量的影响[J]. 中国家禽, 2010, 32(5): 14-18. |
| [19] |
HAYASHI H, SHIBATA K, SAKAMOTO M, et al. Prevotella copri sp. nov. and Prevotella stercorea sp. nov., isolated from human faeces[J]. International Journal of Systematic and Evolutionary Microbiology, 2007, 57(Pt 5): 941-946. |
| [20] |
AZCARATE-PERIL M A, FOSTER D M, CADENAS M B, et al. Acute necrotizing enterocolitis of preterm piglets is characterized by dysbiosis of ileal cosa-assocmuiated bacteria[J]. Gut Microbes, 2011, 2(4): 234-243. DOI:10.4161/gmic.2.4.16332 |




