2. 内蒙古农牧业科学院动物营养与饲料研究所, 呼和浩特 010031
2. Research Institute of Animal Nutrition and Feed, Inner Mongolia Academy of Animal Sciences, Hohhot 010031, China
肠道是动物机体消化吸收营养物质的主要场所,而黏膜作为肠道上皮的重要屏障,可有效阻挡肠道内微生物及其毒素向体内其他组织器官和血液循环扩散[1],在侵袭与抗侵袭过程中保持动态稳定[2]。肠黏膜上皮屏障的完整性对于维持消化系统甚至整个动物机体的健康具有重要作用,当其遭到破坏或功能失调会促进肠道感染性疾病的发生,严重时会导致全身性炎症反应或多器官功能衰竭[3-4]。肌球蛋白轻链激酶(myosin light chain kinase, MLCK)是肠黏膜上皮屏障功能变化最主要的钙调素激酶,随着对其结构和功能的深入研究,MLCK在介导肠黏膜上皮通透性改变中所起的作用受到众多学者的广泛关注,近年来已成为分子生物学和细胞生物学领域的研究热点之一。因此,了解MLCK介导肠黏膜上皮屏障功能变化的调控机制对动物营养学研究具有重要意义。
1 MLCK的结构及生物学功能 1.1 MLCK的基本结构MLCK是第1个被发现的依赖于钙调蛋白(calmodulin, CaM)的丝氨酸/苏氨酸特异性蛋白激酶,在真核生物的肌细胞以及哺乳动物的非肌细胞中动态调节肌动球蛋白重组和细胞收缩[5]。MLCK在哺乳动物中主要有mylk1和mylk2 2种基因编码[6],分为横纹肌型MLCK(skeletal muscle MLCK, skMLCK)和平滑肌型MLCK(smooth muscle MLCK, smMLCK),二者分别位于不同的染色体上,其中skMLCK仅限于在骨骼肌组织中表达,其基因编码1个催化结构域以及由自动抑制区和Ca2+/CaM结合序列组成的调节区域[7]。但由于启动子的不同,smMLCK以细胞特异性方式表达出3种转录本。其中分子质量为130 ku的称为短链MLCK(S-MLCK),在机体的大多数组织中都有表达,其在胃肠道基本紧张状态的维持、胃排空以及小肠推动等基本动力方面发挥重要的调节作用[8];而分子质量为220 ku的称为长链MLCK(L-MLCK),主要分布于胚胎组织、体外培养细胞、上皮细胞和非肌细胞中[9]。研究发现,在肠上皮细胞中,肌球蛋白轻链(myosin light chain, MLC)发生磷酸化主要是由L-MLCK表达所引起[10]。smMLCK基因的第3种转录本编码的是C末端的免疫球蛋白T(lgT)样结构。
Feng等[11]研究发现,哺乳动物smMLCK保守结构域如图 1所示。smMLCK N末端的肌动蛋白结合位点由3个DFRxxL基序组成,且能与纯化的F肌动蛋白结合,将酶锁定在收缩装置内[12-13]。免疫球蛋白(Ig)1和Ig2 2个结构域也与肌动蛋白结合[14],而IgT结构域与C末端的平滑肌肌球蛋白(smooth muscle myosin, SMM)结合,该结构蛋白对于维持平滑肌细胞中肌球蛋白纤维的稳定性具有重要作用[15]。中心激酶结构域作为MLCK、三磷酸腺苷(adenosine triphosphate, ATP)以及调节性肌球蛋白Ⅱ轻链(regulatory myosin Ⅱ light chain, RLC)结合位点的催化部位,可将ATP上的磷酸转运到底物上[16]。
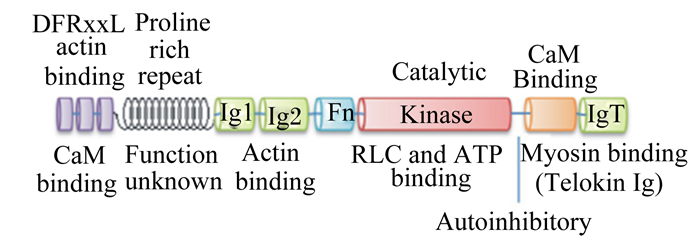
|
DFRxxL:D、F、R和L分别为天冬氨酸、苯丙氨酸、精氨酸和亮氨酸,x为任意氨基酸;Actin binding:肌动蛋白结合位点;CaM binding:钙调蛋白结构域;Proline rich repeat:富脯氨酸重复序列;Function unknown:功能未知;Ig1:免疫球蛋白1;Ig2:免疫球蛋白2;Fn:纤维蛋白3型结构域;Catalytic:催化;Kinase:激酶结构域;RLC and ATP binding:调节性肌球蛋白Ⅱ轻链和三磷酸腺苷结合位点;Autoinhibitory:自抑制作用;IgT:免疫球蛋白T;Myosin binding:肌球蛋白结合位点;Telokin Ig:免疫球蛋白超级家族Telokin蛋白。 图 1 哺乳动物smMLCK结构域 Figure 1 Domain structure of smMLCK of mammalian[11] |
除此之外,在非脊椎动物中也发现了与MLCK有关的激酶。在果蝇中,1个有复杂启动子的基因会产生多个具有相同末端的转录本[17],较小的转录本(3.2~5.2 kb)编码的蛋白质与哺乳动物的MLCK大小相似;而较大的转录本(13~25 kb)编码的蛋白质类似于哺乳动物的蛋白质titins;最大的转录本(25 kb)编码1个926 ku的stretchin MLCK。另外,在线虫和海兔中表达的MLCK相关激酶为twitchin,其也有1个结合到催化结构域上的自动抑制区,但不含有Ca2+/CaM结合序列,是由Ca2+结合蛋白S100A12激活[18]。在盘基网柄菌中表达的MLCK只含有催化结构域和被磷酸化以激活的调节区域,是结构最为简单的一种[19]。
1.2 MLCK的生物学功能MLCK是细胞收缩的关键调控因子,其主要功能是介导MLC发生磷酸化[20-21],研究表明,Ca2+/CaM是MLCK活性最重要的调节器。当外来不同信号刺激时,细胞内游离的Ca2+浓度升高,Ca2+首先与CaM结合形成Ca2+/CaM复合体,MLCK能够与Ca2+/CaM复合体结合解除MLCK的天然抑制序列,形成激活的p-MLCK[7, 11]。而p-MLCK使MLC上第18位苏氨酸(Thr18)和第19位丝氨酸(Ser19)残基的磷酸化水平升高,改变MLC的空间构象[22]。磷酸化的MLC可活化肌球蛋白重链头部的ATP酶,所产生的能量使肌动蛋白与肌球蛋白相互作用,介导肌动蛋白发生收缩。Ca2+/CaM也可与DFRxxL结合导致肌动蛋白结合减弱[23],使细胞骨架肌动蛋白微丝滑动,引起细胞骨架重排,细胞发生向心性收缩,细胞间的紧密连接(tight junction, TJ)被破坏,直接催化MLC从非磷酸化型向磷酸化型转变,导致细胞黏膜通透性增加[24]。此外,Kamm等[7]和Simard等[25]研究发现,MLCK不仅可以调节细胞收缩,而且对细胞迁移、运动以及细胞凋亡具有调控作用。
2 MLCK介导肠黏膜上皮屏障功能变化的信号转导机制机械屏障作为肠黏膜屏障的重要组成部分,主要由肠上皮细胞和相邻细胞间的连接构成。而细胞要协调发挥各种功能,则有赖于细胞黏着和细胞连接。细胞的连接方式主要分为TJ、黏着连接(adhesion junction, AJ)、间隙连接(gap junction, GJ)和桥粒连接(desmosome junction, DJ)[26],其中TJ是肠上皮细胞间最重要的连接方式,调控着水和溶质等小分子物质的跨上皮转运,是决定细胞间通透性的关键因素[27],在肠黏膜上皮屏障功能的维护中起着举足轻重的作用。TJ的结构蛋白主要由跨膜蛋白家族(包括紧密连接蛋白Claudin、Occludin)和外周支架蛋白(紧密连接蛋白ZO)构成。Blair等[28]研究发现,MLCK通过调节Claudin、Occludin及ZO的蛋白质表达,可引起肠黏膜通透性增加,由此可知,MLCK在TJ通透性动态调节过程中发挥重要作用[29]。研究表明,上皮细胞收缩性改变是不同原因引起肠黏膜通透性增加的共同通路,主要受骨架蛋白中肌球蛋白和肌动蛋白的影响,肌球蛋白的主要作用是调控细胞骨架结构并参与细胞的多种生理活动,而这些主要是通过MLC的磷酸化与去磷酸化来实现。MLC发生磷酸化是生物屏障通透性增加的分子基础[30-31],是肠上皮TJ屏障功能障碍的关键所在。多种细胞因子、炎症介质等神经及体液介质均可通过MLC磷酸化而引起黏膜通透性增加[32-33]。因此,在MLCK介导的肠黏膜上皮细胞通透性增加中,效应分子MLC磷酸化是关键环节,而MLCK的激活可通过下列途径进行调控。
2.1 促分裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)信号通路MAPK属于丝氨酸/苏氨酸蛋白激酶,由Sturgill等[34]首次从3T3-L1脂肪母细胞中纯化出来。研究证实,MAPK存在于所有生物体的大多数细胞内,是真核生物细胞重要的信号转导系统之一,可将细胞外信号刺激传导至细胞及其核内部。MAPK通过影响基因转录和调控,进而影响细胞的生物学功能[35]。MAPK信号转导通路在细胞内具有生物进化的高度保守性。目前发现,MAPK信号系统主要包括细胞外信号调节激酶(extracellular signal-regulated kinase, ERK)、p38 MAPK和c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK),其中ERK在维持细胞形态和构建细胞骨架方面发挥重要作用。研究表明,ERK1/2的激活可促使下游转录激活因子ETS样蛋白1(Elk-1)的激活并迁移到细胞核内,与位于最小启动子区域(-310~-296)内的顺式结合位点相结合,触发MLCK基因活化以及MLC磷酸化,导致肠上皮细胞TJ受损,黏膜通透性增加[36]。另有研究表明,同型半胱氨酸通过促进丝裂原活化细胞外信号调节激酶(mitogen-activated extracellular signal-regulated kinase, MEK)-ERK-MLCK蛋白磷酸化影响结肠炎大鼠的肠黏膜通透性,进而加重肠道的炎症过程[37]。而Al-Sadi等[36]发现,白细胞介素-1β(IL-1β)诱导的肠上皮细胞TJ通透性增加是通过ERK1/2信号转导途径调节MLCK基因表达来介导的,在敲除ERK1/2或使用ERK1/2抑制剂后能有效抑制MLC磷酸化。因此,ERK在MLCK诱导的肠黏膜上皮细胞通透性增加中起到重要作用。
在烧伤引起的小鼠肠道屏障功能损伤中,p38 MAPK信号通路可激活MLCK,导致肠黏膜组织形态发生改变,上皮细胞间TJ通透性增加。注射p38 MAPK抑制剂后会降低p38 MAPK磷酸化水平和MLCK基因表达水平。由此可见,MAPK信号通路在MLCK介导的肠黏膜上皮屏障功能紊乱及细胞通透性改变中占据重要地位。
2.2 MLCK介导的MLC磷酸化信号通路肠黏膜通透性改变与MLCK的调节密切相关,而MLC发生磷酸化是肠黏膜上皮TJ屏障功能障碍的关键所在。Moriez等[38]研究发现,注射脂多糖后大鼠的上皮细胞TJ扩张,MLCK被激活,MLC磷酸化程度增加,使得细胞收缩和细胞间隙形成,最终影响结肠黏膜的通透性。注射MLCK特异性抑制剂ML-7后能够显著降低MLCK的活性及其所诱导的屏障功能紊乱。研究报道,用炎性因子如肿瘤坏死因子-α(TNF-α)和干扰素-γ(IFN-γ)处理后的单层上皮细胞模型中,MLCK的表达水平上调,MLC磷酸化明显升高,上皮细胞的屏障功能遭到破坏,而这些结果均能够被MLCK抑制剂所改善[39]。以上结果表明,MLCK所介导的MLC磷酸化信号通路在内毒素或不同炎性因子所引起的肠上皮屏障功能损害的发生机制中具有重要作用。
陈传莉[40]研究表明,小鼠早期严重烧伤以及缺氧引起的肠黏膜通透性升高,会伴随有MLCK蛋白表达水平及MLC磷酸化程度增加,注射ML-9抑制剂后MLC磷酸化被抑制。除此之外,MLCK所介导的MLC磷酸化信号通路也参与了热应激所导致的肠黏膜上皮屏障功能损害的发生,当注射ML-7特异性抑制剂后能够阻止MLC磷酸化以及肠黏膜上皮通透性增加。
MLC磷酸化除了主要受MLCK的调控外,还受到肌球蛋白轻链磷酸酶(myosin light chain phosphatase, MLCP)的负调控[41]。Rho激酶(Rho kinase, ROCK)能够与MLCP亚基作用,造成MLCP失活,进而阻止MLCP对MLC的去磷酸化作用,使得胞浆内的MLC磷酸化水平增加[42]。严重烧伤后肠黏膜ROCK激活和MLC磷酸化水平增加,是导致大鼠肠黏膜通透性增加及屏障功能损害的分子机制之一。因此,ROCK激活是导致MLC磷酸化的又一原因。
2.3 蛋白激酶C(protein kinase C, PKC)PKC是20世纪70年代被发现的一类由Ca2+激活的磷脂依赖性蛋白激酶,在哺乳动物的组织、器官以及细胞中广泛分布,通过蛋白质磷酸化的催化作用,对动物细胞生长、分化、代谢、信息传递及信号转导等具有重要的调节作用[43]。PKC的分子质量为70~90 ku,分子结构由N端的调节区域和C端的催化区域组成,该蛋白激酶一旦被激活会转移到细胞膜对其蛋白底物进行磷酸化作用并引发许多细胞内反应[44],但在不同的细胞中,PKC激活的亚型及主要通路有所不同。作为一种蛋白激酶,PKC可直接作用于MLC的丝氨酸/苏氨酸残基,使MLC发生磷酸化;也可通过激活MLCK,引起细胞骨架蛋白MLC磷酸化而导致细胞结构蛋白的重组排列[45]。研究表明,当肠黏膜上皮细胞PKC被激活后,MLCK磷酸化状态及其酶活性会发生改变,进而引起MLC磷酸化状态的改变,影响周围连接肌动球蛋白环的收缩,最终导致肠黏膜上皮通透性增加[46]。因此,PKC可通过磷酸化MLCK介导肠黏膜上皮屏障功能发生改变。
2.4 Ca2+浓度Ca2+在维持肠黏膜上皮正常生理功能中扮演重要角色,细胞内游离Ca2+浓度改变调节着细胞的能量代谢、蛋白质磷酸化和去磷酸化修饰、基因表达和调控等活动[47]。Ca2+是调节MLCK活性的最基本介质,通过与CaM结合并激活MLCK是决定MLC磷酸化和引起细胞收缩的重要因素[23, 48]。研究表明,细胞外Ca2+浓度降低时能够激活细胞内MLCK的活性,肌动蛋白和肌球蛋白发生向心性收缩,细胞间TJ破坏,进而导致肠黏膜上皮屏障功能遭到破坏,使其通透性增加[49]。Ma等[50]研究发现,Ca2+诱导的肠黏膜上皮TJ屏障功能改变与MLCK激活有关,使用MLCK抑制剂ML-7后能够阻止MLCK活化以及肠黏膜上皮细胞通透性增加,这说明Ca2+通过活化MLCK引起肠黏膜上皮通透性增加。此外,Ca2+通道是一种细胞膜上的、与Ca2+转运相关的特定蛋白质,其激活对于细胞内外Ca2+浓度的调控至关重要,Ca2+通道在MLCK介导肠黏膜上皮通透性增加的过程中也发挥重要作用。
3 小结多种信号分子可通过不同的信号转导通路激活MLCK,导致肠黏膜上皮屏障功能紊乱。其中MLCK介导的MLC磷酸化为MLCK介导肠黏膜通透性增加的关键环节,同时也是细胞内多种信号通路的中心环节。MLCK活性及其蛋白质表达水平增加均可引起MLC磷酸化程度增加,细胞间TJ发生改变,导致细胞收缩和细胞间隙增大,从而影响肠黏膜上皮屏障功能,通透性增加。近年来,MLCK介导肠黏膜上皮屏障损伤机制的研究取得了很多进展,但有关这方面的研究主要集中在人类和单胃动物上,在反刍动物上的研究较少,因此,有必要进一步探索MLCK对反刍动物肠黏膜上皮屏障功能及分子调控机制的影响。同时,随着大数据时代的到来,生物信息学在动物营养学代谢疾病的研究中取得广泛应用,这对更好地挖掘参与MLCK介导反刍动物肠黏膜通透性改变的关键信号通路以及相关的上下游功能基因具有指导意义,更为今后探索防治肠黏膜上皮屏障功能损害的新型技术措施提供理论依据。
| [1] |
BARRETT K E. New ways of thinking about (and teaching about) intestinal epithelial function[J]. Advances in Physiology Education, 2008, 32(1): 25-34. DOI:10.1152/advan.00092.2007 |
| [2] |
YAN L, YANG C H, TANG J G. Disruption of the intestinal mucosal barrier in Candida albicans infections[J]. Microbiological Research, 2013, 168(7): 389-395. DOI:10.1016/j.micres.2013.02.008 |
| [3] |
GOSAIN A, GAMELLI R L. Role of the gastrointestinal tract in burn sepsis[J]. Journal of Burn Care and Rehabilitation, 2005, 26(1): 85-91. DOI:10.1097/01.BCR.0000150212.21651.79 |
| [4] |
NAGPAL K, MINOCHA V R, AGRAWAL V, et al. Evaluation of intestinal mucosal permeability function in patients with acute pancreatitis[J]. The American Journal of Surgery, 2006, 192(1): 24-48. DOI:10.1016/j.amjsurg.2006.02.001 |
| [5] |
DU L, KIM J J, SHEN J, et al. Crosstalk between inflammation and ROCK/MLCK signaling pathways in gastrointestinal disorders with intestinal hyperpermeability[J]. Gastroenterology Research and Practice, 2016, 2016: 7374197. |
| [6] |
EIKEMO H, MOLTZAU L R, HUSSAIN R I, et al. CaMKⅡ in addition to MLCK contributes to phosphorylation of regulatory light chain in cardiomyocytes[J]. Biochemical and Biophysical Research Communications, 2016, 471(1): 219-225. DOI:10.1016/j.bbrc.2016.01.132 |
| [7] |
KAMM K E, STULL J T. Dedicated myosin light chain kinases with diverse cellular functions[J]. Journal of Biological Chemistry, 2001, 276(7): 4527-4530. DOI:10.1074/jbc.R000028200 |
| [8] |
HE W Q, PENG Y J, ZHANG W C, et al. Myosin light chain kinase is central to smooth muscle contraction and required for gastrointestinal motility in mice[J]. Gastroenterology, 2008, 135(2): 610-620. DOI:10.1053/j.gastro.2008.05.032 |
| [9] |
CHEN D P, LIN Y, XIONG Y J. Epithelial MLCK and smooth muscle MLCK may play different roles in the development of inflammatory bowel disease[J]. Digestive Diseases and Science, 2014, 59(5): 1068-1069. DOI:10.1007/s10620-014-3101-y |
| [10] |
SHEN L, TURNER J R. Role of epithelial cells in initiation and propagation of intestinal inflammation.Eliminating the static:tight junction dynamics exposed[J]. American Journal of Physiology-Gastrointestinal and Liver Physiology, 2006, 290(4): G577-G582. DOI:10.1152/ajpgi.00439.2005 |
| [11] |
FENG H, HALDEMAN B D, JACKSON D, et al. Biochemistry of smooth muscle myosin light chain kinase[J]. Archives of Biochemistry and Biophysics, 2011, 510(2): 135-146. DOI:10.1016/j.abb.2011.04.018 |
| [12] |
SMITH L, SU X P, LIN P J, et al. Identification of a novel actin binding motif in smooth muscle myosin light chain kinase[J]. Journal of Biological Chemistry, 1999, 274(41): 29433-29438. DOI:10.1074/jbc.274.41.29433 |
| [13] |
GALLAGHER P J, STULL J T. Localization of an actin binding domain in smooth muscle myosin light chain kinase[J]. Molecular and Cellular Biochemistry, 1997, 173(1/2): 51-57. DOI:10.1023/A:1006876318155 |
| [14] |
YE L H, HAYAKAWA K, KISHI H, et al. The structure and function of the actin-binding domain of myosin light chain kinase of smooth muscle[J]. Journal of Biological Chemistry, 1997, 272(51): 32182-32189. DOI:10.1074/jbc.272.51.32182 |
| [15] |
YANG X, WANG J G, MA D B, et al. Myosin light chain kinase regulates hearing in mice by influencing the F-actin cytoskeleton of outer hair cells and cochleae[J]. International Journal of Molecular Medicine, 2014, 33(4): 905-912. DOI:10.3892/ijmm.2014.1634 |
| [16] |
ROUX E, MBIKOU P, FAJMUT A.Role of protein kinase network in excitation-contraction coupling in smooth muscle cell[M].Intech Open Access Publisher, 2012: 287-320.
|
| [17] |
CHAMPAGNE M B, EDWARDS K A, ERICKSON H P, et al. Drosophila stretchin-MLCK is a novel member of the titin/myosin light chain kinase family[J]. Journal of Molecular Biology, 2000, 300(4): 759-777. DOI:10.1006/jmbi.2000.3802 |
| [18] |
HEIERHORST J, TANG X X, LEI J Y, et al. Substrate specificity and inhibitor sensitivity of Ca2+/S100-dependent twitchin kinases[J]. European Journal of Biochemistry, 1996, 242(3): 454-459. |
| [19] |
SMITH J L, SILVEIRA L A, SPUDICH J A. Activation of dictyostelium myosin light chain kinase A by phosphorylation of Thr166[J]. EMBO Journal, 1996, 15(22): 6075-6083. DOI:10.1002/embj.1996.15.issue-22 |
| [20] |
SHEN L, BLACK E D, WITKOWSKI E D, et al. Myosin light chain phosphorylation regulates barrier function by remodeling tight junction structure[J]. Journal of Cell Science, 2006, 119(10): 2095-2106. DOI:10.1242/jcs.02915 |
| [21] |
CONNELL L E, HELFMAN D M. Myosin light chain kinase plays a role in the regulation of epithelial cell survival[J]. Journal of Cell Science, 2006, 119(11): 2269-2281. DOI:10.1242/jcs.02926 |
| [22] |
HONG F, HALDEMAN B D, JOHN O A, et al. Characterization of tightly associated smooth muscle myosin-myosin light-chain kinase-calmodulin complexes[J]. Journal of Molecular Biology, 2009, 390(5): 879-892. DOI:10.1016/j.jmb.2009.05.033 |
| [23] |
GAO N, HUANG J, HE W Q, et al. Signaling through myosin light chain kinase in smooth muscles[J]. Journal of Biological Chemistry, 2013, 288(11): 7596-7605. DOI:10.1074/jbc.M112.427112 |
| [24] |
BELVITCH P, ADYSHEV D, ELANGOVAN V R, et al. Proline-rich region of non-muscle myosin light chain kinase modulates kinase activity and endothelial cytoskeletal dynamics[J]. Microvascular Research, 2014, 95: 94-102. DOI:10.1016/j.mvr.2014.07.007 |
| [25] |
SIMARD E, KOVACS J J, MILLER W E, et al. β-arrestin regulation of myosin light chain phosphorylation promotes AT1aR-mediated cell contraction and migration[J]. PLoS One, 2013, 8(11): e80532. DOI:10.1371/journal.pone.0080532 |
| [26] |
HARHAJ N S, ANTONETTI D A. Regulation of tight junctions and loss of barrier function in pathophysiology[J]. International Journal of Biochemistry and Cell Biology, 2004, 36(7): 1206-1237. DOI:10.1016/j.biocel.2003.08.007 |
| [27] |
MARTÍNEZ C, GONZÁLEZ-CASTRO A, VICARIO M, et al. Cellular and molecular basis of intestinal barrier dysfunction in the irritable bowel syndrome[J]. Gut and Liver, 2012, 6(3): 305-315. DOI:10.5009/gnl.2012.6.3.305 |
| [28] |
BLAIR S A, KANE S V, CLAYBURGH D R, et al. Epithelial myosin light chain kinase expression and activity are upregulated in inflammatory bowel disease[J]. Laboratory Investigation, 2006, 86(2): 191-201. DOI:10.1038/labinvest.3700373 |
| [29] |
TURNER J R. Molecular basis of epithelial barrier regulation:from basic mechanisms to clinical application[J]. The American Journal of Pathology, 2006, 169(6): 1901-1909. DOI:10.2353/ajpath.2006.060681 |
| [30] |
CHEN C, TAO T, WEN C, et al. Myosin light chain kinase (MLCK) regulates cell migration in a myosin regulatory light chain phosphorylation-independent mechanism[J]. Journal of Biological Chemistry, 2014, 289(41): 28478-28488. DOI:10.1074/jbc.M114.567446 |
| [31] |
BIRUKOVA A A, TIAN X Y, COKIC L, et al. Endothelial barrier disruption and recovery is controlled by substrate stiffness[J]. Microvascular Research, 2013, 87: 50-57. DOI:10.1016/j.mvr.2012.12.006 |
| [32] |
CAO M, WANG P, SUN C H, et al. Amelioration of IFN-γ and TNF-α-induced intestinal epithelial barrier dysfunction by berberine via suppression of MLCK-MLC phosphorylation signaling pathway[J]. PLoS One, 2013, 8(5): e61944. DOI:10.1371/journal.pone.0061944 |
| [33] |
MU X W, PAN C, ZHENG S Y, et al. Protective effects of carbon monoxide-releasing molecule-2 on the barrier function of intestinal epithelial cells[J]. PLoS One, 2014, 9(8): e104032. DOI:10.1371/journal.pone.0104032 |
| [34] |
STURGILL T W, RAY L B, ANDERSON N G, et al. Purification of mitogen-activated protein kinase from epidermal growth factor-treated 3T3-L1 fibroblasts[J]. Methods in Enzymology, 1991, 200: 342-351. DOI:10.1016/0076-6879(91)00151-L |
| [35] |
KYRIAKIS J M, AVRUCH J. Mammalian mitogen-activated protein kinase signal transduction pathways activated by stress and inflammation[J]. Physiological Reviews, 2001, 81(2): 807-869. DOI:10.1152/physrev.2001.81.2.807 |
| [36] |
AL-SADI R, YE D M, SAID H M, et al. Cellular and molecular mechanism of interleukin-1β modulation of Caco-2 intestinal epithelial tight junction barrier[J]. Journal of Cell Molecular Medicine, 2011, 15(4): 970-982. DOI:10.1111/jcmm.2011.15.issue-4 |
| [37] |
丁少桢, 丁浩, 梅俏, 等. 同型半胱氨酸调控MEK-ERK-MLCK通路影响结肠炎大鼠肠黏膜通透性的实验研究[J]. 中国药理学通报, 2016, 32(4): 498-502. DOI:10.3969/j.issn.1001-1978.2016.04.012 |
| [38] |
MORIEZ R, SALVADOR-CATTIER C, THEODOROU V, et al. Myosin light chain kinase is involved in lipopolysaccharide-induced disruption of colonic epithelial barrier and bacterial translocation in rats[J]. The American Journal of Pathology, 2005, 167(4): 1071-1079. DOI:10.1016/S0002-9440(10)61196-0 |
| [39] |
ZOLOTAREVSKY Y, HECHT G, KOUTSOURIS A, et al. A membrane-permeant peptide that inhibits MLC kinase restores barrier function in in vitro models of intestinal disease[J]. Gastroenterology, 2002, 123(1): 163-172. DOI:10.1053/gast.2002.34235 |
| [40] |
陈传莉.肌球蛋白轻链激酶介导的肌球蛋白轻链磷酸化在严重烧伤早期肠黏膜屏障损害中的作用[D].硕士学位论文.重庆: 第三军医大学西南医院烧伤研究所, 2009. http://cpfd.cnki.com.cn/Article/CPFDTOTAL-GZKX201008002076.htm
|
| [41] |
YUEN S L, OGUT O, BROZOVICH F V. Differential phosphorylation of LZ+/LZ-MYPT1 isoforms regulates MLC phosphatase activity[J]. Archives of Biochemistry and Biophysics, 2014, 562: 37-42. DOI:10.1016/j.abb.2014.08.011 |
| [42] |
CARBAJAL J M, SCHAEFFER R C, J r. RhoA inactivation enhances endothelial barrier function[J]. American Journal of Physiology:Cell Physiology, 1999, 277(5 Pt 1): C955-C964. |
| [43] |
INOUE M, KISHIMOTO A, TAKAI Y, et al. Studies on a cyclic nucleotide-independent protein kinase and its proenzyme in mammalian tissues. Ⅱ. Proenzyme and its activation by calcium-dependent protease from rat brain[J]. Journal of Biological Chemistry, 1977, 252(21): 7610-7616. |
| [44] |
XU W C, ZHOU Q, ASHENDEL C L, et al. Novel protein kinase C inhibitors:synthesis and PKC inhibition of β-substituted polythiophene derivatives[J]. Bioorganic & Medicinal Chemistry Letters, 1999, 9(15): 2279-2282. |
| [45] |
于淼, 杨万超, 李文志. 蛋白激酶C信号通路在血脑屏障损伤中的研究进展[J]. 疑难病杂志, 2016, 15(2): 209-212. DOI:10.3969/j.issn.1671-6450.2016.02.029 |
| [46] |
TURNER J R, ANGLE J M, BLACK E D, et al. PKC-dependent regulation of transepithelial resistance:roles of MLC and MLC kinase[J]. American Journal of Physiology, 1999, 277(3): C554-C562. DOI:10.1152/ajpcell.1999.277.3.C554 |
| [47] |
CLAPHAM D E. Calcium signaling[J]. Cell, 2007, 131(6): 1047-1058. DOI:10.1016/j.cell.2007.11.028 |
| [48] |
SANDERS K M, SANG D K, RO S, et al. Regulation of gastrointestinal motility-insights from smooth muscle biology[J]. Nature Reviews Gastroenterology & Hepatology, 2012, 9(11): 633-645. |
| [49] |
陈意, 李方方, 张勇, 等. 肠黏膜上皮组织紧密连接的生物学功能和作用机理[J]. 动物营养学报, 2017, 29(9): 3068-3074. DOI:10.3969/j.issn.1006-267x.2017.09.007 |
| [50] |
MA T Y, TRAN D, HOA N, et al. Mechanism of extracellular calcium regulation of intestinal epithelial tight junction permeability:role of cytoskeletal involvement[J]. Microscopy Research and Technique, 2000, 118(4): 156-168. |




