2. 教育部动物抗病营养重点实验室, 成都 611130;
3. 四川农业大学动物科技学院, 成都 611130
2. Key Laboratory of Animal Disease-Resistance Nutrition, Ministry of Education, Chengdu 611130, China;
3. College of Animal Science, Sichuan Agricultural University, Chengdu 611130, China
病毒是专性细胞内寄生微生物,只能利用宿主细胞的生化装置来进行自我复制,其侵袭扰乱细胞正常生命活动,导致疾病发生,严重威胁人及动物健康和动物安全生产。营养物质是一切生命活动的物质基础,既影响动物的生产潜力和效率,也决定了动物的健康状况[1]。近年来,大量研究表明人和动物的抗病毒能力与其营养状况密切相关[2-7]。因此,通过营养技术增强动物病毒抵抗力具有重大的理论和实践意义。维生素A也称视黄醇(retinol,ROH),是所有脊椎动物所必需的营养素之一,它不仅具有维持动物正常生长发育的功能[8],同时还有抗感染的能力,被称为“抗感染维生素”[9]。研究发现,维生素A能增强动物抗病毒感染的能力,增强接种病毒疫苗后的保护效应,减轻病毒性传染病的严重程度,降低死亡率[6-7, 10-13]。本文简要总结了维生素A增强动物抗病毒的能力及其机制,以期为进一步深入研究其调节动物抗病毒能力的作用机理提供参考。
1 维生素A增强动物抗病毒能力的活性形式维生素A主要通过其活性代谢产物全反式视黄酸(all-trans retinoic acid,ATRA)发挥增强动物抗病毒的能力。动物摄入的维生素A主要以视黄酯(retinyl esters,REs)的形式储于肝脏星状细胞中[14]。肝脏储存的REs不断地水解产生ROH,并释放进循环系统以供组织细胞吸收利用,维持机体正常需要[15]。组织细胞吸收的ROH首先在视黄醇脱氢酶作用下氧化为视黄醛,然后在视黄醛脱氢酶催化下不可逆地转化为视黄酸(retinoic acid,RA)[16]。RA存在多种异构体,包括ATRA、13-顺式RA(13-cis-RA,13cRA)和9-顺式RA(9-cis-RA,9cRA)等,其中ATRA被认为是维生素A在机体发挥大多数生理功能的活性形式[17-18]。视黄酸受体(retinoic acid receptors,RARs)属于核受体超家族的一类子受体,通常与类视黄醇X受体(retinoid X receptors,RXRs)形成异源二聚体作用于靶基因启动子区的视黄酸反应元件(retinoic acid responsive elements,RARE)来调节基因的转录活性[19]。ATRA作为RARs的天然配体,它发挥作用的经典方式是与RARs的配体结构域结合,增强相关功能基因的诱导表达,进而发挥功能效应[16]。Cho等[20]研究发现维生素A增强动物抗病毒能力的作用与其能否代谢为ATRA密切相关。ATRA增强动物抗病毒能力的作用在多项研究中得到证实[20-25],这与ATRA能调节抗病毒相关分子的表达相关。研究表明,ATRA以RARs依赖的方式发挥增强抗病毒能力的作用[22-23]。可见,维生素A主要通过转化为ATRA以RARs依赖的方式发挥其增强动物抗病毒能力的作用。
2 维生素A对动物抗病毒能力的影响维生素A在机体抵抗单链(ss)RNA病毒、双链(ds)RNA病毒及DNA病毒感染的过程中发挥着重要作用(表 1)。ssRNA病毒包括不分节段(副黏病毒科、丝状病毒科、弹状病毒科和博尔纳病毒科)和分节段(正黏病毒科、布尼亚病毒病毒科和沙粒病毒科)两大类[26]。目前维生素A抗(-)ssRNA病毒的研究集中于副黏病毒科,该病毒科主要包括麻疹病毒、腮腺炎病毒、犬瘟热病毒和新城疫病毒等。麻疹病毒和腮腺炎病毒的宿主主要是人类,二者感染分别引起麻疹和腮腺炎。临床研究显示补充维生素A能减少麻疹病毒感染引起的发病率和死亡率[27-28],表明维生素A在抗麻疹病毒的过程中起着重要作用。因此,世界卫生组织推荐维生素A用于治疗儿童急性麻疹[29]。Trottier等[22]研究发现,生理浓度的ROH能显著抑制外周血单核细胞以及多种细胞系中麻疹病毒的复制增殖,证实了维生素A的抗麻疹病毒作用。Soye等[23]研究发现,ROH剂量依赖性地抑制腮腺炎病毒复制增殖,表明维生素A具有抗腮腺炎病毒作用。新城疫病毒主要感染禽类,对鸡等常见家禽具有高度的传染性和致死性。Okpe等[6]在仔鸡的商业饲料中按照每千克饲粮额外补充600 IU维生素A,发现在仔鸡饲粮中额外补充600 IU维生素A延迟了新城疫病毒攻毒后临床标志出现的时间和显著减轻了感染后组织器官损伤和疾病症状,攻毒后的死亡率相对于未补充组降低了36%,表明补充维生素A能在一定程度上增强仔鸡抗新城疫病毒的能力。犬瘟热病毒是一种严重威胁犬科和猫科等动物健康的病毒。Rodeheffer等[7]报道,给维生素A充足的雪貂鼻内接种犬瘟热病毒,发现在接种当天和接种后第1天肌肉注射30 mg维生素A的雪貂没有明显的感染症状,而未注射维生素A的雪貂出现明显的感染症状,表明维生素A具有增强雪貂抗犬瘟热病毒能力的作用。由于已有的研究对象集中于(-)ssRNA病毒的副黏病毒科成员,维生素A是否能增强动物抗其他(-)ssRNA病毒的能力有待进一步研究。
|
|
表 1 维生素A对不同病毒感染的作用 Table 1 Effects of vitamin A on different viral infections |
(+)ssRNA病毒主要包括诺如病毒、肠道病毒71型和丙型肝炎病毒等。诺如病毒是一种无囊膜病毒,感染人和动物后可引起急性病毒性胃肠炎。Lee等[24]研究发现,ROH能以剂量依赖的方式抑制鼠科诺如病毒在鼠巨噬细胞系RAW 264.7和小鼠体内的复制,说明维生素A具有抑制诺如病毒的作用。肠道病毒71型是小RNA病毒科肠道病毒属成员,是手足口病的主要病原体之一。Chen等[25]发现ATRA处理可显著减少肠道病毒71型感染细胞数量和抑制病毒感染引起的细胞凋亡,说明维生素A可能通过代谢产生ATRA发挥抗肠道病毒71型的作用。丙型肝炎病毒是一种具有包膜的黄病毒科病毒,是引起输血后肝炎的主要病原体。Bitetto等[5]报道,大部分丙型肝炎病毒感染的病人存在血清维生素A缺乏现象,且这种缺乏与抗病毒治疗无效有关。Cho等[20]和Murakami等[31]研究均发现ATRA能抑制丙型肝炎病毒复制,表明维生素A可通过代谢产物ATRA发挥抗丙型肝炎病毒的作用。
目前关于维生素A对dsRNA和DNA病毒影响的研究报道很有限。轮状病毒是一种属于呼肠孤病毒科的dsRNA病毒,是引起儿童和仔猪病毒性腹泻的主要病原体之一。Chattha等[12]报道,维生素A缺乏组和充足组的仔猪分别经轮状病毒攻毒后,缺乏组的腹泻严重程度和持续时间以及粪便中病毒滴度都显著高于充足组,表明维生素A具有增强动物抗轮状病毒能力的作用。Kandasamy等[13]报道,通过使用轮状病毒攻毒已接种轮状病毒疫苗后的无菌仔猪来评价疫苗的保护效率,发现接种疫苗对产前和产后2个阶段维生素A都缺乏组和充足组无菌仔猪的腹泻保护效率分别为25%和100%,缺乏组粪便中的病毒滴度是充足组的350倍,表明在仔猪产前和产后2个阶段维生素A缺乏损害了接种轮状病毒疫苗的保护效应。腺病毒属于dsDNA病毒,是引起人畜共患的急性传染病的病原体之一。血清谷草转氨酶和谷丙转氨酶活性及肝脏炎性浸润可反映肝脏炎症和损伤。Jie等[30]报道,复制缺陷型重组腺病毒诱导的肝炎模型小鼠腹腔注射ATRA显著降低了血清谷草转氨酶和谷丙转氨酶活性及肝脏炎性浸润,表明ATRA能减轻腺病毒感染导致的肝脏炎症和损伤。可见,维生素A可通过代谢产物ATRA发挥抗腺病毒的作用。
3 维生素A增强抗病毒能力的机制 3.1 提高视黄酸诱导基因-Ⅰ(retinoic acid-induced gene Ⅰ,RIG-Ⅰ)受体介导的干扰素-Ⅰ(interferon-Ⅰ,IFN-Ⅰ)表达以增强天然抗病毒免疫反应天然抗病毒免疫反应对于限制病毒的早期扩散是必不可少的,维生素A能以视黄酸受体α(retinoic acid receptors α,RARα)依赖的方式上调RIG-Ⅰ的表达,增强RIG-Ⅰ介导的信号级联反应,促进IFN-Ⅰ的诱生来增强天然抗病毒免疫反应。细胞对病毒入侵的感知能力依赖于一类能特异性地识别病毒表达的病原相关分子模式的模式识别受体,这类受体主要包括Toll样受体(Toll-like receptors,TLRs)和RIG-Ⅰ样受体(RIG-Ⅰ like receptors,RLRs)[32-33]。RIG-Ⅰ是RLRs的一个核心成员,研究表明ATRA在抗(-)ssRNA病毒(麻疹病毒和腮腺炎病毒)和(+)ssRNA病毒(肠道病毒71型)反应过程中能以RARα依赖的方式上调RIG-Ⅰ的表达[23, 25, 34]。ATRA发挥的抗麻疹病毒和腮腺炎病毒的反应也被证实需要RIG-Ⅰ参与[23, 34]。干扰素调节因子-1(interferon regulatory factor-1,IRF-1)是一种转录因子,能结合于RIG-Ⅰ基因启动子,且这种结合作用对RIG-Ⅰ的诱导表达是至关重要的[34]。研究表明,ATRA能以RAR依赖的方式上调IRF-1的表达和增加IRF-1核定位数量以及招募IRF-1至RIG-Ⅰ启动子[23, 34]。因此,ATRA能通过IRF-1信号途径上调RIG-Ⅰ的诱导表达,增强细胞对病毒的识别能力。RIG-Ⅰ识别病毒RNA后触发下游的信号级联反应,导致干扰素调节因子-3(interferon regulatory factor-3, IRF-3)、干扰素调节因子-7(interferon regulatory factor-7,IRF-7)和核因子-κB(nuclear factor-κB,NF-κB)等转录调节因子的激活,进而诱导IFN-Ⅰ等抗病毒基因的表达。IFN-Ⅰ包括干扰素-β(interferon-β,IFN-β)和多种干扰素-α(interferon-α,IFN-α)的亚型,是早期中断病毒复制阻止病毒扩散的关键免疫分子[28]。研究表明,ATRA能通过RIG-Ⅰ信号途径上调IFN-Ⅰ的表达而抑制麻疹病毒、腮腺炎病毒和肠道病毒71型感染[23, 34-35]。综上,ATRA可能通过IRF-1信号途径上调RIG-Ⅰ的表达,提高机体对病毒的识别能力,以促进RIG-Ⅰ介导的IFN-Ⅰ表达,增强IFN-Ⅰ介导的抗病毒天然免疫反应,发挥抗病毒作用(图 1)。
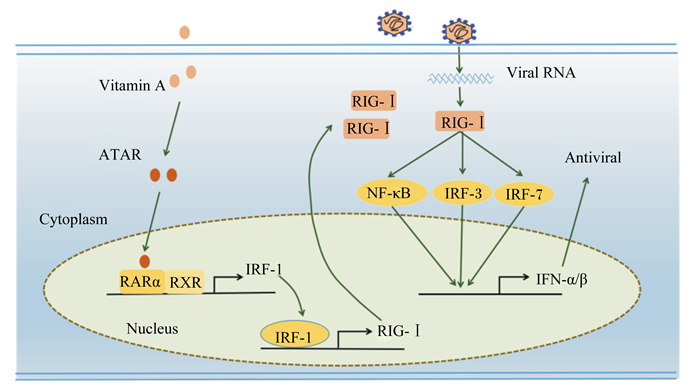
|
Vitamin A:维生素A;Cytoplasm:细胞质;Nucleus:细胞核;Viral RNA:病毒RNA;Antiviral:抗病毒;ATAR:全反式视黄酸all-trans retinoic acid;RARα:视黄酸受体α retinoic acid receptors α;RXRs:类视黄醇X受体retinoid X receptors;IRF-1:干扰素调节因子-1 interferon regulatory factor-1;RIG-Ⅰ:视黄酸诱导基因-Ⅰ retinoic acid-induced gene Ⅰ;IRF-3:干扰素调节因子-3 interferon regulatory factor-3;IRF-7:干扰素调节因子-7 interferon regulatory factor-7;NF-κB:核因子-κB nuclear factor-κB;IFN-α/β:干扰素-α/β interferon-α/β。 图 1 维生素A调节RIG-Ⅰ介导的IFN-Ⅰ抗病毒途径的可能机制 Figure 1 Potential mechanism of vitamin A modulates RIG-Ⅰ-mediated IFN-Ⅰ antiviral pathway |
病毒是一种良好的抗原,能引起适应性免疫应答,B淋巴细胞接受抗原刺激后增殖分化成为浆细胞产生免疫球蛋白,介导体液免疫抑制病毒感染。IgA是黏膜分泌液中的主要免疫球蛋白,主要分布于唾液、呼吸道、消化道等黏膜表面,是机体抵抗病毒等微生物感染的第1道防线。研究表明维生素A在调节呼吸道等部位IgA对病毒及疫苗的黏膜免疫反应中发挥重要作用。小鼠分别饲喂2种不同水平维生素A的饲粮,鼻内接种甲型流感病毒H3N2后,高维生素A水平组唾液中的病毒特异性抗体滴度显著高于低水平组[36]。维生素A缺乏显著降低小鼠接种仙台病毒后鼻相关淋巴组织中的病毒特异性IgA抗体滴度,但在接种病毒的同时通过鼻腔途径给维生素A缺乏小鼠补充视黄醇棕榈酸酯(0.6、6.0、60.0和600.0 IU)后,其病毒特异性抗体滴度呈剂量依赖性提高,在补充60.0 IU时差异显著[37]。小鼠维生素A缺乏降低了流感病毒疫苗(FluMist)接种后诱导的鼻相关淋巴组织病毒特异性IgA抗体滴度;但在维生素A缺乏小鼠接种疫苗的当天和接种后的第3、7天通过强饲补充300 μg RA或600 IU维生素A棕榈酸酯均提高了鼻淋巴组织的病毒特异性IgA抗体滴度[38]。增加IgA抗体形成细胞数量可提高IgA抗体产生。小鼠维生素A缺乏显著减少了仙台病毒接种后在鼻相关淋巴组织诱导的病毒特异性IgA抗体形成细胞数量,但是在接种病毒的同时通过鼻腔给维生素A缺乏小鼠补充视黄醇棕榈酸酯(0.6、6.0、60.0和600.0 IU)后,其病毒特异性IgA抗体形成细胞数量呈剂量依赖性提高,在补充6.0 IU时差异显著[37]。维生素A缺乏显著减少了小鼠接种FluMist疫苗后鼻相关淋巴组织诱导的病毒特异性IgA抗体形成细胞数量,但维生素A缺乏小鼠接种疫苗的当天和接种后的第3、7天通过强饲补充300 μg RA或600.0 IU维生素A棕榈酸酯均显著增加鼻淋巴组织的病毒特异性IgA抗体形成细胞数量[38]。以上这些结果表明适宜水平的维生素A和RA能增加病毒及其疫苗诱导的特异性IgA抗体形成细胞数量,提高病毒特异性IgA抗体分泌水平,增强黏膜IgA介导的适应性抗病毒能力。
3.3 增加肠道具有抗病毒活性乳杆菌的数量发挥抗病毒作用动物肠道微生物通过与黏膜免疫系统的交互作用在病原体感染和黏膜免疫反应过程中发挥着至关重要的作用[39-40]。乳杆菌属作为肠道菌群的重要组成部分,其部分成员具有抗病毒活性[24, 41]。研究发现,4种不同的乳杆菌菌株(L. ruminis SPM 1308、L. fermentum KCTC 3112、L. rhamnosus KCTC 18427P和L. reuteri KCTC 18428P)能显著抑制RAW264.7细胞中诺如病毒复制,且显著上调RAW264.7细胞IFN-β mRNA的丰度,表明这4种乳杆菌能通过上调IFN-β基因的表达抑制诺如病毒复制[24]。饲粮组成是影响肠道菌群结构的重要因素之一。给小鼠分别饲喂维生素A缺乏饲粮和维生素A充足饲粮(含维生素A 3 000 IU/kg),结果发现,缺乏组小鼠的空肠、回肠和盲肠部位的细菌总量与充足组相比均显著增加,但3个乳杆菌属相对数量比充足组分别减少62%、82%和86%,表明适宜水平的维生素A具有增加肠道乳杆菌属细菌数量的作用[42]。因此,维生素A可能通过调节肠道菌群结构,提高肠道菌群组成中具有抗病毒活性的乳杆菌属细菌数量,间接增强机体抵抗病毒感染的能力,但维生素A影响肠道菌群结构的具体机制有待进一步研究。
4 小结综上所述,维生素A具有增强动物抗病毒能力的作用,其发挥作用的机制与上调RIG-Ⅰ介导的IFN-Ⅰ表达增强天然抗病毒反应,提高病毒特异性IgA分泌增强适应性抗病毒免疫反应,以及调节肠道菌群增加具有抗病毒活性乳杆菌的数量等途径有关。在畜禽生产中,饲粮中充足的维生素A既能增强畜禽病毒抵抗力,也能增强疫苗的保护效应。但维生素A增强抗病毒能力的具体机制仍待进一步研究。
| [1] |
陈代文, 毛湘冰, 余冰, 等. 猪抗病营养研究进展[J]. 动物营养学报, 2014, 26(10): 2992-3002. DOI:10.3969/j.issn.1006-267x.2014.10.011 |
| [2] |
HANSDOTTIR S, MONICK M M, LOVAN N, et al. Vitamin D decreases respiratory syncytial virus induction of NF-kappaB-linked chemokines and cytokines in airway epithelium while maintaining the antiviral state[J]. Journal of Immunology, 2010, 184(2): 965-974. DOI:10.4049/jimmunol.0902840 |
| [3] |
FARNIK H, BOJUNGA J, BERGER A, et al. Low vitamin D serum concentration is associated with high levels of hepatitis B virus replication in chronically infected patients[J]. Hepatology, 2013, 58(4): 1270-1276. DOI:10.1002/hep.v58.4 |
| [4] |
ZHAO Y, YU B, MAO X B, et al. Dietary vitamin D supplementation attenuates immune responses of pigs challenged with rotavirus potentially through the retinoic acid-inducible gene Ⅰ signalling pathway[J]. British Journal of Nutrition, 2014, 112(3): 381-389. DOI:10.1017/S000711451400097X |
| [5] |
BITETTO D, BORTOLOTTI N, FALLETI E, et al. Vitamin A deficiency is associated with hepatitis C virus chronic infection and with unresponsiveness to interferon-based antiviral therapy[J]. Hepatology, 2013, 57(3): 925-933. DOI:10.1002/hep.26186 |
| [6] |
OKPE G C, EZEMA W S, SHOYINKA S V, et al. Vitamin A dietary supplementation reduces the mortality of velogenic Newcastle disease significantly in cockerels[J]. International Journal of Experimental Pathology, 2015, 96(5): 326-331. DOI:10.1111/iep.12138 |
| [7] |
RODEHEFFER C, VON MESSLING V, MILOT S, et al. Disease manifestations of canine distemper virus infection in ferrets are modulated by vitamin A status[J]. The Journal of Nutrition, 2007, 137(8): 1916-1922. DOI:10.1093/jn/137.8.1916 |
| [8] |
CAÑETE A, CANO E, MUÑOZ-CHÁPULI R, et al. Role of vitamin A/retinoic acid in regulation of embryonic and adult hematopoiesis[J]. Nutrients, 2017, 9(2): 159. DOI:10.3390/nu9020159 |
| [9] |
GREEN H N, MELLANBY E. Vitamin A as an anti-infective agent[J]. British Medical Journal, 1928, 2(3537): 691-696. DOI:10.1136/bmj.2.3537.691 |
| [10] |
MWANZA-LISULO M, KELLY P. Potential for use of retinoic acid as an oral vaccine adjuvant[J]. Philosophical Transactions of the Royal Society B:Biological Sciences, 2015, 370(1671): 20140145. DOI:10.1098/rstb.2014.0145 |
| [11] |
VLASOVA A N, CHATTHA K S, KANDASAMY S, et al. Prenatally acquired vitamin A deficiency alters innate immune responses to human rotavirus in a gnotobiotic pig model[J]. The Journal of Immunology, 2013, 190(9): 4742-4753. DOI:10.4049/jimmunol.1203575 |
| [12] |
CHATTHA K S, KANDASAMY S, VLASOVA A N, et al. Vitamin A deficiency impairs adaptive B and T cell responses to a prototype monovalent attenuated human rotavirus vaccine and virulent human rotavirus challenge in a gnotobiotic piglet model[J]. PLoS One, 2013, 8(12): e82966. DOI:10.1371/journal.pone.0082966 |
| [13] |
KANDASAMY S, CHATTHA K S, VLASOVA A N, et al. Prenatal vitamin A deficiency impairs adaptive immune responses to pentavalent rotavirus vaccine (RotaTeq®) in a neonatal gnotobiotic pig model[J]. Vaccine, 2014, 32(7): 816-824. DOI:10.1016/j.vaccine.2013.12.039 |
| [14] |
CHELSTOWSKA S, WIDJAJA-ADHI M A K, SILVAROLI J A, et al. Molecular basis for vitamin A uptake and storage in vertebrates[J]. Nutrients, 2016, 8(11): 676. DOI:10.3390/nu8110676 |
| [15] |
HALL J A, GRAINGER J R, SPENCER S P, et al. The role of retinoic acid in tolerance and immunity[J]. Immunity, 2011, 35(1): 13-22. DOI:10.1016/j.immuni.2011.07.002 |
| [16] |
ERKELENS M N, MEBIUS R E. Retinoic acid and immune homeostasis:a balancing act[J]. Trends in Immunology, 2017, 38(3): 168-180. DOI:10.1016/j.it.2016.12.006 |
| [17] |
ARNOLD S L M, AMORY J K, WALSH T J, et al. A sensitive and specific method for measurement of multiple retinoids in human serum with UHPLC-MS/MS[J]. Journal of Lipid Research, 2012, 53(3): 587-598. DOI:10.1194/jlr.D019745 |
| [18] |
STEVISON F, JING J, TRIPATHY S, et al. Role of retinoic acid-metabolizing cytochrome p450s, CYP26, in inflammation and cancer[J]. Advances in Pharmacology, 2015, 74: 373-412. DOI:10.1016/bs.apha.2015.04.006 |
| [19] |
BASTIEN J, ROCHETTE-EGLY C. Nuclear retinoid receptors and the transcription of retinoid-target genes[J]. Gene, 2004, 328: 1-16. DOI:10.1016/j.gene.2003.12.005 |
| [20] |
CHO N E, BANG B R, GURUNG P, et al. Retinoid regulation of antiviral innate immunity in hepatocytes[J]. Hepatology, 2016, 63(6): 1783-1795. DOI:10.1002/hep.28380 |
| [21] |
HANLEY T M, KIEFER H L B, SCHNITZLER A C, et al. Retinoid-dependent restriction of human immunodeficiency virus type 1 replication in monocytes/macrophages[J]. Journal of Virology, 2004, 78(6): 2819-2830. DOI:10.1128/JVI.78.6.2819-2830.2004 |
| [22] |
TROTTIER C, CHABOT S, MANN K K, et al. Retinoids inhibit measles virus in vitro via nuclear retinoid receptor signaling pathways[J]. Antiviral Research, 2008, 80(1): 45-53. DOI:10.1016/j.antiviral.2008.04.003 |
| [23] |
SOYE K J, TROTTIER C, Di LENARDO T Z, et al. In vitro inhibition of mumps virus by retinoids[J]. Virology Journal, 2013, 10: 337. DOI:10.1186/1743-422X-10-337 |
| [24] |
LEE H, KO G. Antiviral effect of vitamin A on norovirus infection via modulation of the gut microbiome[J]. Scientific Reports, 2016, 6: 25835. DOI:10.1038/srep25835 |
| [25] |
CHEN S Y, YANG Y, XU J, et al. Effect of all-trans-retinoic acid on enterovirus 71 infection in vitro[J]. British Journal of Nutrition, 2014, 111(9): 1586-1593. DOI:10.1017/S0007114513004133 |
| [26] |
陆承平. 最新动物病毒分类简介[J]. 中国病毒学, 2005, 20(6): 682-688. |
| [27] |
D'SOUZA R M, D'SOUZA R. Vitamin A for the treatment of children with measles-a systematic review[J]. Journal of Tropical Pediatrics, 2002, 48(6): 323-327. DOI:10.1093/tropej/48.6.323 |
| [28] |
HUIMING Y, CHAOMIN W, MENG M. Vitamin A for treating measles in children[J]. The Cochrane Database of Systematic Reviews, 2005, 5(4): 85-86. |
| [29] |
ANONYMOUS. Vitamin A for measles[J]. The Lancet, 1987, 329(8541): 1067-1068. DOI:10.1016/S0140-6736(87)90487-9 |
| [30] |
JIE Z L, LIANG Y J, YI P P, et al. Retinoic acid regulates immune responses by promoting IL-22 and modulating s100 proteins in viral hepatitis[J]. The Journal of Immunology, 2017, 198(9): 3448-3460. DOI:10.4049/jimmunol.1601891 |
| [31] |
MURAKAMI Y, FUKASAWA M, KANEKO Y, et al. Retinoids and rexinoids inhibit hepatitis C virus independently of retinoid receptor signaling[J]. Microbes and Infection, 2014, 16(2): 114-122. DOI:10.1016/j.micinf.2013.10.016 |
| [32] |
TAKEUCHI O, AKIRA S. Pattern recognition receptors and inflammation[J]. Cell, 2010, 140(6): 805-820. DOI:10.1016/j.cell.2010.01.022 |
| [33] |
THOMPSON M R, KAMINSKI J J, KURT-JONES E A, et al. Pattern recognition receptors and the innate immune response to viral infection[J]. Viruses, 2011, 3(6): 920-940. DOI:10.3390/v3060920 |
| [34] |
SOYE K J, TROTTIER C, RICHARDSON C D, et al. RIG-Ⅰ is required for the inhibition of measles virus by retinoids[J]. PLoS One, 2011, 6(7): e22323. DOI:10.1371/journal.pone.0022323 |
| [35] |
TROTTIER C, COLOMBO M, MANN K K, et al. Retinoids inhibit measles virus through a type Ⅰ IFN-dependent bystander effect[J]. The FASEB Journal, 2009, 23(9): 3203-3212. DOI:10.1096/fj.09-129288 |
| [36] |
CUI D M, MOLDOVEANU Z, STEPHENSEN C B. High-level dietary vitamin A enhances T-helper type 2 cytokine production and secretory immunoglobulin a response to influenza A virus infection in BALB/c mice[J]. The Journal of Nutrition, 2000, 130(5): 1132-1139. DOI:10.1093/jn/130.5.1132 |
| [37] |
SURMAN S L, JONES B G, RUDRARAJU R, et al. Intranasal administration of retinyl palmitate with a respiratory virus vaccine corrects impaired mucosal IgA response in the vitamin A-deficient host[J]. Clinical and Vaccine Immunology, 2014, 21(4): 598-601. |
| [38] |
SURMAN S L, JONES B G, SEALY R E, et al. Oral retinyl palmitate or retinoic acid corrects mucosal IgA responses toward an intranasal influenza virus vaccine in vitamin A deficient mice[J]. Vaccine, 2014, 32(22): 2521-2524. DOI:10.1016/j.vaccine.2014.03.025 |
| [39] |
KAMADA N, SEO S U, CHEN G Y, et al. Role of the gut microbiota in immunity and inflammatory disease[J]. Nature Reviews Immunology, 2013, 13(5): 321-335. DOI:10.1038/nri3430 |
| [40] |
CHU H T, MAZMANIAN S K. Innate immune recognition of the microbiota promotes host-microbial symbiosis[J]. Nature Immunology, 2013, 14(7): 668-675. DOI:10.1038/ni.2635 |
| [41] |
SEO B J, MUN M R, KUMAR V J R, et al. Bile tolerant Lactobacillus reuteri isolated from pig feces inhibits enteric bacterial pathogens and porcine rotavirus[J]. Veterinary Research Communications, 2010, 34(4): 323-333. DOI:10.1007/s11259-010-9357-6 |
| [42] |
AMIT-ROMACH E, UNI Z, CHELED S, et al. Bacterial population and innate immunity-related genes in rat gastrointestinal tract are altered by vitamin A-deficient diet[J]. The Journal of Nutritional Biochemistry, 2009, 20(1): 70-77. DOI:10.1016/j.jnutbio.2008.01.002 |




