2. 西华师范大学生命科学学院, 西南野生动植物资源保护教育部重点实验室, 南充 637009
2. Key Laboratory of Southwest China Wildlife Resources Conservation of Ministry of Education, College of Life Science, China West Normal University, Nanchong 637009, China
蛋氨酸与生物体内各种含硫化合物的代谢密切相关,参与新蛋白质的合成[1-2]。动物的快速生长常与蛋白质的合成速度呈正比例关系[3],而蛋白质的合成也是肠道生长发育的重要基础。氨基酸可促进肠道的生长发育,如4.82%支链氨基酸可促进肉鸡肠道的生长发育[4],外源谷氨酰胺的添加也可显著促进肉仔鸡早期肠道的生长发育[5]。此外,饲粮中粗蛋白质水平也可影响猪的生产性能以及胃肠道的发育[6]。因此,蛋氨酸可能对动物的肠道的生长发育有着重要的作用。
动物对蛋氨酸需要量因不同品种、不同日龄、不同生理状态(如妊娠期、哺乳期以及幼仔期)以及不同性别而有差异。蛋氨酸供应不足将会导致动物生长性能以及生理功能受损。蛋氨酸缺乏会降低肉仔鸡体重、食物摄入量和饲料转化效率[7],导致机体蛋白质合成减少[8],影响细胞氧化功能[9]。蛋氨酸缺乏也会造成肉仔鸡免疫器官受损[10-12]。除此之外,蛋氨酸缺乏也可影响心脏、肝脏等脏器某些酶的活性,引起严重的肝脏组织损伤[13]。然而,目前尚未见到蛋氨酸缺乏对肠道发育及其功能的研究。
肠道是机体接触外界抗原物质最直接的部位,肠道具有消化和吸收营养物质、电解质以及吸收水的功能,也可以分泌一些酶及转运蛋白,而管腔内黏膜系统属于重要的机体免疫系统,对于机体防御机能具有重要作用[14]。已有研究指出,肠道的吸收功能与其形态学有着密切的相关性,任何形态学的改变都会导致肠道的功能受损[15-16]。因此,本试验主要通过光学显微镜观察小肠绒毛高度、隐窝深度,以及通过组织化学方法统计杯状细胞的数量变化来研究蛋氨酸缺乏对肉仔鸡小肠发育和功能的影响,为研究蛋氨酸对人及其他动物肠道功能的影响提供一定的参考依据。
1 材料与方法 1.1 试验饲粮和试验动物选取1日龄科宝(Cobb)肉鸡健雏120只,体重为(45±5) g,购于四川省成都市温江正大畜禽有限公司。使用玉米-豆粕型基础饲粮作为对照组饲粮,试验组饲粮为在基础饲粮中不额外添加蛋氨酸。饲粮参照NRC肉鸡营养标准配制,其组成及营养水平见表 1。
|
|
表 1 饲粮组成及营养水平(饲喂基础) Table 1 Composition and nutrient levels of diets (as-fed basis) |
主要试剂:4%多聚甲醛、各浓度梯度(50%、65%、70%、75%、85%、90%、95%和100%)酒精、苏木精、伊红、过碘酸和Schiff染液等。
主要仪器:石蜡切片机(LEICA,KD-2258,浙江省金华市科迪仪器设备有限公司,中国)、光学显微镜(OLMPUS,BA410,麦克奥迪实业集团有限公司,中国)、显微摄相系统(MoticamPro205A,尼康,日本)和Image Pro Plus v6.0(中国)等。
1.3 试验设计 1.3.1 动物分组及饲养管理将120只肉仔鸡随机分为2组,每组6个重复,每个重复10只鸡,其中每组的1个重复用于全程观察。试验期间2组肉仔鸡分别饲喂基础饲粮和蛋氨酸缺乏饲粮,饲养于不锈钢制试验禽笼内,每个重复1个笼子,自由饮水和采食,其他饲养管理方式与常规育雏方案一致,试验期42 d。采样时间点为第14、28和42天。
1.3.2 组织学观察分别于试验第14、28和42天,各组随机选取5只鸡剖杀,取十二指肠、空肠和回肠中段约1 cm的组织样,置于4%多聚甲醛中固定,经流水冲洗后,再使用75%、85%、95%和100%的酒精进行各级脱水,之后用甲苯进行透明处理,最后将样品进行浸蜡、包埋处理,再将样品切成5 μm厚的薄片进行贴片,再经苏木精-伊红(HE)染色,在光学显微镜下观察、拍照,从组织切片上选10个典型视野(绒毛完整、走向平直),测量小肠绒毛高度和隐窝深度,其平均值作为测定数据并计算绒毛高度/隐窝深度(V/C)值。
1.3.3 小肠杯状细胞组织化学观察样品采集及切片制作方法同小肠组织学观察,染色方法用过碘酸希夫-阿利新蓝染色法。
染色步骤如下:常规石蜡切片至水洗;阿利新蓝液染色5 min(滴染);自来水冲洗,再用蒸馏水冲洗;过碘酸液染2~5 min,水洗;Schiff染液染30 min(或多),水洗10 min(细水流冲洗);可选用明矾苏木精复染1 min左右,分化,蓝化;最后水洗、脱水、透明、封片。
染色结果为杯状细胞呈蓝色(酸性黏蛋白)、品红色(含中性黏蛋白)及蓝红混合色(含酸中性黏蛋白混合物)。
显微照相,Image Pro Plus图像分析系统进行杯状细胞计数。方法如下:每只鸡各肠段分别取5张过碘酸希夫-阿利新蓝染色的石蜡切片,每张切片随机取5个视野,统计杯状细胞的数目,计数结果采用Excel 2007进行统计学分析。
1.4 数据统计与分析试验数据采用SPSS 16.0软件进行统计分析。各组数据均以平均值±标准差表示,并用独立样本t检验分析法比较试验组与对照组间差异的显著性, 其中P < 0.05表示差异显著,P < 0.01表示差异极显著。
2 结果 2.1 蛋氨酸缺乏对肉仔鸡小肠形态结构的影响 2.1.1 蛋氨酸缺乏对肉仔鸡十二指肠形态结构的影响由表 2可知,28和42日龄时,与对照组相比,试验组肉仔鸡十二指肠绒毛高度显著或极显著降低(P < 0.05或P < 0.01);14、28和42日龄时,试验组肉仔鸡十二指肠隐窝深度均显著降低(P < 0.05);42日龄时,试验组肉仔鸡十二指肠V/C值也显著降低(P < 0.05)。
|
|
表 2 蛋氨酸缺乏对肉仔鸡十二指肠形态结构的影响 Table 2 Effects of methionine deficiency on duodenal morphological structure of broilers |
由表 3可知,蛋氨酸缺乏对肉仔鸡空肠形态结构的影响变化趋势与十二指肠相似。14、28和42日龄时,与对照组相比,试验组肉仔鸡空肠绒毛高度显著或极显著降低(P < 0.05或P < 0.01);42日龄时,试验组肉仔鸡空肠隐窝深度也极显著低于对照组(P < 0.01);28和42日龄时,试验组肉仔鸡空肠V/C值与对照组相比显著降低(P < 0.05)。
|
|
表 3 蛋氨酸缺乏对肉仔鸡空肠形态结构的影响 Table 3 Effects of methionine deficiency on jejunal morphological structure of broilers |
由表 4可知,14、28和42日龄时,与对照组相比,试验组肉仔鸡回肠绒毛高度均极显著降低(P < 0.01),而隐窝深度也显著或极显著低于对照组(P < 0.05或P < 0.01);14和42日龄时,试验组肉仔鸡回肠V/C值与对照组相比显著或极显著降低(P < 0.05或P < 0.01)。
|
|
表 4 蛋氨酸缺乏对肉仔鸡回肠形态结构的影响 Table 4 Effects of methionine deficiency on ileal morphological structure of broilers |
组织化学检测结果表明杯状细胞主要分布在小肠绒毛上皮细胞之间(图 1~图 3)和隐窝内(图 4~图 6)。
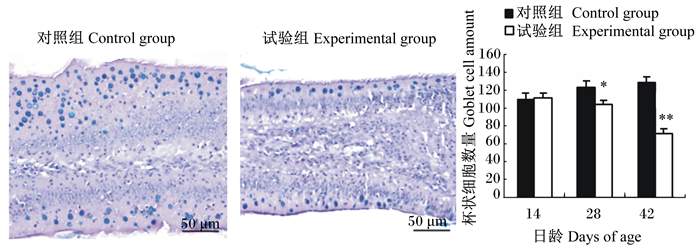
|
*表示与对照组相比差异显著(P< 0.05),**表示与对照组相比差异极显著(P< 0.01)。下图同。 * mean significantly different compared with the control group (P< 0.05), ** mean extremely significantly different compared with the control group (P< 0.01). The same as below. 图 1 十二指肠绒毛上皮细胞间杯状细胞 Figure 1 Goblet cells among epithelial cells of duodenal villi (400×) |
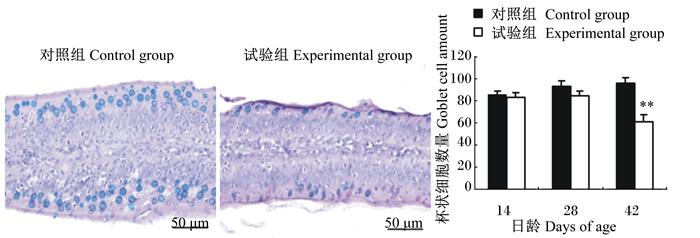
|
图 2 空肠绒毛上皮细胞间杯状细胞 Figure 2 Goblet cells among epithelial cells of jejunal villi (400×) |
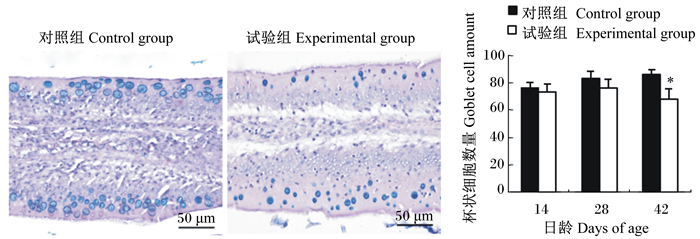
|
图 3 回肠绒毛上皮细胞间杯状细胞 Figure 3 Goblet cells among epithelial cells of ileal villi (400×) |
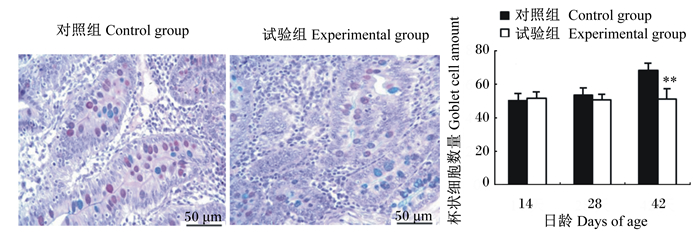
|
图 4 十二指肠隐窝间杯状细胞 Figure 4 Goblet cells in crypt of duodenum (400×) |
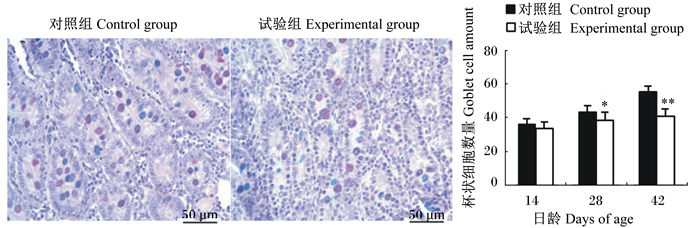
|
图 5 空肠隐窝间杯状细胞 Figure 5 Goblet cells in crypt of jejunum (400×) |
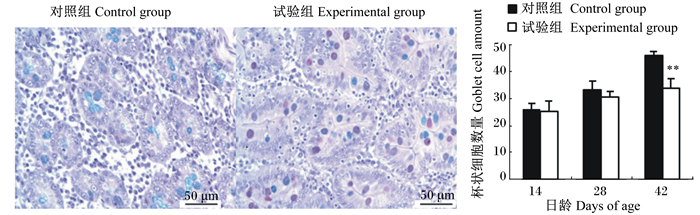
|
图 6 回肠隐窝间杯状细胞 Figure 6 Goblet cells in crypt of ileum (400×) |
如图 1所示,28和42日龄时,与对照组相比,试验组十二指肠绒毛上皮细胞间的杯状细胞数量呈显著或极显著减少(P < 0.05或P < 0.01);如图 2所示,42日龄时,与对照组相比,试验组空肠绒毛上皮细胞间的杯状细胞数量极显著减少(P < 0.01);如图 3所示,42日龄时,试验组回肠绒毛上皮细胞间的杯状细胞数量显著减少(P < 0.05)。
如图 4所示,42日龄时,与对照组相比,试验组十二指肠隐窝间的杯状细胞数量极显著减少(P < 0.01);如图 5所示,28和42日龄时,试验组空肠隐窝间的杯状细胞数量显著或极显著低于对照组(P < 0.05或P < 0.01);如图 6所示,42日龄时,与对照组相比,试验组回肠隐窝间的杯状细胞也极显著减少(P < 0.01)。
3 讨论肠道作为内环境与外环境相通的关键部位,具有十分重要的功能,尤其是小肠黏膜具有免疫屏障功能,可防止肠道微生物和其他毒素对肠道的侵袭,并且小肠作为动物重要的消化吸收器官,具有消化吸收营养物质、矿物质盐以及吸收水的功能[17]。小肠绒毛的完整性决定了其消化吸收的能力[18],同时可以保护机体,防止机体吸收有害物质。据研究显示,饲粮中蛋氨酸的增加有助于维持断奶仔猪小肠黏膜的屏障功能[19-21]。本研究发现,蛋氨酸缺乏会导致肠道发育受阻以及肠道屏障功能受损,主要表现在小肠绒毛高度、隐窝深度以及V/C值降低,小肠杯状细胞数量减少。
肠道内环境的直接表现为绒毛高度、隐窝深度和V/C值,这几项指标是反映肠道健康的重要参数。有研究已证实V/C值是评价机体肠道发育状态的可靠指标[22]。本研究发现,饲粮中蛋氨酸缺乏会对十二指肠、空肠和回肠绒毛细胞产生负面效应,包括绒毛高度缩短、隐窝深度降低以及V/C值降低。研究表明,绒毛高度的增加与肠道消化吸收功能增强密切有关,绒毛高度增加相当于增加了小肠消化吸收的表面积,从而使它的刷状缘酶表达活性增加,营养物质运输功能也随之增强[23-24]。所以我们推测,蛋氨酸缺乏可能会影响肠道刷状缘酶表达活性以及影响营养物质新陈代谢等,最终使肠道相关营养物质的转运和消化吸收能力减弱。此结果表明蛋氨酸缺乏会使小肠的结构受损,导致小肠的生长发育受阻,动物消化吸收营养物质的能力受到抑制,从而降低了动物生长性能和影响动物的正常生长发育。除此之外,因为肠道中有黏膜免疫系统并包含多种参与免疫机制的免疫细胞,所以蛋氨酸缺乏亦可能影响免疫功能。
杯状细胞广泛的分布于肠道上皮细胞之间,并可分泌黏液[25-26],其可合成和分泌大分子量的糖类复合物——黏蛋白[27-28]。黏蛋白是一种糖蛋白,释入管腔内成为润滑性黏液涂布于上皮表面,对上皮具有保护作用,是保护肠道完整性和健康的第1道屏障[29-30]。我们的研究结果显示,蛋氨酸缺乏组的杯状细胞数量在十二指肠、空肠和回肠各段均显著低于对照组。而肠道上皮细胞间杯状细胞的数量变化与肠段、饮食习惯、饲养管理、病原体侵入、个体发育阶段以及物种种类密切相关[27]。在本研究中,通过对比蛋氨酸缺乏组与对照组的试验结果,我们推测小肠杯状细胞数量的减少可能也与蛋白质缺乏有关(动物合成蛋白质的起始氨基酸均为蛋氨酸),并已有试验指出虹鳟鱼饲粮中提高植物蛋白质水平会使肠道中杯状细胞数量增加[30]。通过本次研究表明,蛋氨酸缺乏会减少肉仔鸡小肠杯状细胞数量,对杯状细胞分泌黏蛋白产生负面效应,最终改变黏液层中黏蛋白的结构组成及其理化性质[31],说明小肠黏液层的保护功能降低,肠道的屏障功能受损。而黏蛋白导致的肠道屏障功能受损会影响肠道上皮细胞紧密连接的通透性、免疫调节系统等方面,从而会促使许多肠道疾病如炎症性、溃疡性和肿瘤性疾病的发生[32]。
4 结论蛋氨酸缺乏会造成肉仔鸡小肠(十二指肠、空肠和回肠)绒毛高度、隐窝深度以及V/C值降低,并且导致杯状细胞数量减少。这表明蛋氨酸缺乏时小肠正常发育会受到阻碍,其功能也会受损。
| [1] |
张伦. 开发蛋氨酸市场看好[J]. 中国制药信息, 2005, 21(8): 31-33. |
| [2] |
WATERLOW J C, TOMKINS A, GRANTHAMM-CGREGOR S M. Protein-energy malnutrition[M]. London: Edward Arnold, Hodder & Stoughton, 1992.
|
| [3] |
UTTERY P J. Protein turnover in animals[J]. Tropical Animal Production, 1981, 6(3): 204-213. |
| [4] |
常银莲, 刘国华, 常文环, 等. 支链氨基酸对肉鸡生长性能及肠道发育的影响[J]. 动物营养学报, 2016, 28(1): 79-91. DOI:10.3969/j.issn.1006-267x.2016.01.012 |
| [5] |
戴四发, 王立克, 金光明, 等. 外源谷氨酰胺对AA肉鸡肠道早期生长发育的影响[J]. 中国饲料, 2002(16): 12-13. DOI:10.3969/j.issn.1004-3314.2002.16.006 |
| [6] |
田志梅, 马现永. 日粮蛋白水平对猪胃肠道消化吸收功能及肠道健康的影响[J]. 广东饲料, 2015, 24(9): 35-37. DOI:10.3969/j.issn.1005-8613.2015.09.009 |
| [7] |
KIKUSATO M, SUDO S, TOYOMIZU M. Methionine deficiency leads to hepatic fat accretion via impairment of fatty acid import by carnitine palmitoyltransferase Ⅰ[J]. British Poultry Science, 2015, 56(2): 225-231. DOI:10.1080/00071668.2014.996529 |
| [8] |
MÉTAYER-COUSTARD S, MAMERI H, SEILIEZ I, et al. Methionine deprivation regulates the S6K1 pathway and protein synthesis in avian QM7 myoblasts without activating the GCN2/eIF2 alpha cascade[J]. The Journal of Nutrition, 2010, 140(9): 1539-1545. DOI:10.3945/jn.110.122663 |
| [9] |
TANG Y L, TAN B, XIONG X, et al. Methionine deficiency reduces autophagy and accelerates death in intestinal epithelial cells infected with enterotoxigenic Escherichia coli[J]. Amino Acids, 2015, 47(10): 2199-2204. DOI:10.1007/s00726-014-1781-4 |
| [10] |
HECHT G. Microbial pathogenesis and the intestinal cell[M]. Washington D.C.: ASM, 2003: 60-66.
|
| [11] |
WU B Y, CUI H M, PENG X, et al. Effect of methionine deficiency on the thymus and the subsets and proliferation of peripheral blood T-cell, and serum IL-2 contents in broilers[J]. Journal of Integrative Agriculture, 2012, 11(6): 1009-1019. DOI:10.1016/S2095-3119(12)60093-8 |
| [12] |
Wu B Y, CUI H M, PENG X, et al. Pathology of spleen in chickens fed on a diet deficient in methionine[J]. Health, 2012, 4(1): 32-38. |
| [13] |
吴邦元.蛋氨酸缺乏对雏鸡免疫器官及免疫功能影响的研究[D].硕士学位论文.雅安: 四川农业大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10626-1011221885.htm
|
| [14] |
HEDEMANN M S, DYBKJÆR L, JENSEN B B. Pre-weaning eating activity and morphological parameters in the small and large intestine of piglets[J]. Livestock Science, 2007, 108(1/2/3): 128-131. |
| [15] |
BURACZEWSKA L, ŚWIECH E, TUŚNIO A, et al. The effect of pectin on amino acid digestibility and digesta viscosity, motility and morphology of the small intestine, and on N-balance and performance of young pigs[J]. Livestock Science, 2007, 109(1/2/3): 53-56. |
| [16] |
YU J, YIN P, LIU F H, et al. Effect of heat stress on the porcine small intestine:a morphological and gene expression study[J]. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 2010, 156(1): 119-128. |
| [17] |
ZIEGLER T R, EVANS M E, FERNÁNDEZ-ESTÍVARIZ C, et al. Trophic and cytoprotective nutrition for intestinal adaptation, mucosal repair, and barrier function[J]. Annual Review of Nutrition, 2003, 23(1): 229-261. DOI:10.1146/annurev.nutr.23.011702.073036 |
| [18] |
ZITNAN R, KUHLA S, NÜRNBERG K, et al. Influence of the diet on the morphology of ruminal and intestinal mucosa and on intestinal carbohydrate levels in cattle[J]. Veterinární Medicina, 2003, 48(7): 175-180. |
| [19] |
BAUCHART-THEVRET C, STOLL B, CHACKO S, et al. Sulfur amino acid deficiency upregulates intestinal methionine cycle activity and suppresses epithelial growth in neonatal pigs[J]. American Journal of Physiology:Endocrinology and Metabolism, 2009, 296(6): E1239-E1250. DOI:10.1152/ajpendo.91021.2008 |
| [20] |
陈祥, 宦海霞, 万婷, 等. 猪源大肠杆菌F18菌毛的体外表达和抗原特性[J]. 微生物学报, 2014, 54(2): 236-242. |
| [21] |
CHEN Y, LI D F, DAI Z L, et al. L-methionine supplementation maintains the integrity and barrier function of the small-intestinal mucosa in post-weaning piglets[J]. Amino Acids, 2014, 46(4): 1131-1142. DOI:10.1007/s00726-014-1675-5 |
| [22] |
WANG Y H, XU M, WANG F N, et al. Effect of dietary starch on rumen and small intestine morphology and digesta pH in goats[J]. Livestock Science, 2009, 122(1): 48-52. DOI:10.1016/j.livsci.2008.07.024 |
| [23] |
CASPARY W F. Physiology and pathophysiology of intestinal absorption[J]. The American Journal of Clinical Nutrition, 1992, 55(1): 299S-308S. DOI:10.1093/ajcn/55.1.299s |
| [24] |
ZHONG H J, LI H M, LIU G F, et al. Increased maternal consumption of methionine as its hydroxyl analog promoted neonatal intestinal growth without compromising maternal energy homeostasis[J]. Journal of Animal Science and Biotechnology, 2016, 7(1): 46. DOI:10.1186/s40104-016-0103-y |
| [25] |
SCHNEEMAN B O, RICHTER B D, JACOBS L R. Response to dietary wheat bran in the exocrine pancreas and intestine of rats[J]. The Journal of Nutrition, 1982, 112(2): 283-286. |
| [26] |
NIMMERFALL F, ROSENTHALER J. Significance of the goblet-cell mucin layer, the outermost luminal barrier to passage through the gut wall[J]. Biochemical and Biophysical Research Communications, 1980, 94(3): 960-966. DOI:10.1016/0006-291X(80)91328-5 |
| [27] |
DEPLANCKE B, GASKINS H R. Microbial modulation of innate defense:goblet cells and the intestinal mucus layer[J]. The American Journal of Clinical Nutrition, 2001, 73(6): 1131S-1141S. DOI:10.1093/ajcn/73.6.1131S |
| [28] |
KIM J J, KHAN W I. Goblet cells and mucins:role in innate defense in enteric infections[J]. Pathogens, 2013, 2(1): 55-70. DOI:10.3390/pathogens2010055 |
| [29] |
JEURISSEN S H, LEWIS F, VAN DER KLIS J D, et al. Parameters and techniques to determine intestinal health of poultry as constituted by immunity, integrity, and functionality[J]. Current Issues in Intestinal Microbiology, 2002, 3(1): 1-14. |
| [30] |
OSTASZEWSKA T, DABROWSKI K, PALACIOS M E, et al. Growth and morphological changes in the digestive tract of rainbow trout (Oncorhynchus mykiss) and pacu (Piaractus mesopotamicus) due to casein replacement with soybean proteins[J]. Aquaculture, 2005, 245(1/2/3/4): 273-286. |
| [31] |
SMITS C H M, ANNISON G. Non-starch plant polysaccharides in broiler nutrition-towards a physiologically valid approach to their determination[J]. Worlds Poultry Science Journal, 1996, 52(2): 203-221. DOI:10.1079/WPS19960016 |
| [32] |
卢月, 林汉杰, 韩凌. 肠道黏膜屏障调节机制研究进展[J]. 国际消化病杂志, 2015, 35(5): 323-324, 333. DOI:10.3969/j.issn.1673-534X.2015.05.008 |




