2. 兰州大学生命科学学院, 兰州 730000;
3. 中国科学院西北生态环境资源研究院, 兰州 730000
2. School of Life Sciences of Lanzhou University, Lanzhou 730000, China;
3. Northwest Institute of Eco-Environment and Resources, Chinese Academy of Sciences, Lanzhou 730000, China
藏羊作为我国三大原始绵羊品种之一,主要生活在海拔3 000~5 000 m的高寒地区[1],是藏区人民在特殊自然环境下长期选育而成的关键畜种,其存栏量约为5 000万头,在我国畜牧业中占有重要地位[2]。千百年来,藏羊一直处在传统、粗放的饲养管理模式之下,全年在天然草地上自由放牧而没有任何补饲[3]。由于受特殊的地理环境和气候条件所限制,青藏高原牧草供应存在严重的季节性不平衡。在冷季,牧草生物量急剧下降,同时其营养物质含量也严重降低,粗蛋白质(CP)含量仅为2.96%~10.44%[4]。在如此严酷的环境下,藏羊不但保证了自身种群的正常繁衍生息,而且还为牧民提供了优质的动物产品,这从侧面反映了藏羊对青藏高原的特殊环境产生了很强的适应性机制[5]。
反刍动物由于瘤胃的存在,因此具有不同于单胃动物的消化特点。反刍动物瘤胃中栖息着大量的微生物,一方面,它们帮助宿主动物降解纤维性碳水化合物,从而提供挥发性脂肪酸等能量物质;另一方面,瘤胃微生物利用动物摄入的营养物质进行微生物蛋白(microbial protein,MCP)合成,从而为宿主提供生长、生产和维持需要的绝大部分氨基酸资源。据报道,反刍动物小肠所吸收的氨基酸1/2以上来源于MCP[6]。尤其是在给反刍动物饲喂粗饲料为主的饲粮时,瘤胃MCP几乎是其所需蛋白质的唯一来源[7]。研究表明,瘤胃MCP的产量与饲粮能量、蛋白质、矿物质、维生素和生长因子水平密切相关[8]。Zhou等[9]研究发现,藏羊具有较低的氮素维持需要量[0.50 g/(kg BW0.75·d)]的特点,仅为相同体重下NRC(1985)[10]绵羊的66%。同时,当藏羊采食低氮饲粮时,其肝脏产生的尿素有88%可重新循环进入消化道[5],为瘤胃MCP合成提供氮源。因此,探究低氮条件下的瘤胃微生物氮(microbial nitrogen,MN)合成效率及其对饲粮能量水平的响应规律在指导藏羊冷季生产中具有重要的现实意义。
估测反刍动物瘤胃MN产量的传统方法主要是标记法[11],总体上分为内源标记物和外源标记物2类。用微生物标记物测定瘤胃MN产量的方法一般都要用到瘤胃或十二指肠瘘管,该方法不便于操作,测定步骤繁琐,在实践中难以推广利用,且违背动物福祉[12]。尿嘌呤衍生物(purine derivatives,PD)法因无损动物、简单易行、准确性高等优点,被广泛用于反刍动物MCP产量的估测[13-14]。其原理是反刍动物尿PD来源于十二指肠所吸收的微生物和机体蛋白质的嘌呤代谢终产物,而后者含量较少,可忽略不计。因此,尿PD与瘤胃MCP产量具有高度的相关性。经过几十年的发展,对尿PD法的研究已经得到适用于不同动物的估测模型,包括绵羊[15]、山羊[16]、黄牛[17]、肉牛[18]和牦牛[10]。目前,关于藏羊尿PD排出量的研究还相对较少,特别是在低氮条件下藏羊瘤胃MCP合成量对饲粮能量调控的响应规律还未见报道。基于此,本试验将通过模拟青藏高原冷季牧草CP含量,探究能量调控对藏羊尿PD排出量和瘤胃MN产量的响应规律,揭示藏羊特殊的氮代谢机制,从而为青藏高原藏羊生产实践中的冷季科学补饲提供理论依据和技术支持。
1 材料与方法 1.1 试验地点和日期试验于2016年11月至2017年1月在甘肃省天祝藏族自治县安远镇兰州大学青藏高原生态系统管理国际中心乌鞘岭试验站(北纬37°14′20.54″,东经102°48′34.32″,海拔3 154 m)进行。
1.2 试验动物与试验设计试验选取5只1.5周岁、体重为(47.70±2.46) kg且体况相近的健康去势公藏羊;采用4×4拉丁方设计,其中1只藏羊为重复,并分别饲喂低能饲粮、中低能饲粮、中高能饲粮和高能饲粮。整个试验分4期进行,每期21 d,其中预试期15 d,正试期6 d。具体试验设计见表 1。
|
|
表 1 试验设计 Table 1 Experimental design |
试验饲粮的配制参照中国《肉羊饲养标准》(NY/T 816—2004)[19]和《中国饲料成分及营养价值表(2015年第26版)》[20],4种试验饲粮粗蛋白质含量[(6.97±0.05)%,模拟青藏高原冷季牧草粗蛋白质含量[4, 21],该值低于绵羊的最低蛋白质维持需要]相近,消化能(DE)水平分别为8.21(低能饲粮)、9.33(中低能饲粮)、10.45(中高能饲粮)和11.57 MJ/kg(高能饲粮)。试验饲粮组成及营养水平见表 2。
|
|
表 2 试验饲粮组成及营养水平(风干基础) Table 2 Composition and nutrient levels of experimental diets (air-dry basis) |
试验前注射伊维菌素对藏羊进行驱虫处理,同时对圈舍及所用器具进行清洁和消毒。试验羊单笼饲养,每天分2次(08:00和17:00)采用全混合日粮(TMR)方式饲喂,每日饲喂量为代谢体重(BW0.75)的4.5%(干物质基础),自由饮水。在晨饲前收集前1天的剩料,准确记录每只羊的采食量。为减少藏羊在试验过程中产生应激反应,在试验开始前对藏羊进行为期20 d的适应期,以使试验动物适应饲养环境和试验饲粮。
1.5 样品采集与分析 1.5.1 样品采集与处理试验开始后的第16天,即正试期第1天的08:00(饲喂前)开始采用全收粪尿法收集粪便和尿液,连续收集5 d,并记录每头藏羊每天的尿液排出量和粪便排出量。粪便按四分法取样,采集其总量的10%装入自封袋中,于-20 ℃保存备测。尿液混合均匀后按其总量的10%取样,用50%的硫酸溶液对尿液进行酸化,使pH<3.0,以固定尿中氮和抑制微生物生长。并于-20 ℃保存待测。
1.5.2 测定方法及计算公式藏羊尿PD(尿囊素、尿酸、黄嘌呤和次黄嘌呤)的含量采用高效液相色谱仪(Agilent,LC-1200)测定。液相色谱条件:色谱柱为菲罗门synergi 4u hydro-RP80A(250 mm×4.6 mm);柱温为35 ℃;样品温度为室温;进样体积为10 μL;检测波长为220 nm;流动相为30 mmol/L乙酸铵;流速为1 mL/min,等度洗脱。具体方法参照李晓鹏等[22]的方法。饲粮、尿液和粪便中氮含量采用凯氏定氮法[23]测定。

|
藏羊瘤胃MN产量根据Chen等[24]所建立的模型进行计算,即根据藏羊小肠吸收嘌呤量计算藏羊瘤胃MN产量。具体公式如下:
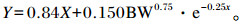
|
式中:X指小肠吸收的嘌呤量;Y指尿PD排出量;BW0.75指代谢体重(kg)。
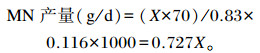
|
式中:X指小肠吸收的嘌呤量;70指每毫摩尔嘌呤含70 mg氮;0.83指微生物核酸的消化率为83%;0.116指绵羊瘤胃微生物中嘌呤氮占总氮的比例为11.6%。
总可消化养分(TDN)摄入量、嘌呤氮指数(PNI)MCP产量和MCP合成效率(MPS)计算公式如下:

|
所有试验数据用Excel 2007软件进行预处理。采用SPSS 22.0软件中一般线性模型(general linear model, GLM)中的多项式正交对比模块进行单变量分析。P < 0.05表示差异显著,P>0.10为差异不显著,0.05≤P≤0.10表示差异有显著趋势。
2 结果与分析 2.1 低氮条件下饲粮能量水平对藏羊尿PD排出量、PD各组分排出量及小肠吸收嘌呤量的影响由表 3可知,随着饲粮能量水平的升高,尿PD排出量和十二指肠PD吸收量均线性增加(P < 0.05)。在尿PD各组分中,随饲粮能量水平的升高,尿酸排出量线性增加(P < 0.05),尿囊素排出量呈现增加趋势(0.05≤P≤0.10),次黄嘌呤排出量呈三次曲线式变化(P < 0.05),但黄嘌呤排出量不受饲粮能量水平的显著影响(P>0.10)。此外,尿PD各组分排出量占PD排出量的百分比各组间无显著差异(P>0.10)。
|
|
表 3 低氮条件下饲粮能量水平对藏羊尿PD排出量的影响 Table 3 Effects of dietary energy level on urinary PD excretion of Tibetan sheep under low nitrogen condition |
由表 4可知,TDN摄入量随饲粮能量水平的升高而线性增加(P < 0.05),但是氮摄入量在各组间无显著差异(P>0.10)。随着饲粮能量水平的升高,尿氮排出量线性降低(P < 0.05),而尿嘌呤氮和PNI均线性增加(P < 0.05)。瘤胃MN产量及MPS均随饲粮能量水平的升高而线性增加(P < 0.05)。
|
|
表 4 低氮条件下饲粮能量水平对藏羊瘤胃MN产量及PNI的影响 Table 4 Effects of dietary energy level on rumen MN production and PNI of Tibetan sheep under low nitrogen condition |
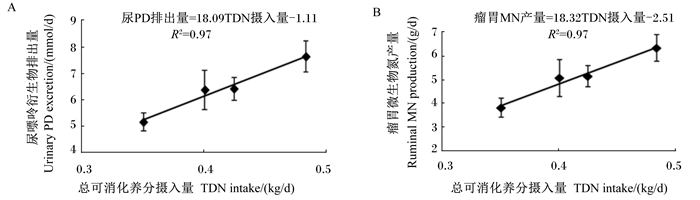
由于TDN摄入量(kg/d)与尿PD排出量(mmol/d)、瘤胃MN产量(g/d)之间具有较强的线性相关关系(表 5),通过线性回归分析建立了它们之间的数学模型(图 1),模型如下:尿PD排出量=18.09TDN摄入量-1.11(n=20,R2=0.97);瘤胃MN产量=18.32TDN摄入量-2.51(n=20,R2=0.97)。
|
图 1 尿PD排出量(A)和瘤胃MN产量(B)与TDN摄入量的相关关系 Figure 1 Correlation relationships between TDN intake and urinary PD excretion (A) or ruminal MN production (B) |
|
|
表 5 TDN摄入量与尿PD排出量和瘤胃MN产量的相关性 Table 5 Correlations between TDN intake and urinary PD excretion or ruminal MN production |
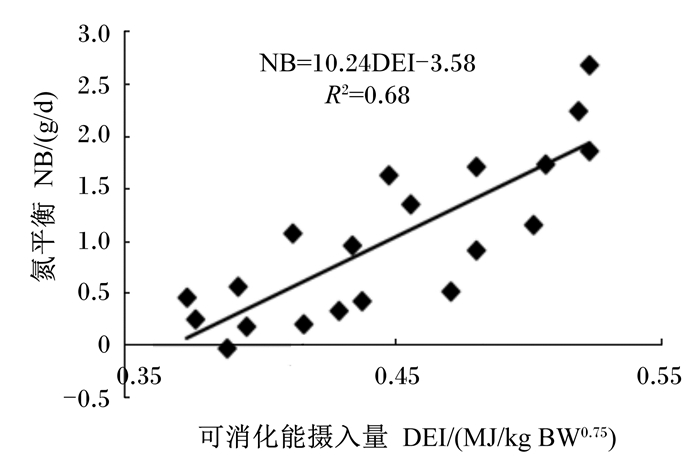
由于NB(g/d)与DEI(MJ/kg BW0.75)之间呈现较高的线性相关关系,通过线性回归分析建立了它们之间的数学模型(图 2),模型如下:NB=10.24DEI-3.58(R2=0.68)。
|
图 2 NB与DEI的相关关系 Figure 2 Correlation relationship between NB and DEI |
尿PD是反刍动物体内嘌呤代谢的终产物,其排出量受多种因素的影响,包括营养物质(干物质、蛋白质和能量等)采食量、饲料添加剂的使用、体重和动物种类等[16]。对于反刍动物而言,尿PD主要来源于小肠吸收的核酸嘌呤(大多源自微生物核酸)。因此,尿PD排出量和瘤胃MCP合成量存在高度的正相关性。
反刍动物尿PD各组分中,尿囊素和尿酸所占比重较大[27],而次黄嘌呤和黄嘌呤所占比重较小[28-29]。本试验结果显示,藏羊尿囊素、尿酸、次黄嘌呤+黄嘌呤排出量占尿PD排出量的变化范围分别为67%~76%、12%~15%和10%~17%,其中尿囊素和尿酸排出量占比略低于Chen等[30]在绵羊上的报道,而次黄嘌呤+黄嘌呤排出量占比略高于Chen等[30]所报道的范围。研究发现,黄牛[31]和牦牛[32]尿PD中黄嘌呤和次黄嘌呤含量很低或者几乎没有(< 1%),这是因为牛属动物体内血液、肝脏和肠道黏膜细胞中具有较高的黄嘌呤氧化酶活性,次黄嘌呤和黄嘌呤较易被氧化而形成尿酸或尿囊素。因此,本试验中藏羊比其他绵羊尿PD中相对较高的次黄嘌呤和黄嘌呤含量可能也与体内较低的黄嘌呤氧化酶活性有关。
随饲粮能量水平的升高,尿囊素排出量呈线性增加趋势,尿酸排出量线性增加。因此,本试验中尿PD排出量变化主要是由于尿囊素和尿酸排出量的变化引起的。藏羊尿PD排出量随饲粮能量水平的升高而增加,这与Deshpande等[33]、Fujihara等[34]和Chen等[35]在绵羊上报道的变化趋势一致。一方面,可能是因为随饲粮能量水平的升高,促使瘤胃中可发酵碳水化合物增加,从而促进微生物的生长和MCP的合成,最终导致尿PD排出量的增加[36];另一方面,可能是因为精料比随饲粮能量水平的升高而增加,使瘤胃食糜的排出速度加快,减少了原虫对细菌的吞食作用,从而提高微生物进入真胃和小肠的速度,最终提高了MCP产量和尿PD排出量[30]。前人的研究表明,绵羊[15]、黄牛[17]、牦牛[10]尿中PD随TDN摄入量的提高而增加,这与本试验在藏羊上的研究结果相同,并且得到了尿PD排出量和TDN摄入量两者之间的线性模型:尿PD排出量=18.09TDN摄入量-1.11(R2=0.97)。当TDN摄入量=0时,尿PD排出量=-1.11 mmol/d[即-0.06 mmol/(kg BW0.75·d)],可用于内源PD排出量的估测。该值低于刘浩等[37]在绵羊上得到的内源PD排出量[0.09 mmol/(kg BW0.75·d)],但高于马涛等[38]在绵羊上得到的内源PD排出量[-0.14 mmol/(kg BW0.75·d)]。然而,在Chen等[24]所建立的估测模型中,绵羊内源PD排出量为0.150 mmol/(kg BW0.75·d),这可能会高估了本试验中藏羊内源PD排出量,从而导致低估本试验中藏羊MN产量。就绵羊而言,通过延长尿PD排出量和TDN摄入量的回归直线得到的内源PD排出量并不能代表其真实内源PD排出量,这是因为随TDN摄入量升高,尿PD排出量也相应增加,而内源PD排出量则会降低,当尿PD排出量高于0.6 mmol/(kg BW0.75·d)[15]时,内源PD排出量则可忽略不计,因此,绵羊的内源PD排出量并非一个恒定值,会随着饲粮营养物质摄入量的不同而产生变化。
3.2 低氮条件下瘤胃MN产量和PNI对饲粮能量水平的响应规律反刍动物能够借助瘤胃内栖居的厌氧微生物,利用饲粮蛋白质降解产生的氨、肽和氨基酸作为氮源,以及饲粮有机物发酵产生的挥发性脂肪酸和ATP分别作为碳架和能量合成MCP[10]。MCP是反刍动物重要的氮源供应者,其能向宿主动物提供蛋白质需要量的40%~80%[7],尤其当饲粮氮摄入较低时,其对于反刍动物氮素营养的供需平衡意义更为重要。MCP合成受多种因素的影响,包括饲粮碳水化合物含量、氮的存在形式、维生素含量、矿物质含量、饲粮饲喂频率、添加剂类型和纤维种类及含量等[9]。本试验结果表明,低氮条件下,瘤胃MN产量随饲粮能量水平的升高而增加,这可能是由于饲粮能量水平提高增加了瘤胃可发酵碳水化合物数量,从而促进了微生物的生长和MN合成,这与Fujihara等[34]在绵羊上的研究结果相一致,但与Chen等[24]的研究结果相反。NRC(2001)[39]中用TDN摄入量估测MCP产量,因此MPS和瘤胃MN产量/氮摄入量均可反映瘤胃微生物将饲粮氮转化为MN的效率,并且通过建立数学模型:瘤胃MN产量(g/d)=18.32TDN摄入量(kg/d)-2.51,得到TDN摄入量与瘤胃MN产量存在线性相关(R2=0.97),方程斜率表示单位TDN摄入量的MN合成量,该值高于NRC(1996)[40]中肉牛上所得到的斜率值,且达到了2倍之多,这也从侧面反映了藏羊MN较高的合成效率。本试验中MPS和MN产量/氮摄入量均随饲粮能量水平的升高而线性增加,这表明,在低氮条件下,饲粮能量水平的升高有利于将饲粮氮转化为MN;而在饲粮能量供应不足时会抑制微生物的活性,从而使得饲粮氮转化为MN的效率变低;同时,这也证实了藏羊高效的饲粮氮素利用效率必须要有充足的能量作为保障。另外,根据NB与DEI的线性模型可以估测,当NB为0时,DEI为0.35 MJ/kg BW0.75,即当饲粮CP含量为6.97%时(模拟冷季牧草CP含量),藏羊维持氮平衡需要的DE为0.35 MJ/kg BW0.75。
PNI受动物品种及饲粮组成等因素的影响,是一种简单、有效估测饲粮中可降解蛋白转化为MCP效率的指标,并且该指数能够与饲粮蛋白质摄入及可降解能力相结合,PNI越高,表明瘤胃降解氮合成MCP的效率较高[41]。PNI在实际生产中的应用可有效改善反刍动物饲养管理,提高氮素利用效率,减少氮素排泄[25, 42]。本试验结果表明,PNI变化范围在0.09~0.17,低氮条件下,PNI随饲粮能量水平的升高而线性升高。这与Wang等[43]发现PNI随牦牛干草采食量增加而升高的研究结果相似。本试验中,高能量、低氮条件下较高的PNI表明,藏羊在氮素胁迫下,瘤胃微生物利用饲粮可降解蛋白的效率随饲粮能量水平的升高而升高,以弥补饲粮氮素匮乏的限制,从而为藏羊提供更多的氮源。
4 结论当饲粮CP含量为6.97%时,藏羊维持氮平衡的DE需要量为0.35 MJ/kg BW0.75;提高饲粮能量水平(DE水平:8.21~11.57 MJ/kg)可提高藏羊瘤胃MN的合成量,改善饲粮氮素利用效率,从而弥补饲粮氮素匮乏的限制。因此,在青藏高原冷季,可通过补饲能量物质来提高藏羊对氮素营养胁迫的适应力。
| [1] |
LONG R J, DONG S K, WEI X H, et al. The effect of supplementary feeds on the bodyweight of yaks in cold season[J]. Livestock Production Science, 2005, 93(3): 197-204. DOI:10.1016/j.livprodsci.2004.08.016 |
| [2] |
向泽宇, 王长庭. 青藏高原藏羊遗传资源的现状、存在问题及对策[J]. 中国畜牧兽医文摘, 2011, 27(2): 1-4. |
| [3] |
ZHOU J W, GUO X S, DEGEN A A, et al. Urea kinetics and nitrogen balance and requirements for maintenance in Tibetan sheep when fed oat hay[J]. Small Ruminant Research, 2015, 129: 60-68. DOI:10.1016/j.smallrumres.2015.05.009 |
| [4] |
谢敖云, 柴沙驼, 王万邦, 等. 高山草甸草地牧草产量及其营养变化规律[J]. 青海畜牧兽医杂志, 1996, 26(2): 8-10. |
| [5] |
周建伟.藏羊对青藏高原氮素营养胁迫的适应性研究[D].博士学位论文.兰州: 兰州大学, 2015.
|
| [6] |
AFRC.Technical committee on responses to nutrients.Nutritive requirements of ruminant animal: protein[Z].AFRC Technical Committee on Response to Nutrients.Report No. 9.Nutrition Abstracts and Reviews (Series B), 1992, 62: 787-835.
|
| [7] |
ØRSKOV E R. Protein nutrition in ruminants[M]. 2nd ed. London: The Academic Press, 1992.
|
| [8] |
王虎成.尿嘌呤衍生物排出量估测青藏高原牦牛瘤胃微生物蛋白产量研究[D].博士学位论文.兰州: 兰州大学, 2009: 60-64.
|
| [9] |
ZHOU J W, MI J D, TITGEMEYER E C, et al. A comparison of nitrogen utilization and urea metabolism between Tibetan and fine-wool sheep[J]. Journal of Animal Science, 2015, 93(6): 3006-3017. DOI:10.2527/jas.2014-8865 |
| [10] |
NRC.Nutrient requirements of sheep[S].6th ed.Washington, D.C.: National Academies, 1985.
|
| [11] |
BRODERIC G A, MERCHEN N P. Markers for quantifying microbial protein synthesis in the rume[J]. Journal of Dairy Science, 1992, 75(9): 2618-2632. DOI:10.3168/jds.S0022-0302(92)78024-2 |
| [12] |
郭辉, 杨膺白, 李丽莉, 等. 尿液嘌呤法估测瘤胃微生物蛋白研究[J]. 中国草食动物, 2007(6): 59-62. DOI:10.3969/j.issn.2095-3887.2007.06.027 |
| [13] |
钟伟, 李光玉, 罗国良. 尿液嘌呤衍生物法估测瘤胃微生物蛋白产量的研究进展[J]. 家畜生态学报, 2008, 29(1): 99-102. DOI:10.3969/j.issn.1673-1182.2008.01.023 |
| [14] |
王虎成, 龙瑞军, 马亚玲, 等. 尿嘌呤衍生物估测瘤胃微生物蛋白产量的原理及研究进展[J]. 饲料工业, 2008, 29(1): 47-51. DOI:10.3969/j.issn.1001-991X.2008.01.017 |
| [15] |
CHEN X B, HOVELL F D D, ØSKOV E R, et al. Excretion of purine derivatives by ruminants:effect of exogenous nucleic acid supply on purine derivative excretion by sheep[J]. British Journal of Nutrition, 1990, 63(1): 131-142. DOI:10.1079/BJN19900098 |
| [16] |
BELENGUER A, YAEÑZ D, BALCELLS J, et al. Urinary excretion of purine derivatives and prediction of rumen microbial outflow in goats[J]. Livestock Production Science, 2002, 77(2/3): 127-135. |
| [17] |
VERBIC J, CHEN X B, MACLEOD N A, et al. Excretion of purine derivatives by ruminants.Effect of microbial nucleic acid infusion on purine derivative excretion by steers[J]. The Journal of Agricultural Science, 1990, 114(3): 243-248. DOI:10.1017/S0021859600072610 |
| [18] |
IRIKI T, ITOH K, ABE M. Weight gain, N-balance and excretion of purine derivatives into urine in calves aged 3-6 months and fed diets differing in CP level and in N-source[J]. Nihon Chikusan Gakkaiho, 1989, 60(10): 916-922. DOI:10.2508/chikusan.60.916 |
| [19] |
中华人民共和国农业部.NY/T 816—2004肉羊饲养标准[S].北京: 中国农业出版社, 2004.
|
| [20] |
熊本海, 罗清尧, 赵峰, 等. 中国饲料成分及营养价值表(2015年第26版)制订说明[J]. 饲料广角, 2015(21): 21-31. |
| [21] |
淡瑞芳, 张海涛, 龙瑞军, 等. 藏系绵羊瘤胃细菌数量及其放牧地牧草养分随季节变化的研究[J]. 草业学报, 2009, 18(1): 100-104. DOI:10.3321/j.issn:1004-5759.2009.01.015 |
| [22] |
李晓鹏, 周围, 王虎成, 等. 高效液相色谱法对牦牛血浆与尿中嘌呤衍生物及肌酐含量的测定[J]. 分析测试学报, 2009, 28(7): 867-871. DOI:10.3969/j.issn.1004-4957.2009.07.024 |
| [23] |
AOAC.Official methods of analysis of Association of Official Analytical Chemists[S].15th ed.Washington, D.C.: Association of Official Analytical Chemists, 1990.
|
| [24] |
CHEN X B, CHEN Y K, FRANKLIN M F, et al. The effect of feed intake and body weight on purine derivative excretion and microbial protein supply in sheep[J]. Journal of Animal Science, 1992, 70(5): 1534-1542. DOI:10.2527/1992.7051534x |
| [25] |
ZHANG Y, ZHOU J W, GUO X S, et al. Influences of dietary nitrogen and non-fiber carbohydrate levels on apparent digestibility, rumen fermentation and nitrogen utilization in growing yaks fed low quality forage based-diet[J]. Livestock Science, 2012, 147(1/2/3): 139-147. |
| [26] |
CHEN X B, SUBBA D B, ØRSKOV E R, et al.Nuclear based technologies for estimating microbial protein supply in ruminant livestock: purine nitrogen index, potentially a new parameter for rapid feed evaluation in ruminants[C]//Proceedings of the Second Research Coordination Meeting of a Coordinated Research Project.Vienna, Austria: FAO, 1998: 97-110.
|
| [27] |
BALCELLS J, GUADA J A, CASTRILLO C, et al. Urinary excretion of allantoin and allantoin precursors by sheep after different rates of purine infusion into the duodenum[J]. The Journal of Agricultural Science, 1991, 116(2): 309-317. DOI:10.1017/S002185960007773X |
| [28] |
钟伟, 龙瑞军, LIANG J B, 等. 不同比例香根草日粮对沼泽性水牛尿嘌呤衍生物排出量的影响[J]. 甘肃农业大学学报, 2007, 42(1): 25-29. DOI:10.3969/j.issn.1003-4315.2007.01.006 |
| [29] |
CHEN X B.Excretion of purine derivatives by sheep and cattle and its use for the estimation of absorbed microbial protein[D].Ph.D.Thesis.Aberdeen: University of Aberdeen, 1989.
|
| [30] |
CHEN X B, GOMES M J.Estimation of microbial protein supply to sheep and cattle based on urinary excretion of purine derivatives.An overview of technical details[C]//International Feed Resources Unit, Occasional Publication.Aberdeen, UK: Rowett Research Institute, 1995.
|
| [31] |
李丽莉, 梁坤, 韦升菊, 等. 不同日粮采食水平对青年母水牛尿中嘌呤衍生物排出规律的影响研究[J]. 黑龙江畜牧兽医(科技版), 2009(23): 11-14. |
| [32] |
王惟惟, 王传洋, 郝力壮, 等. 饲粮氮水平对牦牛尿嘌呤衍生物排出量与瘤胃微生物氮产量的影响[J]. 动物营养学报, 2017, 29(11): 3932-3941. DOI:10.3969/j.issn.1006-267x.2017.11.013 |
| [33] |
DESHPANDE K Y, MEHRA U R, SINGH P, et al. Purine derivatives concentration in body fluids as influenced by different energy levels in dairy cows[J]. The Indian Journal of Animal Sciences, 2011, 81(12): 1244-1247. |
| [34] |
FUJIHARA T, SHEM M N, NAKAMURA K. Effect of dietary energy levels on the urinary excretion of purine derivatives in sheep[J]. Animal Science Journal, 2005, 76(5): 441-445. DOI:10.1111/asj.2005.76.issue-5 |
| [35] |
CHEN X B, SAMARAWEERA L, KYLE D J, et al. Urinary excretion of purine derivatives and tissue xanthine oxidase (EC 1.2.3.2) activity in buffaloes (Bubalis bubalis) with special reference to differences between buffaloes and Bos taurus cattle[J]. British Journal of Nutrition, 1996, 75(3): 397-407. DOI:10.1079/BJN19960142 |
| [36] |
JETANA T, SUTHIKRAI W, USAWANG S, et al. The effects of concentrate added to pineapple (Ananas Comosus Linn. Mer.) waste silage in differing ratios to form complete diets, on digestion, excretion of urinary purine derivatives and blood metabolites in growing, male, Thai swamp buffaloes[J]. Tropical Animal Health and Production, 2009, 41(4): 449-459. DOI:10.1007/s11250-008-9207-5 |
| [37] |
刘浩, 周建伟, 张瑛, 等. 燕麦干草对藏羊尿中嘌呤衍生物、肌酐及马尿酸排出量的影响[J]. 家畜生态学报, 2014, 35(9): 38-44. DOI:10.3969/j.issn.1673-1182.2014.09.008 |
| [38] |
马涛.肉羊瘤胃微生物蛋白质合成量预测方法的研究[D].博士学位论文.北京: 中国农业科学院, 2014.
|
| [39] |
NRC.Nutrient requirements of dairy cattle[S].7th ed.Washington, D.C.: The National Academies, 2001.
|
| [40] |
NRC.Nutrient requeriments of beef cattle[S].Washington, D.C.: The National Academies, 1996.
|
| [41] |
马涛.肉羊瘤胃微生物蛋白质合成量预测方法的研究[D].博士学位论文.北京: 中国农业科学院, 2014.
|
| [42] |
MAKKAR H P S, CHEN X B. Estimation of microbial protein supply in ruminants using urinary purine derivatives[M]. Netherlands: Springer, 2004.
|
| [43] |
WANG H C, LONG R J, LIANG J B, et al. Comparison of nitrogen metabolism in yak (Bos grunniens) and indigenous cattle (Bos taurus) on the Qinghai-Tibetan Plateau[J]. Asian-Australasian Journal of Animal Sciences, 2011, 24(6): 766-773. DOI:10.5713/ajas.2011.10350 |




