2. 中国水产科学研究院长江水产研究所, 武汉 430223;
3. 武汉先锋水产科技有限公司, 武汉 430207
2. Yangtze River Fisheries Research Institute, Chinese Academy of Fishery Sciences, Wuhan 430223, China;
3. Wuhan Xianfeng Aquaculture Technology company limited, Wuhan 430207, China
杂交鲌“先锋1号”是以经选育的翘嘴红鲌(Erythroculter ilishaeformis)为母本,以经选育的黑尾近红鲌(Ancherythroculter nigrocauda)为父本,采用鱼类远缘杂交技术及分子辅助育种技术获得的鲌鱼新品种,该品种于2012年通过国家水产原良种审定委员会审定。杂交鲌“先锋1号”具有体型好、生长速度快、养殖成本低、容易捕捞及活鱼运输等优点,在池塘养殖经济效益显著,适宜在全国范围内推广。
杂交鲌“先锋1号”是选育的鲌鱼新品种,要推广该品种的人工养殖,就需提供优质的配合饲料,但目前关于其营养与饲料方面的研究报道很少,因此有必要开展杂交鲌“先锋1号”营养需求研究。蛋白质是维持鱼类生长、发育及其他生理活动必需的营养物质,也是饲料中成本最高的部分,饲料中蛋白质水平不足则不能满足鱼类生长的需要[1],但添加量过多则蛋白质被用于能量消耗,造成资源浪费,增加饲料成本[2]。本团队前期开展的池塘示范养殖效果表明,杂交鲌“先锋1号”从大规格鱼种养殖到成鱼阶段,对饲料蛋白质需求量约为32%,而对其幼鱼阶段还未开展相关研究。根据以往研究报道,翘嘴红鲌幼鱼对蛋白质的需求量为41%~43%[3-4]和48%~54%[5],而杂交鲌“先锋1号”生长速度比父本和母本都要快,因此直接参考翘嘴红鲌蛋白质需求量数据并不合适。本试验拟采用不同蛋白质水平的饲料投喂杂交鲌“先锋1号”幼鱼,研究其对饲料蛋白质的需求量,旨在为杂交鲌“先锋1号”的营养与饲料研究及人工配合饲料的研发提供基础数据。
1 材料与方法 1.1 试验饲料以鱼粉、酪蛋白和明胶为主要蛋白质源,糊精为主要糖源,豆油和玉米油为脂肪源配制蛋白质水平分别为25%、30%、35%、40%、45%和50%的6种等脂等能的半纯化饲料。试验饲料组成及营养水平见表 1,各种干性原料经粉碎后过60目筛,按表 1中的配比称重后混匀,少量的组分采用逐级扩大法混合,加入豆油和玉米油混合均匀,再加适量水充分混合,然后用制粒机(KL105A4-2,浙江新昌县陈氏机械厂)制成直径2 mm的圆柱形颗粒。置于室内通风处晾干后用破碎机(SX-150,湖北省石首市四新机械厂)破碎,并用分样筛筛除粉末,选取粒径为0.5~1.2 mm的饲料分装,置于-20 ℃冰柜中备用。各组饲料蛋白质水平实测值分别为25.63%、30.28%、35.13%、40.26%、45.42%和50.53%。
|
|
表 1 试验饲料组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of experimental diets (DM basis) |
试验鱼为国家级湖北武汉鲌鱼良种场提供的杂交鲌“先锋1号”F1代,运回室内养殖车间后先采用1%的淡盐水消毒,并于水泥池内暂养2周,期间投喂各个试验组的混合饲料,使其适应养殖环境及试验饲料。试验开始前,将暂养鱼饥饿24 h后,挑选健康无伤、规格基本一致的试验鱼630尾,平均体重为(5.42±0.16) g,随机分为6组,每组3个重复,每个重复放养35尾鱼,养殖于循环水养殖系统中,该系统包括18个容积为400 L的玻璃纤维养殖桶(直径82 cm,高度80 cm,水深75 cm)、砂滤缸和蓄水塔等设施。养殖试验共持续56 d,每组投喂1种试验饲料,每天投喂3次(08:30—9:00、12:30—13:00、16:30—17:00各1次),表观饱食投喂。每日10:00对砂滤缸进行反冲洗,并清除养殖桶内粪便,每日换水量约占系统总体积的1/4(水源为曝气后的城市自来水)。每日记录水温、观察试验鱼摄食及死亡情况,将死鱼捞出并称重记录。饲养期间的水温为28~32 ℃,pH为7.3~7.6,溶解氧浓度>5 mg/L,NH4+-N浓度<0.2 mg/L,采用自然光照周期。
1.3 样本采集养殖试验结束后,将试验鱼饥饿24 h,统计每个养殖桶中试验鱼的数量,并称重记录。从每个桶中随机选取3尾试验鱼,使用MS-222溶液(150 mg/L)浸泡将鱼麻醉,测定体长与体重,从尾部静脉采血并收集于1.5 mL离心管中,将离心管在4 ℃冰箱中静置2 h,3 000 r/min离心10 min,取上层血清备用。在冰盘上对鱼进行解剖,取内脏和肝脏称重记录,分离肠道取中肠,将肝脏和肠道样品保存于-80 ℃冰柜中备用。每个桶另外随机取3尾鱼,用于全鱼营养成分的检测。
1.4 试验指标测定生长指标计算公式:

|
式中:M0和Mt分别为试验鱼的初始体重和终末体重(g);T为养殖天数(d);F为饲料消耗量(g);W0和Wt分别为试验鱼的初始总重和终末总重(g);P为饲料粗蛋白质含量(%);BP0和BPt分别为试验鱼初始鱼体粗蛋白质含量和终末鱼体粗蛋白质含量(%);N0和Nt分别为试验鱼的初始尾数和终末尾数;Mv为样品鱼内脏重(g);Mh为样品鱼肝脏重(g);Mw和L分别为样品鱼体重(g)和体长(cm)。
饲料和全鱼样品的水分、粗蛋白质、粗脂肪和粗灰分含量分别采用105 ℃恒温干燥失重法、凯氏定氮法、索氏抽提法和马福炉灼烧法[6]测定。饲料总能用氧弹量热仪(SDC311,湖南三德科技股份有限公司)测定。
血清甘油三酯(TG)、总胆固醇(TCHO)、总蛋白(TP)含量及谷草转氨酶(AST)和谷丙转氨酶(ALT)活性采用希森美康Sysmex Chemix-800全自动生化分析仪测定。
将肠道和肝脏样品置于4 ℃冰箱内解冻,称取1 g组织样品(精确到0.001 g),按照重量(g)和体积(mL)为1 : 9的比例加入0.65%生理盐水,置于冰上机械匀浆,3 000 r/min离心10 min,取上清液用于酶活性及蛋白浓度的检测[7]。蛋白酶活性采用福林-酚试剂法[8]测定,淀粉酶活性采用碘-淀粉比色法测定,脂肪酶活性采用微板法测定,蛋白浓度采用考马斯亮蓝法测定,均使用南京建成生物工程研究所生产的试剂盒检测。
1.5 数据处理采用SPSS 18.0统计软件对试验数据进行单因素方差分析(one-way ANOVA),用Duncan氏多重比较法分析组间的差异显著性(P < 0.05),试验结果以平均值±标准差表示。利用折线回归分析得出杂交鲌“先锋1号”幼鱼对蛋白质的需求量[9]。
2 结果 2.1 饲料蛋白质水平对杂交鲌“先锋1号”幼鱼生长性能和饲料利用的影响由表 2可知,随着饲料蛋白质水平的升高,试验鱼增重率和特定生长率先显著上升(P < 0.05),在饲料蛋白质水平达到35.13%后趋于平稳,35.13%~50.53%之间并无显著差异(P>0.05)。饲料系数则表现出相反的变化趋势,随着饲料蛋白质水平的升高先呈显著下降(P < 0.05),当饲料蛋白质水平达到40.26%后趋于稳定,40.26%、45.42%和50.53%组间无显著差异(P>0.05)。蛋白质效率和蛋白质沉积率前4组无显著差异(P>0.05),45.42%组开始呈下降趋势,50.53%组最低,且显著低于前4组(P<0.05)。
|
|
表 2 饲料蛋白质水平对杂交鲌“先锋1号”幼鱼生长性能和饲料利用的影响 Table 2 Effects of dietary protein levels on growth performance and feed utilization of juvenile hybrid F1 |
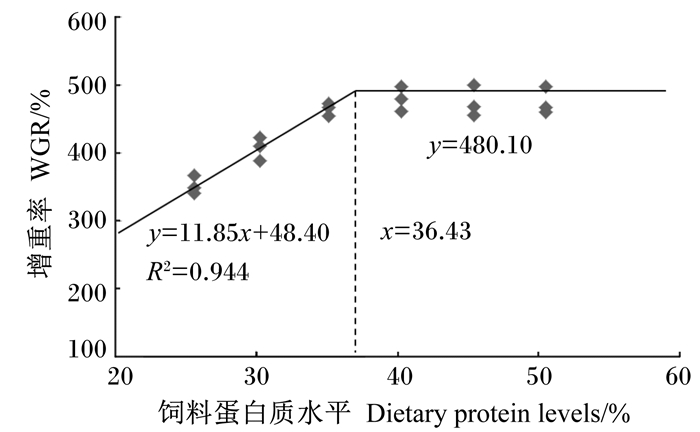
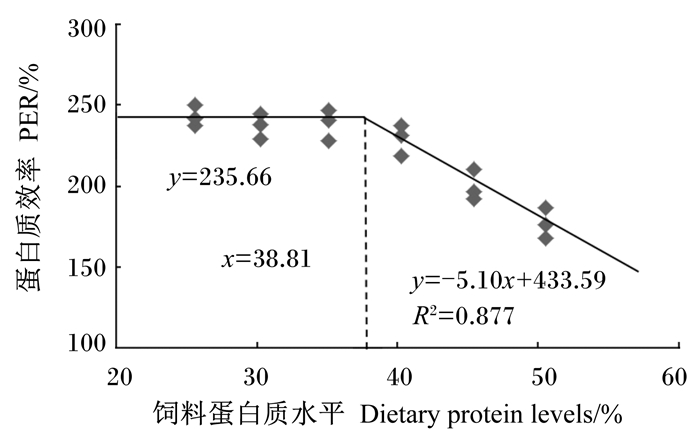
试验鱼的脏体比和肝体比随着饲料蛋白质水平的升高呈下降趋势,45.42%和50.53%组的脏体比显著低于前4组(P < 0.05),50.53%组的肝体比最低,显著低于25.63%、30.28%和40.26%组(P < 0.05)。饲料蛋白质水平对肥满度和成活率无显著影响(P>0.05)。以饲料蛋白质水平为自变量,增重率或者蛋白质效率为因变量,利用折线回归分析得知,杂交鲌“先锋1号”幼鱼对饲料蛋白质的需求量分别为36.43%(图 1)和38.81%(图 2)。
|
图 1 杂交鲌“先锋1号”幼鱼增重率与饲料蛋白质水平的折线回归关系 Figure 1 Broken-line regression relationship between WGR and dietary protein levels of juvenile hybrid F1 |
|
图 2 杂交鲌“先锋1号”幼鱼蛋白质效率与饲料蛋白质水平的折线回归关系 Figure 2 Broken-line regression relationship between PER and dietary protein levels of juvenile hybrid F1 |
由表 3可知,饲料蛋白质水平对全鱼水分、粗灰分含量无显著影响(P>0.05)。随着饲料蛋白质水平升高,全鱼粗蛋白质含量有上升趋势,40.26%、45.42%和50.53%组均显著高于25.63%组(P < 0.05),但这3组之间无显著差异(P>0.05);全鱼粗脂肪含量呈下降趋势,40.26%和45.42%组显著低于前3组(P < 0.05),50.53%组显著低于前5组(P < 0.05)。
|
|
表 3 饲料蛋白质水平对杂交鲌“先锋1号”幼鱼全鱼营养成分的影响 Table 3 Effects of dietary protein levels on whole body composition of juvenile hybrid F1 |
由表 4可知,饲料蛋白质水平对血清TG和TCHO含量无显著影响(P>0.05),但显著影响血清TP含量及AST和ALT活性(P < 0.05)。随着饲料蛋白质水平的升高,血清TP含量呈先升高后下降的趋势,40.26%组血清TP含量最高,且显著高于其余各组(P < 0.05);饲料蛋白质水平在25.63%~45.42%时,血清AST活性随蛋白质水平的升高而上升,当饲料蛋白质水平继续上升到50.53%,其活性反而下降,显著低于45.42%组(P < 0.05);血清ALT活性随蛋白质水平的升高先上升,在饲料蛋白质水平达到45.42%后趋于稳定,45.42%和50.53%组显著高于其余各组(P < 0.05),但这2组之间无显著差异(P>0.05)。
|
|
表 4 饲料蛋白质水平对杂交鲌“先锋1号”幼鱼血清生化指标的影响 Table 4 Effects of dietary protein levels on serum biochemical indexes of juvenile hybrid F1 |
由表 5可知,饲料蛋白质水平对试验鱼肠道和肝脏的蛋白酶和淀粉酶活性有显著影响(P < 0.05),对脂肪酶活性无显著影响(P>0.05)。随着饲料蛋白质水平的升高,肠道的蛋白酶活性显著升高,在50.53%组最高,并显著高于前5组(P < 0.05),肠道的淀粉酶活性则显著降低(P < 0.05),同样在50.53%组最低,显著低于前5组(P < 0.05)。肝脏的消化酶活性变化趋势与肠道类似,蛋白酶活性以50.53%组最高,40.26%、45.42%和50.53%组显著高于25.63%组(P < 0.05),淀粉酶活性以50.53%组最低,显著低于除了45.42%组以外的其余各组(P < 0.05)。肝脏和肠道的脂肪酶活性则不受饲料蛋白质水平的影响,各组间均无显著差异(P>0.05)。
|
|
表 5 饲料蛋白质水平对杂交鲌“先锋1号”幼鱼消化酶活性的影响 Table 5 Effects of dietary protein levels on digestive enzyme activity of juvenile hybrid F1 |
本试验中,各组试验鱼的成活率在99.05%~100.00%,说明杂交鲌“先锋1号”幼鱼能较好地适应试验条件和试验饲料,而且其性情温顺,这也是成活率较高的主要原因。在饲料蛋白质水平为25.63%~35.13%时,杂交鲌“先锋1号”幼鱼的增重率和特定生长率随着饲料蛋白质水平的增加显著上升,说明饲料蛋白质水平可以显著影响其生长性能。当饲料蛋白质水平达到35.13%以后,生长性能基本趋于稳定,在饲料蛋白质水平在35.13%~50.53%内无显著差异,蛋白质效率和蛋白质沉积率在饲料蛋白质水平达到45.42%以后也出现下降,说明过多的蛋白质并未用于生长、可能作为能量物质分解供能[10]。对草鱼(Ctenopharyngodon idella)[11]、台湾泥鳅(Taiwan loach)[12]和牙鲆(Paralichthys olivaceus)[13]等鱼类的研究均出现类似结果,当饲料蛋白质达到一定水平后,生长性能不再上升而是趋于稳定,蛋白质效率则出现显著下降。
在本试验中,杂交鲌“先锋1号”幼鱼的脏体比和肝体比随着饲料蛋白质水平的升高呈下降趋势。这可能是由于试验的饲料配方采取等脂等能的设计,低蛋白质水平组的饲料中碳水化合物含量较高,而鱼类摄食过多的碳水化合物会造成体内脂肪沉积,并贮存于肝脏和内脏的脂肪组织中[14-15],因而造成脏体比和肝体比升高,在翘嘴红鲌[4]、台湾泥鳅[12]、星斑川鲽(Platichthys stellatus)[16]和达氏鲟(Acipenser dabryanus)[17]的研究中也出现相似的变化趋势。但黄姑鱼(Nibea albiflora)[7]和北方须鳅(Barbatula barbatula nuda)[18]的脏体比和肝体比则不受饲料蛋白质水平的影响,这可能与试验对象、饲料配方和试验条件有关。
当生长性能随着饲料营养水平先线性上升后趋于稳定时,可以利用折线模型来分析营养素的需求量[19]。本研究中,以增重率和蛋白质效率为评价指标时,采用折线模型分析得到杂交鲌“先锋1号”幼鱼对蛋白质的需求量为36.43%~38.81%,这要高于本团队前期池塘示范养殖中得出的数据32%,这主要是生长阶段和养殖环境的不同造成的差异。本试验的养殖对象为幼鱼,幼鱼生长速度快,因而新陈代谢加快造成鱼类对蛋白质的需求量升高。并且池塘养殖环境中鱼类有可能摄食天然饵料,这也造成其对饲料蛋白质需求量要低于本试验的结果。本试验结果表明,杂交鲌“先锋1号”幼鱼对蛋白质的需求量要低于之前报道的翘嘴红鲌幼鱼的需求量(40.94%~41.35%)[3]。翘嘴红鲌在野生环境中属于肉食性鱼类,经过人工驯化后可投喂人工配合饲料,但对蛋白质的需求量较高。杂交鲌“先锋1号”以翘嘴红鲌为母本,以黑尾近红鲌为父本,但是生长速度要快于翘嘴红鲌和黑尾近红鲌。本研究中饲料蛋白质水平为40.26%~50.53%时蛋白质效率显著降低,说明杂交鲌“先锋1号”幼鱼可能主要通过提高蛋白质的利用率来降低蛋白质的需求量。
3.2 饲料蛋白质水平对杂交鲌“先锋1号”幼鱼全鱼营养成分的影响本研究中,全鱼粗蛋白质含量在饲料蛋白质水平为25.63%~40.26%时,随着饲料蛋白质水平的升高先增加,但40.26%~50.53%%蛋白质水平下基本保持一致。这与牙鲆[13]和星斑川鲽[16]的研究类似,说明饲料中过多的蛋白质并未积累到鱼体,可能主要用于氧化供能,因此粗蛋白质含量并未持续上升,这也导致蛋白质沉积率在高蛋白质组出现下降。但在北方须鳅[18]、尼罗罗非鱼(Oreochromis niloticus)[20]的研究中,饲料蛋白质水平对全鱼粗蛋白质含量却并无显著影响,试验鱼种类和试验条件的差异可能是主要原因。
全鱼粗脂肪含量则随着饲料蛋白质水平的升高逐渐下降,在50.53%组最低,这和对翘嘴红鲌[3]和鲈鱼(Lateolabrax japonicus)[21]的研究结果一致。本试验中各组饲料的脂肪水平基本一致,但低蛋白质组饲料中碳水化合物含量较高,鱼类摄入糖源过多,未用于能源的糖在鱼体内转化为脂肪,因此全鱼脂肪含量升高。各组全鱼水分含量在69.95%~71.25%变化,粗灰分含量为3.01%~3.28%,均未受饲料蛋白质水平的显著影响,这和翘嘴红鲌[3]、尼罗罗非鱼[20]和鲈鱼[21]等鱼类的试验结果一致。
3.3 饲料蛋白质水平对杂交鲌“先锋1号”幼鱼血清生化指标的影响血清生化指标反映了鱼体的生理状况及营养物质在体内的代谢状况,可以评价鱼体的健康及营养状况。TG和TCHO是血脂的重要组成部分,其主要合成场所在肝脏,其含量变化在一定程度上可以反映体内脂类代谢情况。本试验中各组的血清TG和TCHO含量无显著差异,这与对尼罗罗非鱼[20]、达氏鲟[17]和欧洲鳇(Huso huso)[22]的研究结果类似,可能主要受饲料脂肪水平基本一致的影响。
血清TP含量反映了鱼体的营养状况及对饲料蛋白质的消化吸收程度,受饲料蛋白质水平影响明显。本试验中血清TP含量随着饲料蛋白质水平先升高,在蛋白质水平为40.26%后又呈下降趋势。这说明当饲料蛋白质水平超过机体的需求量时,鱼体并未对其有效的吸收,多余的蛋白质被浪费掉,蛋白质效率和生长性能的变化也呈现相同的趋势。AST和ALT是重要的氨基转移酶,可以催化氨基酸和酮酸之间的氨基转移,参与氨基酸的生物合成。本研究中随着饲料蛋白质水平的升高,血清AST和ALT活性基本呈升高趋势,这和对达氏鲟[17]的研究基本一致。
3.4 饲料蛋白质水平对杂交鲌“先锋1号”幼鱼消化酶活性的影响本研究中,杂交鲌“先锋1号”幼鱼的肠道蛋白酶活性随着饲料蛋白质水平的升高而升高,在蛋白质水平为50.53%时活性达到最高,这与翘嘴红鲌[23]、黄姑鱼[7]和鲈鱼[21]的研究结果类似。由于肠道是主要的消化器官,其对蛋白质水平的变化比较敏感,因此饲料中的蛋白质能刺激肠道蛋白酶的分泌[24]。但也有研究认为,饲料蛋白质水平过高可能会增加肠道的消化负担,对肠道蛋白酶的分泌产生负反馈调节[25],例如在刺鲃(Barbudes caldwell)[26]的研究中发现,当饲料蛋白质上升到一定水平(40.26%~50.53%)后,肠道淀粉酶活性并未继续上升反而出现显著下降。本试验中肝脏蛋白酶活性随蛋白质水平的升高先持续升高,在饲料蛋白质水平为40.26%~50.53%内保持稳定,这说明不同器官对饲料蛋白水平的变化的适应性不同步,因此肠道和肝脏消化酶活性的变化趋势并不完全一致。
肠道和肝脏淀粉酶活性则与蛋白酶活性变化趋势相反,随着饲料蛋白质水平升高而下降,均在蛋白质水平达到50.53%时最低,这和饲料中糊精的添加水平是一致的,说明淀粉酶活性的变化主要受到糖含量的影响。多数研究表明,养殖鱼类的脂肪酶活性不受饲料蛋白质水平的影响,如翘嘴红鲌[22]、南亚野鲮(Labeo rohita)[27]和黄姑鱼[7]等。本研究中,饲料蛋白质水平对试验鱼肠道和肝脏的脂肪酶活性均无显著影响,与以往研究结果一致。这可能主要是受饲料脂肪水平的影响,各组饲料脂肪水平相等,因此脂肪酶活性未出现显著差异。
4 结论在本试验条件下,以增重率和蛋白质效率为评价指标,通过折线回归分析得到杂交鲌“先锋1号”幼鱼对饲料蛋白质的需求量分别为36.43%和38.81%。
| [1] |
ABDEL-TAWWAB M, AHMAD M H, KHATTAB Y A E, et al. Effect of dietary protein level, initial body weight, and their interaction on the growth, feed utilization, and physiological alterations of Nile tilapia, Oreochromis niloticus(L.)[J]. Aquaculture, 2010, 298(3/4): 267-274. |
| [2] |
SUN L H, CHEN H R, HUANG L M. Growth, faecal production, nitrogenous excretion and energy budget of juvenile yellow grouper (Epinephelus awoara) relative to ration level[J]. Aquaculture, 2007, 264(1/2/3/4): 228-235. |
| [3] |
陈建明, 叶金云, 王友慧, 等. 翘嘴红鲌幼鱼对蛋白质的需要量[J]. 水产学报, 2005, 29(1): 83-86. |
| [4] |
王桂芹, 周洪琪, 董永利, 等. 翘嘴红鲌幼鱼最适蛋白需求量的研究[J]. 吉林农业大学学报, 2004, 26(5): 556-560. DOI:10.3969/j.issn.1000-5684.2004.05.023 |
| [5] |
赵吉伟, 叶继丹. 饲料蛋白质含量对翘嘴红鲌生长影响的初步研究[J]. 水产学杂志, 2001, 14(2): 21-23. DOI:10.3969/j.issn.1005-3832.2001.02.006 |
| [6] |
Association of Official Analytical Chemists (AOAC).Official methods of analysis of AOAC international[S].17th ed.Gaithersburg, MD: AOAC International, 2000.
|
| [7] |
鲁琼, 王立改, 楼宝, 等. 饲料蛋白质水平对黄姑鱼幼鱼生长性能、体组成和消化酶活性的影响[J]. 动物营养学报, 2015, 20(12): 3763-3771. DOI:10.3969/j.issn.1006-267x.2015.12.015 |
| [8] |
桂远明. 水产养殖学专业实验实习教材-水产动物机能学实验[M]. 北京: 中国农业出版社, 2004: 113-116.
|
| [9] |
ROBBINS K R, SAXTON A M, SOUTHERN L L. Estimation of nutrient requirements using broken-line regression analysis[J]. Journal of Animal Science, 2006, 84(Suppl.13): E155-W165. |
| [10] |
SANTIAGO C B, REYES O S. Optimum dietary protein level for growth of bighead carp (Aristichthys nobilis) fry in a static water system[J]. Aquaculture, 1991, 93(2): 155-165. DOI:10.1016/0044-8486(91)90214-R |
| [11] |
李彬, 梁旭方, 刘立维, 等. 饲料蛋白水平对大规格草鱼生长、饲料利用和氮代谢相关酶活性的影响[J]. 水生生物学报, 2014, 38(2): 233-240. |
| [12] |
曾本和, 王万良, 朱龙, 等. 饲料蛋白质水平对台湾泥鳅生长性能、形体指标和体成分的影响[J]. 动物营养学报, 2017, 29(9): 3413-3421. DOI:10.3969/j.issn.1006-267x.2017.09.047 |
| [13] |
KIM K, WANG X J, BAI S C. Reevaluation of the dietary protein requirement of Japanese flounder Paralichthys olivaceus[J]. Journal of the World Aquaculture Society, 2010, 34(2): 133-139. |
| [14] |
YANG S D, LIN T S, LIOU C H, et al. Influence of dietary protein levels on growth performance, carcass composition and liver lipid classes of juvenile Spinibarbus hollandi(Oshima)[J]. Aquaculture Research, 2015, 34(8): 661-666. |
| [15] |
REN M C, AI Q H, MAI K S, et al. Effect of dietary carbohydrate level on growth performance, body composition, apparent digestibility coefficient and digestive enzyme activities of juvenile cobia, Rachycentron canadum L[J]. Aquaculture Research, 2011, 42(10): 1467-1475. DOI:10.1111/are.2011.42.issue-10 |
| [16] |
丁立云, 张利民, 王际英, 等. 饲料蛋白水平对星斑川鲽幼鱼生长、体组成及血浆生化指标的影响[J]. 中国水产科学, 2010, 17(6): 1285-1292. |
| [17] |
张磊, 危起伟, 张书环, 等. 饲料蛋白水平对达氏鲟幼鱼生长性能、体组成、消化酶活性以及血液生化指标的影响[J]. 淡水渔业, 2016, 46(6): 79-85. DOI:10.3969/j.issn.1000-6907.2016.06.014 |
| [18] |
韩如政, 骆小年, 韩雨哲, 等. 北方须鳅幼鱼的饲料蛋白质需求量[J]. 动物营养学报, 2016, 28(12): 3905-3911. |
| [19] |
李爱杰. 水产动物营养与饲料学[M]. 北京: 中国农业出版社, 1996: 103.
|
| [20] |
杨弘, 徐起群, 乐贻荣, 等. 饲料蛋白质水平对尼罗罗非鱼幼鱼生长性能、体组成、血液学指标和肝脏非特异性免疫指标的影响[J]. 动物营养学报, 2012, 24(12): 2384-2392. DOI:10.3969/j.issn.1006-267x.2012.12.013 |
| [21] |
陈壮, 梁萌青, 郑珂珂, 等. 饲料蛋白水平对鲈鱼生长、体组成及蛋白酶活力的影响[J]. 渔业科学进展, 2014, 35(2): 51-59. DOI:10.3969/j.issn.1000-7075.2014.02.008 |
| [22] |
MOHSENI M, POURALI H R, KAZEMI R, et al. Evaluation of the optimum dietary protein level for the maximum growth of juvenile beluga (Huso huso L.1758)[J]. Aquaculture Research, 2015, 45(11): 1832-1841. |
| [23] |
钱曦, 王桂芹, 周洪琪, 等. 饲料蛋白水平及豆粕替代鱼粉比例对翘嘴红鲌消化酶活性的影响[J]. 动物营养学报, 2007, 19(2): 182-187. DOI:10.3969/j.issn.1006-267X.2007.02.017 |
| [24] |
杨代勤, 严安生, 陈芳, 等. 不同饲料对黄鳝消化酶活性的影响[J]. 水产学报, 2003, 27(6): 558-563. |
| [25] |
DAS K M, TRIPATHI S D. Studies on the digestive enzymes of grass carp, Ctenopharyngodon idella(Val.)[J]. Aquaculture, 1991, 92: 21-32. DOI:10.1016/0044-8486(91)90005-R |
| [26] |
吕耀平, 陈建明, 叶金云, 等. 饲料蛋白质水平对刺鲃幼鱼的生长、胴体营养组成及消化酶活性的影响[J]. 农业生物技术学报, 2009, 17(2): 276-281. DOI:10.3969/j.issn.1674-7968.2009.02.016 |
| [27] |
DEBNATH D, PAL A K, SAHU N P, et al. Digestive enzymes and metabolic profile of Labeo rohita fingerlings fed diets with different crude protein levels[J]. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 2007, 146(1): 107-114. DOI:10.1016/j.cbpb.2006.09.008 |




