2. 唐人神集团股份有限公司院士工作站, 株洲 412002;
3. 中国科学院亚热带农业生态研究所, 中国科学院亚热带农业生态工程重点实验室, 长沙 410125
2. Academician Workstation of Tangrenshen Group, Zhuzhou 412002, China;
3. Key Laboratory for Agro-Ecological Processes in Subtropical Region, Institute of Subtropical Agriculture, Chinese Academy of Sciences, Changsha 410125, China
现代养猪生产中,仔猪断奶时间一般为18~28日龄,断奶行为给仔猪在生活及环境方面带来了很大的变化并容易引起腹泻,导致仔猪生长受阻甚至死亡,给养猪生产带来较大损失。研究表明,饲粮中添加药理剂量氧化锌(3 000 mg/kg左右)可以显著降低断奶仔猪腹泻率[1-3],增加采食量并提高日增重[4-5]。但长期添加药理剂量氧化锌反过来又会影响断奶仔猪生长发育,药理剂量氧化锌降低仔猪腹泻促进生长的这种优势只能维持到断奶后3周,超过3周氧化锌毒性的负面作用就会显现出来[6-7]。并且,氧化锌的利用率很低,大约有80%的氧化锌从粪便中排出[8],造成锌源的浪费和环境的污染。由于环保意识的不断加强,可降低锌排放的高利用率新型氧化锌成为行业研究的热点。新工艺生产的多孔氧化锌,与普通氧化锌相比具有更好的流动性、更大的比表面积、更低的系酸力,可以有效降低断奶仔猪腹泻并促进其生长[9-10]。有研究表明,肠道短链脂肪酸含量及微生物菌群与仔猪断奶后腹泻、肠道健康状况有较大关系[11-12],但目前关于多孔氧化锌在这方面的研究报道较少。因此,本试验拟探讨不同添加量的多孔氧化锌对断奶仔猪粪便微量元素排放、肠道短链脂肪酸含量及菌群多样性的影响,旨在为多孔氧化锌在仔猪饲粮中的应用提供理论和科学依据。
1 材料与方法 1.1 试验材料本试验所用多孔氧化锌(锌含量为75%)由法国Animine公司提供;普通氧化锌(锌含量为79%)由湖北博华农牧科技有限公司提供。
1.2 试验设计及试验饲粮按照体重相近的原则,选取192头健康状况良好的21日龄“杜×长×大”断奶仔猪[平均体重(6.32±0.24) kg],再按照体重相近原则分成4个组,分别为A组(正对照组,在基础饲粮中添加3 000 mg/kg普通氧化锌)、B组(负对照组,基础饲粮)、C组(在基础饲粮中添加750 mg/kg多孔氧化锌)、D组(在基础饲粮中添加1 500 mg/kg多孔氧化锌),每组6个重复,每个重复8头仔猪(公母各占1/2),试验期14 d。试验用基础饲粮参照NRC(2012)仔猪营养需要标准进行配制,其组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
饲养试验在唐人神集团股份有限公司科研猪场进行。试验猪在保育高床上饲养,饲粮为固体颗粒料,自由采食,自由饮水,按时打扫栏内卫生,定期消毒,按照常规程序进行免疫。
1.4 样品的采集试验第13天16:00,每个重复选1头仔猪,无菌收集直肠内容物(粪便),分为2份,分别放入10 mL冻存管并迅速放入液氮中保存,一份用于检测微量元素含量,另一份用于检测短链脂肪酸含量;试验第14天,每个重复屠宰1头仔猪,无菌采集空肠中段与盲肠内容物,分别放入5 mL冻存管并迅速置于液氮中。样品采集完毕后转移到-80 ℃冰箱保存备用。
1.5 测定指标及方法 1.5.1 饲粮中营养成分含量测定饲粮中粗蛋白质含量参照国家标准GB/T 6432—1994进行测定;赖氨酸含量参照国家标准GB/T 18246—2000进行测定;钙含量参照国家标准GB/T 6436—2002进行测定。
1.5.2 粪便中微量元素含量测定粪便中微量元素含量采用原子吸收光谱仪(Thermo Fisher ICE3500,美国)测定。测定前将新鲜粪样在65 ℃烘干,粉碎,过40目筛,自封袋保存。准确称取1~2 g粪样于坩埚中,然后在电炉上加热至完全碳化,随后转到550 ℃马弗炉中灼烧灰化4 h至无炭粒且呈灰白色,取出冷却后加入10 mL浓硝酸,再次置于电炉加热至微沸,微沸状态持续5 min,趁热过滤至100 mL容量瓶中,冷却后定容,待测。
1.5.3 盲肠内容物和粪便中短链脂肪酸含量测定盲肠内容物和粪便中短链脂肪酸含量的测定采用气相色谱法(岛津GC-2014ATF/SPL气相色谱仪,日本)。准确称取1 g样品,加4 mL超纯水,振荡混匀30 min后,15 000 r/min离心15 min将上清液转移;重复以上步骤1次,合并上清液并定容到10 mL离心管中,取4.5 mL上清液,按9 : 1体积比在样品中加入25%偏磷酸,固定3 h以上。然后15 000 r/min离心10 min,45 μm滤膜过滤,加入上机瓶。
色谱条件:色谱柱选用DB-FFAP柱,规格30 mm×250 μm×0.25 μm;载气为高纯氮气,流量0.8 mL/min,辅助气为高纯氢气,火焰离子检测器(FID)温度280 ℃,进样口温度250 ℃,分流比50 : 1,进样量1 μL;程序升温,初始温度60 ℃,以20 ℃/min速率升温至220 ℃,保持1 min。
1.5.4 肠道菌群多样性分析将样品送至上海派森诺生物技术公司,使用高通量测序技术对空肠内容物进行16S rRNA基因测序。
1.6 数据处理及分析试验数据经Excel 2007整理后,采用SAS 8.0统计软件的one-way ANOVA程序进行单因素方差分析,采用Tukey’s法进行组间多重比较,数据用平均值表示,用SEM反映组间样本均值的离散程度、衡量样本均值与总体均值离散程度。统计分析以P < 0.05表示有差异显著。
2 结果与分析 2.1 多孔氧化锌对断奶仔猪粪便中微量元素含量的影响由表 2可知,与添加3 000 mg/kg普通氧化锌的A组相比,添加750 mg/kg多孔氧化锌的C组、添加1 500 mg/kg多孔氧化锌的D组及未添加氧化锌的B组粪便中锌含量显著降低(P < 0.05);C组粪便中锰含量显著高于A组、D组(P < 0.05),与B组差异不显著(P>0.05)。各组粪便中铜、铁含量差异不显著(P>0.05)。
|
|
表 2 多孔氧化锌对断奶仔猪粪便中微量元素含量的影响(风干基础) Table 2 Effects of porous zinc oxide on microelement contents in feces of weaned piglets (air-dry basis) |
由表 3可知,与B组相比,A组、C组、D组盲肠内容物中乙酸含量分别增加了33.58%、44.74%、39.79%(P < 0.05);C组和D组盲肠内容物中丙酸含量显著增加(P < 0.05),A组则无显著变化(P>0.05);A组、C组、D组盲肠内容物中异丁酸、异戊酸和戊酸含量无显著变化(P>0.05)。盲肠内容物中各短链脂肪酸含量在A组、C组和D组之间均无显著差异(P>0.05)。粪便中各短链脂肪酸含量在各组之间均无显著差异(P>0.05)。
|
|
表 3 多孔氧化锌对断奶仔猪盲肠内容物和粪便中短链脂肪酸含量的影响 Table 3 Effects of porous zinc oxide on short chain fatty acid contents in cecum content and feces of weaned piglets |
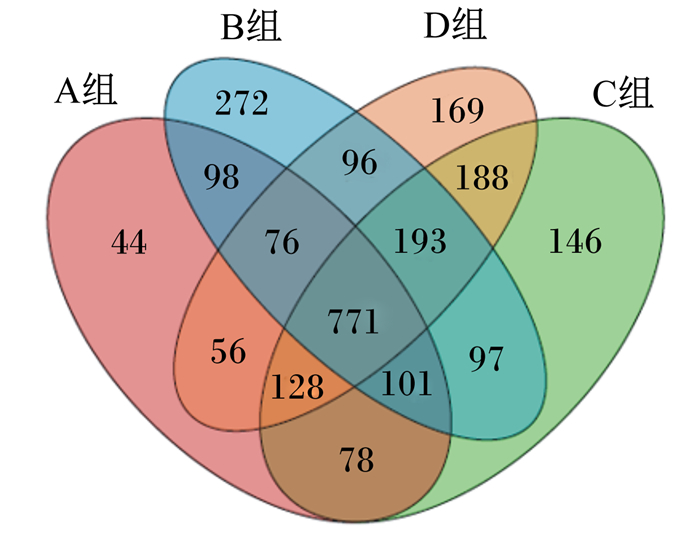
根据空肠内容物样品中的可操作分类单元(OTUs),聚类分析结果将共有、特有的OTUs进行分析并绘制了Venn图,从图 1中可以看出,A组、B组、C组、D组共有的OTUs个数为771,其中A组特有的OTUs数为44,B组特有的OTUs数为272,C组特有的OTUs数为146,D组特有的OTUs数为169。
|
图 1 OTUs聚类分析结果 Figure 1 OTUs clustering analysis results |
使用QIIME软件,对OTUs丰度矩阵中每个样本的序列按90%的相似度在不同深度下随机抽样,以每个深度下抽取的序列数及其对应的OTUs数分别计算反映群落丰富度的Chao1、ACE指数及兼顾群落均匀性的Shannon和Simpson指数。从表 4可以看出,与A组相比,B组、C组、D组的Chao1、ACE指数逐渐升高,虽然组间差异不显著(P>0.05),但在一定程度上也可以反映菌落丰富度在增加;B组的Shannon指数最高,为6.23,其次是C组、D组,分别为6.04和5.84,A组最低,为5.30,Simpson指数变化规律与Shannon指数类似,表明高剂量普通氧化锌有抑制菌群丰富度与均匀度的趋势,从而降低菌群多样性。
|
|
表 4 α多样性指数 Table 4 α diversity indices |
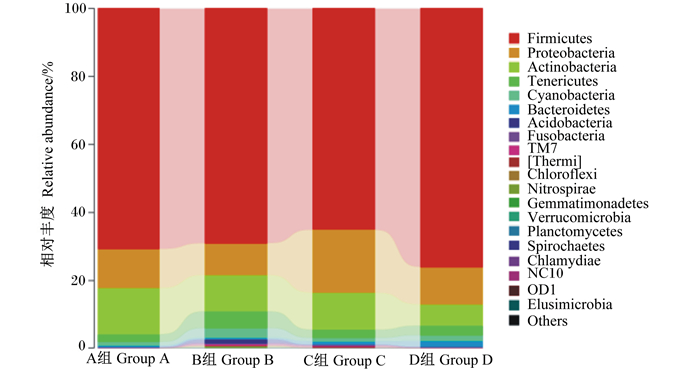
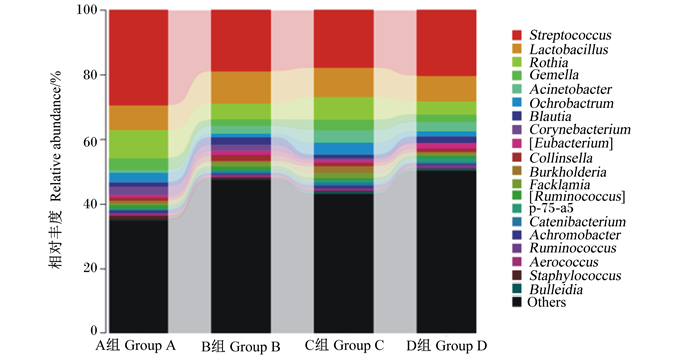
根据物种注释结果,分别在门水平和属水平选取了丰富度排名前20的物种进行了分析,由图 2可知,在门水平上,仔猪空肠主要优势菌群包括厚壁菌门(Firmicutes)、变形杆菌门(Proteobacteria)、放线菌门(Actinobacteria)、无壁菌门(Tenericutes);C组与D组相比,随着多孔氧化锌添加量的增加,厚壁菌门相对丰度增加,变形杆菌门、放线菌门相对丰度降低。从整体来看,添加氧化锌后对空肠的菌群结构与均匀度有较大的影响。由图 3可知,在属水平上,仔猪空肠主要优势菌群包括链球菌属(Streptococcus)、乳杆菌属(Lactobacillus)、罗斯氏菌属(Rothia)和其他物种;与B组相比,A组、D组链球菌属相对丰度增加,乳杆菌属相对丰度降低,A组、C组罗氏菌属相对丰度增加;另外,C组不动杆菌属(Acinetobacter)和苍白杆菌属(Ochrobactrum)相对丰度最高。
|
Firmicutes:厚壁菌门;Proteobacteria:变形杆菌门;Actinobacteria:放线菌门;Tenericutes:无壁菌门;Cyanobacteria:蓝细菌门;Bacteroidetes:拟杆菌门;Acidobacteria:酸杆菌门;Fusobacteria:梭杆菌门;Chloroflexi:绿屈挠菌门;Nitrospirae:硝化螺旋菌门;Gemmatimonadetes:芽单胞菌门;Verrucomicrobia:疣微菌门;Planctomycetes:浮霉状菌门;Spirochaetes:螺旋体门;Chlamydiae:衣原体门;Elusimicrobia:迷踪菌门;Others:其他。 图 2 空肠菌群门水平分布 Figure 2 Bacterial distribution in jejunum at phylum level |
|
Streptococcus:链球菌属;Lactobacillus:乳杆菌属;Rothia:罗斯氏菌属;Gemella:孪生球菌属;Acinetobacter:不动杆菌属;Ochrobactrum;苍白杆菌属;Corynebacterium:棒杆菌属;Eubacterium:真杆菌属;Collinsella:柯林斯氏菌属;Burkholderia:伯克霍尔德氏菌属;Facklamia:费克蓝姆氏菌属;Catenibacterium:粪球菌属;Achromobacter:无色杆菌属;Ruminococcus:瘤胃球菌属;Aerococcus:气球菌属;Staphylococcus:葡萄球菌属;Others:其他。 图 3 空肠菌群属水平分布 Figure 3 Bacterial distribution in jejunum at genus level |
研究表明,饲粮中锌和铜、铁存在着拮抗作用,即添加高锌时会降低铜、铁的吸收利用率,会使得粪便中铜、铁的含量增加,这种拮抗作用可能是由于多个微量元素在装运过程中竞争共用转运载体产生的[13-16]。本试验结果中,相比于负对照组,添加3 000 mg/kg普通氧化锌及750、1 500 mg/kg多孔氧化锌并未对断奶仔猪粪便中铜含量造成显著影响,同时,也未显著影响断奶仔猪粪便中铁含量,这与Carlson等[17]、王超[18]的研究结果一致。一般情况下,配制高剂量氧化锌的饲粮时都会将铜、铁添加量加大,以保证在拮抗作用下有足够的铜、铁被仔猪吸收而满足其生长,这样高剂量氧化锌对铜、铁的拮抗作用相对来说会减弱或者消除[8]。本研究结果还表明,与添加3 000 mg/kg普通氧化锌相比,添加750和1 500 mg/kg多孔氧化锌显著降低了断奶仔猪粪便中锌含量。Wang等[19]研究表明,与饲粮中添加氧化锌+硫酸黏杆菌混合物相比,添加1 200 mg/kg纳米氧化锌显著降低粪便中锌含量。申俊华等[20]研究了包被氧化锌对粪便中锌含量的影响,认为可以使用低浓度氧化锌替代高浓度普通氧化锌,从而达到降低粪便中锌含量,节约锌源,减少污染环境,与本试验结果一致。另外,本试验结果还显示,添加750 mg/kg多孔氧化锌的C组粪便中锰含量显著高于A组、D组,与B组差异不显著,同时B组粪便中锰含量显著高于添加1 500 mg/kg多孔氧化锌的D组,饲粮中锌水平对粪便中锰含量而言,似乎并没有很强的相关性,这与徐书培[21]的研究结果基本一致。
3.2 多孔氧化锌对断奶仔猪盲肠内容物及粪便中短链脂肪酸含量的影响短链脂肪酸一般是指乙酸、丙酸、丁酸、异丁酸、戊酸和异戊酸,它们由肠道微生物通过厌氧发酵肠道中纤维和抗性淀粉而产生[22]。短链脂肪酸中,乙酸可迅速被肠上皮吸收进入外周血液并为宿主供能[23],丙酸经上皮吸收后进入肝脏,用于糖原合成[24],丁酸是结肠上皮细胞的能源物质,能促进肠道上皮细胞增值与发育[25],肠道微生物也可以通过利用乳酸和丙酸转化为丁酸。短链脂肪酸还可以降低肠道pH,促进有益菌如比双歧杆菌等的增殖,并抑制特定病原菌的定植[26-27]。因此,肠道短链脂肪酸含量的增加有益于肠道健康,有利于动物生长。本研究结果显示,与负对照组相比,添加3 000 mg/kg普通氧化锌及750、1 500 mg/kg多孔氧化锌使断奶仔猪盲肠内容物中乙酸含量分别增加了33.58%、44.74%、39.79%,且添加750、1 500 mg/kg多孔氧化锌还显著提高了断奶仔猪盲肠内容物中丙酸的含量;与添加3 000 mg/kg普通氧化锌相比,添加750、1 500 mg/kg多孔氧化锌对断奶仔猪盲肠内容物中各短链脂肪酸含量均未产生显著影响。低剂量氧化锌组与高剂量氧化锌组断奶仔猪盲肠内容物中各短链脂肪酸含量无显著差异的结果与Starke等[7]报道的结果相似,而与Janczyk等[28]报道的对仔猪饲喂高剂量氧化锌饲粮4周后,造成了盲肠内容物中丙酸和异丁酸含量显著下降的结果不一致。其原因可能与饲喂高剂量氧化锌饲粮时间长短相关,饲喂时间超过3周,锌离子毒性累积,对仔猪负面作用凸显[6-7]。
3.3 多孔氧化锌对断奶仔猪肠道菌群多样性的影响仔猪肠道内的有益菌和有害菌是相互拮抗、相互依存的,以维持肠道菌群动态平衡。但断奶应激会破坏这种动态平衡,有研究报道,仔猪产生断奶应激后,肠道内菌群结构容易失调[29],导致仔猪腹泻、饲料转化率下降等问题出现。
本试验结果显示,与未添加氧化锌及添加750、1 500 mg/kg多孔氧化锌相比,添加3 000 mg/kg普通氧化锌后空肠菌群总OUTs数及特有OUTs数减少,Chao1、ACE、Shannon指数都有所下降,且Simpson指数有下降的趋势,意味着高剂量普通氧化锌在一定程度上会降低空肠菌群多样性,不添加氧化锌或添加低剂量氧化锌有利于增加空肠菌群多样性,这种现象可能与低锌环境下细菌的生长调节相关,这与李治学[29]、吕航[30]对回肠菌群多样性的研究结果一致。
有研究表明,高剂量氧化锌显著降低了仔猪回肠中罗伊斯乳酸杆菌、瑞士乳杆菌的比例,增加了魏氏菌、明串珠菌、链球菌的比例[31];高剂量氧化锌降低了35日龄仔猪空肠和回肠乳酸杆菌的数量,并降低了大肠杆菌的数量[7];高剂量氧化锌有降低盲肠乳酸杆菌、双歧杆菌数量的趋势[32]。这些结果说明高剂量氧化锌对空肠、回肠及盲肠菌群多样性的影响基本一致,空肠、回肠的菌群结构很大程度上影响到了后肠菌群结构。本试验结果显示,与未添加氧化锌的负对照组相比,添加3 000 mg/kg普通氧化锌和1 500 mg/kg多孔氧化锌后空肠菌群中乳杆菌属的相对丰度降低,链球菌属的相对丰度增加,与前人研究结果一致,但其具体机制还需进一步研究。
4 结论① 饲粮中添加750和1 500 mg/kg多孔氧化锌可以降低断奶仔猪粪便中锌含量,节约锌资源并减少环境污染。
② 饲粮中添加多孔氧化锌可以提高盲肠中短链脂肪酸含量,有利于丰富肠道菌群多样性。
| [1] |
HILL G M, CROMWELL G L, CRENSHAW T D, et al. Growth promotion effects and plasma changes from feeding high dietary concentrations of zinc and copper to weanling pigs (regional study)[J]. Journal of Animal Science, 2000, 78(4): 1010-1016. DOI:10.2527/2000.7841010x |
| [2] |
LI X L, YIN J L, LI D F, et al. Dietary supplementation with zinc oxide increases IGF-Ⅰ and IGF-Ⅰ receptor gene expression in the small intestine of weanling piglets[J]. Journal of Nutrition, 2006, 136(7): 1786-1791. DOI:10.1093/jn/136.7.1786 |
| [3] |
WANG Y, TANG J W, MA W Q, et al. Dietary zinc glycine chelate on growth performance, tissue mineral concentrations, and serum enzyme activity in weanling piglets[J]. Biological Trace Element Research, 2010, 133(3): 325-334. |
| [4] |
HAHN J D, BAKER D H. Growth and plasma zinc responses of young pigs fed pharmacologic levels of zinc[J]. Journal of Animal Science, 1993, 71(11): 3020-3024. DOI:10.2527/1993.71113020x |
| [5] |
CARLSON M S, BOREN C A, BOREN C A, et al. Evaluation of various inclusion rates of organic zinc either as polysaccharide or proteinate complex on the growth performance, plasma, and excretion of nursery pigs[J]. Journal of Animal Science, 2004, 82(5): 1359-1366. DOI:10.2527/2004.8251359x |
| [6] |
JANCZYK P, KREUZER S, ASSMUS J, et al. No protective effects of high-dosage dietary zinc oxide on weaned pigs infected with Salmonella enterica serovar typhimurium DT104[J]. Applied and Environmental Microbiology, 2013, 79(9): 2914-2921. DOI:10.1128/AEM.03577-12 |
| [7] |
STARKE I C, PIEPER R, NEUMANN K, et al. The impact of high dietary zinc oxide on the development of the intestinal microbiota in weaned piglets[J]. FEMS Microbiology Ecology, 2014, 87(2): 416-427. |
| [8] |
BUFF C E, BOLLINGER D W, ELLERSIECK M R, et al. Comparison of growth performance and zinc absorption, retention, and excretion in weanling pigs fed diets supplemented with zinc-polysaccharide or zinc oxide[J]. Journal of Animal Science, 2005, 83(10): 2380-2386. DOI:10.2527/2005.83102380x |
| [9] |
MORALES J, CORDERO G, PIÑEIRO C, et al. Zinc oxide at low supplementation level improves productive performance and health status of piglets[J]. Journal of Animal Science, 2012, 90(Suppl.4): 436-438. |
| [10] |
LONG L N, CHEN J S, ZHANG Y G, et al. Comparison of porous and nano zinc oxide for replacing high-dose dietary regular zinc oxide in weaning piglets[J]. PLoS One, 2017, 12(8): e0182550. DOI:10.1371/journal.pone.0182550 |
| [11] |
赵桂英, 段纲, 杨亮宇, 等. 仔猪消化道菌群变化与仔猪腹泻的关系[J]. 家畜生态学报, 2004, 25(4): 44-47. DOI:10.3969/j.issn.1673-1182.2004.04.013 |
| [12] |
苏勇, 谢飞, 朱伟云. 健康与腹泻仔猪粪样中挥发性脂肪酸和菌群区系的比较[J]. 微生物学报, 2011, 51(12): 1632-1638. |
| [13] |
HALL A C, YOUNG B W, BREMNER I. Intestinal metallothionein and the mutual antagonism between copper and zinc in the rat[J]. Journal of Inorganic Biochemistry, 1979, 11(1): 57-66. |
| [14] |
李光辉. 微量元素间及其与营养素之间的协同与拮抗作用[J]. 乳业科学与技术, 2005, 27(2): 80-82. DOI:10.3969/j.issn.1671-5187.2005.02.010 |
| [15] |
王希春, 吴金节, 汤继顺, 等. 高锌日粮对断奶仔猪血清、组织及粪便中铜、铁、锌水平的影响[J]. 南京农业大学学报, 2009, 32(4): 127-132. |
| [16] |
TRUCCOLO M M.Swine supplementation with zinc and copper: a review about organic minerals as a solution for environmental contamination[C]//47th Croatian and 7th International Symposium on Agriculture.Opatija, Croatia, 2012.
|
| [17] |
CARLSON M S, HOOVER S L, HILL G M, et al. Effect of pharmacological zinc on intestinal metallothionein concentration and morphology in the nursery pig[J]. Journal of Animal Science, 1998, 76: 57. |
| [18] |
王超.包膜氧化锌促仔猪生长效果及机理研究[D].博士学位论文.杭州: 浙江大学, 2013.
|
| [19] |
WANG C, ZHANG L G, SU W P, et al. Zinc oxide nanoparticles as a substitute for zinc oxide or colistin sulfate:effects on growth, serum enzymes, zinc deposition, intestinal morphology and epithelial barrier in weaned piglets[J]. PLoS One, 2017, 12(7): e0181136. DOI:10.1371/journal.pone.0181136 |
| [20] |
申俊华, 周安国, 王之盛, 等. 包被氧化锌对断奶仔猪腹泻指数及肠道发育的影响[J]. 畜牧兽医学报, 2013, 44(6): 894-900. |
| [21] |
徐书培.山东省不同猪场饲料中微量元素营养调查及研究[D].硕士学位论文.泰安: 山东农业大学, 2016. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=D833745
|
| [22] |
徐万里, 陆高, 梁世杰, 等. 短链脂肪酸介导的菌群-宿主互动与肠易激综合征的研究进展[J]. 世界华人消化杂志, 2015, 23(36): 5815-5822. |
| [23] |
DEN BESTEN G, VAN EUNEN K, GROEN A K, et al. The role of short-chain fatty acids in the interplay between diet, gut microbiota, and host energy metabolism[J]. Journal of Lipid Research, 2013, 54(9): 2325-2340. DOI:10.1194/jlr.R036012 |
| [24] |
BOETS E, DEROOVER L, LUYPAERTS A, et al. Colonic derived propionate as substrate for gluconeogenesis:an in vivo, stable isotope study in humans[J]. Gastroenterology, 2015, 148(4, Suppl.1): S84. |
| [25] |
BULTMAN S J. Molecular pathways:gene-environment interactions regulating dietary fiber induction of proliferation and apoptosis via butyrate for cancer prevention[J]. Clinical Cancer Research, 2014, 20(4): 799-803. DOI:10.1158/1078-0432.CCR-13-2483 |
| [26] |
FUKUDA S, TOH H, HASE K, et al. Bifidobacteria can protect from enteropathogenic infection through production of acetate[J]. Nature, 2012, 469(7331): 543-547. |
| [27] |
ESWARAN S, MUIR J, CHEY W D. Fiber and functional gastrointestinal disorders[J]. The American Journal of Gastroenterology, 2013, 108(5): 718-727. DOI:10.1038/ajg.2013.63 |
| [28] |
JANCZYK P, BÜSING K, DOBENECKER B, et al. Effect of high dietary zinc oxide on the caecal and faecal short-chain fatty acids and tissue zinc and copper concentration in pigs is reversible after withdrawal of the high zinc oxide from the diet[J]. Journal of Animal Physiology & Animal Nutrition, 2015, 99(Suppl.1): 13-22. |
| [29] |
李治学.新型氧化锌对断奶仔猪生产性能与肠道功能的影响及其作用机制研究[D].博士学位论文.杭州: 浙江大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10335-1016267413.htm
|
| [30] |
吕航.高锌对断奶仔猪生产性能和肠道健康的影响[D].硕士学位论文.广州: 华南农业大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10564-1016923136.htm
|
| [31] |
VAHJEN W, PIEPER R, ZENTEK J. Increased dietary zinc oxide changes the bacterial core and enterobacterial composition in the ileum of piglets[J]. Journal of Animal Science, 2011, 89(8): 2430-2439. DOI:10.2527/jas.2010-3270 |
| [32] |
梅绍锋.高铜对断奶仔猪的促生长和微生态效应研究[D].博士学位论文.雅安: 四川农业大学, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10626-2009258858.htm
|




