壳聚糖广泛存在于自然界中,是由虾、蟹、昆虫的几丁质外壳经过不同程度地脱乙酰基而得到的一种无毒聚氨基葡萄糖。壳寡糖(COS)是壳聚糖的降解产物,聚合度(DP)在2~20,分子质量≤3 000 u,其生物活性比壳聚糖更强[1];COS是天然糖中唯一大量存在的碱性氨基寡糖,因具有多元化的生物学作用,使其在医学研究、生物医药和食品科学等领域中受到广泛关注[1]。目前,随着国家对抗生素的使用要求越来越严格以及养殖环境的变化,如何使动物自身免疫力不断提高,从而减少对抗生素的依赖、改善药物残留所带来的危害越来越被大家所重视。因此,在畜牧兽医领域中,COS作为一种天然的免疫增强和炎症调节活性物质,在增强动物免疫机能和抗炎方面具有较高的研究价值和广阔的应用前景。
1 COS的理化性质及生物学作用COS可完全溶于水,部分溶于甲醇和二甲基亚砜,不溶于丙酮和乙醇。DP为2~4的COS可溶于甲醇,但DP>5的COS溶解性较差;由于范德华力等低分子间相互作用,低分子质量COS(< 1 500 u)在较宽pH的范围内可溶于水[2]。COS自身氨基带正电荷,是目前发现的自然界中唯一碱性寡糖,无毒,有较好的生物相容性和生物可降解性以及对大分子药物缓释等特性[1]。因此,与壳聚糖相比,COS在治疗中有更大的应用空间。
COS在胃肠道中不被分解,很容易通过肠上皮细胞吸收,优先分配到肝脏、脾脏和肾脏,可被动物直接吸收入血作用于靶细胞。COS在血浆、肝脏、肾脏和尿液中被溶菌酶降解,其主要排泄途径是尿液[3-4]。目前研究发现,COS具有调节免疫力、抗氧化、抗应激、抗微生物、抑制肿瘤生长、活化肠道有益菌和降低胆固醇等多种生物学作用[5-10]。还能促进组织再生、增强药物和DNA传递和钙吸收等功能[8]。
2 COS的免疫增强作用COS发挥免疫调节的生物学效应,与其对免疫器官、多种免疫细胞的调节效应及诱导多种细胞因子的分泌密切相关。DP在3~8的COS在体外可显著增强原代264.7巨噬细胞的增殖活性和对中性红的吞噬能力,小鼠口服COS后脾脏指数和血清免疫球蛋白(Ig)G含量增加[11]。口服COS还能显著升高环磷酰胺(Cy)诱导的免疫抑制小鼠胸腺和脾脏指数、迟发型变态(DTH)反应、巨噬细胞吞噬作用和一些酶活性,并增强细胞因子白细胞介素(IL)-2、IL-12和干扰素-γ(IFN-γ)的产生[12]。与此同时,COS对T淋巴细胞也产生了明显的调节作用,给小鼠腹腔注射COS己二酸(20 mg/kg)4次,未成熟CD4+、CD8+胸腺T细胞的百分比降低,成熟CD4+、CD8+胸腺淋巴细胞的百分比增加,COS增加了脾脏CD19+细胞百分比,而对肠系膜淋巴结CD19+细胞的百分比无显著影响[13]。这说明COS促进了胸腺淋巴细胞的成熟和分化,并调节了脾脏B淋巴细胞和淋巴结T淋巴细胞的数量。在肉仔鸡(1日龄)饲粮中添加不同水平(0、50、100、150 mg/kg)的COS,第21天和第42天COS(100 mg/kg)添加组仔鸡血清IgG、IgA、IgM含量升高,COS同时促进了免疫器官的发育(脾脏、法氏囊、胸腺重量增加)[14]。COS及衍生物还可通过Th1途径,对接种新城疫活疫苗鸡群的抗原特异性细胞免疫发挥辅助作用[15]。另外,断奶应激可导致血清抗体和细胞因子水平降低,而COS可使早期断奶仔猪空肠黏膜和淋巴结IL-1β基因的表达升高,同时增加了血清IL-1β、IL-2、IL-6、IgA、IgG和IgM含量[16]。由此可以看出,COS可能通过调节细胞因子和抗体的产生提高动物机体细胞介导的免疫反应。因此,COS作为饲料添加剂在家禽和猪的营养方面得到广泛应用[17]。还有学者研究了皮下植入COS对犬巨噬细胞和多核细胞激活的影响,结果发现5和10 mg/kg COS植入术后24~96 h体内,中性粒细胞数量显著增加,巨噬细胞活性增强;20 mg/kg COS植入组直到术后120 h巨噬细胞仍然保留高活性,这提示COS可以作为一种有效的免疫增强剂用于术后免疫抑制的预防[18-19]。COS是以分子质量依赖的方式通过巨噬细胞发挥免疫调节活性,因此,COS作为一种新型的免疫抑制性疾病治疗剂显示出巨大的潜力[19]。
由先天免疫和获得性免疫组成的免疫系统在消除病原体和外来物质方面起着重要作用。药物或营养保健品对免疫功能的增强可能对免疫功能丧失或衰退的人(如老年人)特别有益。通过体外和体内模型现已证明COS有望增强先天免疫和获得性免疫。产生免疫增强作用的COS的体外剂量为10~100 μg/mL,体内剂量为100~500 mg/(kg·d)[11, 20]。它可刺激巨噬细胞分泌肿瘤坏死因子-α(TNF-α)和IL-1[20-21]。此外,COS处理可导致巨噬细胞中诱导型一氧化氮合酶(iNOS)表达和一氧化氮(NO)的产生增加[11]。COS是通过与巨噬细胞上的膜受体相互作用而发挥这种免疫刺激作用,而且已有研究证明COS在巨噬细胞中的免疫刺激作用依赖于Toll样受体4(TLR4)的调节[11]。此外,COS可通过c-Jun氨基末端激酶(JNK)-c-Jun/活化蛋白(AP)-1信号通路刺激Caco-2细胞中IL-8(嗜中性粒细胞趋化因子)以及其他趋化因子配体及其受体[包括趋化因子配体20及趋化因子受体6(CCR6)和趋化因子配体17及趋化因子受体8(CCR8)]的表达[21]。以上研究表明COS可以增强肠上皮细胞的免疫应答,这是防止病原体侵入的第1道防线。
COS的免疫增强作用也已在动物体内得到证明。在小鼠试验中,口服COS能使脾脏指数和血清免疫球蛋白含量增加,这表明COS可增强获得性免疫[11]。此外,在COS处理后,血清中单核细胞的比例和IL-6以及IFN-γ的含量也显著增加;重要的是,COS能显著降低金黄色葡萄球菌感染小鼠的死亡率(从90%至0)[22]。在平均年龄为80岁的老年人中,口服COS(5.1 g/d,持续8周)与血清IL-12和IFN-γ含量的升高有关,它们是已知的T细胞分化刺激剂[23]。所有这些研究表明COS对先天和获得性免疫系统功能具有增强作用(表 1)。
|
|
表 1 COS对细胞和机体免疫的调节作用 Table 1 Regulation function of COS on cell and body immunity |
炎症是一种涉及多种类型的免疫和非免疫细胞的生物反应,它可以保护机体免受有害刺激造成的损伤。通常,炎症反应是由外源性物质和组织损伤产物所激发,伴随着促炎细胞因子的产生、免疫细胞的募集和活化以及自由基的产生[24-25]。正常情况下,这些炎症过程能清除异物和病原体并促使组织的再生。然而,在某些疾病过程中,炎症反应变得过度,会引起急性或慢性的炎症反应和相关的组织/器官损伤。已报道的COS在体外和体内试验显示出抗炎作用的剂量分别为20 μg/mL~1 mg/mL和10~100 mg/(kg·d)[26-28]。巨噬细胞是存在于所有组织中的免疫细胞,它们通过吞噬作用清除病原体或细胞碎片[29]。已有研究表明,COS在巨噬细胞中可抑制脂多糖(LPS)诱导的炎症反应,包括促炎介质[TNF-α、IL-6、iNOS、环氧合酶-2(COX-2)、前列腺素E2(PGE2)和NO]的表达和释放[26-27]。有趣的是,在这种细胞模型中,COS脱乙酰度(DD)的增加与抗炎活性的增加相关。现已证实COS可降低LPS诱导的败血症小鼠模型的死亡率、抑制全身性炎症反应(由血清中TNF-α和IL-1的含量所指示)和减少对肝脏、肾脏和肺脏的损伤[30]。COS可显著降低LPS诱导的这些受损器官中中性粒细胞的浸润和脂质过氧化反应。COS还可以抑制嗜碱性粒细胞、嗜中性粒细胞和淋巴细胞的活化。嗜碱性粒细胞和嗜中性粒细胞是炎症急性期涉及到的主要粒细胞[29]。嗜碱性粒细胞在哮喘等过敏性疾病的发病过程中发挥着重要作用,而嗜中性粒细胞是细菌感染的一线应答者并且参与大多数炎症性疾病。同样,COS可抑制已活化的中性粒细胞活性氧的产生、脱颗粒和黏附,这表明它可抑制嗜中性粒细胞的激活[31]。重要的是,COS在变态反应性疾病治疗中的潜在应用已在卵白蛋白诱导的过敏性肺炎小鼠模型(哮喘小鼠模型)上有了研究[32]。口服COS[16 mg/(kg·d)]抑制了小鼠变态反应过程中促炎性细胞因子[即肺组织和支气管肺泡灌洗液中IL-4、IL-13和TNF-α]的产生。
另外,COS[10~20 mg/(kg·d)]可降低5%葡聚糖硫酸钠(DSS)或4%醋酸诱导的小鼠急性结肠炎模型的死亡率和肠道炎症反应,并降低结肠组织中核因子-κB(NF-κB)活化以及TNF-α、IL-6的含量,COS对小鼠炎症性肠病(IBD)治疗作用可能是通过抑制肠上皮细胞NF-κB的信号转导和细胞凋亡实现的[28]。COS还降低了血清促炎性细胞因子(TNF-α和IL-6)含量,并通过抑制炎症细胞中髓过氧化物酶(MPO)活性以及NF-κB、COX-2和iNOS活性而阻止结肠黏膜炎症反应[33]。另外,COS还能平衡Th1细胞因子,减少TNF-α和IL-6的产生、下调CD44和TLR4的表达和抑制T淋巴细胞增殖,从而减轻尘螨类引起的小鼠气道炎症反应[34]。如果将COS按小剂量和高剂量每天给自身免疫性前色素层炎(EAAU)大鼠腹腔注射,COS呈剂量依赖性的显著减弱睫状体损伤的临床评分和白细胞浸润,COS有效地减少了炎症介质[TNF-α、iNOS、单核细胞趋化蛋白1(MCP-1)、趋化因子(RANTES)和细胞间黏附分子-1(ICAM-1)]的表达[35]。另有研究发现,给21日龄断奶仔猪接种产肠毒素大肠杆菌,然后饲粮中添加300 mg/kg COS饲喂21 d,与对照组(基础饲粮组)相比,断奶后仔猪腹泻率、钙调蛋白水平与TLR4蛋白表达均显著降低,添加COS增强了空肠黏膜IL-1β、IL-6的mRNA表达。饲粮中添加300 mg/kg COS可有效减轻肠道炎症并提高细胞介导的免疫反应,作为饲料添加剂,壳聚糖与金霉素缓解仔猪肠道炎症的作用相当,但其影响机制可能不同[36]。目前,壳聚糖及COS在犬体内的抗炎作用研究报道甚少,而主要应用于骨缺损的修复[37-39]。综观以上文献,通过口服或注射途径给予COS均可对动物机体的免疫和炎症反应产生调节作用,所以COS在动物免疫抑制和炎症性疾病中的应用具有广阔前景(表 2)。
|
|
表 2 COS在细胞和机体内抗炎活性 Table 2 Antiinflammatory activity of COS in cells and body |
目前,COS调节免疫功能和炎症反应的确切作用机制尚不清楚,从现有的研究报道来看,COS可能通过MAPK和NF-κB信号通路对机体免疫和炎症产生影响。NO作为体内重要的生物信息分子在免疫调节中起着重要作用,COS能显著提高巨噬细胞NF-κB蛋白水平,特异性抑制剂阻断NF-κB可导致NO、TNF-α水平的降低,这表明NF-κB在COS诱导巨噬细胞产生NO和TNF-α中起着潜在的作用[40]。COS抑制巨噬细胞NO和炎症因子TNF-α、IL-6产生,还依赖于NF-κB激活的MAPK通路的控制。LPS是革兰氏阴性细菌细胞壁的组成成分,参与了多种炎症相关疾病的病理过程,LPS结合TLR-4,促进NF-κB向细胞核内移位,诱导促炎基因的转录从而引发炎症反应[41]。COS在多种细胞和动物模型中已被广泛证明可通过以上途径抑制LPS或其他刺激物诱导的炎症反应[16]。COS通过NF-κB抑制因子-α(IκB-α)的降解,阻止p65亚基向核内移位并导致NF-κB/DNA结合活性的降低,从而导致LPS诱导的炎症因子TNF-α、IL-6释放减少。然而,这一过程还依赖于NF-κB激活的MAPK通路的控制[35, 41-42]。MAPK由3种下游介质组成,包括p38 MAPK、细胞外信号调节激酶1/2(ERK1/2)和应激活化蛋白激酶1/2(JNK1/2)。这3种介质促进AP-1向核内移位,诱导促炎基因的转录。现有研究表明,COS是通过抑制NF-κB和MAPK信号通路来缓解LPS诱导的炎症,给小鼠腹腔注射COS(10 mg/kg)可减少视网膜缺血再灌注损伤炎症介质(TNF-α、MCP-1、iNOS、ICAM-1)的表达,这种作用的发挥可能是通过阻断NF-κB、JNK和ERK的活化和促进p38的激活实现的[43]。在给EAAU模型大鼠每天腹腔注射小剂量COS(5 μmg/kg)和高剂量COS(10 μmg/kg)的研究中,COS有效地减少了炎症介质的表达,其机制可能是COS降低了IκB的降解和p65在虹膜/睫状体中的存在,导致NF-κB/DNA结合活性的降低[35]。COS能使LPS诱导的猪髂动脉诱导内皮细胞ICAM-1和E-选择素mRNA的表达降低,是通过抑制p38 MAPK/ERK1/2和NF-κB细胞信号转导级联反应实现的,COS通过抑制p38 MAPK和ERK1/2途径,进而抑制了LPS诱导的NF-κB p65移位[44]。所以,COS可能是通过抑制MAPK的磷酸化和激活NF-κB来下调LPS诱导的PIECs中E-选择素和ICAM-1的表达,从而证实了COS的抗炎作用。此外,COS还可抑制LPS诱导的人脐静脉内皮细胞(HUVECs)IL-6的表达,但其机制可能受2条平行的信号通路所调节:即通过p38 MAPK通路而不依赖NF-κB的激活以及通过ERK1/2通路依赖于NF-κB的激活[45]。由以上可以看出,COS对炎症反应的调节作用可能是通过抑制IκB的降解,阻止p65亚基向核内移位,降低了NF-κB/DNA结合活性而发挥抗炎和免疫调节作用,但这种作用的发挥可能还与ERK、JNK、p38 MAPK的磷酸化水平密切相关,其具体机制和相互之间的联系仍需进一步研究(图 1)。
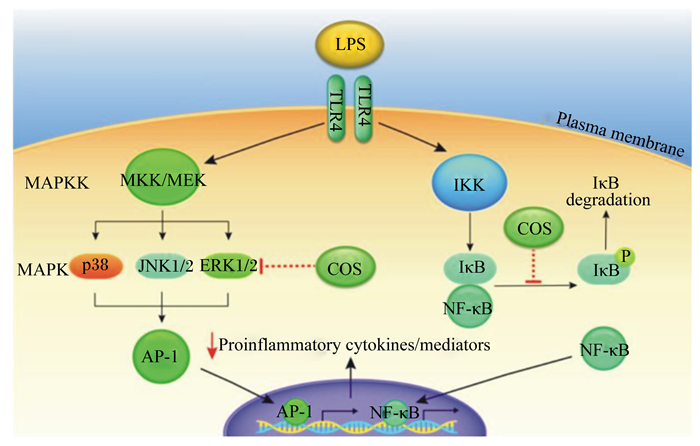
|
LPS:脂多糖;TLR4:Toll样受体4;plasma membrane:质膜;MAPKK:促分裂原活化蛋白激酶激酶;MAPK:丝裂原活化蛋白激酶;MKK/MEK:MAPK激酶;p38:蛋白38;JNK1/2:应激活化蛋白激酶1/2;ERK1/2:细胞外信号调节激酶1/2;COS:壳寡糖;IKK:核因子κB抑制物激酶;IκB:核因子-κB抑制因子-α;NF-κB:核因子-κB;AP-1:核转录因子激活蛋白-1;Proinflammatory cytokines/mediators:前炎性细胞活素/介质。 图 1 COS对MAPK和NF-κB信号通路的影响机制 Fig. 1 Influence mechanism of COS on MAPK and NF-κB signaling pathways[8] |
COS在奶牛生产实践中具有广阔的应用前景,不仅可以改变瘤胃内菌群结构,降低甲烷的产生,还能使微生物蛋白质的合成和纤维的分解增加,并可提高奶牛生产性能、免疫功能、抗氧化能力及改善后肠道菌群结构[46]。与此同时,COS作为新型的无害添加剂,有着良好的抗氧化性、免疫调节能力、改善肠道微生态平衡等作用,且不会对动物机体产生毒副作用、安全可靠,使其在养猪生产中得到了广泛应用[47]。研究表明,饲粮中添加COS降低了仔猪的腹泻率,减少肠道黏膜的损伤和改善肠道微生态平衡,同时可显著提高日增重,从而提高仔猪的生长性能[48]。另有研究报道,蛋鸡饲粮中添加COS,提高了蛋鸡的产蛋率、鸡蛋的质量以及蛋鸡的免疫力[49-50]。由此表明,COS在维持动物健康、提高动物生产性能、改善畜产品品质等方面具有很大的利用和开发价值。
6 小结和展望COS代表了一类天然聚合物,不仅具有水溶性和低黏度等理化特性,而且有良好的药理学作用和安全性以及多种有益的生物学活性,使其在动物疾病防治中具有较大的应用前景。COS对AMPK的激活和炎性信号传导通路的抑制(包括NF-κB和MAPK通路)被认为是其发挥抗炎和免疫增强作用的主要机制。然而,目前研究使用的是COS混合物,且主要集中在细胞和动物模型上对其生物活性和毒性进行研究。因此,未来还需使用化学特性更为明确的纯化COS在动物体内进一步完善其作用途径和机制,并在实际生产中验证和评价COS对动物常发疾病的预防、治疗效果及安全性,从而为在动物生产中的推广和有效利用COS提供理论指导。
| [1] |
KIM H, TATOR C H, SHOICHET M S. Chitosan implants in the rat spinal cord:biocompatibility and biodegradation[J]. Journal of Biomedical Materials Research Part A, 2011, 97A(4): 395-404. DOI:10.1002/jbm.a.v97a.4 |
| [2] |
AAM B B, HEGGSET E B, NORBERG A L, et al. Production of chitooligosaccharides and their potential applications in medicine[J]. Marine Drugs, 2010, 8(5): 1482-1517. DOI:10.3390/md8051482 |
| [3] |
DONG W, HAN B Q, FENG Y L, et al. Pharmacokinetics and biodegradation mechanisms of a versatile carboxymethyl derivative of chitosan in rats:in vivo and in vitro evaluation[J]. Biomacromolecules, 2010, 11(6): 1527-1533. DOI:10.1021/bm100158p |
| [4] |
DONG W, YANG Z Q, PENG Y, et al. Effects of molecular weights on the absorption, distribution and urinary excretion of intraperitoneally administrated carboxymethyl chitosan in rats[J]. Journal of Materials Science:Materials in Medicine, 2012, 23(12): 2945-2952. DOI:10.1007/s10856-012-4747-7 |
| [5] |
DREWNOWSKA O, TUREK B, CARSTANJEN B, et al. Chitosan-a promising biomaterial in veterinary medicine[J]. Polish Journal of Veterinary Sciences, 2013, 16(4): 843-848. DOI:10.2478/pjvs-2013-0119 |
| [6] |
MASUDA S, AZUMA K, KUROZUMI S, et al. Anti-tumor properties of orally administered glucosamine and N-acetyl-D-glucosamine oligomers in a mouse model[J]. Carbohydrate Polymers, 2014, 111: 783-787. DOI:10.1016/j.carbpol.2014.04.102 |
| [7] |
MATTAVEEWONG T, WONGKRASANT P, CHANCHAI S, et al. Chitosan oligosaccharide suppresses tumor progression in a mouse model of colitis-associated colorectal cancer through AMPK activation and suppression of NF-κB and mTOR signaling[J]. Carbohydrate Polymers, 2016, 145: 30-36. DOI:10.1016/j.carbpol.2016.02.077 |
| [8] |
MUANPRASAT C, CHATSUDTHIPONG V. Chitosan oligosaccharide:biological activities and potential therapeutic applications[J]. Pharmacology & Therapeutics, 2016, 170: 80-97. |
| [9] |
ŞENEL S, MCCLURE S J. Potential applications of chitosan in veterinary medicine[J]. Advanced Drug Delivery Reviews, 2004, 56(10): 1467-1480. |
| [10] |
吴玉潇, 徐海涛, 高云华, 等. 壳寡糖的生物活性研究进展[J]. 明胶科学与技术, 2015, 35(3): 128-132. DOI:10.3969/j.issn.1004-9657.2015.03.004 |
| [11] |
ZHANG P, LIU W Z, PENG Y F, et al. Toll like receptor 4(TLR4) mediates the stimulating activities of chitosan oligosaccharide on macrophages[J]. International Immunopharmacology, 2014, 23(1): 254-261. DOI:10.1016/j.intimp.2014.09.007 |
| [12] |
MEI Y X, CHEN H X, ZHANG J, et al. Protective effect of chitooligosaccharides against cyclophosphamide-induced immunosuppression in mice[J]. International Journal of Biological Macromolecules, 2013, 62: 330-335. DOI:10.1016/j.ijbiomac.2013.09.038 |
| [13] |
OBMIÑSKA-MRUKOWICZ B, SZCZYPKA M, GAWEDA B. Modulatory effects of chitosan adipate on the T and B lymphocyte subsets in mice[J]. Journal of Veterinary Science, 2006, 7(2): 157-160. DOI:10.4142/jvs.2006.7.2.157 |
| [14] |
HUANG R L, DENG Z Y, YANG C B, et al. Dietary oligochitosan supplementation enhances immune status of broilers[J]. Journal of the Science of Food and Agriculture, 2010, 87(1): 153-159. |
| [15] |
RAUW F, GARDIN Y, PALYA V, et al. The positive adjuvant effect of chitosan on antigen-specific cell-mediated immunity after chickens vaccination with live Newcastle disease vaccine[J]. Veterinary Immunology and Immunopathology, 2010, 134(3/4): 249-258. |
| [16] |
YIN Y L, TANG Z R, SUN Z H, et al. Effect of galacto-mannan-oligosaccharides or chitosan supplementation on cytoimmunity and humoral immunity in early-weaned piglets[J]. Asian-Australasian Journal of Animal Sciences, 2008, 21(5): 723-731. DOI:10.5713/ajas.2008.70408 |
| [17] |
SWIATKIEWICZ S, SWIATKIEWICZ M, ARCZEWSKA-WLOSEK A, et al. Chitosan and its oligosaccharide derivatives (chito-oligosaccharides) as feed supplements in poultry and swine nutrition[J]. Journal of Animal Physiology and Animal Nutrition, 2015, 99(1): 1-12. DOI:10.1111/jpn.12222 |
| [18] |
KOSAKA T, KANEKO Y, NAKADA Y, et al. Effect of chitosan implantation on activation of canine macrophages and polymorphonuclear cells after surgical stress[J]. Journal of Veterinary Medical Science, 1996, 58(10): 963-967. DOI:10.1292/jvms.58.10_963 |
| [19] |
ZHENG B, WEN Z S, HUANG Y J, et al. Molecular weight-dependent immunostimulative activity of low molecular weight chitosan via regulating NF-κB and AP-1 signaling pathways in RAW264.7 macrophages[J]. Marine Drugs, 2016, 14(9): 169. DOI:10.3390/md14090169 |
| [20] |
FENG J, ZHAO L H, YU Q Q. Receptor-mediated stimulatory effect of oligochitosan in macrophages[J]. Biochemical and Biophysical Research Communications, 2004, 317(2): 414-420. DOI:10.1016/j.bbrc.2004.03.048 |
| [21] |
BAHAR B, O'DOHERTY J V, MAHER S, et al. Chitooligosaccharide elicits acute inflammatory cytokine response through AP-1 pathway in human intestinal epithelial-like (Caco-2) cells[J]. Molecular Immunology, 2012, 51(3/4): 283-291. |
| [22] |
MOON J, KIM H, KOO H C, et al. The antibacterial and immunostimulative effect of chitosan-oligosaccharides against infection by Staphylococcus aureus isolated from bovine mastitis[J]. Applied Microbiology and Biotechnology, 2007, 75(5): 989-998. DOI:10.1007/s00253-007-0898-8 |
| [23] |
KIM H M, HONG S H, YOO S J, et al. Differential effects of chitooligosaccharides on serum cytokine levels in aged subjects[J]. Journal of Medicinal Food, 2006, 9(3): 427-430. DOI:10.1089/jmf.2006.9.427 |
| [24] |
KARIN M, CLEVERS H. Reparative inflammation takes charge of tissue regeneration[J]. Nature, 2016, 529(7586): 307-315. DOI:10.1038/nature17039 |
| [25] |
TAKEUCHI O, AKIRA S. Pattern recognition receptors and inflammation[J]. Cell, 2010, 140(6): 805-820. DOI:10.1016/j.cell.2010.01.022 |
| [26] |
LEE S H, SENEVIRATHNE M, AHN C B, et al. Factors affecting anti-inflammatory effect of chitooligosaccharides in lipopolysaccharides-induced RAW264.7 macrophage cells[J]. Bioorganic & Medicinal Chemistry Letters, 2009, 19(23): 6655-6658. |
| [27] |
YOON H J, MOON M E, PARK H S, et al. Chitosan oligosaccharide (COS) inhibits LPS-induced inflammatory effects in RAW 264.7 macrophage cells[J]. Biochemical and Biophysical Research Communications, 2007, 358(3): 954-959. DOI:10.1016/j.bbrc.2007.05.042 |
| [28] |
YOUSEF M, PICHYANGKURA R, SOODVILAI S, et al. Chitosan oligosaccharide as potential therapy of inflammatory bowel disease:therapeutic efficacy and possible mechanisms of action[J]. Pharmacological Research, 2012, 66(1): 66-79. |
| [29] |
ARTIS D, SPITS H. The biology of innate lymphoid cells[J]. Nature, 2015, 517(7534): 293-301. DOI:10.1038/nature14189 |
| [30] |
QIAO Y, BAI X F, DU Y G. Chitosan oligosaccharides protect mice from LPS challenge by attenuation of inflammation and oxidative stress[J]. International Immunopharmacology, 2011, 11(1): 121-127. |
| [31] |
DOU J L, TAN C Y, DU Y G, et al. Effects of chitooligosaccharides on rabbit neutrophils in vitro[J]. Carbohydrate Polymers, 2007, 69(2): 209-213. DOI:10.1016/j.carbpol.2006.09.029 |
| [32] |
CHUNG M J, PARK J K, PARK Y I. Anti-inflammatory effects of low-molecular weight chitosan oligosaccharides in IgE-antigen complex-stimulated RBL-2H3 cells and asthma model mice[J]. International Immunopharmacology, 2012, 12(2): 453-459. DOI:10.1016/j.intimp.2011.12.027 |
| [33] |
AZUMA K, OSAKI T, KUROZUMI S, et al. Anti-inflammatory effects of orally administered glucosamine oligomer in an experimental model of inflammatory bowel disease[J]. Carbohydrate Polymers, 2015, 115: 448-456. DOI:10.1016/j.carbpol.2014.09.012 |
| [34] |
CHEN C L, WANG Y M, LIU C F, et al. The effect of water-soluble chitosan on macrophage activation and the attenuation of mite allergen-induced airway inflammation[J]. Biomaterials, 2008, 29(14): 2173-2182. DOI:10.1016/j.biomaterials.2008.01.023 |
| [35] |
FANG I M, YANG C H, YANG C M. Chitosan oligosaccharides attenuate ocular inflammation in rats with experimental autoimmune anterior uveitis[J]. Mediators of Inflammation, 2014, 2014: 827847. |
| [36] |
XIAO D F, WANG Y F, LIU G, et al. Effects of chitosan on intestinal inflammation in weaned pigs challenged by enterotoxigenic Escherichia coli[J]. PLoS One, 2014, 9(8): e104192. DOI:10.1371/journal.pone.0104192 |
| [37] |
LI F, LIU X, ZHAO S L, et al. Porous chitosan bilayer membrane containing TGF-β1 loaded microspheres for pulp capping and reparative dentin formation in a dog model[J]. Dental Materials, 2014, 30(2): 172-181. DOI:10.1016/j.dental.2013.11.005 |
| [38] |
LI H, JI Q X, CHEN X M, et al. Accelerated bony defect healing based on chitosan thermosensitive hydrogel scaffolds embedded with chitosan nanoparticles for the delivery of BMP2 plasmid DNA[J]. Journal of Biomedical Materials Research Part A, 2017, 105(1): 265-273. DOI:10.1002/jbm.a.35900 |
| [39] |
YANG L, WANG Q H, PENG L H, et al. Vascularization of repaired limb bone defects using chitosan-β-tricalcium phosphate composite as a tissue engineering bone scaffold[J]. Molecular Medicine Reports, 2015, 12(2): 2343-2347. DOI:10.3892/mmr.2015.3653 |
| [40] |
李俊良.壳聚糖对断奶仔猪免疫功能的影响及其调节机制的研究[D].博士学位论文.呼和浩特: 内蒙古农业大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10129-1014375685.htm
|
| [41] |
MOLTENI M, GEMMA S, ROSSETTI C. The role of toll-like receptor 4 in infectious and noninfectious inflammation[J]. Mediators of Inflammation, 2016, 2016: 1-9. |
| [42] |
KIM J H, KIM Y S, HWANG J W, et al. Sulfated chitosan oligosaccharides suppress LPS-induced NO production via JNK and NF-κB inactivation[J]. Molecules, 2014, 19(11): 18232-18247. DOI:10.3390/molecules191118232 |
| [43] |
FANG I M, YANG C M, YANG C H. Chitosan oligosaccharides prevented retinal ischemia and reperfusion injury via reduced oxidative stress and inflammation in rats[J]. Experimental Eye Research, 2015, 130: 38-50. DOI:10.1016/j.exer.2014.12.001 |
| [44] |
LI Y, XU Q S, WEI P, et al. Chitosan oligosaccharides downregulate the expression of E-selectin and ICAM-1 induced by LPS in endothelial cells by inhibiting MAP kinase signaling[J]. International Journal of Molecular Medicine, 2014, 33(2): 392-400. DOI:10.3892/ijmm.2013.1589 |
| [45] |
LIU H T, LI W M, LI X Y, et al. Chitosan oligosaccharides inhibit the expression of interleukin-6 in lipopolysaccharide-induced human umbilical vein endothelial cells through p38 and ERK1/2 protein kinases[J]. Basic & Clinical Pharmacology & Toxicology, 2010, 106(5): 362-371. |
| [46] |
DANIELSSON R, DICKSVED J, SUN L, et al. Methane production in dairy cows correlates with rumen methanogenic and bacterial community structure[J]. Frontiers in Microbiology, 2017, 8: 226. |
| [47] |
陈辉, 肖定福. 壳寡糖的生物学功能及其在养猪生产中的应用[J]. 饲料博览, 2017(4): 8-11. DOI:10.3969/j.issn.1001-0084.2017.04.003 |
| [48] |
HU S L, WANG Y, WEN X L, et al. Effects of low-molecular-weight chitosan on the growth performance, intestinal morphology, barrier function, cytokine expression and antioxidant system of weaned piglets[J]. BMC Veterinary Research, 2018, 14: 215. DOI:10.1186/s12917-018-1543-8 |
| [49] |
YAN L, LEE J H, MENG Q W, et al. Evaluation of dietary supplementation of delta-aminolevulinic acid and chito-oligosaccharide on production performance, egg quality and hematological characteristics in laying hens[J]. Asian-Australasian Journal of Animal Sciences, 2010, 23(8): 1028-1033. DOI:10.5713/ajas.2010.90639 |
| [50] |
孟晓, 王纪亭, 万文菊, 等. 低分子质量壳寡糖对蛋鸡生产性能、蛋品质、血清生化指标、盲肠微生物数量及脾脏白细胞介素-2、肿瘤坏死因子-α基因表达的影响[J]. 动物营养学报, 2017, 29(5): 1590-1599. |




