基质蛋白是蛋壳有机基质的重要组分,其分泌贯穿蛋壳形成的全过程[1]。基质蛋白可调控晶体的生长,通过调控碳酸钙的沉积速度,以及蛋壳晶体的大小、定向和形态,对蛋壳的结构和功能具有积极作用[2-3]。此外,基质蛋白还可提供抗菌保护作用,维持胶护膜的正常功能[4]。蛋壳的形成是动态时序性过程,在此过程中,基质蛋白的种类和作用各不相同,如何通过营养调控手段,调节某特定基质蛋白在特定阶段的分泌和表达,从而影响蛋壳结构和品质,是目前研究的重点和难点。前期文章主要关注基质蛋白在蛋壳的分布、生化结构和主要功能等[5-7],但关于基质蛋白如何调控蛋壳品质的文章较少。本文从基质蛋白的种类和特点、在蛋壳的分布和对蛋壳结构的作用,以及蛋壳中基质蛋白的调控等方面,简述基质蛋白对蛋壳品质的调控进展,以期为蛋壳品质的研究提供思路。
1 基质蛋白的分类和特点蛋壳是在输卵管和子宫内,碳酸钙和有机基质的动态时序性分泌和沉积形成。蛋壳中有机基质含量为1.0%~3.5%,其中包含基质蛋白(70%)、蛋白聚糖(11%)和糖蛋白[8]。根据基质蛋白的特点可将其分为3种:白蛋白(卵清蛋白、卵转铁蛋白、溶菌酶)、广泛存在的蛋白[骨桥蛋白(OPN)、丛生蛋白]、特殊蛋壳基质蛋白[520多种,包括ovocleidin-17(OC-17)、ovocleidin-116(OC-116)、ovocalyxin-32(OCX-32)、ovocalyxin-36(OCX-36)、ovocalyxin-25(OCX-25)、ovocalyxin-21(OCX-21)等][9]。基质蛋白在蛋壳形成的3个阶段的表达量不同,通过聚类分析,可主要包括3类,第1类是在钙化起始时富集的蛋白,如卵转铁蛋白、卵清蛋白、OC-17以及2种新的钙结合蛋白[表皮细胞生长因子(EGF)样重复盘状结构I样域蛋白3(EDIL3)、人乳脂肪球EGF因子蛋白8(MFGE8)];第2类是在钙化起始和末期富集的蛋白,如分子伴侣、折叠蛋白、蛋白酶及其抑制剂、OCX-21;第3类是在蛋壳形成各阶段均分泌的蛋白,如抗菌类的蛋白[10]。根据基质蛋白的作用方式不同,可将基质蛋白分为磷酸化的基质蛋白(OPN、OC-17、OC-116)、糖基化的基质蛋白(OC-116)、与免疫性能相关的基质蛋白(OCX-32、OCX-36、卵清蛋白、溶菌酶、卵转铁蛋白)。
2 基质蛋白在蛋壳的分布和对蛋壳结构的作用蛋壳的质量和功能很大程度上受其致密而又多孔性的特殊结构决定。蛋壳形成的动态时序性特征,使得蛋壳具有特殊的超微结构,包括未钙化的内基质膜和外基质膜、钙化的不规则乳突层、栅栏层、垂直晶体层和胶护膜(6层,由内至外)[11],并且使得蛋壳晶体具有一定的大小、形状以及结晶取向(微观结构)[1]。基质蛋白的分泌贯穿蛋壳形成的全过程,在蛋壳形成的钙化起始、线性沉积和钙化末期,子宫液中的基质蛋白种类和含量不同[12],其有序的分泌沉积,定位于蛋壳不同结构层[13]。基质膜和乳突层沉积的基质蛋白主要是卵清蛋白、卵转铁蛋白、溶菌酶和OCX-36,栅栏层含有大量的OC-116、OC-17、OPN和OCX-36,垂直晶体层和胶护膜主要含有OCX-32和OCX-36[14]。图 1是蛋壳的超微结构和基质蛋白的分布图。
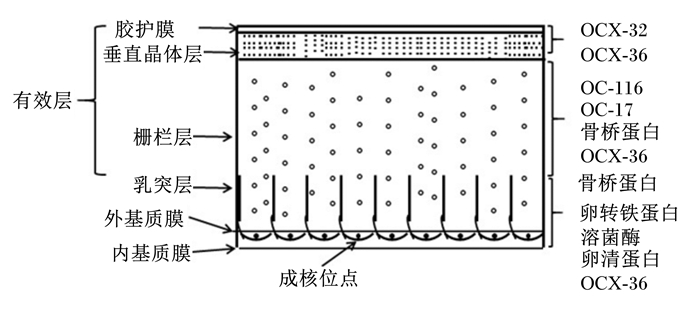
|
图 1 蛋壳的超微结构和基质蛋白的分布 Fig. 1 Ultrastructure and matrix proteins distribution of eggshells |
蛋壳质量和结构的变化与蛋壳基质蛋白的组成差异有关[2]。产蛋后期蛋壳品质的下降,与蛋壳中基质蛋白相对比例下降和结晶质地改变有关[15-16]。与青年禽类相比,老龄家禽蛋壳中基质蛋白OC-17、卵转铁蛋白和卵清蛋白的含量增加,晶体方向改变[17]。换羽后,蛋壳品质得到改善,晶体的平均大小降低,蛋壳中OC-116和OC-17的含量增加,卵转铁蛋白含量下降[18]。蛋壳中的有机基质可分为酸不溶性基质、水不溶性基质、可溶性基质3种,正常蛋壳中这3种基质含量线性相关,而丘疹蛋中无此现象;正常蛋壳的重量比丘疹蛋要高,但3种基质的比例较丘疹蛋壳中降低;正常蛋壳的力学特性与钙化蛋壳的有机基质含量相关,而丘疹蛋壳则无此相关性,这可能是由具有负面作用的某些蛋白不均衡的富集导致的[19]。蛋壳的厚度,尤其是乳突层的厚度,与晶体的大小和方向具有显著的正相关性,而晶体大小受卵清蛋白和卵转铁蛋白调控,晶体的方向则与OC-116和OCX-32相关[20]。此外,利用基因组技术发现卵清蛋白与蛋壳强度和厚度有关,OPN与蛋壳硬度和韧性有关,OC-116与蛋壳厚度、弹性和蛋形指数有关,OCX-32与乳突层厚度有关[21]。因此,基质蛋白可影响蛋壳的结构和品质。
3 基质蛋白对蛋壳品质的调控基质蛋白可通过以下方面影响蛋壳形成:蛋白的磷酸化作用,如OPN、OC-116、OC-17、OCX-32等,依赖磷酸化的形式调控晶体的形成过程[22-23];或作为核心蛋白,与糖胺聚糖结合形成高度硫酸化的蛋白聚糖(如OC-116与硫酸皮肤素结合形成硫酸皮肤素蛋白聚糖),通过互相之间的静电作用调控蛋壳的矿化过程[24];或通过与免疫相关的基质蛋白,如卵转铁蛋白、溶菌酶、OCX-36等,参与蛋壳晶体的形成,改变蛋壳品质[17-18]。
3.1 基质蛋白的磷酸化对蛋壳品质的调控磷酸化基质蛋白(OPN、OC-116和OC-17)可能通过调控晶体在乳突层和栅栏层的沉积影响蛋壳的结构和质量。首先,基质蛋白OPN、OC-116和OC-17主要存在于蛋壳乳突和栅栏层中,其在子宫液中的分泌量在钙化起始(产蛋后5.5~10 h,乳突形成期)和线性沉积期(产蛋后11~20 h,栅栏层形成期)大量增加[25]。其次,磷酸化基质蛋白在蛋壳乳突和栅栏层形成过程中发挥重要作用,影响蛋壳的结构和质量。
骨桥蛋白是一种高度磷酸化的基质蛋白,由蛋壳腺管状上皮细胞合成和分泌,主要沉积在栅栏层,可通过调节钙化速度以及晶体的定向而影响栅栏层的生长[26]。此外,OPN还存在于乳突层的基部,促进钙储备体的区域化[27]。蛋壳的晶体面天然是一个分裂面,钙化过程中OPN可附着到晶体生长的表面,调控晶体的生长速度和方向,促进晶体的优势构象,并沿着晶体表面影响其对断裂的抵抗力[28]。OPN的基因表达与卵蛋进入子宫的机械应力有关,卵蛋进入子宫后,蛋壳腺内OPN的表达量显著增加[29]。在过饱和溶液中,蛋壳OPN的去磷酸化,可缓解其对碳酸钙沉积的抑制作用[22]。然而,蛋壳腺内OPN表达不正常,影响蛋壳的正常钙化。类雌激素处理后,蛋壳厚度降低,这主要与OPN表达量减少有关[30];OPN合成减少与蛋壳强度存在直接关系,在破蛋的钝端和尖端OPN的表达量都减少[31];子宫上皮细胞特定部位OPN表达量的减少或缺乏,影响蛋壳形成皱褶、丘疹和破损[32]。此外,候选基因关联分析发现OPN与蛋壳断裂韧性有关[21]。也有研究发现家禽蛋壳OPN是蛋壳腺内碳酸酐酶(CA)的抑制剂,当添加碱性磷酸酶(ALP)后,OPN发生去磷酸化,降低对CA的抑制作用,这表明OPN可能作为子宫液中CA的调控因子,或可能抑制CA活性而终止蛋壳钙化[33]。由此可见,OPN表达量的减少会降低对碳酸钙沉积的抑制作用,促进晶体的生长,同时也会降低其在晶体表面的黏合,使得晶体抵抗断裂的能力下降,晶体大小、方向不一,蛋壳品质下降。由此可见,蛋壳腺内OPN的含量要保持在一定的范围内。
基质蛋白OC-116是一种功能性壳基质蛋白,它的表达具有时间特异性,只有在蛋壳开始钙化时才能检测到该蛋白存在,其主要在蛋壳的线性沉积阶段形成,并沉积于栅栏层[25],参与蛋壳柱状结构的形成,调节晶体的微观结构[34]。研究表明,OC-116与分泌型钙结合磷酸化蛋白(SCPP)均含有常见的遗传基因,可分泌蛋白和酸性物质,而SCPP可通过酸性氨基酸如谷氨酸、天冬氨酸和磷酸化的丝氨酸结合钙离子(Ca2+)[35]。由此推断,OC-116可能是以磷酸化的方式参与蛋壳的钙化过程。此外,研究表明,OC-116存在糖基化位点,作为核心蛋白与硫酸皮肤素结合形成蛋白聚糖,通过互相之间的静电作用影响晶体在栅栏层的沉积[2, 34]。可见,OC-116以磷酸化或糖基化的形式在蛋壳腺内发挥作用,OC-116的去磷酸化作用或可促进其以糖基化的形式参与蛋壳栅栏层晶体的生长。研究表明,换羽后蛋壳品质改善,晶体变小,与蛋壳腺内OC-116的含量增加有关[18]。此外,OC-116与蛋壳弹性、厚度和形状有关[21]。因此,可通过改变OC-116的作用形式或含量,调控蛋壳栅栏层晶体的生长速度和定向。
基质蛋白OC-17是一种主要的禽类壳基质蛋白,在管状蛋壳腺内合成和分泌,存在于整个蛋壳钙化过程中,主要沉积在乳突层和栅栏层[36]。OC-17是一种磷酸化基质蛋白,由142个氨基酸残基组成,包含2个磷酸化丝氨酸(Ser)的位点(Ser-61和Ser-67)[37]。OC-17虽为磷酸化蛋白,但可以在天冬酰胺(Asn)-59位点发生糖基化,OC-17发生糖基化作用(成为OC-23)时,Ser-61位点不会被磷酸化,这说明不同的修饰过程是相互独立的[23]。体外试验表明,OC-17可影响方解石聚合物的形成过程,促进单个规则的菱形方解石堆积形成形状不规则的晶体聚合物,并具有浓度依赖性,与蛋壳乳突层的晶体聚合物结构相同,是方解石晶体发生聚集的基础,提供关键性结构支撑[37]。进一步研究发现,OC-17可与方解石表面紧密接触,与水分子竞争结合位点,而影响晶体的结构[38]。此外,OC-17在蛋壳基质中的含量的变化可影响蛋壳的质量。与青年母鸡相比,老龄母鸡的蛋壳强度、蛋壳比例和指数显著降低,但OC-17含量却是青年母鸡的1.58倍[19]。基质蛋白OC-17的含量随日龄增加而分泌增多,导致方解石的结晶位点增加、晶体致密性降低,蛋壳强度下降[16]。由此可见,蛋禽产蛋后期蛋壳品质的降低或可通过调控蛋壳基质蛋白OC-17的含量得到解决。
可见,磷酸化基质蛋白OPN、OC-116、OC-17可调控蛋壳晶体在乳突层和栅栏层的生长和定向,影响蛋壳的超微结构和微观结构,从而调控蛋壳品质。
3.2 基质蛋白的糖基化对蛋壳品质的调控除基质蛋白外,蛋白聚糖也是有机基质的重要成分,影响蛋壳的形成[39]。蛋白聚糖由糖胺聚糖和核心蛋白组成,糖胺聚糖是蛋白聚糖的功能区域,但必须与相应的核心蛋白结合才能发挥作用。其中,OC-116是硫酸皮肤素蛋白聚糖的核心蛋白,在线性沉积期大量分泌,调控栅栏层形成,并沉积在栅栏层[22]。OC-116具有2个糖基化位点,62N-Q-T位点首先发生糖基化,当此位点全部糖基化后,另一位点293N-D-S才被少量的糖基化[40]。OC-116的糖基化与硫酸皮肤素形成蛋白聚糖,可调控晶体的沉积速度和结晶质地[41]。同时,硫酸角质素蛋白聚糖在钙化起始期分泌,可参与第1枚晶体的成核,影响乳突核的密度,但其核心蛋白并不清楚。此外,蛋壳的有机胶护膜包含大量的糖蛋白(>90%),可维持蛋壳的结构和保护蛋壳[42]。可见,蛋白的糖基化是调控蛋壳品质的方向之一。
3.3 与免疫相关基质蛋白对蛋壳品质的调控研究表明,基质蛋白可作为蛋壳的防御性物质[43],在蛋壳形成过程中发挥钙化与抗菌保护的双重作用[44]。与免疫相关的基质蛋白,如卵清蛋白、卵转铁蛋白、溶菌酶、OCX-36、OCX-32,主要在钙化起始或末期发挥作用。卵清蛋白是最丰富的一种白蛋白,主要在钙化起始期分泌,存在于蛋壳乳突层[45]。卵转铁蛋白可隔绝细菌生长所需的铁离子,由子宫管状腺细胞分泌,免疫印迹和实时荧光PCR(RT-PCR)的分析结果表明,卵转铁蛋白主要在输卵管的近端(膨大部和白峡部)分泌,而在远端(红峡部和子宫)分泌较少,主要分布在基质膜,可影响晶体的成核,少量存在于蛋壳钙化层中,也可调控晶体的生长,并可作为一种抑菌剂,抑制沙门氏菌的生长[46]。溶菌酶主要位于基质膜,尤其是内基质膜,也存在于蛋壳钙化层中,发挥钙化和抗菌的保护作用[47]。OCX-32由上皮细胞分泌,主要在峡部和子宫内,在钙化末期大量分泌,位于栅栏层外层、垂直晶体层和胶护膜[48]。OCX-36在钙化期大量分泌,主要位于钙化蛋壳的内层,尤其是基质膜,与先天免疫反应如脂多糖蛋白(LBP)等具有同源性,发挥自然防御作用[49]。
与免疫相关的基质蛋白(溶菌酶、卵转铁蛋白、OCX-36、OCX-32)除发挥抗菌作用外,还可能通过调控晶体在基质膜、乳突层及钙化外层的沉积影响蛋壳的形成和结构。卵转铁蛋白(0.5 mg/mL)可促进晶体变小和垂直生长[46];然而,青年鸡较老年鸡蛋壳品质的提高,或换羽后蛋壳品质的改善,蛋壳中卵转铁蛋白的含量却降低[17-18]。可见,蛋壳中卵转铁蛋白含量应控制在一定范围。高浓度的溶菌酶(>10 mg/mL)可促使晶体沿着c轴(与乳突面垂直的轴)生长,抑制其在{110}面生长(与c轴呈90°方向),促进晶体优势构象[47, 50]。此外,蛋白质组学分析结果表明,产蛋后期蛋壳品质的改善与蛋壳中增加的免疫相关蛋白含量有关,如淋巴细胞86抗原前体、溶菌酶、免疫球蛋白聚合前体物等[51]。可见,与免疫相关的基质蛋白在蛋壳形成中发挥重要作用,影响蛋壳品质。
3.4 营养调控基质蛋白对蛋壳品质的影响营养调控蛋壳品质的早期研究主要关注蛋壳中矿物质的沉积,如钙、磷的来源及比例等,通过调控钙离子的吸收和转运,影响蛋壳的形成。近来研究表明,微量元素(锰、锌)和饲料添加剂,如微生态制剂、有机酸等,也可调控蛋壳品质[52],这可能主要通过调控蛋壳的有机基质,而影响蛋壳结构和品质。饲粮添加锰(40~160 mg/kg)可改善后期蛋鸡的蛋壳结构和强度,一方面,锰通过调控蛋壳腺内蛋白的糖基化和聚糖代谢,提高蛋白聚糖和糖蛋白的表达[53-55],另一方面,锰可调控蛋壳基质蛋白的表达,主要是与蛋壳钙化或与免疫功能有关的蛋白,改变蛋壳钙化过程或机体的生理状态[51]。饲粮添加锌(35~140 mg/kg)可改善蛋壳的结构和厚度[56],一方面是由于锌是CA的活性因子,可提高血浆和蛋壳腺内CA活性,促进碳酸钙的沉积[57],另一方面可能与蛋壳腺内基质蛋白的变化有关,其中OPN与OC-116的基因表达量受锌源和水平的显著影响[58]。如上所述,OPN、OC-116、OC-17在乳突和栅栏层形成过程中大量分泌,可依赖磷酸化的形式调控晶体的沉积;锌是碱性磷酸酶的组成部分,或可调控体内的磷酸化而影响上述基质蛋白的表达或作用方式而影响蛋壳结构。饲粮添加微生态制剂(如800 mg/kg枯草芽孢杆菌)、有机酸(如0.05%短链脂肪酸)和植物提取物(如1%~3%黑茴香籽的提取物)可提高后期蛋鸡的蛋壳品质,降低软破蛋率[52, 59],但其调控机理并不清楚。推测上述添加剂可能通过调控肠道的酸碱度,影响矿物元素的吸收利用,而调控蛋壳的矿化;也可能与免疫相关的基质蛋白变化有关,但都需进一步研究。
4 结语综上,基质蛋白广泛存在于蛋壳中,通过磷酸化、糖基化的形式或与免疫相关的基质蛋白,参与蛋壳形成,进而调控蛋壳的结构和品质。但基质蛋白的种类和数量在蛋壳的分布不同,发挥作用的时间和位点有所差别,如何精确调控特定基质蛋白的分泌和表达,是通过基质蛋白调控蛋壳品质的重点。通过调控基质蛋白的磷酸化(如锌)、糖基化(如锰、植物提取物、多糖)或免疫相关基质蛋白的表达(如微生态制剂),影响基质蛋白在蛋壳形成中的分泌和作用,是营养调控蛋壳品质的重要方向。
| [1] |
HINCKE M T, NYS Y, GAUTRON J, et al. The eggshell:structure, composition and mineralization[J]. Frontiers in Bioscience, 2012, 17: 1266-1280. DOI:10.2741/3985 |
| [2] |
NYS Y, GAUTRON J, GARCIA-RUIZ J M, et al. Avian eggshell mineralization:biochemical and functional characterization of matrix proteins[J]. Comptes Rendus Palevol, 2004, 3(6/7): 549-562. |
| [3] |
ROBERTS J R. Factors affecting egg internal quality and egg shell quality in laying hens[J]. The Journal of Poultry Science, 2004, 41(3): 161-177. DOI:10.2141/jpsa.41.161 |
| [4] |
ROSE-MARTEL M, SMILEY S, HINCKE M T. Novel identification of matrix proteins involved in calcitic biomineralization[J]. Journal of Proteomics, 2015, 116: 81-96. DOI:10.1016/j.jprot.2015.01.002 |
| [5] |
章世元, 周光玉, 徐春燕, 等. 禽类蛋壳基质蛋白的研究进展[J]. 中国家禽, 2009, 31(11): 37-40. |
| [6] |
刘亚平, 马美湖. 蛋壳特异性基质蛋白结构与功能特性研究进展[J]. 中国家禽, 2015, 37(13): 50-56. |
| [7] |
肖俊峰, 武书庚, 张海军, 等. 四种壳基质蛋白研究进展[J]. 中国家禽, 2012, 34(9): 44-47. DOI:10.3969/j.issn.1004-6364.2012.09.010 |
| [8] |
BAKER J R, BALCH D A. A study of the organic material of hen's-egg shell[J]. Biochemical Journal, 1962, 82(2): 352-361. |
| [9] |
MANN K, MAČEK B, OLSEN J V. Proteomic analysis of the acid-soluble organic matrix of the chicken calcified eggshell layer[J]. Proteomics, 2006, 6(13): 3801-3810. DOI:10.1002/(ISSN)1615-9861 |
| [10] |
MARIE P, LABAS V, BRIONNE A, et al. Data set for the proteomic inventory and quantitative analysis of chicken uterine fluid during eggshell biomineralization[J]. Data in Brief, 2014, 1: 65-69. DOI:10.1016/j.dib.2014.09.006 |
| [11] |
ARIAS J L, FINK D J, XIAO S Q, et al. Biomineralization and eggshells:cell-mediated acellular compartments of mineralized extracellular matrix[J]. International Review of Cytology, 1993, 145: 217-250. DOI:10.1016/S0074-7696(08)60428-3 |
| [12] |
GAUTRON J, HINCKE M T, NYS Y. Precursor matrix proteins in the uterine fluid change with stages of eggshell formation in hens[J]. Connective Tissue Research, 1997, 36(3): 195-210. DOI:10.3109/03008209709160220 |
| [13] |
HINCKE M T, BERNARD A M, LEE E R, et al. Soluble protein constituents of the domestic fowl's eggshell[J]. British Poultry Science, 1992, 33(3): 505-516. DOI:10.1080/00071669208417489 |
| [14] |
JONCHÈRE V, RÉHAULT-GODBERT S, HENNEQUET-ANTIER C, et al. Gene expression profiling to identify eggshell proteins involved in physical defense of the chicken egg[J]. BMC Genomics, 2010, 11: 57. DOI:10.1186/1471-2164-11-57 |
| [15] |
PANHELEUX M, BAIN M, FERNANDEZ M S, et al. Organic matrix composition and ultrastructure of eggshell:a comparative study[J]. British Poultry Science, 1999, 40(2): 240-252. |
| [16] |
RODRIGUEZ-NAVARRO A, KALIN O, NYS N, et al. Influence of the microstructure on the shell strength of eggs laid by hens of different ages[J]. British Poultry Science, 2002, 43(3): 395-403. |
| [17] |
PANHELEUX M, NYS Y, WILLIAMS J, et al. Extraction and quantification by ELISA of eggshell organic matrix proteins (ovocleidin-17, ovalbumin, ovotransferrin) in shell from young and old hens[J]. Poultry Science, 2000, 79(4): 580-588. DOI:10.1093/ps/79.4.580 |
| [18] |
AHMED A M H, RODRIGUEZ-NAVARRO A B, VIDAL M L, et al. Changes in eggshell mechanical properties, crystallographic texture and in matrix proteins induced by moult in hens[J]. British Poultry Science, 2005, 46(3): 268-279. DOI:10.1080/00071660500065425 |
| [19] |
LIU Z, SONG L, ZHANG F, et al. Characteristics of global organic matrix in normal and pimpled chicken eggshells[J]. Poultry Science, 2017, 96(10): 3775-3784. DOI:10.3382/ps/pex171 |
| [20] |
DUNN I C, RODRÍGUEZ-NAVARRO A B, MCDADE K, et al. Genetic variation in eggshell crystal size and orientation is large and these traits are correlated with shell thickness and are associated with eggshell matrix protein markers[J]. Animal Genetics, 2012, 43(4): 410-418. DOI:10.1111/age.2012.43.issue-4 |
| [21] |
DUNN I C, JOSEPH N T, BAIN M, et al. Polymorphisms in eggshell organic matrix genes are associated with eggshell quality measurements in pedigree Rhode Island Red hens[J]. Animal Genetics, 2009, 40(1): 110-114. DOI:10.1111/age.2009.40.issue-1 |
| [22] |
HINCKE M T, ST MAURICE M.Phosphorylation-dependent modulation of calcium carbonate precipitation by chicken eggshell matrix proteins[C]//GOLDBERG M, BOSKEY A, ROBINSON C.Chemistry and biology of mineralized tissues.Rosemont: American Academy of Orthopaedic Surgeons, 2000: 13-17. https://www.researchgate.net/publication/284326396_Phosphorylation-dependent_modulation_of_calcium_carbonate_precipitation_by_chicken_eggshell_matrix_proteins
|
| [23] |
MANN K. The chicken egg white proteome[J]. Proteomics, 2007, 7(19): 3558-3568. DOI:10.1002/(ISSN)1615-9861 |
| [24] |
ARIAS J I, JURE C, WIFF J P, et al.Effect of sulfate content of biomacromolecules on the crystallization of calcium carbonate[C]//Proceedings of Materials Research Society Fall Meeting.Boston, MA: Materials Research Society, 2001: 243-250.
|
| [25] |
MANN K, HINCKE M T, NYS Y. Isolation of ovocleidin-116 from chicken eggshells, correction of its amino acid sequence and identification of disulfide bonds and glycosylated Asn[J]. Matrix Biology, 2002, 21(5): 383-387. DOI:10.1016/S0945-053X(02)00031-8 |
| [26] |
HINCKE M T, CHIEN Y C, GERSTENFELD L C, et al. Colloidal-gold immunocytochemical localization of osteopontin in avian eggshell gland and eggshell[J]. Journal of Histochemistry & Cytochemistry, 2008, 56(5): 467-476. |
| [27] |
FERNANDEZ M S, ESCOBAR C, LAVELIN I, et al. Localization of osteopontin in oviduct tissue and eggshell during different stages of the avian egg laying cycle[J]. Journal of Structural Biology, 2003, 143(3): 171-180. DOI:10.1016/j.jsb.2003.08.007 |
| [28] |
CHIEN Y C, HINCKE M T, MCKEE M D. Avian eggshell structure and osteopontin[J]. Cells Tissues Organs, 2008, 189(1/2/3/4): 38-43. |
| [29] |
LAVELIN I, MEIRI N, PINES M. New insight in eggshell formation[J]. Poultry Science, 2000, 79(7): 1014-1017. DOI:10.1093/ps/79.7.1014 |
| [30] |
KAMATA R, SHIRAISHI F, IZUMI T, et al. Mechanisms of estrogen-induced effects in avian reproduction caused by transovarian application of a xenoestrogen, diethylstilbestrol[J]. Archives of Toxicology, 2009, 83(2): 161-171. |
| [31] |
ARAZI H, YOSELEWITZ I, MALKA Y, et al. Osteopontin and calbindin gene expression in the eggshell gland as related to eggshell abnormalities[J]. Poultry Science, 2009, 88(3): 647-653. DOI:10.3382/ps.2008-00387 |
| [32] |
CHIEN Y C, MASICA D L, GRAY J J, et al. Modulation of calcium oxalate dihydrate growth by selective crystal-face binding of phosphorylated osteopontin and polyaspartate peptide showing occlusion by sectoral (compositional) zoning[J]. Journal of Biological Chemistry, 2009, 284(35): 23491-23501. DOI:10.1074/jbc.M109.021899 |
| [33] |
PINES M, KNOPOV V, Bar A. Involvement of osteopontin in egg shell formation in the laying chicken[J]. Matrix Biology, 1995, 14(9): 765-771. DOI:10.1016/S0945-053X(05)80019-8 |
| [34] |
HINCKE M T, GAUTRON J, TSANG C P W, et al. Molecular cloning and ultrastructural localization of the core protein of an eggshell matrix proteoglycan, ovocleidin-116[J]. Journal of Biological Chemistry, 1999, 274(46): 32915-32923. DOI:10.1074/jbc.274.46.32915 |
| [35] |
KAWASAKI K, WEISS K M. Mineralized tissue and vertebrate evolution:the secretory calcium-binding phosphoprotein gene cluster[J]. Proceedings of the National Academy of Sciences of the United States of America, 2003, 100(7): 4060-4065. DOI:10.1073/pnas.0638023100 |
| [36] |
HINCKE M T, TSANG C P W, COURTNEY M, et al. Purification and immunochemistry of a soluble matrix protein of the chicken eggshell (ovocleidin 17)[J]. Calcified Tissue International, 1995, 56(6): 578-583. DOI:10.1007/BF00298593 |
| [37] |
REYES-GRAJEDA J P, MORENO A, ROMERO A. Crystal structure of ovocleidin-17, a major protein of the calcified Gallus gallus eggshell:implications in the calcite mineral growth pattern[J]. Journal of Biological Chemistry, 2004, 279(39): 40876-40881. DOI:10.1074/jbc.M406033200 |
| [38] |
FREEMAN C L, HARDING J H, QUIGLEY D, et al. Protein binding on stepped calcite surfaces:simulations of ovocleidin-17 on calcite {31.16} and {31.8}[J]. Physical Chemistry Chemical Physics, 2012, 14(20): 287-7295. |
| [39] |
王瑛, 杨玉峰, 何健, 等. 蛋壳超微结构及有机基质蛋白对蛋壳品质的影响[J]. 中国家禽, 2015(11): 43-47. |
| [40] |
NIMTZ M, CONRADT H S, MANN K. LacdiNAc (GalNAcβ1-4GlcNAc) is a major motif in N-glycan structures of the chicken eggshell protein ovocleidin-116[J]. Biochimica et Biophysica Acta:General Subjects, 2004, 1675(1/2/3): 71-80. |
| [41] |
FERNANDEZ M S, MOYA A, LOPEZ L, et al. Secretion pattern, ultrastructural localization and function of extracellular matrix molecules involved in eggshell formation[J]. Matrix Biology, 2001, 19(8): 793-803. DOI:10.1016/S0945-053X(00)00128-1 |
| [42] |
RODRÍGUEZ-NAVARRO A B, DOMÍNGUEZ-GASCA N, MUÑOZ A, et al. Change in the chicken eggshell cuticle with hen age and egg freshness[J]. Poultry Science, 2013, 92(11): 3026-3035. DOI:10.3382/ps.2013-03230 |
| [43] |
MINE Y, OBERLE C, KASSAIFY Z. Eggshell matrix proteins as defense mechanism of avian eggs[J]. Journal of Agricultural and Food Chemistry, 2003, 51(1): 249-253. |
| [44] |
ROSE M L H, HINCKE M T. Protein constituents of the eggshell:eggshell-specific matrix proteins[J]. Cellular and Molecular Life Sciences, 2009, 66(16): 2707-2719. DOI:10.1007/s00018-009-0046-y |
| [45] |
HINCKE M T. Ovalbumin is a component of the chicken eggshell matrix[J]. Connective Tissue Research, 1995, 31(3): 227-233. DOI:10.3109/03008209509010814 |
| [46] |
GAUTRON J, HINCKE M T, PANHELEUX M, et al. Ovotransferrin is a matrix protein of the hen eggshell membranes and basal calcified layer[J]. Connective Tissue Research, 2001, 42(4): 255-267. DOI:10.3109/03008200109016840 |
| [47] |
HINCKE M T, GAUTRON J, PANHELEUX M, et al. Identification and localization of lysozyme as a component of eggshell membranes and eggshell matrix[J]. Matrix Biology, 2000, 19(5): 443-453. DOI:10.1016/S0945-053X(00)00095-0 |
| [48] |
GAUTRON J, HINCKE M T, MANN K, et al. Ovocalyxin-32, a novel chicken eggshell matrix protein:isolation, amino acid sequencing, cloning, and immunocytochemical localization[J]. Journal of Biological Chemistry, 2001, 276(42): 39243-39252. DOI:10.1074/jbc.M104543200 |
| [49] |
GAUTRON J, MURAYAMA E, VIGNAL A, et al. Cloning of ovocalyxin-36, a novel chicken eggshell protein related to lipopolysaccharide-binding proteins, bactericidal permeability-increasing proteins, and plunc family proteins[J]. Journal of Biological Chemistry, 2007, 282(8): 5273-5286. DOI:10.1074/jbc.M610294200 |
| [50] |
JIMENEZ-LOPEZ C, RODRIGUEZ-NAVARRO A, DOMINGUEZ-VERA J M, et al. Influence of lysozyme on the precipitation of calcium carbonate:a kinetic and morphologic study[J]. Geochimica et Cosmochimica Acta, 2003, 67(9): 1667-1676. DOI:10.1016/S0016-7037(02)01275-9 |
| [51] |
肖俊峰.日粮锰源和水平对产蛋鸡蛋壳品质的影响及其机理[D].博士学位论文.北京: 中国农业科学院, 2014. http://cdmd.cnki.com.cn/Article/CDMD-82101-1014326763.htm
|
| [52] |
张亚男, 王晶, 武书庚, 等. 微量元素和饲料添加剂调控蛋壳品质的研究进展[J]. 动物营养学报, 2016, 28(10): 3015-3024. DOI:10.3969/j.issn.1006-267x.2016.10.001 |
| [53] |
ZHANG Y N, WANG J, ZHANG H J, et al. Effect of dietary supplementation of organic or inorganic manganese on eggshell quality, ultrastructure, and components in laying hens[J]. Poultry Science, 2017, 96(7): 2184-2193. DOI:10.3382/ps/pew495 |
| [54] |
ZHANG Y N, ZHANG H J, WU S G, et al. Dietary manganese supplementation modulated mechanical and ultrastructural changes during eggshell formation in laying hens[J]. Poultry Science, 2017, 96(8): 2699-2707. DOI:10.3382/ps/pex042 |
| [55] |
ZHANG Y N, ZHANG H J, WU S G, et al. Dietary manganese supplementation affects mammillary knobs of eggshell ultrastructure in laying hens[J]. Poultry Science, 2018, 97(4): 1253-1262. DOI:10.3382/ps/pex419 |
| [56] |
张亚男, 武书庚, 张海军, 等. 锌添加水平对蛋鸡生产性能和蛋壳品质的影响[J]. 动物营养学报, 2013, 25(5): 1093-1098. DOI:10.3969/j.issn.1006-267x.2013.05.026 |
| [57] |
ZHANG Y N, ZHANG H J, WANG J, et al. Effect of dietary supplementation of organic or inorganic zinc on carbonic anhydrase activity in eggshell formation and quality of aged laying hens[J]. Poultry Science, 2017, 96(7): 2176-2183. DOI:10.3382/ps/pew490 |
| [58] |
张亚男.饲粮锌对产蛋后期蛋鸡蛋壳品质及抗氧化机能的影响[D].硕士学位论文.北京: 中国农业科学院, 2013. http://cdmd.cnki.com.cn/Article/CDMD-82101-1013357335.htm
|
| [59] |
崔闯飞, 王晶, 齐广海, 等. 枯草芽孢杆菌对产蛋后期蛋鸡生产性能和蛋壳品质的影响[J]. 动物营养学报, 2018, 30(4): 1481-1488. DOI:10.3969/j.issn.1006-267x.2018.04.032 |




